果蔗中氯虫苯甲酰胺残留检测方法研究
2017-02-18杨玉霞劳水兵周其峰王天顺莫仁甫
杨玉霞,劳水兵,周其峰,王天顺,莫仁甫
(广西农业科学院农产品质量安全与检测技术研究所/农业部甘蔗品质监督检验测试中心,南宁 530007)
◆环境与残留◆
果蔗中氯虫苯甲酰胺残留检测方法研究
杨玉霞,劳水兵,周其峰,王天顺,莫仁甫*
(广西农业科学院农产品质量安全与检测技术研究所/农业部甘蔗品质监督检验测试中心,南宁 530007)
建立了果蔗中氯虫苯甲酰胺残留的气相色谱检测分析方法。样品中氯虫苯甲酰胺用乙腈提取后将其转化为IN-EQW78,再经萃取,弗罗里硅土柱进一步净化后进行GC-μECD检测。结果表明:在0.01~1.0 mg/L质量浓度范围内,氯虫苯甲酰胺呈良好的线性关系(R2为0.999 9)。在添加浓度为0.02~2.0 mg/kg时,蔗茎中氯虫苯甲酰胺回收率为84.05%~104.73%,相对标准偏差为3.67%~7.75%;蔗叶中回收率为77.99%~99.22%,相对标准偏差为1.50%~8.63%。该方法灵敏,精密度和准确度高,杂质干扰少,成本低,符合农药残留测定方法要求。
果蔗;氯虫苯甲酰胺;转化;IN-EQW78;气相色谱;残留
果蔗皮薄茎脆,有生津止渴、清凉解毒的功效,且富含多种氨基酸,营养丰富,是深受人们喜爱的果品之一。氯虫苯甲酰胺(chlorantraniliprole)商品名康宽,是由美国杜邦公司发现并开发的第1个具有新型邻甲酰氨基苯甲酰胺化学结构的广谱型杀虫剂,已在中国获准登记并广泛用于蔬菜、水果和粮食作物。氯虫苯甲酰胺能够有效防治鞘翅目害虫马铃薯甲虫、稻水象甲、绿金龟,双翅目害虫豌豆潜叶蝇、油菜潜叶蝇,半翅目害虫白粉虱、烟粉虱,等翅目害虫甘蔗白蚁,鳞翅目害虫玉米螟、柑橘潜叶蛾、小地老虎、斜纹夜蛾、食心虫、棉铃虫、甘蓝夜蛾、小菜蛾等。其在田间使用剂量下对寄生蜂等天敌以及传粉昆虫安全[1]。近年来,我国果蔗种植面积不断扩大,有机氯、有机磷类杀虫剂被禁限用,氯虫苯甲酰胺广泛用作蔗田杀虫剂,防治蔗田小地老虎、甘蔗螟虫等害虫[2]。氯虫苯甲酰胺残留检测方法主要有高效液相色谱法[3-6]和液-质联用法[7-12]。Ramasubramanian等[13]建立了甘蔗中氯虫苯甲酰胺的液相色谱-串联质谱检测方法,但方法的前处理过于繁琐,需要消耗大量有机溶剂,耗时长,且液相色谱-串联质谱仪价格昂贵。本文采用乙腈浸泡提取样品,进行转化,即氯虫苯甲酰胺转化为可被气相色谱μECD检测的代谢产物IN-EQW78(氯虫苯甲酰胺脱水环化物),之后再经萃取、净化,进行GC-μECD定量测定。采用本方法对广西6个主要果蔗区62份果蔗样品进行了测定。该方法灵敏度高,重复性好,且杂质干扰少,成本低,可为氯虫苯甲酰胺的残留检测提供重要的方法参考。
1 材料与方法
1.1 仪器设备
Agilent 7890A气相色谱仪,带Agilent 7693自动进样器,EPC控制的微电子捕获检测器(μECD);HY-5型直供回旋式振荡器,金坛宏凯仪器厂;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;SE812J型氮吹仪带数控恒温水浴锅,北京帅恩科技有限责任公司;LD5-2A型低速离心机,北京京立离心机有限公司;DS-1型高速组织捣碎机,上海标本模型厂;VORTEX-5型涡旋混合器,海门市其林贝尔仪器制造有限公司;KQ3200DB型数控超声清洗器,昆山市超声仪器有限公司;玻璃层析柱[200 mm× 10 mm(i.d.)]。
1.2 试剂
正己烷、乙酸乙酯、二氯甲烷、乙腈,以上溶剂均为分析纯且经重蒸处理;冰醋酸、无水硫酸镁、饱和氯化钠水溶液、2次蒸馏水;无水硫酸钠(分析纯,650℃烘烤4 h,于干燥器中保存备用);弗罗里硅土(650℃烘4 h,5%水失活)。
氯虫苯甲酰胺标准品(99.5%),德国Dr.Ehrenstorfer公司;IN-EQW78标准品(99.7%),美国杜邦贸易(上海)有限公司。
1.3 方法
1.3.1 样品提取
准确称取蔗茎或蔗叶样品10.0 g于250 mL具塞三角瓶中,加入乙腈40 mL,振荡浸泡过夜。次日先加入2 g NaCl振荡30 min,取上清液加入1.0 g无水MgSO4继续振荡30 min。吸取20 mL上述乙腈液至100 mL聚四氟乙烯离心管中,加入60 mL蒸馏水、5 mL饱和醋酸铅,摇匀后静置30 min。待色素沉淀完全后加入5 mL 5%冰乙酸水溶液,平衡后以3 500 r/min离心5 min,将上清液转移到250 mL分液漏斗。向离心管中再加入20 mL蒸馏水,玻棒贴壁沉淀,超声处理5 min,以3 500 r/min离心5 min,上清液合并。用二氯甲烷30,20,20mL萃取3次,有机层干燥,浓缩。
1.3.2 样品转化
向浓缩液中加入1 mL乙腈、5 mL 0.15%氨水,在75℃水浴锅中转化2.5 h,每隔0.5 h摇晃1次。自然冷却后,将转化液倒入20 mL具塞试管,并加入1 mL饱和NaCl水溶液,用9 mL乙酸乙酯分3次洗涤,并将洗涤液转入。涡旋3 min后,静置分层,用滴管小心移出上层乙酸乙酯至圆底烧瓶中,再用8 mL乙酸乙酯分2次萃取转化液,乙酸乙酯合并,并于50℃浓缩至干,待净化。
1.3.3 样品净化
用带活塞玻璃层析柱(200 mm×10 mm)净化。称取5%水失活的弗罗里硅土3 g,用正己烷湿法装柱,上、下端各加2 cm无水硫酸钠,0.2 g硅土与炭粉混合物(两者质量比为9∶1),加在弗罗里硅土上。用15 mL正己烷+乙酸乙酯液(体积比1∶1)将待净化液转入柱中,然后用45 mL体积比3∶1的正己烷+乙酸乙酯混合液洗脱,收集洗脱液,并浓缩至干,用乙腈定容至5 mL,经气相色谱分析。
1.3.4 色谱条件
检测器:μECD;色谱柱:HP-5MS石英毛细管柱(15 m×0.32 mm,0.25 μm);柱温:初温180℃,保持1 min,以20℃/min的速率升至270℃,再以10℃/min的速率升至300℃,保持5 min;载气(N2)流速:2.5 mL/min;进样口温度:300℃;压力:66.75 kPa;检测器温度:300℃;尾吹气(N2)流速:25 mL/min;进样方式:不分流进样;进样体积:1 μL。定量方式:外标法定量。IN-EQW78相对保留时间为8.27~8.35 min。
1.3.5 氯虫苯甲酰胺残留量的计算
氯虫苯甲酰胺残留量按下列公式计算。
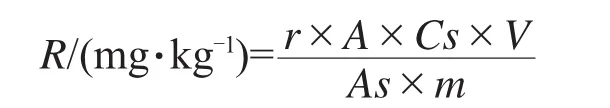
式中:R—样品中氯虫苯甲酰胺残留量,mg/kg;A—样品溶液中IN-EQW78峰面积;As—标样溶液中IN-EQW78峰面积;Cs—标样溶液中IN-EQW78的质量浓度,mg/L;V—样品溶液最终定容体积,mL;m—样品质量,g;r—氯虫苯甲酰胺的相对分子质量与IN-EQW78相对分子质量之比。
2 结果与分析
2.1 分析方法的线性相关性
将IN-EQW78标准乙腈贮备液(1.0 g/L)用乙腈配成质量浓度为0.01,0.05,0.10,0.50,1.00 mg/L的系列标样溶液。在色谱仪上进样1 μL,得对应的峰面积,由峰面积对标样的质量作相关曲线。方法线性回归方程为y=154 348 x-191.35,相关系数(R2)为0.999 9,线性范围为1.0×10-12~1.0×10-9g。
2.2 分析方法的准确度和精密度
准确称取蔗叶、蔗茎各空白样品10.0 g,设定氯虫苯甲酰胺的添加浓度为0.02,0.2,2.0 mg/kg,每浓度重复5次,3个空白对照,按上述方法检测,结果见表1。测定结果表明:当添加浓度为0.02~2.0 mg/kg时,蔗叶中氯虫苯甲酰胺回收率为77.99%~99.22%,相对标准偏差为1.50%~8.63%;蔗茎中氯虫苯甲酰胺回收率为84.05%~104.73%,相对标准偏差为3.67%~7.75%。准确度和精确度均符合农药残留分析的要求。IN-EQW78标样及样品添加谱图见图1~图3。
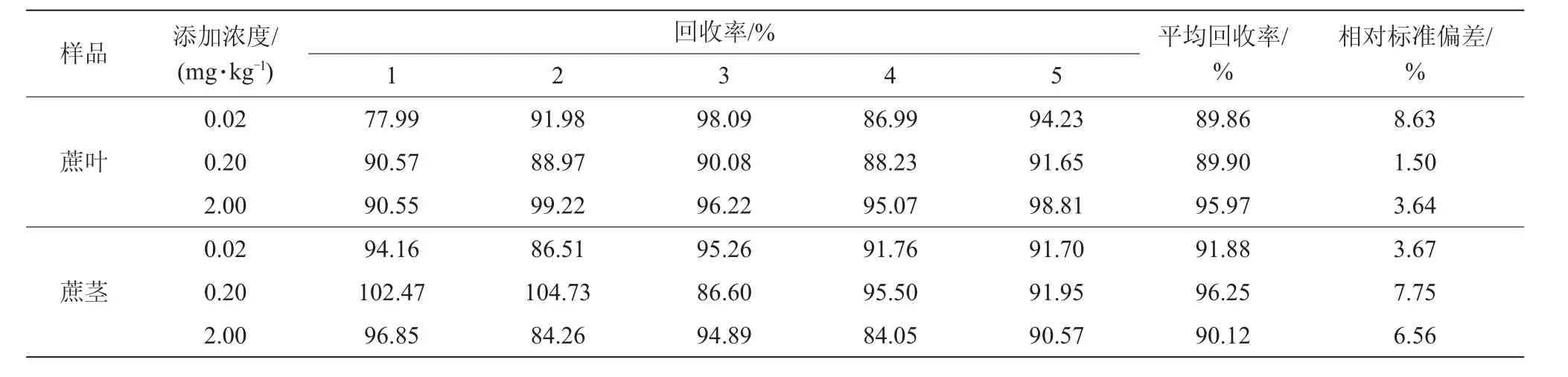
表1 氯虫苯甲酰胺在蔗茎和蔗叶中的添加浓度及回收率

图1 IN-EQW78标样色谱图

图2 蔗叶空白样品色谱图
图3 蔗叶添加样品色谱图
以仪器基线噪声3倍所对应的浓度值计算,本方法的最小检出量为1.083×10-12g;以仪器基线噪声10倍所对应的浓度值计算,氯虫苯甲酰胺在果蔗植株中的最低检测浓度为0.003 mg/kg。
2.3 样品检测
采用本方法对广西6个主要果蔗区的62份果蔗样品进行了测定。蔗叶和蔗茎中氯虫苯甲酰胺均为未检出,即氯虫苯甲酰胺的检出量均低于其检出限0.001 mg/kg。
2.4 炭粉用量的选择
果蔗样品成分复杂,含水量较大,且表皮含有蜡质层,基质干扰严重,对样品的净化和回收影响很大。在样品转化液净化时加入适量的活性炭粉,既对果蔗样品中的色素和蜡质层等物质有一定的吸附,且对所检测农药组分吸附少。试验采用净化柱弗罗里硅土上层加硅土与炭粉混合物(质量比9∶1)净化,用量分别为0.1,0.2,0.3,0.5 g,炭粉用量为混合物的1/10。采用上述前处理方法,同时添加氯虫苯甲酰胺标样溶液,使得添加浓度为0.1 mg/kg,测定氯虫苯甲酰胺的回收率,结果见表2。
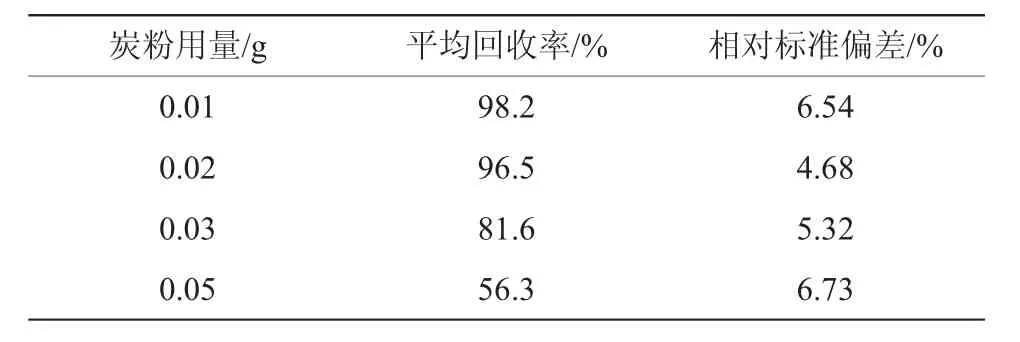
表2 不同炭粉用量下氯虫苯甲酰胺回收率
从表2看出:活性炭用量在0.03~0.05 g之间时,氯虫苯甲酰胺代谢产物IN-EQW78的吸附量较大。活性炭用量为0.02 g时,其对农药吸附较小,且又对干扰组分有一定的吸附,能满足检测分析的要求。
3 小结
本研究建立了果蔗中氯虫苯甲酰胺残留检测分析方法。采用乙腈浸泡提取,二氯甲烷液-液萃取后,再将氯虫苯甲酰胺转化为可被气相色谱μECD检测的代谢物IN-EQW78,之后再经萃取,弗罗里硅土柱进一步净化后,经GC-μECD进行定量测定。运用本方法对广西6个主要果蔗区62份果蔗样品进行了测定。该方法具有分离效果好,回收率高,准确度和灵敏度高的特点,能满足农药残留分析要求。
[1]徐尚成,俞幼芬,王晓军,等.新杀虫剂氯虫苯甲酰胺及其研究开发进展[J].现代农药,2008,7(5):8-11.
[2]于永浩,龙秀珍,曾宪儒,等.200 g/L氯虫苯甲酰胺悬浮剂对甘蔗螟虫的防效及对甘蔗产量的影响[J].安徽农业科学,2013,41 (34):13230-13231.
[3]Kar A,Mandal K,Singh B.Decontamination of Chlorantraniliprole Residues on Cabbage and Cauliflower Through Household ProcessingMethods[J].BullEnvironContamToxicol,2012,88(4):501-506. [4]占绣萍,马琳,陈建波.高效液相色谱法测定蔬菜和土壤中氯虫苯甲酰胺甲氧虫酰肼的残留[J].现代农药,2010,9(5):47-50.
[5]Xu P J,Ren Y,Zhou Z G,et al.Determination of Chlorantraniliprole in Vegetables,Fruits and Grains by SPE Clean-up and LC-UV [J].Chromatographia,2010,72(7/8):763-766.
[6]Malhat F M.Determination of Chlorantraniliprole Residues in Grape by High-Performance Liquid Chromatography[J].Food Anal Methods,2012,5(6):1492-1496.
[7]陈小军,王萌,范淑琴,等.QuEChERS前处理结合UPLC-MS/MS法分析氯虫苯甲酰胺在甘蓝和土壤中的残留[J].中国农业科学, 2012,45(13):2636-2647.
[8]朱建华,赵莉.液相色谱串联质谱法测定果蔬中的唑虫酰胺、氟啶虫酰胺、氯虫苯甲酰胺及氟虫双酰胺残留[J].分析测试学报, 2011,30(6):646-650.
[9]Schwarz T,Snow T A,Santee C J,et al.QuEChERS Multiresidue Method Validation and Mass Spectrometric Assessment for the Novel Anthranilic Diamide Insecticides Chlorantraniliprole and Cyantraniliprole[J].J Agric Food Chem,2011,59(3):814-821.
[10]钱鸣蓉,章虎,吴俐勤,等.高效液相色谱-串联质谱法测定蔬菜中氯虫苯甲酰胺和氟虫双酰胺残留[J].分析化学,2010,38(5): 702-706.
[11]Caboni P,Sarais G,Angioni A,et al.Liquid Chromatography Tandem Mass Spectrometric Ion-Switching Determination of ChlorantraniliproleandFlubendiamideinFruitsandVegetable[J].JAgric Food Chem,2008,56(17):7696-7699.
[12]Dong F S,Xu J,Liu X G,et al.Determination of Chlorantraniliprole Residues in Corn and Soil by UPLC-ESI-MS/MS and Its Application to a Pharmacokinetic Study[J].Chromatographia,2011,74 (5/6):399-406.
[13]Ramasubramanian T,Paramasivam M,Salin K P,et al.Dissipation Kinetics of Chlorantraniliprole in Soils of Sugarcane Ecosystem[J]. Bull Environ Contam Toxicol,2012,89(6):1268-1271.
(责任编辑:顾林玲)
Study on the Analytical Method of Chlorantraniliprole Residues in Chewing Cane
YANG Yu-xia,LAO Shui-bing,ZHOU Qi-feng,WANG Tian-shun,MO Ren-fu*
(Research Institute of Agro-products Quality Safety and Testing Technology,Guangxi Academy of Agriculture Sciences/Quality Supervision and Testing Center for Sugarcane,China Ministry of Agriculture,Nanning 530007,China)
An analytical method was established for determining of chlorantraniliprole residues in chewing cane. Samples were extracted by acetonitrile,then chlorantraniliprole transformed to its derivative IN-EQW78.The derivative was extracted by ethyl acetate,cleaned up on the florisil column and then determined by GC with μECD.The results showed that at the concentration of 0.01-1.0 mg/kg,the method showed a good linear relation with the correlation coefficient of 0.999 9.The recoveries of chlorantraniliprole in chewing cane and cane leaves ranged from 84.05%to 104.73%and from 77.99%to 99.22%,the coefficients of variation were 3.67%-7.75%and 1.50%-8.63%.The method was sensitive,accurate,convenient and could determinate chlorantraniliprole residues in chewing cane.
chewing cane;chlorantraniliprole;transform;IN-EQW78;gas chromatography;residue
TQ 450.2+63
A
10.3969/j.issn.1671-5284.2017.01.012
2016-08-13;
2016-08-26
国家自然科学基金面上项目(21567007);广西农科院科技发展基金青年专项(桂农科2014JQ16);广西农科院基本科研业务费重点项目(桂农科2014YZ25);广西农科院科技发展基金重点项目(桂农科2016JZ12)
杨玉霞(1981—),女,河南省商丘市人,助理研究员,硕士,主要从事农药残留分析及其安全评价工作。E-mail:yang.yx2325@163.com
莫仁甫(1964—),男,广西壮族自治区来宾市人,副研究员,主要从事农药残留分析及安全评价工作。E-mail:morenfu@tom.com
