妊娠期糖尿病孕妇大网膜下脂肪组织全基因组DNA甲基化研究
2017-02-17祁文瑾马润玫
钱 源,孙 浩,肖 雪,祁文瑾,张 兰,马润玫
·论著·
妊娠期糖尿病孕妇大网膜下脂肪组织全基因组DNA甲基化研究
钱 源1*,孙 浩2,肖 雪1,祁文瑾1,张 兰1,马润玫1
背景 大网膜下脂肪组织与妊娠期糖尿病(GDM)密切相关,目前,关于GDM孕妇大网膜下脂肪组织全基因组DNA甲基化研究较少。目的 研究GDM孕妇和无GDM孕妇大网膜下脂肪组织全基因组DNA甲基化差异,为寻找GDM可能的致病基因提供线索。方法 选取2012年1月—2014年5月于昆明医科大学第一附属医院妇产科门诊定期产前检查并入院分娩的GDM孕妇3例为病例组,同期健康孕妇3例为对照组。剖宫产术中剥离大网膜下脂肪组织,提取全基因组DNA。经变性和扩增后酶切扩增产物,将DNA片段与Illumina Methylation BeadChip芯片进行杂交。根据Methylation Analysis Algorithms 生成各样本每个位点的甲基化水平,经过偏差校正和位点过滤,得到甲基化水平。采用DAVID数据库对具有显著性差异的甲基化基因进行Gene Ontology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)信号通路分析。另分别选取同期GDM孕妇和无GDM孕妇各5例,验证候选基因启动子区域甲基化水平差异。结果 病例组1 298个基因低甲基化,1 570个基因高甲基化,其中TMEM195、TCF7L2、IGF1、IGF1R甲基化可能与血糖调控密切相关,DGKG、NRXN3甲基化可能与体质指数(BMI)密切相关。GO功能分析显示,低甲基化基因参与的生物学过程主要是级联反应的活性调节、细胞凋亡调节及蛋白转运等,细胞成分主要为细胞外基质;高甲基化基因参与的生物学过程主要是抗原处理和呈递、主要组织相容复合体(MHC)Ⅱ参与的抗原处理和呈递,细胞成分主要为肌动骨架蛋白、MHC等。KEGG信号通路分析中,富集数>20.000的通路有抗原处理和呈递(富集数为23.142)、过氧化物酶体增殖物激活受体(PPAR)信号通路(富集数为22.068)。分别选取参与抗原处理和呈递、PPAR信号通路中的甲基化差异基因人类白细胞抗原G(HLA-G)、PPARGC1A进行验证。GDM孕妇大网膜下脂肪组织HLA-G启动子区域甲基化水平高于无GDM孕妇(t=4.968,P=0.001)。两者大网膜下脂肪组织PPARGC1A启动子区域甲基化水平比较,差异无统计学意义(t=0.929,P=0.380)。结论 GDM孕妇和健康孕妇大网膜下脂肪组织基因甲基化位点和水平存在显著差异,甲基化差异基因主要参与抗原处理和呈递及PPAR信号通路途径。
糖尿病,妊娠;DNA甲基化;脂肪组织;抗原呈递;过氧化物酶体增殖物激活受体;全基因组关联研究
钱源,孙浩,肖雪,等.妊娠期糖尿病孕妇大网膜下脂肪组织全基因组DNA甲基化研究[J].中国全科医学,2017,20(2):159-164.[www.chinagp.net]
QIAN Y,SUN H,XIAO X,et al.Whole genome DNA methylation in the visceral omental adipose tissue of patients with gestational diabetes mellitus[J].Chinese General Practice,2017,20(2):159-164.
妊娠期糖尿病(GDM)指在妊娠过程中发生的糖耐量异常,是妊娠期常见并发症之一。GDM的发生与糖脂代谢紊乱密切相关,严重危害母婴健康。孕妇妊娠前体质量、妊娠期体质量增加与GDM的发生密切相关。研究显示,大网膜下脂肪组织与代谢相关疾病具有较高的关联性[1-9]。表观遗传学是指在不改变DNA序列的条件下发生的可遗传基因表达的改变,DNA甲基化是其中的一种重要方式。DNA甲基化在脂肪组织生长发育过程中发挥重要作用,特别是启动子区域的甲基化可以调控脂肪细胞分化转录因子,转录辅助因子及多种脂肪组织特异性基因的表达[10-12],其与GDM的发生密切相关。与皮下组织不同,大网膜下脂肪组织在解剖学上拥有更丰富的血流和神经分布,表达更高的细胞因子或底物受体,具有更活跃的细胞代谢活性,使其对人体交感神经系统更敏感,分泌更多的脂肪因子和输出更多的游离脂肪酸,与代谢相关疾病的关联更高。目前,对于妊娠期大网膜下脂肪组织DNA甲基化研究较少,特别是在全基因组水平研究更少。本研究应用全基因组DNA甲基化芯片技术研究GDM孕妇与无GDM孕妇大网膜下脂肪组织的全基因组DNA甲基化水平,对比和分析两者中基因甲基化位点和水平的差异,筛选与GDM相关的目标基因,选取可能的候选基因并进一步扩大样本进行验证,从而为GDM的预防、治疗,及其发生、发展机制的研究提供重要线索。
1 对象与方法
1.1 研究对象 选取2012年1月—2014年5月于昆明医科大学第一附属医院妇产科门诊定期产前检查并入院分娩的GDM孕妇3例为病例组,纳入标准:经75 g口服葡萄糖耐量试验(OGTT)诊断为GDM,既往无高血压、糖尿病及心、肝、肾疾病,无自身免疫性疾病,无重大疾病家族史。另选取同期健康孕妇3例为对照组,纳入标准:75 g OGTT正常,既往无高血压、糖尿病及心、肝、肾疾病,无自身免疫性疾病,无重大疾病家族史。受试者及其家属对本研究知情同意,本研究获得昆明医科大学伦理委员会批准。
1.2 方法
1.2.1 样本采集 在剖宫产术中迅速剥离0.5 cm×0.5 cm×0.5 cm的大网膜下脂肪组织,立即存储于RNAlater中,于-80 ℃超低温冰箱中冻存。
1.2.2 基因组DNA提取和DNA甲基化水平的检测 大网膜下脂肪组织全基因组DNA采用TIANamp 全基因组DNA提取试剂盒〔天根生化科技(北京)有限公司〕提取。将基因组DNA亚硫酸盐处理,变性和扩增后,采用随机内切酶酶切扩增产物。将DNA片段与Illumina Methylation BeadChip芯片进行杂交,通过芯片上的特异性捕获探针与互补的酶切基因片段结合,杂交过夜,清洗后进行单碱基延伸和染色,扫描。
1.2.3 差异性基因筛选 将扫描得到的原始数据,通过Genome Studio软件,根据Methylation Analysis Algorithms 生成各样本每个位点的甲基化水平,经过偏差校正和位点过滤,得到甲基化水平结果。两组样本进行配对的甲基化分析,筛选差异甲基化位点的标准为:α=0.05,β=0.20。使用DAVID数据库对具有显著性差异的甲基化基因进行Gene Ontology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)信号通路分析。
1.2.4 候选基因验证 另分别选取同期GDM孕妇和无GDM孕妇各5例,按上述方法进行样本采集、全基因组DNA提取和亚硫酸盐处理。 KEGG信号通路分析中,富集数>20.000的信号通路有抗原处理和呈递、过氧化物酶体增殖物激活受体(PPAR)。采用Qiagen公司PyroMark PCR kit试剂盒,选取参与抗原处理和呈递、PPAR信号通路的基因人类白细胞抗原G(HLA-G)、PPARGC1A,PyroMark Assay Design Software 2.0软件设计扩增引物和测序引物,并在扩增引物的下游引物序列5′端进行生物素标记。HLA-G扩增引物序列:上游:5′-AAGAGTATAGGAGGATAGGTAAGG-3′,下游:5′生物素标记-AACACCATAACCACCATCCTTAAC-3′;测序引物序列:5′-AAGATTTAGGGAGATATTGAGATAG-3′,5′-ATAGGYGGTGTATGGGTTGGGGAGG-3′,5′-TATTAGGTGATAGGTTTTTAGAGAAG-3′。
PPARGC1A扩增引物序列1:上游:5′-GGGTATTAGGGTTGGAATTTAATGT-3′,下游:5′生物素标记-CTTCCTTCTAATTATTTCCATTTCTCTCA-3′;扩增引物序列2:上游:5′-TTGAAAGGATGGGGTTTTGTG-3′,下游:5′生物素标记-AAACTCCTCCACCCAAAATTC-3′;扩增引物序列3:上游:5′-AGGGGATTTTGGTTATTATATGGT-3′,下游:5′生物素标记-AAACCAACTTTAAATACCACAAACTCTA-3′;测序引物序列:5′-GTATTTTAAGGTAGTTAGGGA-3′,5′-GTTGATTTGAGTAGAGTAGTA-3′,5′-GGAGTAAAGAAAATTGTAGTAAT-3′,5′-GGATTTTGGTTATTATATGGTTAG-3′。按上述方法检测HLA-G、PPARGC1A启动子区域甲基化水平。PCR条件为95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共55个循环;72 ℃继续延伸5 min。
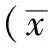
2 结果
2.1 两组全基因组DNA甲基化水平检测 全基因组DNA甲基化水平检测发现,病例组1 298个基因低甲基化,1 570个基因高甲基化。将甲基化差异基因与全基因组多态相关比较研究(GWAS)报道的与肥胖病理特征密切相关的基因对比后,发现共有42个甲基化差异基因。可能与妊娠期的体质量、血压、心血管疾病、2型糖尿病、血脂和血糖等密切相关,其中TMEM195、TCF7L2、IGF1、IGF1R甲基化可能与血糖调控密切相关,DGKG、NRXN3甲基化可能与体质指数密切相关(见表1)。
表1 本研究结果与GWAS发现的相同甲基化差异基因列表
Table1ThedifferentmethylationgenesofthisstudywhichwereidenticalwithGWAS

与肥胖相关的病理特点甲基化差异基因遗传表型体质指数和体质量DGKG、NRXN3与体质指数、体质量增加和下降相关代谢综合征GALNT2、MICB、CAMK2B、TMEM195、TCF7L2与代谢综合征相关血压CNTN4、BAT2、MSRA、C10orf107、PLE⁃KHA7、FLJ32810、ATP2B1、PTPN11肥胖、高血压心血管疾病KLHL29、TCF7L2、APOA4、ATP2B1、SMAD3、SMG6、STX16、CUX2、PTPN11心血管疾病的危险因子,冠心病2型糖尿病RBMS1、MAEA、TCF7L2、GRK5、KCNQ1、CMIP、PALM2、TGFBR3、WISP12型糖尿病的相应病症血脂GALNT2、DNAH11、APOA1、C12orf51、CMIP胆固醇、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、三酰甘油脂肪组织KIAA0495、ZNF608、CNTNAP2、MSRA、BICD2皮下脂肪和内脏脂肪血糖TMEM195、TCF7L2、IGF1、IGF1R空腹血糖胰岛素TCF7L2、PCBP3与空腹胰岛素、胰岛素抵抗相关
2.2 遗传信息学分析 甲基化差异基因的GO功能分析显示,低甲基化基因参与的生物学过程主要是级联反应的活性调节、细胞凋亡调节及蛋白转运等,细胞成分主要为细胞外基质;高甲基化基因参与的生物学过程主要是抗原处理和呈递、主要组织相容复合体(MHC)Ⅱ参与的抗原处理和呈递,细胞成分主要为肌动骨架蛋白、MHC等。KEGG信号通路分析中,富集数>20.000的通路有抗原处理和呈递(富集数为23.142)、PPAR信号通路(富集数为22.068)。
2.3 验证性分析 分别选取参与抗原处理和呈递、PPAR信号通路中的甲基化差异基因HLA-G、PPARGC1A,在5例GDM孕妇和5例无GDM孕妇中进行甲基化水平验证。GDM孕妇大网膜下脂肪组织HLA-G启动子区域甲基化水平为(88.64±12.16)%,高于无GDM孕妇的(60.12±4.12)%,差异有统计学意义(t=4.968,P=0.001)。GDM孕妇、无GDM孕妇大网膜下脂肪组织PPARGC1A启动子区域甲基化水平分别为(35.12±6.28)%、(38.76±6.12)%,差异无统计学意义(t=0.929,P=0.380)。
3 讨论
GDM代谢紊乱的主要特点是胰岛素抵抗。在疾病早期,可通过代偿性增加胰岛素分泌,产生高胰岛素血症,维持血糖水平正常。当该过程发展到超过机体代偿极限,则表现为2型糖尿病。脂肪细胞基因组中的甲基化状态与体质指数、空腹血糖、胰岛素及胰岛素抵抗密切相关,皮下脂肪组织中的瘦素(LEP)、肿瘤坏死因子α(TNF-α)基因启动子的甲基化水平偏低,说明DNA甲基化的异常极可能是导致GDM发生的重要原因[12]。近年来,随着高通量DNA甲基化检测技术的出现,启发了疾病中DNA甲基化的特点,筛选与疾病相关的甲基化生物标记的研究。
GDM的病因涉及遗传、环境、疾病等诸多方面,其发病机制也相当复杂,到目前为止,尚未完全揭示清楚。表观遗传较好解释了复杂疾病的“遗传性丢失”以及不同个体在GDM易患性上存在的差异,较瘦的个体也可能会出现胰岛素抵抗和代谢综合征,并非所有的肥胖个体均会发展成为胰岛素抵抗。本研究旨在寻找GDM孕妇与健康孕妇全基因组DNA甲基化具有差异的基因,推测其可能参与的生物学过程,并对信号通路上的甲基化差异基因进行验证。结果显示,GDM孕妇共有1 298个基因低甲基化,1 570个基因高甲基化。部分差异基因分别参与了糖酵解、三酰甘油合成、三羧酸循环、脂肪酸β氧化、线粒体电子传递以及氧化磷酸化等能量代谢、细胞凋亡、细胞周期以及DNA损伤和修复过程[13-18]。
本研究将甲基化差异基因与GWAS发现的表型相关联的基因列表进行了对比,得到GDM孕妇大网膜下脂肪组织中与之相覆盖的42个基因。这些基因与个体的体质量、体质指数、血压、血脂、血糖、空腹胰岛素等表型特征密切相关。提示这些甲基化差异基因可能参与了胰岛素抵抗过程,在GDM的发生和发展中具有重要作用,并有可能是GDM的致病基因。
本研究结果显示,在大网膜下脂肪组织中,甲基化差异基因主要参与抗原处理和呈递以及PPAR信号转导。脂肪组织是许多细胞的混合体,包括脂肪细胞(占20%~40%)、成纤维细胞、前脂肪细胞、干细胞和免疫细胞。本研究结果是多种细胞混合检测后的结果。因此,根据细胞类型决定其主要的信号通路,GDM孕妇大网膜下脂肪组织中以抗原处理和呈递、PPAR信号通路为主。该结果与高甲基化差异基因GO功能分析相近,与GDM的病理特征一致。
GDM的病理特征之一为常伴有不同于感染、损伤等应激因素作用下的炎性反应[19]。肥胖所致的脂肪组织炎症可能是胰岛素抵抗的首要原因[20]。据报道,脂肪组织的缺氧和过氧化反应导致机体的自然免疫和低度炎性疾病,并且由脂肪组织中的免疫细胞参与了自然免疫和诱发炎症的过程[21]。参与炎性反应的细胞主要是脂肪组织中的免疫细胞,HLA是该过程中的重要分子成分。HLA是目前已知的最为复杂的调控人体特异性免疫应答和决定疾病易患性个体差异的主要基因系统。HLA参与的抗原处理和呈递信号通路所致的炎症在GDM中具有重要作用[22]。推测该信号通路上的差异基因异常表达引起机体产生特异的慢性炎症,成为GDM疾病特征之一。
GDM的另一病理特征为患者体内存在糖脂代谢紊乱及高胰岛素,PPAR信号通路是导致糖脂代谢紊乱和高胰岛素的重要通路。PPAR是一类由配体激活的核转录因子,属于核内受体转录因子超家族,受到相应配体激活后,可与靶基因启动子内的反应原件结合,调控靶基因的转录。PPAR信号通路具有多重生物功效,能增强脂肪组织对胰岛素的敏感性,促进脂肪分解,保持葡萄糖的合成以及分解平衡,以及抑制炎症[23]。推测该信号通路上的基因甲基化升高或降低,影响相应蛋白的表达,导致胰岛素抵抗和糖脂代谢紊乱,诱发GDM的发生、发展。
PPAR信号通路中的PPARGC1A基因富含于脂肪组织中,PPARGC1A是一种转录协同激活因子,与糖皮质激素受体等多种转录因子结合后参与体内能量代谢。抗原处理和呈递信号通路中的HLA-G属非典型HLAⅠ类分子,是重要的免疫耐受分子,在妊娠期特异出现。本研究分别选取了参与两条信号通路中的基因进一步验证,考虑到基因不同区域甲基化的差异以及启动子区域甲基化水平与表达的相互关系,仅研究了候选基因启动子区域的甲基化水平。GDM孕妇HLA-G高甲基化水平可能是通过参与调控机体的免疫炎性反应,从而影响GDM过程。PPARGC1A与人体胰岛素释放有关,其甲基化水平与胰岛素抵抗密切相关,推测该基因的甲基化水平可能是通过调控体内的糖脂代谢,引起胰岛素抵抗,引发GDM的发生、发展。但在本研究中,GDM孕妇与健康孕妇PPARGC1A甲基化水平未见差异,可能是由于验证的样本例数较少,需增加更多样本量进一步讨论其差异性。
综上所述,本研究采用基因芯片对GDM孕妇和健康孕妇大网膜下脂肪组织进行全基因组DNA甲基化检测,发现两者基因的甲基化位点和水平存在显著差异;甲基化差异基因主要参与抗原处理和呈递及PPAR信号通路途径。
编后语:
该结论为更加准确分析GDM的发病机制和寻找可能的候选基因提供了依据,并为研究GDM的致病机制提供思路。由于取样困难,本研究纳入的样本量较少,且验证的候选基因选取数量较少,并未完全验证多数甲基化差异基因,无法对信号通路上差异基因进行系统研究。未来需选取可能与表型和功能密切相关的差异基因,验证后进行信号通路研究,在细胞和动物模型上进行功能研究,以进一步探讨GDM发生的遗传学机制。
作者贡献:钱源进行课题设计与实施、资料收集整理、质量控制、成文并对文章负责;孙浩负责数据分析;肖雪负责基因组甲基化水平检测;祁文瑾、张兰负责样本收集;马润玫负责课题内容咨询。
本文无利益冲突。
[1]骆天红,赵萸,李果,等.肥胖及2型糖尿病患者内脏脂肪基因差异表达研究[J].中国应用生理学杂志,2007,23(2):229-234. LUO T H,ZHAO Y,LI G,et al.Identification of genes that are differently expressed in omental fat of normal weight subjexts,obese subjects and obese diabetic patients[J].Chinese Journal of Applied Physiology,2007,23(2):229-234.
[2]李晓南,陈荣华,Tommy Olsson,等.人类皮下和网膜脂肪组织脂肪细胞因子的表达[J].江苏医药,2005,31(12):914-916. LI X N,CHEN R H,OLSSON T,et al.Expreesion of adipocytokines in human subcutaneous and omental adipose tissues[J].Jiangsu Medical Journal,2005,31(12):914-916.
[3]张磊,石琳琳,卢丹,等.单纯性肥胖及肥胖伴2型糖尿病患者血清中瘦素水平的变化及其与胰岛素抵抗的关系[J].吉林大学学报(医学版),2005,31(1):130-132. ZHANG L,SHI L L,LU D,et al.Changes of serum leptin and their relationships with insulin resistance in patients with simple obesity and patients with type 2 diabetes mellitus complicated with obesity[J].Journal of Jilin University(Medicine Edition),2005,31(1):130-132.
[4]叶小龙,王长江,林刚,等.Visfatin在2型糖尿病患者腹部皮下和网膜脂肪组织中的表达及其与胰岛素抵抗的关系[J].安徽医科大学学报,2007,42(2):205-207. YE X L,WANG C J,LIN G,et al.Expression of visfatin mRNA in subcutaneous and omental adipose tissue of type 2 diabetes and their relation with insulin resistance[J].ACTA Universitatis Medicinalis Anhui,2007,42(2):205-207.
[5]李晓南,陈荣华,潘亚,等.人类皮下和网膜脂肪组织中脂联素基因的表达和调控的研究[J].南京医科大学学报(自然科学版),2006,26(1):6-9. LI X N,CHEN R H,PAN Y,et al.Adiponectin gene expression in human subcutaneous and omental adipose tissue [J].ACTA Universitatis Medicinalis Nanjing(Natural Science),2006,26(1):6-9.
[6]吴海娅,贾伟平,魏丽,等.肥胖及2型糖尿病患者血清视黄醇结合蛋白4水平的变化及其临床意义[J].中华内分泌代谢杂志,2006,22(3):290-293. WU H Y,JIA W P,WEI L,et al.Change and clinical significance of serum retinol binding protein-4 levels in patients with obesity and type 2 diabetes[J].Chinese Journal of Endocrinology and Metabolism,2006,22(3):290-293.
[7]计晨琳,孙斌,韩素萍,等.不同年龄女性脂肪组织11βHSD1 mRNA表达水平及临床意义[J].中国老年学杂志,2012,32(18):3878-3880. JI C L,SUN B,HAN S P,et al.Expression and clinical significance of 11βHSD1 mRNA in adipose tissues of women in different ages[J].Chinese Journal of Gerontology,2012,32(18):3878-3880.
[8]钱源,宗迪,马润玫,等.Luminex液相芯片技术检测与胰岛素抵抗相关的脂肪细胞因子水平在妊娠期糖耐量受损孕妇中的相关性研究[J].中国产前诊断杂志(电子版),2012,4(4):10-13. QIAN Y,ZONG D,MA R M,et al.Study on the relationship between the level of adipocyte factor related to insulin resistance by Luminex liquid chip technology among pregnant women with impaired glucose tolerance[J].Chinese Journal of Prenatal Diagnosis(Electronic Version) ,2012,4(4):10-13.DOI:10.3969/j.issn.1674-7399.2012.04.003.
[9]李冰,杨菊红,王慧杰,等.Chemerin基因在自发性2型糖尿病大鼠脂肪组织中表达的研究[J].天津医科大学学报,2010,16(3):447-450. LI B,YANG J H,WANG H J,et al.Expression of Chemerin mRNA in the adipose tissue of spontaneous type 2 diabetic rat[J].Journal of Tianjin Medical University,2010,16(3):447-450.
[10]张思佳,乔虹.DNA甲基化与人类糖尿病的研究进展[J].中国老年学杂志,2014,34(10):2896-2898. ZHANG S J,QIAO H.Research progress of DNA methylation and diabetes[J].Chinese Journal of Gerontology,2014,34(10):2896-2898.DOI:10.3969/j.issn.1005-9202.2014.10.141.
[11]杨梅,孙家忠,孙妍蕾,等.Leptin基因甲基化与糖尿病的相关性研究[J].中华医学遗传学杂志,2012,29(4):474-477. YANG M,SUN J Z,SUN Y L,et al.Association between Leptin gene promoter methylation and type 2 diabetes mellitus[J].Chinese Journal of Medical Genetics,2012,29(4):474-477.
[12]易斌,蔡旭,张浩,等.基因组DNA和结缔组织生长因子基因启动子甲基化状态与2型糖尿病肾病的关系[J].中华肾脏病杂志,2012,28(3):189-193. YI B,CAI X,ZHANG H,et al.Association of type 2 diabetic nephropathy with methylation status of genomic DNA and connective tissue growth factor gene promoter[J].Chinese Journal of Nephrology,2012,28(3):189-193.
[13]KENDRICK Z W,FIRPO M A,REPKO R C,et al.Serum IGFBP2 and MSLN as diagnostic and prognostic biomarkers for pancreatic cancer[J].HPB(Oxford),2014,16(7):670-676.
[14]CARPINELLI M R,MANNING M G,KILE B T,et al.Two ENU-induced alleles of Atp2b2 cause deafness in mice[J].PLoS One,2013,8(6):e67479.
[15]HU C C,GAN P,ZHANG R Y,et al.Identification of prostate cancer LncRNAs by RNA-Seq[J].Asian Pac J Cancer Prev,2014,15(21):9439-9444.
[16]PILLAI M M,YANG X,BALAKRISHNAN I,et al.MiR-886-3p down regulates CXCL12(SDF1) expression in human marrow stromal cells[J].PLoS One,2010,5(12):e14304.
[17]TSAI N P,LIN Y L,WEI L N.MicroRNA mir-346 targets the 5′-untranslated region of receptor-interacting protein 140(RIP140) mRNA and up-regulates its protein expression[J].Biochem J,2009,424(3):411-418.
[18]HE J,HUA J,DING N,et al.Modulation of microRNAs by ionizing radiation in human gastric cancer[J].Oncol Rep,2014,32(2):787-793.
[19]PICKUP J C.Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes[J].Diabetes Care,2004,27(3):813-823.
[20]LEE J.Adipose tissue macrophages in the development of obesity-induced inflammation,insulin resistance and type 2 diabetes[J].Arch Pharm Res,2013,36(2):208-222.
[21]LAPPAS M,MITTON A,PERMEZEL M.In response to oxidative stress,the expression of inflammatory cytokines and antioxidant enzymes are impaired in placenta,but not adipose tissue,of women with gestational diabetes[J].J Endocrinol,2010,204(1):75-84.
[22]OSBORN O,OLEFSKY J M.The cellular and signaling networks linking the immune system and metabolism in disease[J].Nat Med,2012,18(3):363-374.
[23]CAPOBIANCO E,MARTNEZ N,FORNES D,et al.PPAR activation as a regulator of lipid metabolism,nitric oxide production and lipid peroxidation in the placenta from type 2 diabetic patients[J].Mol Cell Endocrinol,2013,377(1/2):7-15.
(本文编辑:吴立波)
Whole Genome DNA Methylation in the Visceral Omental Adipose Tissue of Patients with Gestational Diabetes Mellitus
QIANYuan1*,SUNHao2,XIAOXue1,QIWen-jin1,ZHANGLan1,MARun-mei1
1.OfficeofPrenatalDiagnosis,DepartmentofObstetricsandGynecology,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming650032,China2.InstituteofMedicalBiologyChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Kunming650031,China
*Correspondingauthor:QIANYuan,Associatechieftechnician;E-mail:yuanqian2x@hotmail.com
Background The visceral omental adipose tissues were closely associated with gestational diabetes mellitus(GDM).Till now,there had been few reports about genome-wide methylation profile in visceral omental adipose tissues of GDM.Objective To investigate the pathogenesis of GDM by measuring and comparing the genome-wide DNA methylation patterns in visceral omental adipose tissues between pregnant women with GDM and the normal pregnancies,in order to provide the clues for explaining the mechanism and process of GDM.Methods Pregnant women who accepted regular prenatal examination and hospital delivery in Department of Obstetrics and Gynecology,the First Affiliated Hospital of Kunming Medical University from January 2012 to May 2014 were enrolled.Three cases of GDM were enrolled as GDM group,while three cases of healthy pregnant women as control group.The visceral omental adipose tissues were obtained at time of term caesarean section.The genome-wide DNA of these tissues were extracted.The products were cleaved after degeneration and amplification.The DNA fragment were hybridized with Illumina Methylation BeadChip chip.The methylation level of each gene sites were calculated according to Methylation Analysis Algorithms with deviation correction and infiltration.DAVID database was used to carry out Gene Ontology(GO) and Kyoto Encyclopedia of Genes and Genomes(KEGG) signaling pathway analysis in methylation gene with significant difference.Five cases of pregnant women with and without GDM in the same period were selected to verify the difference of methylation level of candidate gene promoter region.Results 1 298 genes were hypomethylated and 1 570 genes were hypermethylated in GDM group.Among them,the methylation of TMEM195,TCF7L2,IGF1 and IGF1R might be closely associated with regulation of blood glucose level.The methylation of DGKG and NRXN3 might be closely associated with BMI.The GO function analysis supported that the genes with hypomethylation were mainly involved in the biological processes,such as the regulation of cascade reaction activity,the regulation of cell apoptosis and protein transport,the cellular components were mainly extracellular matrix.The biological processes involved in the hypermethylated genes were mainly antigen processing and presentation,and antigen processing and presentation participated by major histocompatibility complex(MHC) Ⅱ.The main cellular components were muscle actin cytoskeleton proteins,MHC and so on.In the analysis of KEGG signal pathway,the pathway of enrichment >20.000 had antigen processing and presentation(23.142),PPAR(22.068).The different methylation gene HLA-G and PPARGC1A were respectively selected from antigen processing and presentation and PPAR signal pathway to validate.The methylation level of HLA-G promoter region in the visceral omental adipose tissues of GDM pregnant women was higher than non GDM pregnant women(t=4.968,P=0.001).There was no statistically significant difference in the methylation of PPARGC1A promoter region between GDM pregnant women and non GDM pregnant women(t=0.929,P=0.380).Conclusion There are statistically significant difference in gene methylation sites and levels between GDM and healthy pregnant women.The different methylation gene mainly involve in antigen processing and presentation and PPAR signaling pathway.
Diabetes,gestational;DNA methylation;Adipose tissue;Antigen presentation;Peroxisome proliferator-activated receptors;Genome-wide association study
国家自然科学基金资助项目(81360103);云南省科技厅(2012FB039)——昆明医学院应用基础研究联合专项资金项目;中央高校基本科研业务费&协和青年基金资助项目(33320140013)
R 714.256
A
10.3969/j.issn.1007-9572.2017.02.008
2016-02-10;
2016-09-30)
1.650032云南省昆明市,昆明医科大学第一附属医院妇产科产前诊断室
2.650031云南省昆明市,中国医学科学院&北京协和医科大学医学生物学研究所
*通信作者:钱源,副主任技师;E-mail:yuanqian2x@hotmail.com
