兼并PCR技术反应条件的探索
2017-02-07敬永升王艺霖刘肖肖王洪涛
吴 茜,敬永升,王艺霖,刘肖肖,王洪涛
1.河南大学 生命科学学院,河南 开封 475004; 2.河南大学 药学院,河南 开封475004; 3.南京农业大学 生命科学学院,南京 210095
兼并引物是根据蛋白质的氨基酸序列与其对应基因的碱基序列之间的共线性关系设计出的引物[1]。克隆新蛋白基因时,可通过蛋白质序列的测定获取末端氨基酸序列信息,并依据其氨基酸序列,设计兼并引物进行PCR扩增。使用兼并引物进行PCR扩增是获得新基因和基因家族新成员的常见方法[2],广泛应用于病毒检测、医学诊断等研究领域[3]。在基因家族的研究中,也可根据保守序列设计兼并引物进行PCR扩增,寻找基因家族的新成员[4]。
由于遗传密码子的兼并性,特定氨基酸对应的遗传密码子的第三个碱基并不是唯一的,兼并引物特异性比较低,与模板配对概率一般在0.1%~1%之间。研究发现,退火温度和引物的添加量对兼并引物PCR结果有很大的影响[5]。该研究以砀山酥梨(PyrusbretschneideriRehd.)过氧化物酶同工酶基因克隆为例,依据蛋白质测序获得的N端氨基酸序列信息,设计兼并引物,研究探索兼并引物PCR最佳条件,最终得到了目的基因。
1 材料与方法
1.1 材料
砀山酥梨(采自开封市西郊梨园),EasyPurePlantRNAKitEasy、TaqDNApolymerase(北京全式金生物技术有限公司),ReverAidFirstStrandcDNASynthersiskit(Thermo),dNTPs、DNAMarker-DM2000(康为世纪生物科技有限公司)。引物序列合成(大连宝生物工程有限公司合成):
5’-ATGGCNTGKATHGCNAT
3’-TCATTTTTTTTTTTTTTTT
1.2 方法
1.2.1 核酸的提取 取砀山酥梨果肉,在液氮环境中迅速研磨,用CTAB法提取砀山梨果肉中的基因组DNA。总RNA提取按照RNA提取试剂盒的说明操作。
1.2.2cDNA的合成 将RNA反转录成cDNA,按照ThermoReverAidFirstStrandcDNASynthersiskit的说明进行操作。
1.2.3DNA为模板PCR体系和程序的优化 以DNA为模板进行兼并引物PCR,其体系及程序如表1、表2所示。

表1 以DNA为模板的PCR体系优化

表2 以DNA为模板的PCR程序优化
1.2.4cDNA为模板PCR体系和程序的优化 以cDNA为模板进行兼并引物PCR,其体系及程序如表3、表4所示。
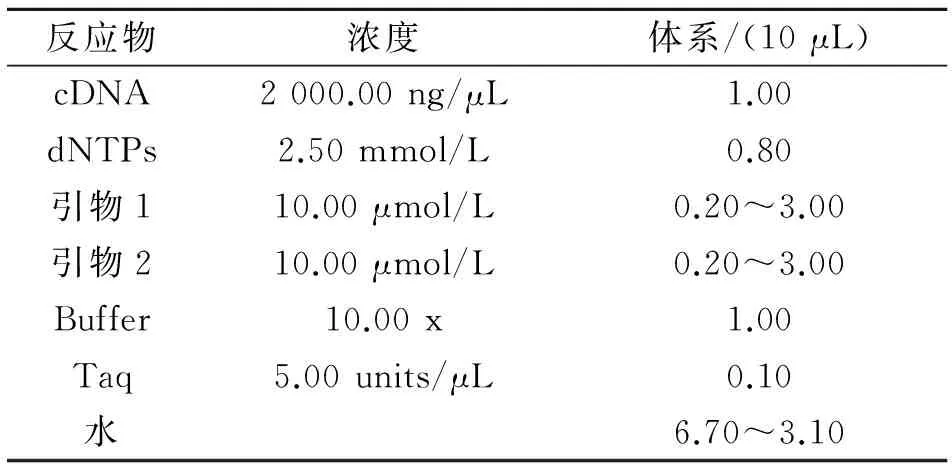
表3 以cDNA为模板的PCR体系优化

表4 以cDNA为模板的PCR程序优化
1.2.5cDNAPCR产物为模板PCR体系和程序的优化 以cDNAPCR产物为模板进行兼并引物PCR,体系及程序如表5、表6所示。
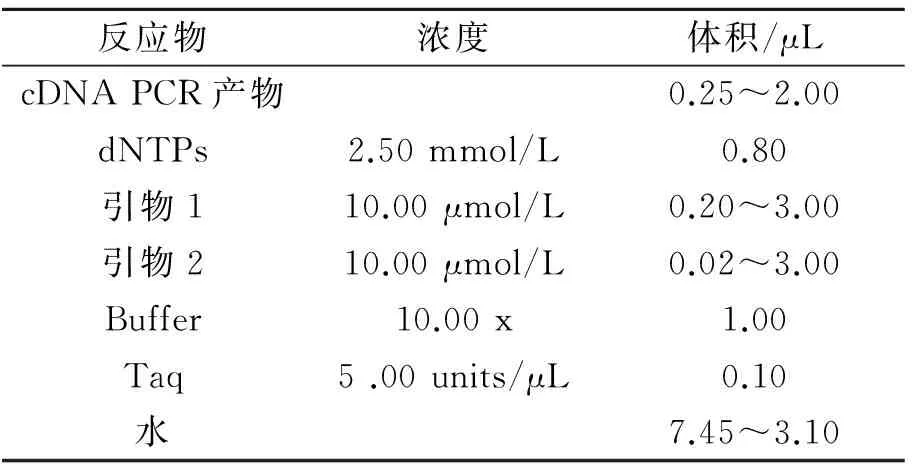
表5 以cDNA PCR产物为模板的PCR体系优化

表6 以cDNA PCR产物为模板的PCR程序优化
1.2.6PCR结果分析 配制0.1%的琼脂糖EB凝胶,使用凝胶电泳技术分析PCR的产物。
2 结果与分析
2.1 RNA提取结果分析
砀山酥梨果肉中总RNA电泳图谱如图1所示。由图1可知,提取到了总RNA。
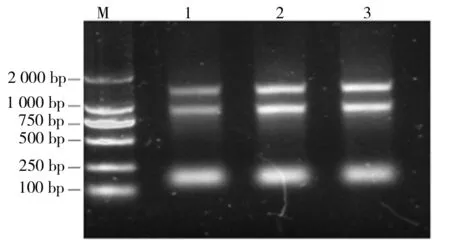
M为2 000 bp的Marker,1~3分别为平行实验的RNA图1 砀山酥梨果肉中总RNA电泳图谱
2.2 以DNA为模板获取目的基因
以DNA为模板,通过退火温度和引物量的优化,获取目的基因。
2.2.1 退火温度的优化 以DNA为模板,引物添加量为0.2μmol/L,退火温度分别为30.0、30.8、32.9、35.1、39.6、43.1、46.9、50.4、54.0、57.1、59.7、60.0 ℃,进行PCR, 并对其产物进行琼脂糖电泳分析。结果如图2所示。引物添加量为0.2μmol/L,退火温度在50.4~54.0 ℃时,PCR结果较好。

M为2 000 bp的Marker,1~12为不同退火温度的PCR产物图2 以DNA为模板的PCR产物电泳图谱
2.2.2 引物添加量配比的优化 以DNA为模板,退火温度为50.0 ℃,引物添加量分别为0.2、0.6、1.0、2.0μmol/L时进行PCR,并对其PCR产物进行琼脂糖电泳分析。结果如图3所示。退火温度为50.0 ℃,引物添加量为0.6~1.0μmol/L时,PCR结果较好。
2.2.3 最适引物配比条件下对退火温度的优化 以DNA为模板,引物添加量为1.0μmol/L,退火温度分别为40.0、40.6、41.9、44.0、46.4、48.7、51.3、53.6、56.0、57.1、59.2、60.0 ℃,进行PCR, 并对其产物进行琼脂糖电泳分析。结果如图4所示。引物添加量为1.0μmol/L,退火温度在51.3~53.6 ℃时PCR结果较好。
由图4结果所示,缩短退火温度梯度范围,退火温度分别为50.0、50.2、50.9、51.8、52.9、53.7、54.8、49.6、55.0 ℃时,再次进行PCR, 并对其PCR产物进行琼脂糖电泳分析。结果如图5所示。当引物添加量为1.0μmol/L,退火温度在53.7~54.8 ℃时PCR结果较好。

M为2 000 bp的Marker,1~4分别为引物添加量不同的PCR产物图3 以DNA为模板的PCR产物电泳图谱

M为2 000 bp的Marker,1~12为不同退火温度的PCR产物图4 以DNA为模板的PCR产物电泳图谱
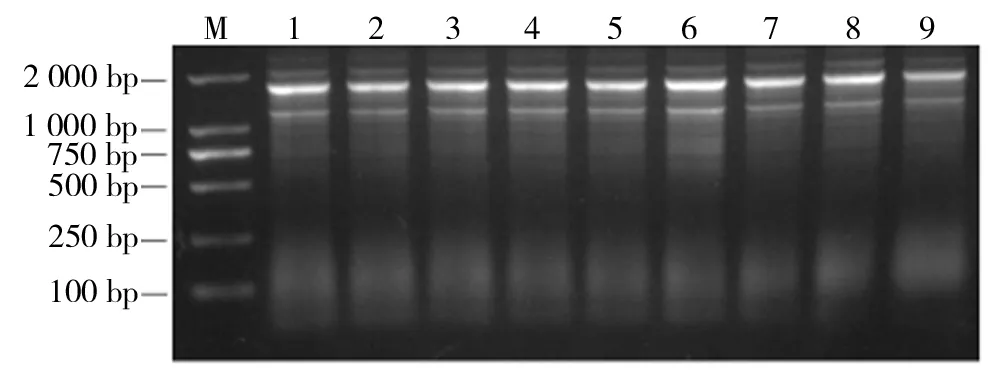
M为2 000 bp的Marker,1~9为不同退火温度的PCR产物图5 以DNA为模板的PCR产物电泳图谱
2.3 cDNA为模板获取目的基因
以cDNA为模板, 通过退火温度和引物添加量的优化,获取目的基因。
2.3.1 退火温度的优化 以cDNA为模板,引物添加量0.2μmol/L,退火温度分别为30.0、30.8、32.9、35.1、39.6、43.1、46.9、50.4、54.0、57.1、59.7、60.0 ℃,进行PCR,对PCR产物进行琼脂糖电泳。结果如图6所示。当引物添加量为0.2μM,退火温度在54.0~59.7 ℃时PCR结果较好。
2.3.2 引物添加量配比的优化 以cDNA为模板,退火温度为50.0 ℃,引物添加量分别为0.2、0.6、1.0、2.0、3.0μmol/L,进行PCR,并对其PCR产物进行琼脂糖电泳分析。结果如图7所示。退火温度为50.0 ℃,引物添加量为1.0μmol/L时PCR结果较好。
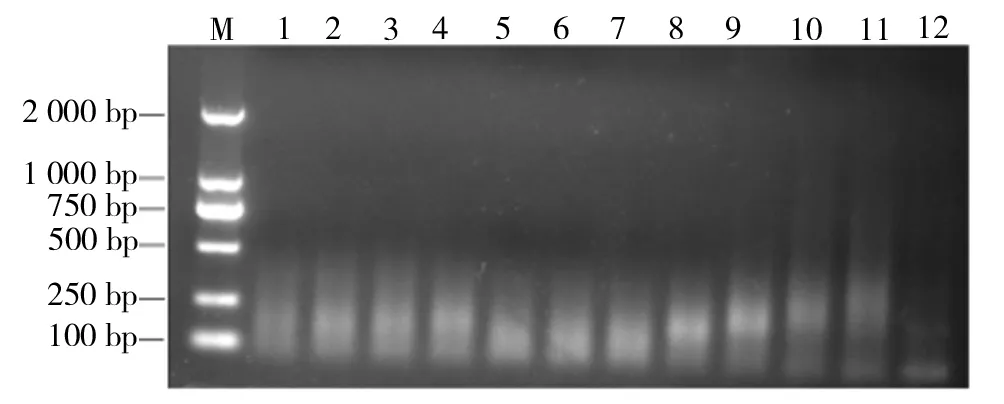
M为2 000 bp的Marker,1~12为不同退火温度的PCR产物图6 以cDNA为模板的PCR产物电泳图谱

M为2 000 bp的Marker,1~5分别为引物添加量不同的PCR产物图7 以cDNA为模板的PCR产物电泳图谱
2.3.3 最适引物配比条件下对退火温度的优化 以cDNA为模板,引物添加量1.0μM,退火温度分别为40.0、40.6、41.9、44.0、46.4、48.7、51.3、53.6、56.0、57.1、59.2、60.0 ℃,进行PCR,并对其PCR产物进行琼脂糖电泳分析。结果如图8所示。引物添加量为1.0μM,退火温度为40.0~50.0 ℃时,PCR效果较好。
由图8结果所示,缩短退火温度梯度范围,退火温度分别为40.0、40.8、41.9、43.2、45.4、47.7、49.2、50.0 ℃,进行PCR,并对PCR产物进行琼脂糖电泳分析。结果如图9所示。引物添加量为1.0μmol/L,退火温度为45.4 ℃时,PCR效果较好。
2.4 cDNA PCR产物为模板获取目的基因
2.4.1 退火温度的优化 将以cDNA为模板45.0℃退火得到的PCR产物再为模板,1∶40的体系添加模板,引物添加量为1.0μmol/L,退火温度分别为40.0、40.8、42.4、44.1、45.4、46.9、48.4、49.8、51.2、52.8、54.2、55.0 ℃,进行PCR,并对其产物进行琼脂糖电泳分析。结果如图10所示。
PCR过程中,以1∶40的体系添加cDNAPCR产物为模板,退火温度为52.8 ℃时,PCR效果较好。
2.4.2 引物添加量配比的优化 退火温度为52.0 ℃,引物添加量1.0μmol/L,以cDNAPCR产物为模板,设置模板添加量。模板添加量与反应体系比分别为1∶40、1∶20、1∶10、1∶5,进行PCR,并对PCR产物进行琼脂糖电泳分析。结果如图11所示。反应体系比例为1∶10~20较好。
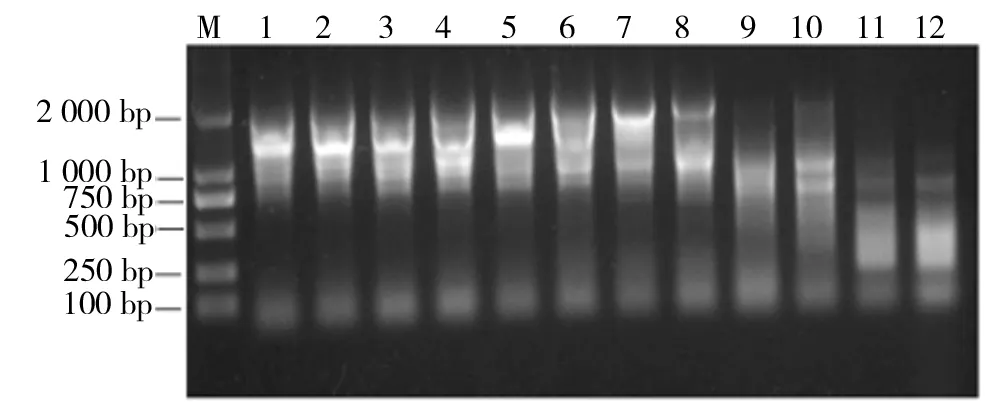
M为2 000 bp的Marker,1~12为不同退火温度的PCR产物图8 以cDNA为模板的PCR产物电泳图谱
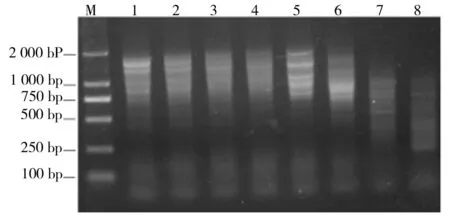
M为2 000 bp的Marker,1~8为不同退火温度的PCR产物图9 以cDNA为模板的PCR产物电泳图谱
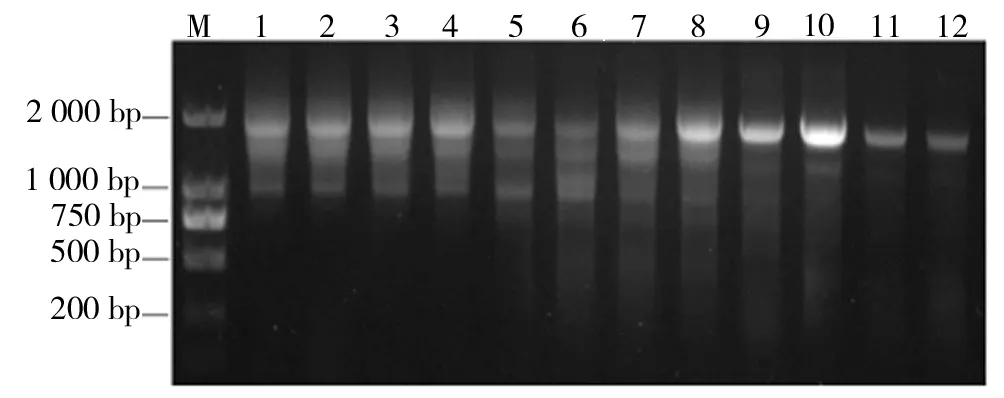
M为2 000 bp的Marker,1~12为不同退火温度的PCR产物图10 以PCR产物为模板再次PCR电泳图谱

M为2 000 bp的Marker,1~4为不同模板添加量图11 以cDNA PCR产物为模板PCR产物电泳图谱
3 讨论
依据蛋白质N端氨基酸序列信息,设计兼并引物能够较好地用于目的基因的克隆。该方法为新基因的克隆提供重要的数据支持。兼并引物的兼并性降低了其自身与模板配对的概率。与特异引物PCR相比,兼并引物PCR克隆目的基因较为困难。目前,通过增加引物浓度和降低退火温度来提高PCR的扩增效率的方法在较多研究中均有应用[6]。杜占文等人在应用兼并引物RT-PCR扩增锌指结构域筛选新基因的实验中,退火温度为30.0℃,体系中引物的浓度为常规PCR引物浓度的100倍[7]。退火温度较高和引物添加量过低时,引物与模板结合困难导致PCR结果不理想;退火温度过低和引物添加量较高时,兼并引物错配概率增大,导致PCR产物中错配基因较多,目的基因不易回收。
该研究以砀山酥梨过氧化物酶基因的克隆为例,依据其氨基酸序列设计兼并引物,分别以DNA、cDNA和cDNAPCR产物为模板,通过设置一系列的退火温度和引物添加量的配比,进行PCR的优化。在尽可能低引物浓度和高退火温度的情况下,获得目的基因。研究发现以DNA为模板进行PCR时,引物添加量为1.0μmol/L(仅为常规PCR引物物添加量的5倍),退火温度在53.7~54.8 ℃时PCR结果较好;以cDNA为模板进行PCR时,退火温度为45.4 ℃,引物添加量为1.0μmol/L时PCR结果较好;以cDNAPCR产物为模板退火温度为52.0 ℃,引物添加量1.0μmol/L,模板添加量与反应体系比分别为1∶10~20时PCR结果较好。该研究为兼并引物PCR设计提供了可靠的实验数据。
[1] 王洪振,周晓馥,宋朝霞,等.简并PCR技术及其在基因克隆中的应用[J].遗传, 2003,25(2):201-204.
[2]WilksFF,KurbanRR,HovensCM,etal.Theapplicationofpolymerasechainreactiontocloningmembersoftheproteintyprosinekinasefamily[J] .Gene, 1989,85(1):67-74.
[3] 丁元明,王继华,刘忠善,等.应用特异引物和简并引物检测百合斑驳病毒[J]. 植物检疫, 2004,3(18):134-137.
[4] 吕星,邢瑞云,郑晖,等.用简并引物扩增与克隆D.radiodurans超氧化物歧化酶和过氧化氢酶基因片段[J].应用与环境生物学报,1995,5(5):515-520.
[5] 史兆兴,王恒樑,苏国富,等.简并PCR及其应用[J]. 生物技术通讯,2004,15(2):172-175.
[6]KnothK,RoberdsS,PoteetC,etal.Highlydegenerate,inosine-containingprimersspecificallyamplifyrarecDNAusingthepolymerasechainreaction[J].NucleicAcidsResearch, 1988,16(22):10932.
[7] 杜占文,张俊武.应用简并引物RT-PCR扩增锌指结构域筛选新基因[J]. 中国医学科学院学报, 2001,23(3):281-284.
