海马CA1区5-HT1A受体调控PTSD大鼠空间记忆的作用*
2017-01-19刘国良孙缦利
林 玲, 刘国良, 孙缦利
(漯河医学高等专科学校,河南 漯河 462002)
海马CA1区5-HT1A受体调控PTSD大鼠空间记忆的作用*
林 玲△, 刘国良, 孙缦利
(漯河医学高等专科学校,河南 漯河 462002)
目的: 观察创伤后应激障碍(PTSD)大鼠海马长时程增强(LTP)的变化以及5-羟色胺1A受体(5-HT1A受体)和突触后致密物蛋白95(PSD-95)的表达,探讨5-HT1A受体调控PTSD大鼠空间记忆的机制。方法: 健康成年SD大鼠36只,随机分为正常对照组和模型组,每组18只。模型组采用连续单一刺激构建PTSD大鼠模型。Morris水迷宫实验检测2组大鼠的学习和记忆能力,电生理实验检测强直性高频刺激对海马LTP的影响,Western blot法和免疫荧光实验检测海马5-HT1A受体和PSD-95蛋白的表达。结果: Morris水迷宫实验结果显示在各实验日模型组大鼠逃避平台的潜伏期较对照组显著延长(P<0.05)。电生理实验结果显示在强直性高频刺激后,2组大鼠海马诱发电位的幅值明显升高,模型组诱发电位的幅值显著低于对照组(P<0.01)。Western blot实验和免疫荧光实验结果显示,与对照组比较, 模型组大鼠海马CA1区5-HT1A受体的表达显著增加(P<0.05),但PSD-95的表达明显减少(P<0.05)。结论: PTSD大鼠空间记忆能力减退,可能与海马CA1区5-HT1A受体的表达增加和PSD-95的表达减少有关。
创伤后应激障碍; 海马; 5-HT1A受体; 突触后致密物蛋白95; 学习和记忆
创伤后应激障碍(posttraumatic stress disorder,PTSD)是指在受到异乎寻常的灾难所致的心理创伤,引起的长期的持续性的精神障碍[1-2],在临床上以认知功能障碍为主要特征,意外事件部分遗忘或清晰记忆,接受及储存新信息功能受损[3]。PTSD已经成为严重威胁人类健康甚至是生命的重要疾病之一,虽然广受关注,但其发病机制目前并不十分清楚,研究表明,5-羟色胺(5-hydroxytryptamine,5-HT)及其受体与焦虑、精神障碍、冲动行为、酒精依赖等精神疾病密切相关[4-5]。为了进一步揭示5-HT1A受体在PTSD发病过程中的作用,本实验采用连续单一刺激(single prolonged stress,SPS)方法构建PTSD大鼠模型[6],通过行为学方法检测大鼠的学习和记忆能力、在体电生理记录海马生物电、Western blot实验和免疫荧光实验检测海马5-HT1A受体和突触后致密物蛋白95 (postsynaptic density protein 95, PSD-95)的表达,探讨5-HT1A受体调控PTSD大鼠空间记忆的机制。
材 料 和 方 法
1 材料
1.1 实验动物 成年雄性Sprague-Dawley(SD)大鼠36只,SPF级,体质量180~220 g,购于湖南斯莱克景达实验动物有限公司,合格证号为SCXK(湘)2011-0003。动物饲养在通风,自然光照环境,室温维持在(22±1)℃。
1.2 试剂 兔抗5-HT1A受体多克隆抗体购自Sigma;鼠抗PSD-95多克隆抗体购自Abcam;FITC标记的羊抗兔荧光II抗、Cy3标记的羊抗鼠荧光II抗、Triton X-100、 BSA等均购于碧云天生物技术有限公司。
1.3 实验仪器 Morris水迷宫(北京医学科学院药物研究所研制);荧光显微镜和冰冻切片机(OLYMPUS);大鼠脑立体定位仪(安徽正华生物仪器设备有限公司);BL-420S生物信号分析系统、微量注射泵(成都泰盟科技有限公司);高速冷冻离心机(Beckman)。
2 方法
2.1 实验动物分组 实验动物随机分为正常对照组和模型组,每组18只。常规分笼饲养,每笼6只,采用国家标准啮齿类动物干燥饲料喂养,供应充足水分。
2.2 PTSD动物模型的制备 按照文献[6]的方法,模型组大鼠连续进行以下步骤处理:禁锢2 h,强迫性游泳20 min(水深40 cm,水温25 ℃);休息15 min后乙醚麻醉至意识丧失。各组动物无干扰饲养,常规摄食饮水,饲养温度为(22±1)℃。
2.3 行为学测试 造模之后24 h,2组大鼠行Morris水迷宫实验。训练期间迷宫外参照物保持不变,训练共进行4 d,每天2次,每次训练时间间隔15 min。
2.4 动物手术 Morris水迷宫实验结束之后24 h,2组各取1/3大鼠(6只)经10%水合氯醛(300 mg/kg)腹腔注射麻醉后固定于立体定位仪上,切开头部皮肤,暴露硬脑膜。定位海马CA1(前囟向后7.5 mm、左旁4.2 mm、颅骨表面向下3.0 mm)植入刺激电极,于同侧海马齿状回(前囟向前3.8 mm、左旁2.5 mm、颅骨表面向下3.5 mm)植入记录电极E1,两者都以E2(前囟向前2.0 mm、左旁2.0 mm、颅骨表面向下3.0 mm)为参考,所有操作均在无菌条件下进行,术后肌注庆大霉素抗感染。
2.5 电生理实验 各组1/3大鼠(6只)行为学实验完毕之后进行电生理实验。
2.5.1 诱发电位的记录 测试刺激由电子刺激器产生(频率为10 Hz、波宽为0.1 ms的方波),诱发的动作电位经生物放大器在记忆示波器上显示,记录最大群峰电位(population spike,PS)幅值作为海马细胞群兴奋性的指标。调整刺激强度,采用引起最大PS幅值所需刺激强度的1/2作为测试刺激的强度,整个实验过程中测试刺激强度参数恒定不变。
2.5.2 高频刺激(high-frequency stimulation,HFS)诱导长时程增强(long-term potentiation,LTP) HFS电流强度同测试刺激,刺激串间隔为100 ms,刺激频率为200 Hz的10串刺激,每串刺激由5个波宽0.1 ms的方波组成,高频刺激的频率为200 Hz,连续给予2次。以给药前30 min记录的6个时点的PS幅值的平均值作为自身基础幅值,每个时点的突触传递水平以与基础突触传递水平比较得出的相对值表示,相对值(%)=(实测值-相对值)/相对值×100%。
2.6 Western blot实验 各组另1/3大鼠(6只)行为学实验完毕之后进行Western blot实验。 大鼠在腹腔麻醉后快速取出全脑,冰浴分离出海马,RIPA充分裂解提取蛋白,BCA蛋白定量试剂盒(Novagen)测定蛋白浓度。调节各组蛋白浓度统一为0.5 g/L,加2×SDS上样缓冲液,99 ℃变性10 min。每孔中加10 μL样品,Tris-SDS聚丙烯酰胺凝胶垂直平板电泳电转印到硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h,分别加入抗5-HT1A受体和PSD-95抗体,4 ℃过夜,倾去I 抗,TBST洗膜3次,每次15 min。分别加入1∶2 000羊抗兔、羊抗鼠甘油 II 抗,置于摇床上摇动,室温下1 h;弃去 II 抗,TBST洗膜 15 min×3次;凝胶成像分析系统成像,检测蛋白质印迹条带,ImageJ软件分析求得平均吸光度值。
2.7 免疫荧光实验 各组最后1/3大鼠进行免疫荧光实验。将各组大鼠灌注后取脑,置于4% 多聚甲醛溶液中过夜,经30%蔗糖溶液脱水后,用恒温(-20 ℃)冰冻切片机作冠状切片,厚度30 μm,隔 4片取 1片脑片,切片经0.3% Triton X-100通透2 h,0.01 mol/L PBS漂洗5 min×3次,10% BSA封闭1 h,0.01 mol/L PBS漂洗5 min×3次。滴加5-HT1A受体和PSD-95 I 抗, 4 ℃ 条件下孵育过夜;复温后0.01 mol/L PBS漂洗5 min、3 次。暗室加入FITC标记的羊抗兔II抗和Cy3标记的羊抗鼠II抗(1∶1 000),室温孵育2 h,0.01 mol/L PBS漂洗5 min×3次,DAPI染核,防淬灭的封片剂封片,荧光显微镜下观察拍片,每张切片检测海马CA1区平均阳性细胞数和积分吸光度值(用IPP 6.0软件分析)。
3 统计学处理
经SPSS 16.0处理,所有实验数据以均数±标准差(mean±SD)表示,数据分析前经正态分布和方差齐性检验,两组间资料的比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 Morris水迷宫实验,不同组别大鼠逃避水下平台潜伏期的比较
在水迷宫实验中,从实验第2天开始,与对照组比较,模型组大鼠逃避水下平台时间明显延长(P<0.05),见图1。

Time (d)
Figure 1.Comparison of the latency between 2 groups of the rats escaping the platform on different experimental days. Mean±SD.n=18.*P<0.05,**P<0.01vscontrol group.
图1 2组大鼠不同实验日逃避水下平台潜伏期的比较
2 电生理实验 HFS对大鼠海马神经元电活动的影响
两组大鼠HFS均能诱导海马神经元突触传递明显增强,呈现LTP样电位变化。对LTP幅值增加的相对值进行比较,与对照组比较,模型组明显下降(P<0.01),见图2。

Figure 2.The PS amplitudes of the rats before and after HFS in control group and model group. Mean±SD.n=6.**P<0.01vscontrol group.
图2 2组大鼠在强直性高频刺激后PS幅值增加相对值的比较
3 Western blot实验检测不同组别大鼠海马CA1区5-HT1A受体和PSD-95的表达
与对照组比较,模型组大鼠海马CA1区5-HT1A受体的表达明显增加(P<0.01),但PSD-95的表达明显减少(P<0.01),见图3。
4 免疫荧光实验检测不同组别大鼠海马CA1区5-HT1A受体和PSD-95的表达
荧光显微镜下,海马CA1区5-HT1A受体及DAPI染色结果显示,与对照组比较,模型组海马神经元胞体增大,胞核增大、胞核染色较淡,海马CA1区神经元胞浆内可见FITC标记的绿色荧光免疫反应阳性产物为5-HT1A受体蛋白,对照组大鼠5-HT1A受体阳性细胞荧光染色浅,而模型组大鼠5-HT1A受体阳性细胞荧光染色强(图4)。

Figure 3.Western blot analysis of 5-HT1Areceptor and PSD-95 expression in the CA1 region of hippocampus in the 2 groups of the rats. Mean±SD.n=6.**P<0.01vscontrol group.
图3 Western blot实验检测2组大鼠海马CA1区5-HT1A和PSD-95的表达
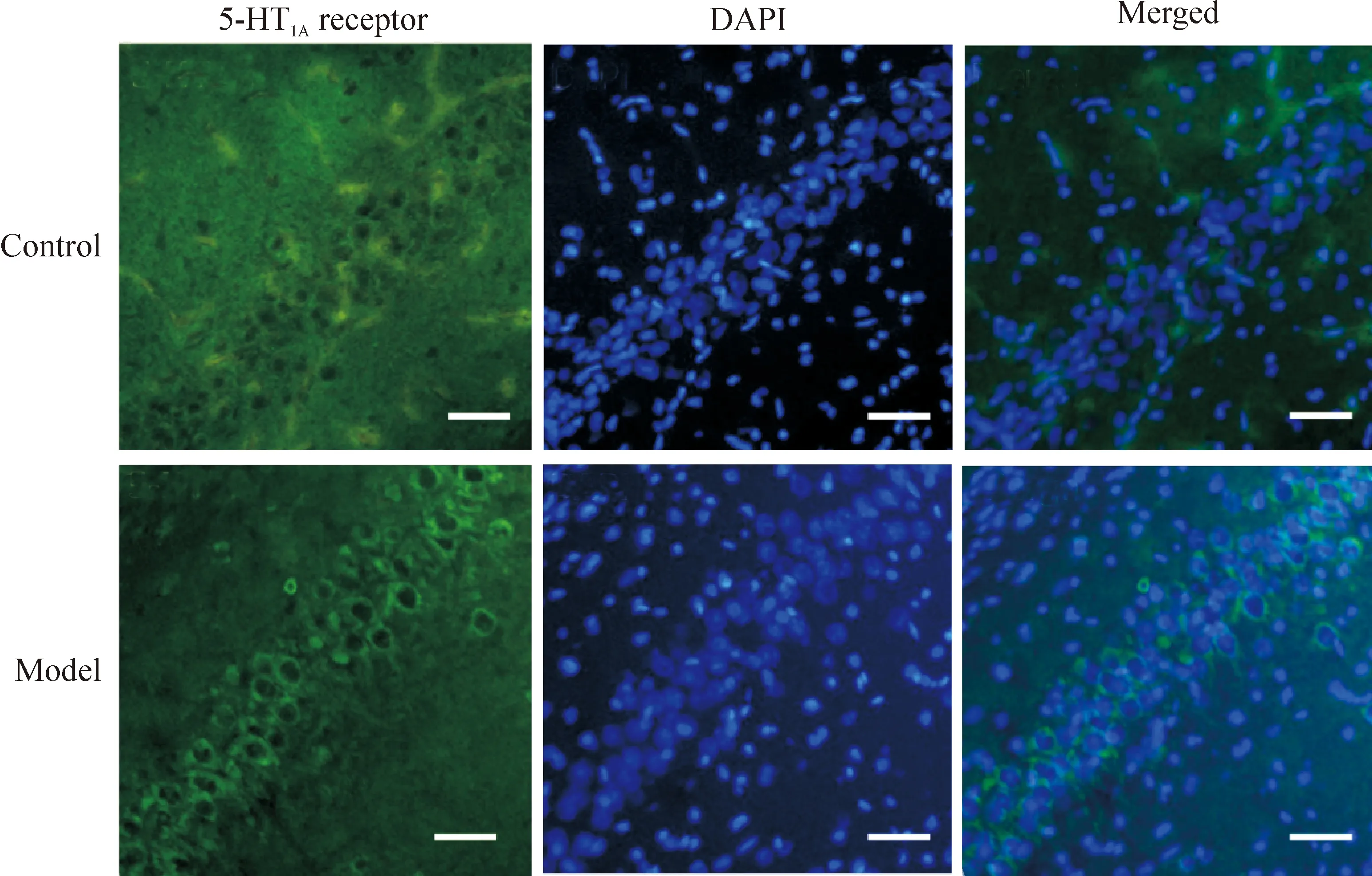
Figure 4.Immunofluorescence observation of 5-HT1Areceptor expression in CA1 region of hippocampus in the 2 group of the rats. The scale bar=20 μm.
图4 免疫荧光实验检测2组大鼠海马CA1区5-HT1A受体的表达
海马CA1区PSD-95蛋白及DAPI染色结果显示,与对照组比较,模型组海马细胞排列稀疏,胞核数量减少;海马CA1区神经元胞浆内可见Cy3标记的红色荧光免疫反应阳性产物为PSD-95蛋白,对照组大鼠PSD-95阳性细胞荧光染色深,而模型组大鼠PSD-95阳性细胞荧光染色浅(图5)。
阳性细胞计数显示,与对照组比较,模型组大鼠海马CA1区5-HT1A受体阳性细胞数明显增多(P<0.05),而PSD-95阳性细胞数明显减少(P<0.01),见图6。
平均积分吸光度的比较结果显示,与对照组比较,模型组大鼠海马CA1区5-HT1A受体积分吸光度明显增强(P<0.05),而PSD-95蛋白积分吸光度明显减弱(P<0.05),见图7。
讨 论
PTSD是一种典型的应激障碍性疾病,应激适应能力可能与脑内5-HT递质系统密切相关,5-HT功能失调可能是PTSD的重要病因学基础[7-8]。其中5-HT1A受体与焦虑、抑郁等精神疾病关系尤为密切[9-10]。5-HT1A受体分为突触前膜和突触后膜受体,突触前膜5-HT1A受体属自身受体,主要位于中缝核5-HT能神经元胞体和树突处,对5-HT系统起负反馈调节作用,其激活后能抑制5-HT神经元电活动,减少突触前膜5-HT的释放。突触后膜5-HT1A受体则主要位于海马CA1区和其他边缘叶区的锥体细胞,其转导机制主要是通过G蛋白偶联抑制cAMP酶活性,使得第二信使cAMP合成减少, 使突触后膜发生超极化,使突触后神经元抑制。

Figure 5.Immunofluorescence observation of PSD-95 expression in the CA1 region of hippocampus in the 2 groups of the rats. The scale bar=20 μm.
图5 免疫荧光实验检测2组大鼠海马CA1区PSD-95的表达

Figure 6.Comparison of 5-HT1Areceptor and PSD-95 positive cells in the CA1 region of hippocampus in the 2 groups of the rats. Mean±SD.n=6.*P<0.05vscontrol group.
图6 大鼠海马CAI区5-HT1A和PSD-95免疫反应阳性细胞计数的比较
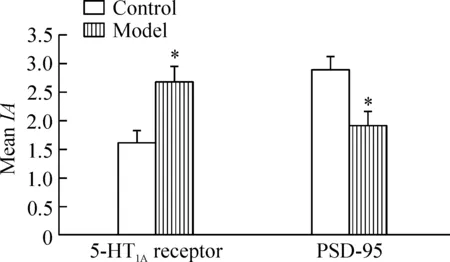
Figure 7.Comparison of the meanIAof 5-HT1Areceptor and PSD-95 in the CA1 region of hippocampus in the 2 groups of the rats. Mean±SD.n=6.*P<0.05vscontrol group.
图7 大鼠海马CAI区5-HT1A受体和PSD-95平均积分吸光度的比较
在本实验中,利用SPS构建PTSD大鼠模型, Morris水迷宫实验结果表明,模型大鼠逃避水下平台的潜伏期较对照组明显延长,目标象限的停留时间较对照组明显缩短,说明了模型组大鼠的空间记忆能力明显减退,这些都符合PTSD 的临床特征,说明PTSD模型复制成功。
LTP和长时程压抑(long-term depression,LTD)是突触可塑性的重要表现形式[11]。LTP是学习记忆的神经基础,也是研究学习与记忆机制的理想模型,而海马是学习记忆活动的关键脑区,在空间记忆的形成中起着关键作用[12]。在电生理实验中,强直性高频刺激均可在2组大鼠海马诱导出稳定的LTP,但是在幅值上,模型组显著低于对照组,说明了创伤后应激障碍大鼠神经元可塑性功能减退。
在Western blot实验和免疫荧光实验中,5-HT1A受体蛋白的表达,与对照组比较,模型组明显增多。这与Liu等[3]研究创伤后应激对大鼠前额叶和海马5-HT1A受体蛋白的影响是一致的。徐爱军等[13]研究创伤后应激障碍大鼠海马5-HT1A受体的表达较对照组显著性减少,本实验结果与之存在一定差异,分析其原因,可能与组织取材的时点不同有关,在该实验中,对5-HT1A受体的检测是在PTSD造模完成之后立即进行,而本实验研究中,对5-HT1A受体的检测是在水迷宫实验结束之后进行的,所以导致了实验结果的差异。
突触后致密物(postsynaptic density,PSD)是位于突触活性区突触后膜下方与胞浆相连的一层致密物质,其中PSD-95又称突触相关蛋白90(synapse-associated protein 90, SAP-90),是新近在谷氨酸能突触中发现的一种特殊蛋白质。研究表明,PSD-95能够介导逆行性信号传递,促进突触前膜突触素的表达增加,增强大鼠的空间记忆能力[14]。王雪银等[15]的研究表明,PSD-95和GluR1的表达增加,能够增强阿尔茨海默病大鼠的空间学习记忆能力。Western blot实验和免疫荧光实验均表明PTSD模型大鼠海马PSD-95的表达较对照组明显减少,学习记忆相关蛋白的表达减少,导致模型大鼠的空间记忆能力减退。在本实验中,PTSD模型组大鼠海马神经元DAPI染色结果图片也显示其细胞核数量较对照组明显减少,分析其原因,可能是连续性单刺激导致大鼠创伤后应激障碍,进而引起海马神经元的损伤,甚至是神经元的坏死所致。这与梁冬施等[16]研究慢性缺氧性应激能导致大鼠海马神经元出现损伤、凋亡等病理变化是一致的。
本实验从行为学、在体电生理、Western blot、免疫荧光等多种方法证实PTSD模型大鼠空间记忆能力减退,突触可塑性功能减退,可能与创伤后应激障碍大鼠海马CA1区5-HT1A受体表达增加和PSD-95蛋白表达减少有关。
[1] Citrome L, Stensbøl TB, Maeda K. The preclinical profile of brexpiprazole: what is its clinical relevance for the treatment of psychiatric disorders?[J]. Expert Rev Neuro-ther, 2015, 15(10):1219-1229.
[2] Sullivan GM, Ogden RT, Huang YY, et al. Higherinvivoserotonin-1a binding in posttraumatic stress disorder: a PET study with [11C]WAY-100635[J]. Depress Anxiety, 2013, 30(3):197-206.
[3] Liu D, Xiao B, Han F, et al. Changes in 5-HT1Areceptor expression in the oculomotor nucleus in a rat model of post-traumatic stress disorder[J]. J Mol Neurosci, 2013, 49(2):360-368.
[4] Luo FF, Han F, Shi YX. Changes in 5-HT1Areceptor in the dorsal raphe nucleus in a rat model of post-traumatic stress disorder[J]. Mol Med Rep, 2011, 4(5):843-847.
[5] Xie H, Han F, Shi X. Single-prolonged stress induce changes of CaM/CaMKIIα in the rats of dorsal raphe nucleus[J]. Neurochem Res, 2012, 37(5):1043-1049.
[6] Liberzon I, Krstov M, Young EA. Stress-restress: effects on ACTH and fast feedback[J]. Psychoneuroendocrinology, 1997, 22 (6):443-453.
[7] Dubrovsky B. The specificity of stress response to different nocuous stimuli: neurosteroids and depression[J]. Brain Res Bull, 2000, 51(6):443-455.
[8] Finn DP, Martí O, Harbuz MS, et al. Behavioral, neuroendrocrine and neurochemical effects of the imidazoline I2receptor selective ligand BU224 in naive rats and rats exposed to the stress of the forced swim test[J]. Psychopharmacology (Berl), 2003, 167(2):195-202.
[9] Le François B, Soo J, Millar AM, et al. Chronic mild stress and antidepressant treatment alter 5-HT1Areceptor expression by modifying DNA methylation of a conserved Sp4 site[J]. Neurobiol Dis, 2015, 82: 332-341.
[10]Gutierrez MG, Mansfield KS, Malmstadt N. The functio-nal activity of the human serotonin 5-HT1Areceptor is controlled by lipid bilayer composition[J]. Biophys J, 2016, 110(11):2486-2495.
[11]Ang YP, Shimizu E, Dube GR, et al. Genetic enhancement of learning and memory in mice[J]. Nature, 1999, 401(6748): 63-69.
[12]Villers A, Giese KP, Ris L. Long-term potentiation can be induced in the CA1 region of hippocampus in the absence of αCaMKII 286-autophosphorylation[J]. Learn Mem, 2014, 21(11):616-626..
[13]徐爱军, 李 冉, 王海涛, 等. 创伤后应激障碍大鼠海马组织5-HT1受体mRNA的表达[J].中风与神经疾病杂志, 2012, 29(2):137-139.
[14]Sohn YI, Lee NJ, Chung A, et al, Antihypertensive drug valsartan promotes dendritic spine density by altering AMPA receptor trafficking[J]. Biochem Biophys Res Commun, 2013, 439(4):464-470.
[15]王雪银, 李宜培, 程相树, 等. 过表达miR-132 改善阿尔茨海默病样学习记忆障碍[J]. 中国病理生理杂志, 2016, 32(1):41-45.
[16]梁冬施,陈利亚,洪芳芳,等. 慢性间歇性低氧对幼鼠脑区AMPK通路的影响[J]. 中国病理生理杂志, 2016, 32(7):1200-1207.
(责任编辑: 卢 萍, 罗 森)
Effect of 5-HT1Areceptor in hippocampal CA1 region on spatial memory of PTSD rats
LIN Ling, LIU Guo-liang, SUN Man-li
(LuoheMedicalCollege,Luohe462002,China.E-mail:linlingshengli@126.com)
AIM: To investigate the change of long-term potentiation (LTP), and the expression of 5-hydroxytryptamine 1A receptor (5-HT1Areceptor) and postsynaptic density protein 95 (PSD-95) in the hippocampus of the rats with posttraumatic stress disorder (PTSD), and to explore the mechanism of 5-HT1Areceptor in the regulation of spatial memory in the PTSD rats.METHODS: Healthy adult SD rats (n=36) were randomly divided into control group and model group, with 18 rats in each group. The rats in model group were treated with single prolonged stress to construct the model of PTSD. Morris water maze (MWM) was used to test the learning and memory ability. The LTP induced by high-frequency stimulation (HFS) was detected by electrophysiological method. The protein expression of 5-HT1Areceptor and PSD-95 in the hippocampus was determined by Western blot and immunofluorescence. RESULTS: The MWM analysis showed that the latency of the rats searching for the underwater platform in model group was significantly longer than that in control group (P<0.01). The results of electrophysiological analysis showed that the amplitude of the evoked potential in both groups were significantly increased after HFS in the hippocampus, but that in model group was significantly lower than that in control group (P<0.01). The results of Western blot and immunofluorescence analysis showed that compared with control group, the protein expression of 5-HT1Areceptor was obviously increased (P<0.05), while the expression of PSD-95 was obviously decreased in model group (P<0.05).CONCLUSION: The spatial memory impairment in the PTSD rats may be associated with the increase in the expression of 5-HT1Areceptor and the decrease in the expression of PSD-95 in the CA1 region of hippocampus.
Posttraumatic stress disorder; Hippocampus; 5-HT1Areceptor; Postsynaptic density protein 95; Learning and memory
1000- 4718(2017)01- 0098- 06
2016- 07- 25
2016- 10- 19
河南省科技厅自然科学资助项目(No. 142300410431);河南省教育厅高等学校重点科研资助项目(No.15B180010);漯河市青年拔尖人才资助项目; 漯河医学高等专科学校科研项目(2015-S-LMC06)
R363
A
10.3969/j.issn.1000- 4718.2017.01.016
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0395-2964505; E-mail: linlingshengli@126.com
