顺铂耐药对食管癌细胞增殖、凋亡、迁移和血管生成的影响*
2017-01-19李朝慧任本洪孙雪娇寇俊婷王晓霞
李朝慧, 任本洪, 孙雪娇, 寇俊婷, 贺 春, 王晓霞
(山西医科大学生物化学与分子生物学教研室,山西 太原 030001)
·论 著·
顺铂耐药对食管癌细胞增殖、凋亡、迁移和血管生成的影响*
李朝慧, 任本洪, 孙雪娇, 寇俊婷, 贺 春, 王晓霞△
(山西医科大学生物化学与分子生物学教研室,山西 太原 030001)
目的: 探讨顺铂(cis-dichlorodiamine platinum,cDDP)耐药对人食管癌KYSE150细胞增殖、凋亡、迁移和血管生成的影响。方法: 首先采用顺铂浓度递增的方法,历经10个月左右的时间成功建立了人食管癌顺铂耐药细胞系KYSE150/cDDP。采用MTT法测定其药物敏感性,并通过形态学观察、MTT实验、集落形成实验、DAPI染色、划痕愈合实验及小管形成实验比较顺铂耐药后食管癌细胞生物学行为的改变。结果: KYSE150细胞和KYSE150/cDDP细胞在形态上无明显差异;MTT实验结果显示,与KYSE150细胞相比,KYSE150/cDDP细胞对cDDP的耐药指数为 6.35,细胞活力下降;集落形成实验结果显示,KYSE150/cDDP细胞的集落形成率为(15.00±3.05)%,而KYSE150细胞的集落形成率为(86.70±6.57)%;DAPI染色显示KYSE150/cDDP细胞的凋亡率为(0.63±0.09)%,而KYSE150细胞的凋亡率为(8.46±1.33)%;划痕愈合实验显示,与KYSE150细胞相比,KYSE150/cDDP细胞的划痕愈合能力更强,其迁移率较KYSE150细胞的迁移率高;小管形成实验显示,KYSE150/cDDP细胞的血管生成数为76.20±3.18,而KYSE150细胞的血管生成数为50.60±1.33;Western blot实验结果显示KYSE150/cDDP细胞中MMP-2和VEGFR2的表达均高于KYSE150细胞。结论: KYSE150/cDDP细胞具有耐药表型,耐药后生长缓慢,凋亡能力降低,迁移和血管生成能力增加,这可能是临床化疗失败的重要原因。
顺铂; 耐药性; 食管癌; 细胞迁移; 血管生成
食管癌是最常见的消化道恶性肿瘤之一,严重威胁着人类的健康。近年来食管癌的发病率在世界范围内呈现明显上升的趋势,我国每年因食管癌死亡的患者人数居恶性肿瘤的第4位[1]。化疗是治疗食管癌的主要有效方法之一,但其耐药性的产生是导致肿瘤治疗失败的重要原因[2]。美国癌症协会研究表明,90%以上的肿瘤患者会不同程度地受到所用化疗药物的毒副作用及其耐药性的影响[3]。因此,研究耐药的机制及寻求耐药逆转的有效方法具有重要的意义。目前,建立肿瘤耐药细胞系是体外研究化疗耐药的有效方法和重要手段,对未来开展肿瘤耐药性的逆转研究及提高临床化疗的疗效具有重要价值[4-6]。本研究采用食管癌常用化疗药物顺铂(cis-dichlorodiamine platinum,cDDP)为诱导剂,以人食管癌细胞株KYSE150为诱导对象,采用化疗药物浓度递增的方法,历经10个月左右的时间,成功诱导建立了人食管癌耐药细胞系KYSE150/cDDP,并在此基础上,研究顺铂耐药对人食管癌KYSE150细胞增殖、凋亡、迁移和血管生成的影响。
材 料 和 方 法
1 材料
食管癌细胞株KYSE150由本实验室保存;人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购于江阴齐氏生物科技有限公司;顺铂购于江苏豪森药业股份有限公司;RPMI-1640 培养基和胎牛血清(fetal bovine serum,FBS)购于HyClone;胰蛋白酶-EDTA消化液、DAPI试剂均购于北京索莱宝科技有限公司;四甲基偶氮唑蓝(MTT)购于Sigma;4%的多聚甲醛购于武汉博士得生物工程有限公司;兔抗人血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)单克隆抗体购于上海生物工程技术服务有限公司;兔抗人MMP-2单克隆抗体和鼠抗人β-actin单克隆抗体购于Santa Cruz;辣根过氧化物酶标记的羊抗兔Ⅱ抗、辣根过氧化物酶标记的羊抗鼠Ⅱ抗均购于Promega。
2 方法
2.1 耐药细胞系KYSE150/cDDP的建立及细胞形态的观察 采用顺铂浓度递增的方法建立耐药细胞系。从低浓度顺铂开始作用处于对数生长期的KYSE150细胞,培养48 h后弃去含药物培养液,换用新鲜不含药物培养基继续培养,每隔1~2 d换液1次,以洗去死亡的细胞,待其恢复生长后,提高顺铂剂量继续作用于该细胞,反复作用直到细胞可在浓度为0.5 mg/L 顺铂培养液中稳定生长,此时KYSE150/cDDP耐药细胞系建成。在此过程中于倒置显微镜下观察细胞形态的变化。
2.2 MTT法测定细胞对cDDP的敏感性 取对数生长期的细胞,调整其细胞密度为每孔1×104,接种于96孔板内,37 ℃培养 12 h待细胞完全贴壁后,弃去培养基,加药孔内加入含不同浓度药物的培养基100 μL,共设6个浓度梯度,每个浓度梯度设置10个复孔同时设空白对照孔。培养48 h后,于每孔中加入MTT溶液(5 g/L)20 μL,37 ℃孵育4 h后,弃净各孔中的溶液,加入DMSO 100 μL,充分溶解后,于490 nm处检测各孔的吸光度(A)值,计算各药物浓度作用下细胞的相对抑制率(%)=(1-加药孔A值/对照孔A值)×100%,通过IC50软件计算50% 细胞生长抑制所需的药物浓度(IC50),耐药指数(RI)=耐药细胞IC50/亲本细胞IC50。
2.3 MTT法测定细胞生长曲线 将每孔800个细胞接种于96孔板,分3组,分别为空白组(只加等量RPMI-1640培养基,不含细胞)、对照组(接种KYSE150细胞)、实验组(接种KYSE150/cDDP细胞),每组设置3个复孔,37 ℃培养,培养结束后,采用上述方法检测各孔的吸光度值,以培养时间为横轴,细胞吸光度值为纵轴,绘制细胞的生长曲线。
2.4 集落形成试验检测细胞生长能力 取对数生长期的细胞制备成单细胞悬液并计数,每个60 mm培养皿中接种1 000个细胞,于CO2培养箱内培养,每3 d换液1次,14 d后,弃去培养基,PBS洗3遍,甲醇固定15 min,结晶紫染色15 min,于显微镜下计数大于50个细胞的集落数,最终得出集落形成率。集落形成率=集落数/接种细胞数×100%。
2.5 DAPI染色检测细胞对UV诱发凋亡的敏感性 取对数生长期的细胞接种于60 mm培养皿内,待细胞密度为80%时,将培养基弃去,用UV照射细胞20 s,加入新鲜培养基继续培养12 h。然后弃去培养基,PBS洗3次,用4%的多聚甲醛固定15 min,PBS洗3次,之后DAPI 避光染色15 min,于荧光显微镜下观察细胞核形态的变化。选取随机视野计数细胞总数以及核浓缩、核碎裂细胞数,每组细胞计数3个视野。凋亡率(%)=核浓缩、核碎裂细胞数/细胞总数×100%。
2.6 划痕实验检测细胞迁移能力 取单层细胞已铺满60 mm培养皿的细胞,用200 μL的枪头划痕, PBS洗2遍,加入无血清培养基培养24 h,于划痕后的0 h和24 h在倒置显微镜下观察细胞的愈合情况。
2.7 体外 HUVEC小管形成试验检测细胞培养上清液促小管形成能力 基质胶4 ℃过夜冻融,在预冷的96孔板中每孔加入50 μL基质胶,37 ℃孵育45 min。HUVECs经胰酶消化后计数,调整其浓度为5×108/L,在各孔分别加入20 μL HUVECs悬液并使其分布均匀,之后在孔中分别加入提前经饥饿处理48 h的细胞上清液20 μL,孵育6 h后镜下观察并拍照。每孔取3个视野计数小管形成数。
2.8 Western blot 检测蛋白的表达水平 收集对数生长期细胞加入细胞蛋白裂解液(含PMSF蛋白酶抑制剂),冰上裂解40 min,120 000 r/min离心20 min收集上清液,获得细胞总蛋白,Bradford法测定蛋白浓度。采用SDS-PAGE进行蛋白分离后,转至硝酸纤维素膜上,5%脱脂奶粉室温封闭3 h,加入稀释好的MMP-2、VEGFR2或β-actin抗体,4 ℃摇床中过夜,PBST洗膜10 min、3次,加入相应的 II 抗室温孵育2 h,PBST洗膜10 min、3次,化学发光成像,使用Quantity One对结果进行分析。
3 统计学处理
采用SPSS 17.0进行统计学分析,数据以均数±标准差(mean±SD)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 KYSE150/cDDP耐药细胞系的建立及细胞形态学的观察
采用顺铂浓度递增的方法对KYSE150细胞进行体外诱导,历经10个月左右的时间成功建立了在含0.5 mg/L 顺铂的培养液中可以稳定生长的耐药细胞系,将其命名为KYSE150/cDDP。其中,在处于对数生长期的KYSE150细胞中加入顺铂后的24 h~48 h内,细胞生长已基本停止,于加药后第4天开始,细胞形态出现明显变化,部分细胞由于死亡而呈现漂浮状态,培养液变黄变浑浊,残存的贴壁细胞变得大小不一,形态不规则,有巨细胞的产生,胞内颗粒增多。每隔1~2 d换液 1 次,以洗去死亡的细胞,25 d左右的时间出现细胞克隆,待其恢复稳定生长后传代,细胞逐渐接近原来的细胞形态,见图1。

Figure 1.The cell morphology observed under inverted microscope (×100). The images showed the morphology of normal KYSE150 cells (A), KYSE150 cells treated with cDDP for 4 d (B) and 25 d (C), as well as KYSE150/cDDP cells (D).
图1 倒置显微镜下观察细胞的形态
2 细胞耐药性及其生长曲线的测定
通过MTT法得出顺铂对KYSE150/cDDP细胞的IC50为(15.50±0.21)μmol/L,对KYSE150细胞的IC50为(2.44±0.14) μmol/L,耐药指数为6.35。与KYSE150细胞相比,KYSE150/cDDP细胞的生长速率较为缓慢,见图2。

Figure 2.The growth curves of KYSE150/cDDPs cells and KYSE150 cells detected by MTT assay. Mean±SD.n=3.
图2 KYSE150/cDDP细胞与KYSE150细胞的生长曲线
3 细胞集落形成能力的变化
集落形成试验显示,KYSE150与KYSE150/cDDP细胞集落形成率分别是(86.70±6.57)% 和(15.00±3.05)%,差异具有统计学意义(P<0.01);且KYSE150细胞形成的集落较大(图3)。这表明顺铂耐药导致细胞的集落形成能力有所下降,与上述MTT实验结果的变化趋势一致。

Figure 3.The efficiency of colony formation of KYSE150 cells and KYSE150/cDDP cells. Mean±SD.n=3.**P<0.01vsKYSE150.
图3 KYSE150细胞与KYSE150/cDDP细胞的集落形成情况
4 细胞凋亡的变化
经UV诱导照射后DAPI染色结果显示,KYSE150细胞出现核碎裂、核浓缩等细胞凋亡现象(图4中箭头所示),细胞凋亡率为(8.46±1.33)%,而KYSE150/cDDP细胞的凋亡率为(0.63±0.09)%,差异具有统计学意义(P<0.01),提示顺铂耐药抑制细胞的凋亡,见图4。

Figure 4.The apoptosis of KYSE150 cells and KYSE150/cDDP cells under fluorescence microscope (×200). Mean±SD.n=3.**P<0.01vsKYSE150.
图4 荧光显微镜下观察KYSE150细胞与KYSE150/cDDP细胞的凋亡情况
5 细胞迁移能力的变化
划痕愈合实验结果显示,划痕24 h后KYSE150/cDDP细胞已基本愈合,其迁移率为(96.80±0.60)%;而KYSE150细胞尚未愈合完全,其迁移率为(68.60±1.47)%,表明耐药细胞的迁移能力较强,差异具有统计学意义(P<0.01)。Western blot实验结果显示,KYSE150/cDDP细胞中转移相关蛋白MMP-2的表达量明显高于KYSE150细胞,灰度比值分别是0.48±0.02和0.08±0.03,差异具有统计学意义(P<0.01),见图5。
6 血管形成能力的变化
通过体外HUVEC小管形成实验,我们发现KYSE150/cDDP细胞形成的小管管腔更为完整,血管生成数为76.20±3.18,而KYSE150细胞的血管生成数为50.60±1.33,差异具有统计学意义(P<0.01),表明耐药细胞的血管生成能力较强。Western blot实验结果显示,KYSE150/cDDP细胞中的VEGFR2表达量明显高于KYSE150细胞,灰度比值分别为1.15±0.02和0.56±0.03,差异具有统计学意义(P<0.01),见图6。
讨 论
目前,许多恶性肿瘤在治疗期间出现对化疗药物的耐受现象,因而导致肿瘤治疗的失败。因此研究化疗耐药性产生的原因对于临床肿瘤治疗具有重要的意义。继Broggini在1988年首次成功建立了对阿霉素耐药的结肠癌细胞株后,一系列肿瘤耐药细胞株开始成功建立:如卵巢癌顺铂耐药细胞株COC1/DDP[7]、肺腺癌顺铂耐药细胞株A549/DDP[8]、人胃癌顺铂耐药细胞株BGC-823-cDDP[9]等。顺铂是临床上治疗食管癌的主要化疗药物之一,是一种铂类金属络合物,其作用机制主要是使DNA链间及链内发生交链,形成顺铂-DNA的复合物发挥作用,进而干扰DNA的复制和合成[10],顺铂也可以与核蛋白及胞浆蛋白结合,引起肿瘤细胞的凋亡,因此顺铂可以作为一种较为广谱的抗肿瘤化疗药物[11]。但是,近年来,随着临床化疗的普遍开展,不少肿瘤患者均出现了顺铂耐药的现象[12-14]。因此,体外诱导肿瘤细胞耐药的方法将会为进一步研究肿瘤耐药的机制提供细胞实验模型,有助于探讨临床肿瘤化疗失败的原因。
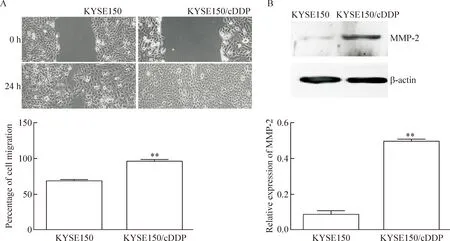
Figure 5.The migratory ability of KYSE150 cells and KYSE150/cDDP cells. A: the wound healing abilities of KYSE150 cells and KYSE150/cDDP cells (×100); B: the protein expression of MMP-2 in KYSE150 cells and KYSE150/cDDP cells detected by Western blot. Mean±SD.n=3.**P<0.01vsKYSE150.
图5 KYSE150细胞与KYSE150/cDDP细胞的迁移情况
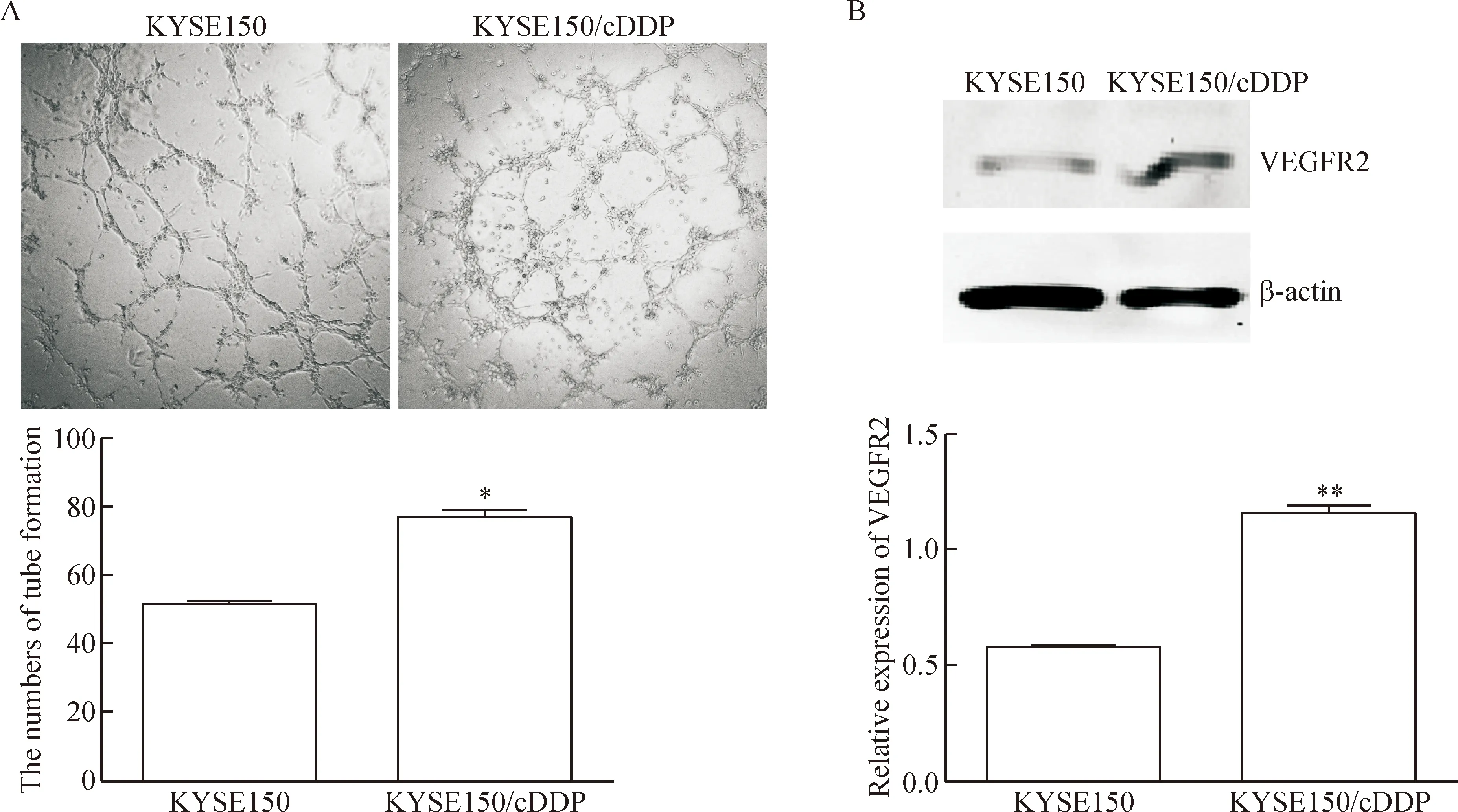
Figure 6.The abilities of tube formation of KYSE150 cells and KYSE150/cDDP cells. A: the numbers of tube formation of KYSE150 cells and KYSE150/cDDP cells (×400); B: the protein expression of VEGFR2 in KYSE150 cells and KYSE150/cDDP cells detected by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vsKYSE150.
图6 KYSE150细胞与KYSE150/cDDP细胞的小管形成情况
通过化疗药物体外诱导建立耐药细胞株常用的方法主要有大剂量间歇冲击疗法和浓度逐步递增法 2 种[15]。2种方法比较,第 1 种方法更符合临床特点,但是由于初始给药剂量难以掌握容易出现剂量过大导致肿瘤细胞全部死亡;而第2种加药方法是从小剂量开始的,待肿瘤细胞适应后再逐渐增加剂量,成功率较高,但是比较耗时。目前实验室建立耐药细胞株多采用第2种方法。本实验采用顺铂浓度递增的方法,最终成功建立了人食管癌顺铂耐药细胞系KYSE150/cDDP。
本研究发现,与亲本细胞相比,耐药细胞在前期生长较为缓慢,这可能是由于顺铂药物的冲击作用导致的,或者由于顺铂作用于细胞内的DNA,进而抑制DNA的复制,导致细胞停滞于G1期[16],此时细胞生长缓慢,耐药细胞一旦进入S期后,可以进行正常的有丝分裂,完成整个细胞周期,达到正常的生长速度。此现象与以往在耐药细胞系中的研究报道结果一致[17-19]。DAPI染色实验发现,耐药细胞凋亡较亲本细胞少,提示细胞耐药导致抑制肿瘤细胞的凋亡,此结果与杨皎娃等[20]在胃癌研究中的结果一致。划痕愈合实验发现,KYSE150/cDDP细胞的迁移能力明显高于对照组,同时Western blot实验结果证实耐药细胞中MMP-2的表达量明显增高。MMP-2作为一种降解基底膜和细胞外基质的关键酶,可以加速细胞外基质的降解,促进从原发部位脱落的肿瘤细胞更快地迁移至新的部位定居,导致肿瘤的恶化[21]。而肿瘤血管生成与细胞迁移及细胞外基质降解等过程密切相关[21]。本研究通过HUVEC小管形成实验证实耐药细胞的小管形成能力更强,管腔更完整,说明更多的新生血管为耐药细胞的增殖和转移提供了营养物质。同时研究发现,VEGFR2在耐药细胞中的表达量增高,而VEGFR2在促进内皮细胞迁移和血管形成方面发挥重要的作用,提示顺铂耐药可能通过活化VEGFR2信号通路来促进肿瘤血管的生成。本研究揭示了顺铂耐药导致肿瘤细胞凋亡受抑,迁移和血管生成能力增强,因而导致肿瘤的侵袭和转移,进而造成临床顺铂化疗失败。
[1] 冉 刚, 李苏宜. 食管鳞癌组织VEGF表达及临床意义研究进展[J]. 癌症进展, 2012, 10(4):350-354.
[2] Larsen AK, Escargueil AE, Skladanowski A. Resistance mechanisms associated with altered intracellular distribution of anticancer agents[J]. Pharmacol Ther, 2000, 85(3): 217-229.
[3] Yeh JJ, Hsu WH, Wang JJ, et al. Predicting chemotherapy response to paclitaxel-based therapy in advanced non-small-cell lung cancer with P-glycoprotein expression[J]. Respiration, 2003, 70(1):32-35.
[4] Yang LY, Trujillo JM. Biological characterization of multidrug-resistant human colon carcinoma sublines induced/selected by two methods[J]. Cancer Res, 1990, 50(11):3218-3225.
[5] 樊爱琳, 刘国鹏, 郑善銮, 等. 逆转录病毒转染法建立兔VX-2多药耐药株[J]. 第四军医大学学报, 2003, 24(23):2129-2131.
[6] 李 敏, 轩小燕, 黄玉敏, 等. 药物诱导与耐药基因转染两种方法建立的人食管癌顺铂耐药细胞系的比较[J]. 广东医学, 2012, 33(6):726-729.
[7] 周 静, 魏月华, 蔡红兵, 等. 卵巢癌细胞株COC1、顺铂耐药细胞株COC1/DDP的蛋白质组学比较 [J]. 武汉大学学报:医学版, 2012, 33(1):1-4.
[8] 高贵洲, 王建军, 石思恩. P型铜转运ATP酶(ATP7B)在肺腺癌细胞株A549中的表达与顺铂耐药的关系[J]. 中国肺癌杂志, 2009, 12(4):350-353.
[9] 王 攀, 王崇树, 魏寿江, 等. 顺铂诱导的人胃癌耐药细胞BGC-823/CDDP的建立[J]. 重庆医学, 2011, 40(4):323-325.
[10]Szymkowski DE, Yarema K, Essigmann JM, et al. An intrastrand d(GpG) platinum crosslink in duplex M13 DNA is refractory to repair by human cell extracts[J]. Proc Natl Acad Sci U S A, 1992, 89(22):10772-10776.
[11]汪明明, 崔速南. 抗癌新药顺铂的研究进展 [J]. 癌症, 1986, 4(1):105-109.
[12]Min XJ, Li H, Hou SC, et al. Dysfunction of volume-sensitive chloride channels contributes to cisplatin resistance in human lung adenocarcinoma cells[J]. Exp Biol Med (Maywood), 2011, 236(4):483-491.
[13]Min L, Chen Q, He S, et al. Hypoxia-induced increases in A549/CDDP cell drug resistance are reversed by RNA interference of HIF-1α expression[J]. Mol Med Rep, 2012, 5(1):228-232.
[14]Kasprzak MM, Szmigiero L, Zyner E, et al. Proapoptotic activityinvitroof two novel ruthenium (Ⅱ) complexes with flavanone-based ligands that overcome cisplatin resistance in human bladder carcinoma cells[J]. J Inorg Biochem, 2010, 105(4):518-524.
[15]Schabel FJ, Skipper HE, Trader MW, et al. Establishment of cross-resistance profiles for new agents [J]. Can-cer Treat Rep, 1983, 67(10):905-922.
[16]Eder JP Jr, Chan VT, Ng SW, et al. DNA topoisomerase Ⅱ alpha expression is associated with alkylating agent resistance [J]. Cancer Res, 1995, 55(24):6109-6116.
[17]李 敏, 王志举, 付 庆, 等. 人食管癌顺铂耐药细胞系的建立及耐药相关基因的筛选[J]. 中国卫生检验杂志, 2007, 17(1):18-20.
[18]程军军, 魏小龙. 顺铂耐药性L1210细胞亚系的建立及特征 [J]. 军事医学, 1994, 16(1):708-710.
[19]贾 平, 李 芳, 吴明富, 等. 卵巢癌拓扑替康耐药细胞株的建立及其生物学特征 [J]. 现代妇产科进展, 2004, 13(3):174-177.
[20]杨皎娃, 牛建花, 曾季平, 等. 胃癌多药耐药细胞株BGC823/5-FU的建立及其耐药机制的研究 [J]. 中国病理生理杂志, 2008, 24(11):2167-2170.
[21]Kubota Y. Tumor angiogenesis and anti-angiogenic therapy [J]. Keio J Med, 2012, 61(2):47-56.
(责任编辑: 陈妙玲, 罗 森)
Effects of cDDP resistance on proliferation, apoptosis, migration and angiogenesis of esophageal cancer cells
LI Chao-hui, REN Ben-hong, SUN Xue-jiao, KOU jun-ting, HE Chun, WANG Xiao-xia
(DepartmentofBiochemistryandMolecularBiology,ShanxiMedicalUniversity,Taiyuan030001,China.E-mail:wxiaoxia99007@126.com)
AIM: To investigate the effect ofcis-dichlorodiamine platinun (cDDP) resistance on proliferation, apoptosis, migration and angiogenesis of esophageal cancer cell line KYSE150. METHODS: Using the method of increa-sing concentration of cDDP in culture for 10 months, the human esophageal carcinoma cDDP-resistant cell line named KYSE150/cDDP was established successfully. The drug sensitivity was measured by MTT assay. The changes of the biological behaviors between the parental cell line and resistant cell line were determined by morphological observation assay, MTT assay, colony formation assay, DAPI staining, wound healing assay and tube formation experiment.RESULTS: No significant morphological difference between KYSE150 cells and KYSE150/cDDP cells was observed. Compared with KYSE150 cells, the drug resistance index of KYSE150/cDDP cells was 6.35, and the viability of KYSE150/cDDP cells was decreased. The colony formation rate of KYSE150/cDDP cells was (15.00±3.05)%, while the colony formation rate of KYSE150 cells was (86.70±6.57)%. The apoptotic rate of KYSE150/cDDP cells was (0.63±0.09)%, and that of KYSE150 cells was (8.46±1.33)%. Compared with KYSE150 cells, KYSE150/cDDP cells showed a stronger healing ability of scratch, and the migration rate was higher than that of KYSE150 cells. The results of tube formation experiment showed that the vessel number in KYSE150/cDDP group was 76.20±3.18, while the vessel number in KYSE150 group was 50.60±1.33. The protein expression of MMP-2 and VEGFR2 in KYSE150/cDDP cells was higher than that in KYSE150 cells.CONCLUSION: KYSE150/cDDP cells present drug-resistant phenotype and show a slow growth rate. The ability of apoptosis is decreased, and the abilities of cell migration and angiogenesis are increased. This may be an important reason for the failure of clinical chemotherapy for esophageal cancer.
cis-Dichlorodiamine platinum; Drug resistance; Esophageal cancer; Cell migration; Angiogenesis
1000- 4718(2017)01- 0001- 06
2016- 08- 18
2016- 10- 27
国家自然科学基金资助项目(No. 81372676);中国博士后基金资助项目(No. 2014M551058);山西省自然科学基金资助项目(No. 201601D011130)
R730.23
A
10.3969/j.issn.1000- 4718.2017.01.001
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0351-4135637; E-mail: wxiaoxia99007@126.com
