塞来昔布减低HL-60和HL-60A细胞活力、诱导凋亡及抑制自噬*
2017-01-19刘相富刘玲玲林哲生陈玉婵冯宝莹张祥忠
陆 英, 刘相富, 刘玲玲, 林哲生, 陈玉婵, 冯宝莹, 张祥忠△
(中山大学附属第三医院 1输血科, 2血液科,广东 广州 510630)
塞来昔布减低HL-60和HL-60A细胞活力、诱导凋亡及抑制自噬*
陆 英1, 2, 刘相富1▲, 刘玲玲2, 林哲生1, 陈玉婵1, 冯宝莹1, 张祥忠2△
(中山大学附属第三医院1输血科,2血液科,广东 广州 510630)
目的: 探讨塞来昔布对急性髓细胞白血病(AML) HL-60细胞和HL-60A细胞的活力、凋亡及自噬的影响。方法: 用不同浓度的(0、20、40、60、80和100 μmol/L)塞来昔布作用于HL-60细胞和HL-60A细胞, 24 h、48 h和72 h后用MTT法检测细胞活力。用流式细胞术检测塞来昔布作用HL-60细胞和HL-60A细胞24 h后的凋亡率。用Western blot法检测凋亡相关蛋白cleaved caspase-3、cleaved PARP,自噬相关蛋白LC3、P62,以及mTOR信号途径相关蛋白。结果: 塞来昔布作用于HL-60细胞24 h、48 h和72 h的 IC50分别为49.4 μmol/L、32.0 μmol/L和25.1 μmol/L,对于HL-60A细胞,相应的 IC50分别是69.1 μmol/L、42.5 μmol/L和29.6 μmol/L。塞来昔布作用24 h后,流式细胞术检测显示HL-60细胞中Annexin-Ⅴ+PI-、Annexin-Ⅴ+PI+及Annexin-Ⅴ-PI+细胞的比例增多; HL-60A细胞中Annexin-Ⅴ+PI-及Annexin-Ⅴ+PI+细胞的比例增多。Western blot实验结果显示塞来昔布作用后,cleaved caspase-3和cleaved PARP的蛋白水平增高,提示该凋亡作用是通过caspase途径的。自噬相关蛋白LC3Ⅱ及P62的表达均增加,mTOR、p-mTOR以及下游的4-EBP、p-4-EBP的蛋白水平没有变化,说明塞来昔布能够抑制AML细胞自噬,该作用与mTOR途径无关。 结论: 塞来昔布对HL-60细胞和HL-60A细胞活力的抑制作用呈浓度以及时间依赖性,该作用与塞来昔布诱导细胞凋亡及坏死有关。塞来昔布能够通过非mTOR依赖途径抑制AML细胞自噬,有望联合应用于AML的治疗,有助于增强某些引起保护性自噬的化疗药物的细胞毒作用。
塞来昔布; 急性髓细胞白血病; 细胞凋亡; 自噬
急性髓细胞白血病(acute myeloid leukemia,AML)是一种造血系统的恶性克隆性疾病,是成人急性白血病中最常见的类型。近30年来,AML的标准治疗方案为传统的“ 3+7”方案,即3 d的蒽环类药物加上7 d的阿糖胞苷。近年来随着新药的出现和治疗方法的改进,白血病的完全缓解率有了明显提高,但其多药耐药性以及较高的复发率仍是目前治愈白血病的主要障碍[1]。许多基础以及临床的研究报道了AML对蒽环类药物以及阿糖胞苷耐药[2-3],因此探索新的治疗方法以克服白血病细胞耐药是AML研究的重要课题。
塞来昔布(celecoxib)是由Searle制药厂研发的一种新型抗炎药,1998年12月31日在美国上市,商品名为西乐葆,用于治疗骨关节炎和类风湿性关节炎。近年来发现其具有抗肿瘤作用,美国FDA在2009年批准了塞来昔布治疗家族性腺瘤性息肉病(familial adenomatous polyposis,FAP),用于减少结肠和直肠癌的发病率[4]。另有研究表明塞来昔布对其它实体肿瘤包括肝癌、乳腺癌以及肺癌等均有增殖抑制作用[5-7]。有关塞来昔布对血液系统肿瘤作用的研究相对较晚,报道也相对较少。2004年研究者发现,与正常志愿者的淋巴组织相比,淋巴瘤组织细胞的COX-2水平增高2.2~4.3倍,选择性COX-2抑制剂塞来昔布能够抑制肿瘤细胞增殖,促进细胞凋亡,此作用呈时间和剂量依赖性[8]。2005年血液学权威杂志《Blood》发表了一项塞来昔布衍生物OSU03012治疗慢性淋巴细胞白血病的实验结果,此复合物可以同时通过线粒体依赖以及非依赖途径促进白血病细胞的凋亡,而且此凋亡作用与Bcl-2无关[9]。此后相继研究表明塞来昔布能促进多种AML细胞包括HL-60、NB4、MR2细胞的凋亡[10-12]。
细胞自噬(autophagy)是真核细胞利用溶酶体对自身细胞器及蛋白质进行降解的生物学过程[13],是真核生物对细胞内物质进行周转的重要形式。自噬在肿瘤细胞中的作用非常复杂,因其能够同时抑制肿瘤的发生以及促进其存活而被喻为肿瘤发生发展过程中的双刃剑,这种看似矛盾的作用与肿瘤类型、疾病分期及治疗手段有关[14]。目前尚未见塞来昔布对血液系统肿瘤自噬作用的相关报道。本研究以HL-60细胞和HL-60A细胞为研究对象,首次探索塞来昔布对耐阿霉素的HL-60A细胞的生长抑制作用,以及其对AML细胞株自噬的影响。
材 料 和 方 法
1 试剂和仪器
塞来昔布购自Pfizer;RPMI-1640培养基购自Gibco;胎牛血清购自杭州四季青公司;氯喹、MTT、碘化丙啶(propidium iodide, PI)及RNase A购自Sigma。抗LC3、P62、mTOR、p-mTOR、4-EBP、p-4-EBP、cleaved caspase-3、cleaved PARP和GAPDH单克隆抗体均购自Cell Signaling Technology。细胞培养箱和酶标仪购自Bio-Rad;流式细胞仪购自BD。
2 细胞培养
HL-60细胞和HL-60A 细胞为中山大学附属第三医院血液实验室保存。细胞接种于含10%胎牛血清的RPMI-1640培养基中,置37 ℃、5% CO2、饱和湿度的培养箱中传代培养,2~3 d换液1次。
3 方法
3.1 MTT法检测细胞活力 取生长良好的HL-60细胞和HL-60A细胞,用新鲜培养基制成细胞悬液,接种于96孔板,每孔的细胞为10 000个,设3个复孔,每孔加入不同浓度的阿霉素或者塞来昔布。24 h、48 h和72 h后用MTT法检测细胞活力,每孔加入5 g/L的MTT 20 μL,细胞培养4 h后弃去上清,加DMSO后,用酶标仪在490 nm波长处检测吸光度(A)。细胞活力 (%)=实验组A值/对照组A值×100%。
3.2 流式细胞术检测细胞凋亡 收集药物处理过的细胞悬液,离心去上清,用结合缓冲液重悬细胞,使细胞浓度为1×108/L。 取100 μL细胞加入5 μL 异硫氰酸荧光素(FTIC)标记的Annexin-Ⅴ 和5 μL PI,充分混匀,避光室温孵育15 min。加入400 μL结合缓冲液,转移至5 mL玻璃管,即刻用流式细胞仪进行分析。Annexin-Ⅴ+PI-为早期凋亡细胞;Annexin-Ⅴ+PI+为晚期凋亡细胞;Annexin-Ⅴ-PI+为坏死细胞。
3.3 Western blot法检测相关蛋白 收集处理后的细胞,离心去上清,PBS洗涤1次,加入适量蛋白裂解液提取蛋白, 测定蛋白浓度,根据浓度计算出一定质量的蛋白所需体积,取等量蛋白,按比例加入loa-ding buffer,离心后100 ℃加热10 min使之变性,保存于-20 ℃备用。 配制好SDS-PAGE胶,加上等质量的蛋白样本,盖上电泳槽盖子电泳2 h,然后转膜,再将含目的蛋白条带的PVDF膜放入封闭液中室温振荡1 h,将封闭的PVDF膜装入杂交袋中,然后加入配好的Ⅰ抗,封好膜后4 ℃孵育过夜,洗膜、封闭后Ⅱ抗室温孵育1 h,发光液发光后显影、定影。用ImageJ 2x软件分析蛋白条带的灰度。
4 统计学处理
SPSS 16.0 软件进行统计学分析,数据用均数±标准差(mean±SD)表示。两组间的比较用t检验。以P<0.05为差异有统计学意义。
结 果
1 塞来昔布对HL-60细胞和HL-60A细胞的增殖抑制作用
为验证HL-60A细胞对阿霉素的耐药性,首先检测了阿霉素对HL-60细胞和HL-60A细胞活力的影响。利用 MTT法检测不同浓度的阿霉素(0、0.1、0.2、0.4和0.8 mg/L)对2种细胞株的活力抑制作用。从图 1可见,0.8 mg/L 阿霉素作用 24 h、48 h和72 h 后,HL-60细胞的活力分别为 23.4%±2.9%、17.7%±0.5%及12.2%±4.4%,HL-60A细胞的活率则分别为63.8%±4.6%、28.6%±4.4%和14.8%±4.7%,阿霉素作用于HL-60细胞24 h的IC50是0.28 mg/L,而对于HL-60A细胞,相应的 IC50是2.23 mg/L。以上结果证实了HL-60A细胞对阿霉素的耐药性。
然后用不同浓度的塞来昔布(0、20、40、60、80和100 μmol/L)处理HL-60细胞和HL-60A细胞,分别在 24 h、48 h和72 h 后检测2种细胞株的活力。从图1可见,塞来昔布作用于HL-60细胞24 h、48 h和72 h的 IC50分别是49.4 μmol/L、32.0 μmol/L和25.1 μmol/L,而对于HL-60A细胞,相应的 IC50分别是69.1 μmol/L、42.5 μmol/L和29.6 μmol/L。由此可见,塞来昔布作用24 h及48 h时对HL-60A细胞活力的抑制作用低于HL-60细胞,而药物作用时间延长至72 h,塞来昔布对2种细胞活力的抑制作用接近。

Figure 1.Celecoxib inhibited the viability of HL-60 cells and HL-60A cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 mg/L doxorubicin;#P<0.05,##P<0.01vs0 μmol/L celecoxib.
图1 塞来昔布抑制HL-60细胞和HL-60A细胞活力
2 塞来昔布对HL-60细胞和HL-60A细胞凋亡率的影响
利用流式细胞术检测不同浓度塞来昔布(0、20、40、60和80 μmol/L)对HL-60细胞和HL-60A细胞凋亡的影响。如图2所示,随着塞来昔布浓度的增加,24 h后死亡细胞的比例均逐渐上升,不同浓度塞来昔布处理的HL-60细胞的凋亡率为分别为7.22%±1.74%、12.83%±2.84%、24.91%±1.33%、27.33%±3.01%和23.01%±3.31%,坏死率分别为1.82%±0.07%、4.18%±0.40%、12.40%±1.69%、50.10%±4.03%和63.45%±8.55%;HL-60A细胞的凋亡率为分别为1.61%±0.49%、12.17%±1.91%、25.67%±4.66%、16.44%±3.90%和15.39%±3.23%,坏死率分别为0.87%±0.04%、2.03%±0.24%、2.55%±0.55%、3.47%±1.39%和8.12%±2.65%。

Figure 2.Celecoxib induced apoptosis of HL-60 cells and HL-60A cells and induced HL-60 cell necrosis. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图2 塞来昔布促进HL-60细胞和HL-60A细胞凋亡以及促进HL-60细胞坏死
3 塞来昔布对凋亡相关蛋白的影响
用Western blot法检测了细胞凋亡相关蛋白cleaved caspase-3和cleaved PARP的蛋白水平。从图3可见,随着塞来昔布浓度的增加,HL-60和HL-60A细胞的cleaved caspase-3及cleaved PARP的蛋白水平也逐渐增加,总PARP 的蛋白水平降低。
4 塞来昔布对HL-60细胞和HL-60A细胞自噬的影响
4.1 塞来昔布作用于HL-60细胞和HL-60A细胞后LC3和P62的变化 随着塞来昔布浓度的增加(0、20、40和80 μmol/L),LC3Ⅱ/LC3Ⅰ及P62蛋白水平均增加,见图4。
4.2 塞来昔布对mTOR途径的影响 从图4可见,随着塞来昔布浓度的增加,AML细胞株中mTOR、p-mTOR以及下游的4-EBP、p-4-EBP蛋白水平没有变化。
4.3 氯喹作用于HL-60细胞后LC3及P62的变化 由图5可见,两种AML细胞经20 μmol/L氯喹处理24 h后LC3 Ⅱ/LC3 Ⅰ以及P62蛋白水平都增加。
Figure 3.The effects of celecoxib on the expression of apoptosis-related proteins in HL-60 cells and HL-60A cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图3 塞来昔布对HL-60和HL-60A细胞凋亡相关蛋白的影响
讨 论
本研究表明随着塞来昔布药物浓度的增加以及作用时间的延长,HL-60细胞、HL-60A细胞活力逐渐降低,说明在一定药物浓度以及作用时间范围内,塞来昔布对HL-60细胞和HL-60A细胞活力的抑制作用呈时间以及剂量依赖性。与HL-60A细胞对阿霉素耐药不同,当塞来昔布的药物浓度提高到60~100 μmol/L,作用时间延长到72 h时,塞来昔布对2株细胞具有相似的细胞活力抑制作用。此实验结果提示塞来昔布有望用于治疗对阿霉素耐药的AML。
研究进一步证实了塞来昔布能够促进HL-60细胞和HL-60A细胞的凋亡。值得一提的是除凋亡这一经典的细胞死亡途径外,塞来昔布还诱导AML细胞的坏死,这一作用在HL-60细胞中尤为突出,随着塞来昔布药物浓度的增加,HL-60细胞坏死数量明显递增,然而对HL-60A而言,不同浓度塞来昔布作用24 h后,坏死的细胞没有明显增加。由此可见,塞来昔布作用AML细胞24 h后,HL-60细胞活力远远低于HL-60A细胞的原因之一是塞来昔布促HL-60A坏死的能力远远低于HL-60细胞。此外,实验还从蛋白水平检测了凋亡相关蛋白cleaved caspase-3以及cleaved PARP。在本研究中,塞来昔布作用于HL-60细胞和HL-60A细胞后,cleaved caspase-3以及cleaved PARP蛋白的水平均明显升高,说明塞来昔布对白血病细胞的促凋亡作用是通过caspase途径的,这与Zhang等[15]的研究一致。
本研究的重点是在塞来昔布对AML细胞的自噬作用的影响。细胞自噬是一个非常复杂而且神秘的过程,至今其中的机制尚未完全研究清楚。细胞自噬过程由自噬体的形成到自噬体与溶酶体的结合,最后到溶酶体的降解,因此自噬的过程又被称为自噬流[16]。本研究用Western blot法检测不同浓度塞来昔布作用于HL-60细胞和HL-60A细胞后LC3的变化。LC3是目前发现的唯一定位于自噬泡膜上的调节蛋白,因此常用作自噬形成的标志[17]。随着塞来昔布浓度的增加,LC3Ⅱ/ LC3Ⅰ逐渐增多,提示自噬体的增加。P62又称SQSTM1,是参与自噬体降解的重要蛋白,随着自噬体的降解,P62逐渐减少[18], 因此P62的降低提示自噬增加,相反P62增加提示自噬被抑制。随着塞来昔布浓度的增加,P62逐渐增加。 LC3及P62的结果提示塞来昔布能够抑制HL-60细胞和HL-60A细胞自噬,其并不是抑制自噬体的形成,而是抑制自噬体的降解。自噬的调节是非常复杂的过程,有多种信号通路包括mTOR、Beclin 1、PI3K及Ca2+等的参与。其中mTOR是ATP和氨基酸的感受器,在自噬过程中发挥着门控作用,是自噬体形成、成熟的关键[19]。
Figure 4.The effects of celecoxib on the expression of autophagy-related proteins in the HL-60 cells and HL-60A cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图4 塞来昔布对HL-60和HL-60A细胞自噬相关蛋白的影响
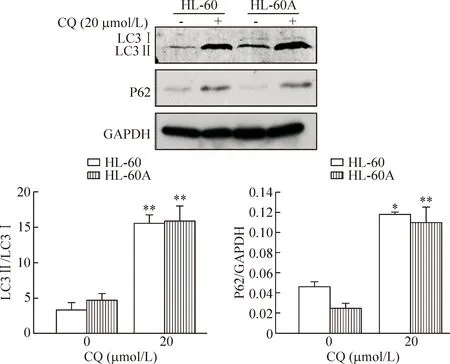
Figure 5.The effects of chloroquine (CQ) on the expression of autophagy-related proteins in the HL-60 cells and HL-60A cells. Mean±SD.n=3. *P<0.05,**P<0.01vs0 μmol/L.
图5 氯喹对HL-60和HL-60A细胞自噬相关蛋白的影响
实验进一步检测mTOR途径相关蛋白,mTOR、p-mTOR以及下游的4-EBP、p-4-EBP蛋白水平没有变化,进一步支持了的LC3Ⅱ的增加并非是自噬体的生成增多引起的。本研究还比较了塞来昔布以及氯喹对2株AML细胞的作用。氯喹是一种常用的自噬抑制剂,它能够通过抑制溶酶体的功能以及抑制自噬体与溶酶体的结合而抑制细胞自噬过程[20]。氯喹能够增加HL-60细胞和HL-60A细胞LC3 Ⅱ和P62水平,这与塞来昔布对HL-60细胞和HL-60A细胞的作用一致,因此进一步证实了塞来昔布与氯喹一样,能够抑制白血病细胞的自噬,这是一个新的发现。
特别值得一提的是在白血病的治疗中,细胞自噬被看作是一种非常重要的能影响各种药物治疗效果的机制[21-23]。在某些治疗药物中,自噬呈现出细胞毒作用促进细胞死亡[21-22],然而,在另外一些治疗方法中,自噬作为一种调节机制能够促进白血病细胞的存活,亦被称作保护性细胞自噬[23]。有1期临床试验结果显示,羟氯喹联合硼替佐米治疗14例复发/难治的多发性骨髓瘤患者,3例(14%)取得较好缓解(very good partial remission,VGPR), 3例(14%)获得微小缓解(minor remission,MR),10例(45%)疾病稳定(stable disease,SD)[24]。以上结果表明化疗或者其它小分子物质联合自噬抑制剂将会是靶向血液系统恶性肿瘤的一种有前途的治疗手段。本实验表明塞来昔布能够抑制白血病细胞株HL-60细胞和HL-60A的细胞自噬,因此,塞来昔布作为可选择的自噬抑制剂,有望联合应用于AML的治疗过程,有助于增强某些引起保护性自噬的化疗药物的细胞毒作用。我们的后期实验将进一步探索塞来昔布联合阿霉素等化疗药物作用于白血病细胞的效果,检测2类药物联用能否增强化疗药物的细胞毒作用以及该作用与细胞自噬的关系。
[1] Lee JH, Joo YD, Kim H, et al. A randomized trial comparing standard versus high-dose daunorubicin induction in patients with acute myeloid leukemia[J]. Blood, 2011, 118(14):3832-3841.
[2] Cai J, Damaraju VL, Groulx N, et al. Two distinct molecular mechanisms underlying cytarabine resistance in human leukemic cells[J]. Cancer Res, 2008, 68(7):2349-2357.
[3] Jiang X, Wang Z, Ding B, et al. The hypomethylating agent prior to chemotherapy improves the therapy efficacy in refractory/replased acute myeloid patients[J]. Oncotarget, 2015, 6(32):33612-33622.
[4] Steinbach G, Lynch PM, Phillips RK, et al. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis[J].N Engl J Med, 2000, 342(26):1946-1952.
[5] Tang TC, Poon RT, Lau CP, et al. Tumor cyclooxygenase-2 levels correlate with tumor invasiveness in human hepatocellular carcinoma[J]. World J Gastroenterol, 2005, 11(11):1896-1902.
[6] Chow LW, Tung SY, Ng TY, et al. Concurrent celecoxib with 5- fluorouracil/epirubicin/cyclophosphamide followed by docetaxel for stages Ⅱ-Ⅲ invasive breast cancer,the OOTR-N001 study[J]. Expert Opinion Investig Drugs, 2013, 22(3):299-307.
[7] Zhang H, Li Z, Wang K. Combining sorafenib with celecoxib synergistically inhibits tumor growth of non-small cell lung cancer cellsinvitroandinvivo[J]. Oncol Rep, 2014, 31(4):1954-1960.
[8] Wun T, McKnight H, Tuscano JM. Increased cyclooxygenase-2 (COX-2): a potential role in the pathogenesis of lymphoma[J]. Leuk Res, 2004, 28(2):179-190.
[9] Johnson AJ, Smith LL, Zhu J, et al. A novel celecoxib derivative, OSU03012, induces cytotoxicity in primary CLL cells and transformed B-cell lymphoma cell line via a caspase- and Bcl-2-independent mechanism[J]. Blood, 2005, 105(6):2504-2509.
[10]Chen C, Xu W, Wang CM. Combination of celecoxib and doxorubicin increases growth inhibition and apoptosis in acute myeloid leukemia cells[J]. Leuk Lymphoma, 2013, 54(11):2517-2522.
[11]胥 昀, 黄 河. 塞来昔布抑制NB4细胞增殖并诱导凋亡的体外研究[J]. 实用肿瘤杂志, 2008, 23(3):219-222.
[12]胥 昀, 赵妍敏, 黄 河, 等. 塞来昔布诱导急性早幼粒细胞白血病细胞株MR2凋亡及机制的研究[J]. 浙江大学学报:医学版,2007, 36(4):319-324.
[13]Levine B, Klionsky DJ. Development by self-digestion:molecular mechanisms and biological functions of auto-phagy[J]. Dev Cell, 2004, 6(4):463-477.
[14]Rubinsztein DC, Gestwicki JE, Murphy LO, et al. Potential therapeutic applications of autophagy[J]. Nat Rev Drug Discov, 2007, 6(4):304-312.
[15]Zhang GS, Liu DS, Dai CW, et al. Antitumor effects of celecoxib on K562 leukemia cells are mediated by cell-cycle arrest, caspase-3 activation, and downregulation of Cox-2 expression and are synergistic with hydroxyurea or imatinib[J]. Am J Hematol, 2006, 81(4):242-255.
[16]Kimura S, Fujita N, Noda T, et al. Monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J]. Methods Enzymol, 2009, 452:1-12.
[17]Chifenti B, Locci MT, Lazzeri G, et al. Autophagy-rela-ted protein LC3 and Beclin-1 in the first trimester of pregnancy[J]. Clin Exp Reprod Med, 2013, 40(1):33-37.
[18]Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J]. J Biol Chem, 2007, 282(33):24131-24145.
[19]Dunlop EA, Tee AR. mTOR and autophagy: a dynamic relationship governed by nutrients and energy[J]. Semin Cell Dev Biol, 2014, 36:121-129.
[20]Yoon YH, Cho KS, Wang JJ, et al. Induction of lysoso-mal dilatation arrested autophagy, and cell death by chloroquine in cultured ARPE-19 cells[J]. Invest Ophthalmol Vis, 2010, 51(11):6030-6037.
[21]Huang Y, Hou JK, Chen TT, et al. PML-RARa enhances constitutive autophagic activity through inhibiting the Akt/mTOR pathway[J]. Autophagy, 2011, 7(10):1132-1144.
[22]Ristic B, Bosnjak M, Arsikin K, et al. Idarubicin induces mTOR-dependent cytotoxic autophagy in leukemic cells[J]. Exp Cell Res, 2014, 326(1):90-102.
[23]Kim Y, Eom JI, Jeung HK, et al. Induction of cytosine arabinoside-resistant human myeloid leukemia cell death through autophagy regulation by hydroxychlo roquine[J]. Biomed Pharmacother, 2015, 73:87-96.
[24]Vogl DT, Stadtmauer EA, Tan KS, et al. Combined auto-phagy and proteasome inhibition:phase 1 trial of hydroxychloroquine and bortezomibin patients with relapsed/refractory myeloma[J]. Autophagy, 2014, 10(8):1380-1390.
(责任编辑: 陈妙玲, 罗 森)
Celecoxib inhibits viability, induces apoptosis and inhibits autophagy in acute myeloid leukemia cell lines HL-60 and HL-60A
LU Ying1, 2, LIU Xiang-fu1, LIU Ling-ling2, LIN Zhe-sheng1, CHEN Yu-chan1, FENG Bao-ying1, ZHANG Xiang-zhong2
(1DepartmentofBloodTransfusion,2DepartmentofHematology,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:bradzxz@126.com)
AIM: To investigate the effects of celecoxib on viability, apoptosis and autophagy in acute myeloid leukemia (AML) cell lines HL-60 and HL-60A. METHODS: The HL-60 cells and HL-60A cells were cultured with various concentrations (0, 20, 40, 60, 80 and 100 μmol/L) of celecoxib. The inhibitory effect of celecoxib on the cell viability was evaluated by MTT assay. Apoptosis was analyzed by Annexin-V/PI staining. Apoptosis-related and autophagy-related proteins were determined by Western blot. RESULTS: IC50of celecoxib were 49.4 μmol/L, 32.0 μmol/L and 25.1 μmol/L for HL-60 cells treated with celecoxib for 24 h, 48 h and 72 h, respectively. For HL-60A cells, the corresponding IC50were 69.1 μmol/L, 42.5 μmol/L and 29.6 μmol/L, respectively. The results of flow cytometry analysis showed the proportions of Annexin-Ⅴ+PI-, Annexin-Ⅴ+PI+and Annexin-Ⅴ-PI+cells were increased in the HL-60 cells, and those of Annexin-Ⅴ+PI-and Annexin-Ⅴ+PI+cells were increased in the HL-60A cells treated with celecoxib for 24 h. After treated with celecoxib, the induction of apoptosis was observed, the apoptosis-related proteins cleaved caspase-3 and cleaved PARP were upregulated, the autophagy-related proteins LC3 II and P62 were both increased, and mTOR, p-mTOR, 4-EBP and p-4-EBP were not changed, indicating that celecoxib inhibited autophagy in the AML cells without the mTOR pathway involvement. CONCLUSION: Celecoxib inhibits the viability of HL-60 cells and HL-60A cells in a time- and dose-dependent manner by its effects of inducing apoptosis and necrosis. Celecoxib inhibits mTOR-independent autophagy in AML cells, indicating a possible way of using celecoxib for enhancing the antitumor activity of therapeutic agents to induce cytoprotective autophagy in the AML cells.
Celecoxib; Acute myeloid leukemia; Apoptosis; Autophagy
1000- 4718(2017)01- 0018- 08
2016- 07- 07
2016- 10- 26
广东省自然科学基金资助项目(No. 2014A030313138);广东省自然科学基金博士启动基金资助项目(No. 2014A030310292)
R733.72
A
10.3969/j.issn.1000- 4718.2017.01.004
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-82179782; E-mail: bradzxz@126.com
▲并列第1作者
