木质素对纤维素酶的吸附作用研究
2017-01-12周晓明杨海涛
姚 兰 周晓明 田 彦 杨海涛,*
(1.湖北工业大学制浆造纸工程学院,湖北武汉,430068;2.齐鲁工业大学制浆造纸科学与技术教育部重点实验室,山东济南,250353)
木质素对纤维素酶的吸附作用研究
姚 兰1,2周晓明1田 彦1杨海涛1,*
(1.湖北工业大学制浆造纸工程学院,湖北武汉,430068;2.齐鲁工业大学制浆造纸科学与技术教育部重点实验室,山东济南,250353)
研究了杨木木质素、银杏木质素、玉米秸秆木质素3种不同来源木质素对纤维素酶的吸附作用,并与微晶纤维素对纤维素酶的吸附作用进行对比。结果表明,杨木木质素为GS型木质素,银杏木质素为G型木质素,玉米秸秆木质素为GSH型木质素;4种底物对于纤维素酶的吸附作用强弱顺序为:银杏木质素>玉米秸秆木质素>杨木木质素>微晶纤维素;木质素主要吸附的是纤维素酶中的内切酶和β-葡萄糖苷酶,而对外切酶的吸附较少。
木质素;纤维素酶;吸附作用;最大吸附量
经济发展、国家安全以及环境保护等各方面的需求促使各个国家积极寻找可以替代石油的新能源。我国是世界第一大发展中国家,开发可以替代石油的新能源具有重要意义。纤维素乙醇在这一背景下应运而生。在纤维素乙醇的生产过程中,如何降低其生产成本是目前亟待解决的难题。数据显示,纤维素酶占纤维素乙醇生产成本的15%~50%[1]。因此,如何降低纤维素酶的用量是降低纤维素乙醇生产成本的关键。在纤维素乙醇的生产过程中,木质素对纤维素酶的无效吸附导致纤维素酶用量增加,从而增加了纤维素乙醇的生产成本。因而,研究木质素对纤维素酶的吸附机理,以减弱木质素的吸附作用是降低纤维素乙醇生产成本的关键所在。
在纤维素乙醇生产中,纤维素酶在其底物——纤维素上的吸附有利于后续酶解的顺利进行[2]。Singh等[3]的研究结果表明,在30℃下,纤维素酶将在10 min内快速吸附于纤维素底物上,这有利于纤维素酶对不溶性纤维素底物的催化降解。由于木质纤维原料中存在木质素,木质素会通过疏水作用引起纤维素酶的无效吸附而降低其有效酶活[4]。因而,利用数学模型研究木质素对纤维素酶的吸附作用,对于降低纤维素乙醇生产成本意义重大。
本实验以银杏、杨木和玉米秸秆为原料,研究不同来源的木质素在50℃下对纤维素酶的吸附作用,绘制其吸附过程的动力学曲线,并与微晶纤维素进行对比。
1 实 验
1.1 木质素的制备
实验选取银杏、杨木和玉米秸秆为原料,采用Björkman[5]提出的方法精制磨木木质素(MWL)。将得到的3种木质素分别命名为银杏木质素、杨木木质素、玉米秸秆木质素。
1.2 纤维素酶吸附实验
采用pH值为4.8的HAc-NaAc缓冲液配制不同蛋白质浓度(0.04~4 g/L)的纤维素酶液,在50℃、200 r/min的旋转培养器上与木质素(质量浓度0.05 g/mL)混合,反应4 h后,离心处理并测定上清液的酶活和蛋白质浓度。同时,将不同蛋白质浓度(0.04~4 g/L)的纤维素酶液、pH值为4.8的HAc-NaAc缓冲溶液加木质素(质量浓度0.05 g/mL)分别作为空白对照样1#和空白对照样2#。在微晶纤维素吸附纤维素酶的实验中,在配制好的酶液中加入葡萄糖(质量浓度5 g/mL)以抑制微晶纤维素的水解,其他条件同上。所有实验重复3次。
1.3 分析方法
(1)红外谱图测试 取1~2 mg木质素样品与10倍量的无水KBr混合(在玛瑙研钵中研磨),混合均匀后,倒入压片模具中压片,采用美国Thermo Nicolet公司Nexus FT-IR型红外光谱仪分析3种木质素的傅里叶变换红外光谱。
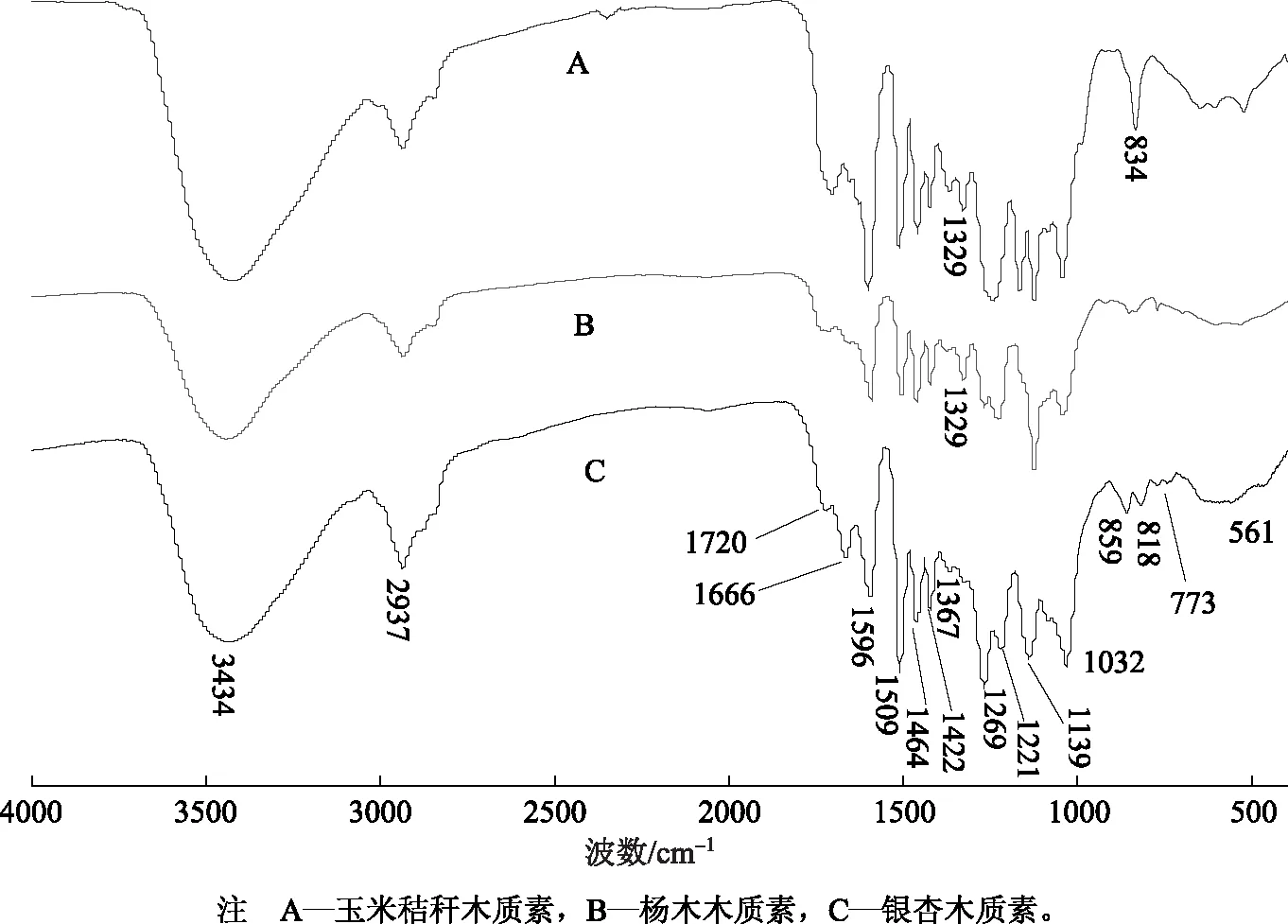
图1 3种木质素红外光谱谱图
(2)蛋白质浓度测定 采用考马斯亮蓝法测定蛋白质浓度。将适当稀释的粗酶液100 μL加入到1 mL的考马斯亮蓝中,混匀,在波长595 nm处读取吸光度,以牛血清蛋白质作为标准物绘制标准曲线。
(3)纤维素酶酶活测定 以1%水杨苷为底物测定β-葡萄糖苷酶酶活[6];以1%羧甲基纤维素钠(CMC)为底物测定内切酶酶活[7];以对硝基苯纤维二糖苷(pNPC)为底物测定外切酶酶活[4]。
2 结果与讨论
2.1 木质素红外光谱分析

2.2 不同底物对纤维素酶吸附动力学的研究
在以往的研究[11]中,对木质纤维原料吸附纤维素酶等温线的研究都在4℃下进行,主要是为了避免木质纤维原料的水解。但是,有研究表明,50℃下吸附反应比4℃时更加强烈[12],且纤维素酶对木质纤维原料的酶解是在纤维素酶的最适温度50℃下进行的,因此,本实验也在该温度下研究木质素对纤维素酶的吸附动力学。在50℃、培养器转速200 r/min、吸附时间4 h的条件下,研究3种来源木质素对纤维素酶的吸附作用,并与微晶纤维素对纤维素酶的吸附作用进行比较。
表1 木质素官能团信号归属

3种木质素与微晶纤维素对纤维素酶的吸附曲线见图2。由图2可以看出,随着纤维素酶溶液中蛋白质浓度的增大,3种木质素和微晶纤维素对纤维素酶的吸附量逐渐增大,最后达到平衡。根据朗格缪尔吸附等温式(见式(1)),可以得出3种木质素和微晶纤维素对纤维素酶的最大吸附量和平衡常数Kp(见表2)。
(1)
K=Emax×Kp
(2)
式中,Ead为酶吸附量,mg/g;Ef为蛋白质浓度,g/L;Emax为最大吸附量,mg/g;Kp为平衡常数;K表征蛋白质与底物的相互作用力。
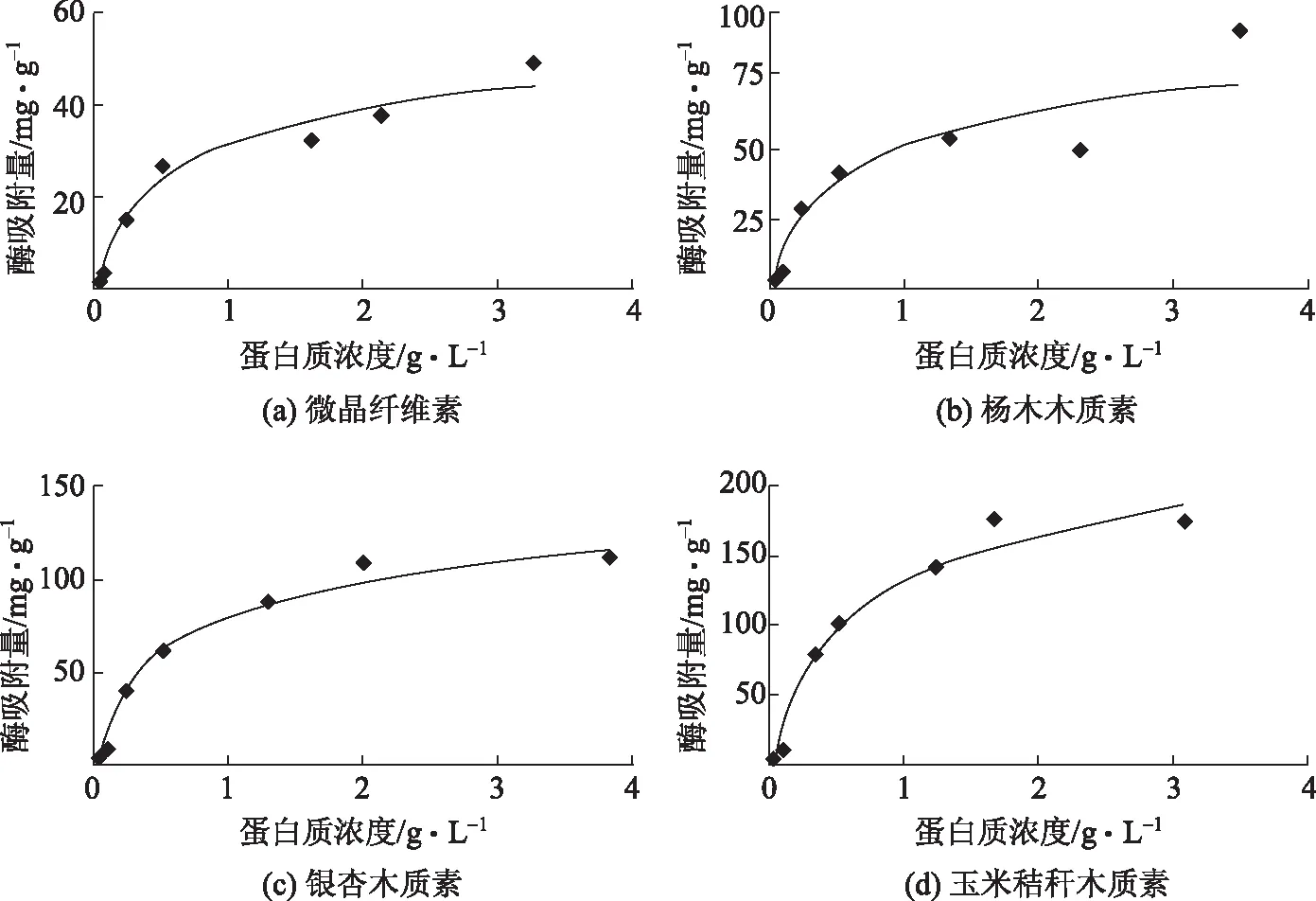
图2 3种木质素和微晶纤维素对纤维素酶的吸附曲线
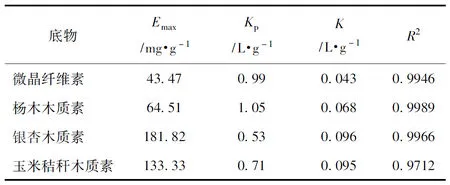
从表2可以看出,50℃时,微晶纤维素对纤维素酶的最大吸附量为43.47 mg/g,而杨木木质素、银杏木质素、玉米秸秆木质素对纤维素酶的最大吸附量分别为64.51、181.82、133.33 mg/g,分别是微晶纤维素最大吸附量的1.5、4.2、3.1倍,表明木质素含量高的物质会吸附更多的纤维素酶,这与以往的研究结果一致[13-14]。但本实验得出的最大吸附量比文献中的稍高,这可能是因为为了避免由于底物颗粒大小不同造成比表面积不同进而对实验结果产生影响,对微晶纤维素和木质素进行筛选,选取100~140目的底物进行实验研究,这些底物可能较其他研究中用的底物小,所以会吸附更多的纤维素酶。实验结果表明,木质素比微晶纤维素可吸附更多的纤维素酶,且与文献中木质纤维原料吸附纤维素酶相比,木质素对纤维素酶的最大吸附量也较大,表明在木质纤维原料中,木质素对纤维素酶的吸附能力最强。
朗缪尔吸附等温线中的参数Kp可反映蛋白质和底物的亲和力,准确的说,是纯化后的单一蛋白质与底物的亲和力,由于本实验中使用的是混合纤维素酶,所以该参数没有实际意义。银杏木质素和玉米秸秆木质素的K相差不大,且在4个底物中两者的K较大,其次是杨木木质素的K,微晶纤维素的K最小,说明木质素对纤维素酶的吸附作用大于微晶纤维素;而3种木质素对纤维素酶吸附作用的大小顺序为:银杏木质素>玉米秸秆木质素>杨木木质素。
2.3 3种木质素对纤维素酶各组分的吸附量
木质素的结构决定了其吸附纤维素酶的组分,通过分析被吸附的纤维素酶组分能够进一步研究木质素对纤维素酶的吸附特征。实验选取了蛋白质浓度分别为0.05、0.1、1、4 g/L的纤维素酶液与3种木质素充分混合均匀直至吸附平衡,以CMC、pNPC、水杨苷为底物测定被木质素吸附后纤维素酶中的内切酶、外切酶、β-葡萄糖苷酶的酶活,评估不同木质素对纤维素酶各组分的吸附程度。3种木质素对纤维素酶各组分和蛋白质的吸附量见图3。
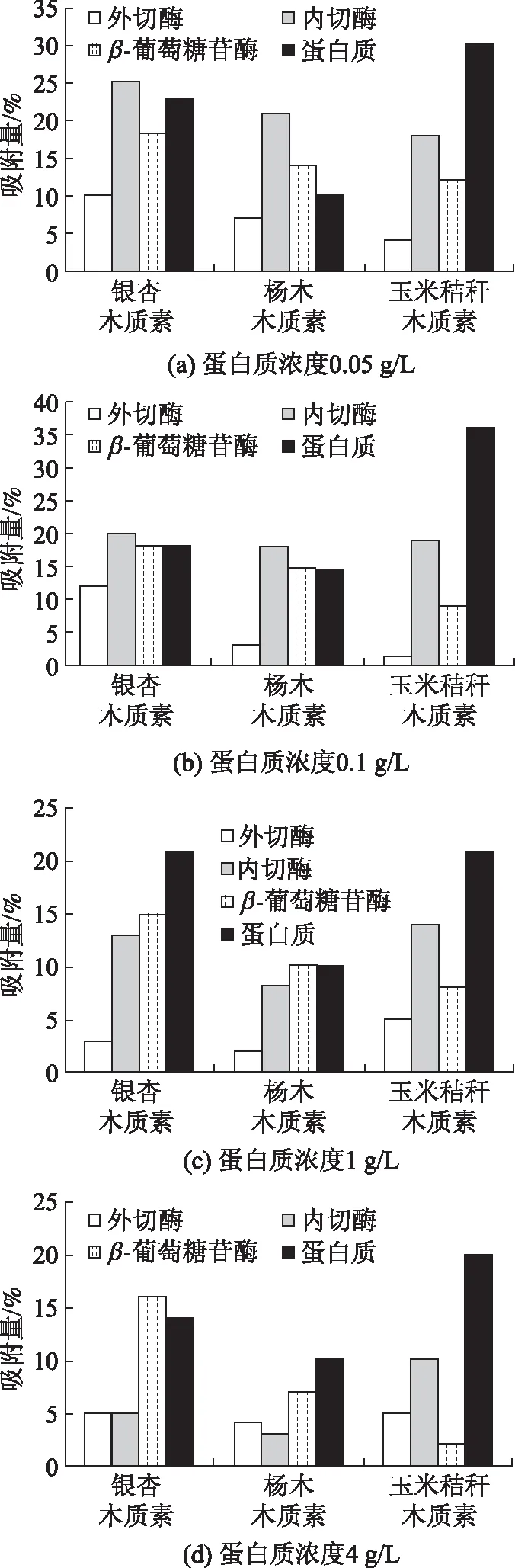
图3 3种木质素对纤维素酶各组分和蛋白质的吸附量
从图3可以明显看出,在实验的蛋白质浓度下,玉米秸秆木质素吸附的蛋白质最多,其次是银杏木质素,杨木木质素吸附的蛋白质最少。尽管玉米秸秆木质素吸附的蛋白质最多,但银杏木质素对纤维素酶各组分的吸附量要大一些。例如,从图3(a)可知,银杏木质素对于外切酶、内切酶、β-葡萄糖苷酶的吸附量分别为10.0%、25.1%和18.2%,分别是玉米秸秆木质素和杨木木质素对外切酶、内切酶、β-葡萄糖苷酶吸附量的2.4、1.4、1.4和1.2、1.5、1.3倍。另外,在低蛋白质浓度(0.05和0.1 g/L)下,3种木质素吸附最多的是内切酶,其次是β-葡萄糖苷酶,木质素对外切酶的吸附作用最弱;在高蛋白质浓度(1和4 mg/mL)下,杨木木质素和银杏木质素对β-葡萄糖苷酶的吸附作用最强,其次是内切酶,而玉米秸秆木质素吸附最多的是内切酶,其次是β-葡萄糖苷酶,所有木质素对外切酶的吸附作用最弱。
上述分析表明,对于每种木质素,对3种酶的吸附量大小顺序为:内切酶≈β-葡萄糖苷酶>外切酶。3种木质素对纤维素酶各组分吸附量大小顺序为:银杏木质素>玉米秸秆木质素>杨木木质素,这与前面吸附动力学曲线分析中得到的最大吸附量结果一致。
3 结 论
来自于银杏、杨木和玉米秸秆中的磨木木质素的结构特点和性质不同,红外光谱分析结果表明,3种木质素分别为G型、GS型和GSH型。通过木质素和微晶纤维素对纤维素酶吸附动力学曲线的研究表明,3种木质素和微晶纤维素对纤维素酶的最大吸附量分别为181.82、133.33、64.51和43.47 mg/g。它们对纤维素酶的亲和力大小为银杏木质素>玉米秸秆木质素>杨木木质素>微晶纤维素,说明木质素比微晶纤维素会吸附更多的纤维素酶,且3种木质素中吸附性能最强的是银杏木质素。木质素主要吸附的是纤维素酶中的内切酶和β-葡萄糖苷酶。
[1] Jeremy S Luterbacher, Jacqueline M Rand, David Martin Alonso, et al. Nonenzymatic Sugar Production from Biomass Using Biomass Derivedγ-Valerolactone [J]. Science, 2014, 343: 277.
[2] Gan Q, Allen S J, Taylor G. Kinetic dynamics in heterogeneous enzymatic hydrolysis of cellulose: an overview, an experimental study and mathematical modelling[J]. Process Biochem, 2003, 38: 1003.
[3] Singh A, Kumar P K R, Schügerl K. Adsorption and reuse of cellulases during saccharification of cellulosic materials[J]. J Biotechnol, 1991, 18: 205.
[4] Xu F, Ding H, Osborn D, et al. Partition of enzymes between the solvent and insoluble substrate during the hydrolysis of lignocellulose by cellulases[J]. Journal of Molecular Catalysis B: Enzymatic, 2008, 51: 42.
[5] Björkman A. Studies on finely divided wood. Part 1.-Extraction of lignin with neutral solvent[J]. Svensk Papperstidn, 1956, 59(13): 477.
[6] Child J J, Eveleigh D E, Sieben A S. Determination of cellulase activity using hydroxyethyl cellulose as substrats[J]. Canadian Journal of Biochemistry, 1973, 51(1): 39.
[7] Deshpander M V, Eriksson K E, Pettersson L G. An assay for selective determination of exo-1,4-β-glucanases in a mixture of cellulolyticenzymes[J]. Anal Biochem, 1984, 138: 481.
[8] Faix O. Classification of lignins from different botanical origins by FT-IR spectroscopy[J]. Holzforschung, 1991, 45(s1): 21.
[9] Yang H T, Zheng X, Yao L, et al. Elucidation of the bonds between cellulose and dehydrogenation polymer with carbon-13 isotopic tracer method[J]. Cellulose Chem Technol, 2013, 47(3/4): 143.
[10] Yang Haitao, Zheng Xing, Yao Lan, et al.Structural changes of lignin in the Soda-AQ pulping process studied using the carbon-13 tracer method[J]. BioResources, 2014, 9(1): 176.
[11] Daniele Longo Machado, Jõao Moreira Neto,José Geraldo da Cruz Pradella, et al. Adsorption characteristics of cellulaseandβ-glucosidase on avicel, pretreated sugarcane bagasse, and lignin[J]. Biotechnology and Applied Biochemistry, 2015, 62(5): 681.
[12] Zheng Yingfu, Zhang Songping, Miao Shida, et al. Temperature sensitivity of cellulase adsorption on lignin and its impact on enzymatic hydrolysis of lignocellulosic biomass[J]. Journal of Biotech-nolog, 2013, 166: 135.
[13] JaKyongKo, Eduardo Ximenes, Youngmi Kim, et al. Adsorption of Enzyme onto Lignins of Liquid Hot Water Pretreated Hardwoods[J]. Biotechnology and Bioengineering, 2015, 112(3): 447.
[14] Seiji Nakagame, Richard P Chandra, John F Kadla, et al. Enhancing the Enzymatic Hydrolysis of Lignocellulosic Biomass by Increasing the Carboxylic Acid Content of the Associated Lignin[J]. Biotechnology and Bioengineering, 2011, 108(3): 538.
(责任编辑:郭彩云)
Study of the Adsorption of Cellulase on Lignin
YAO Lan1,2ZHOU Xiao-ming1TIAN Yan1YANG Hai-tao1,*
(1.SchoolofPulpandPaperEngineering,HubeiUniversityofTechnology,Wuhan,HubeiProvince, 430068;2.KeyLabofPulpandPaperScience&TechnologyofEducationMinistryofChina,QiluUniversityofTechnology,Ji’nan,ShandongProvince, 250353)
(*E-mail: pphtyang1979@aliyun.com.cn)
In the process of bioethanol production, adsorption of cellulase on lignin results in the high cost. In this paper, adsorption of cellulose on lignins from three different sources was studied and compared with the adsorption of cellulose on microcrystalline cellulose. FT-IR analysis showed that milled wood lignins from poplar, gingko and corn stover belonged to GS, G and GSH type, respectively. The results of adsorption of cellulase on lignin showed that the adsorption capacity was expressed as follows: gingko lignin > corn stover lignin > poplar lignin > microcrystalline cellulose. Enzyme activity measurement demonstrated a prominent absorption of endoglucanase andβ-glucosidase on lignins.
lignin; cellulase; adsorption; maximum adsorption capacity
2016- 02- 23
国家自然科学基金(31500496);制浆造纸科学与技术教育部重点实验室开放基金(KF-201409)。
姚 兰,女,1982年生;讲师,博士;主要从事环境资源微生物技术研究工作。
*通信联系人:杨海涛,E-mail:pphtyang1979@aliyun.com.cn。
TS7;TK6
A
1000- 6842(2016)04- 0025- 05
