铜绿假单胞菌临床分离株基因型分析
2017-01-09周小青谢彦彤梁宏洁王可李亚楠孔晋亮
周小青,谢彦彤,梁宏洁,王可,李亚楠,孔晋亮
(1广西医科大学第一附属医院,南宁530021;2广西医科大学)
铜绿假单胞菌临床分离株基因型分析
周小青1,谢彦彤2,梁宏洁1,王可1,李亚楠1,孔晋亮1
(1广西医科大学第一附属医院,南宁530021;2广西医科大学)
目的 分析某院各科室长期持续感染的铜绿假单胞菌(PA)分离株的基因型,探讨PA的基因变异情况。方法 从某院各科室住院患者送检的标本中分离PA,对感染持续时间大于30天的菌株采用随机扩增多态性DNA(RAPD)基因分型技术获得RAPD指纹图谱,并进行同源性聚类分析,通过相似性系数了解PA之间的亲缘关系;对比PA的RAPD型别,判断是否存在爆发流行及同一患者连续感染的PA基因是否发生变异。结果 共收集PA 293株,其中感染持续时间大于30天的菌株117株,扩增出19种基因型条带,分别为A~S型,分型率100%;基因型相似系数范围为0.64~0.93,基因型A和G、基因型B和R、基因型D和E、基因型M和P的相似系数均为0.93,说明它们之间具有高度的同源性。重症医学科及烧伤整形外科各发生一起在不同患者之间检出相同RAPD型别PA菌株的情况,其余患者RAPD型别各不相同。4例患者连续感染的PA指纹图谱发生改变。结论 某院各科室长期持续感染的PA分离株存在多种基因型,提示PA在感染过程中可发生基因变异,存在基因多态性。
铜绿假单胞菌,基因型;随机扩增多态性DNA;基因分型技术
铜绿假单胞菌(PA)是广泛存在于土壤、水和医院环境中的条件致病菌,是导致医院内严重颅脑损伤、大面积烧伤、重症肺炎、肿瘤、糖尿病等免疫力低下患者感染的主要病原菌,感染者主要表现为下呼吸道症状[1,2]。本研究采用随机扩增多态性DNA(RAPD)基因分型技术对PA基因分型进行检测,以了解PA感染状况及其基因变异情况,为PA感染的分子流行病学分析及其治疗提供依据。
1 材料与方法
1.1 材料 菌株: 收集广西医科大学第一附属医院2013年12月~2014年4月临床分离的PA,主要为各科室住院患者送检的痰及肺泡灌洗液、创面分泌物、尿液、血液、腹腔引流液等标本,按常规方法分离并培养,质控菌株为PA ATCC27853,均经法国梅里埃公司API细菌鉴定系统鉴定。将培养菌株保存在-80 ℃超低温冰箱备用。选取感染PA持续时间大于30天的患者标本中分离的117株菌株作为本次研究的实验菌株,其中深部晨痰和肺泡灌洗液81株(69.2%)、创面分泌物21株(17.9%)、深静脉导管5株(4.3%)、尿液5株(4.3%)、血液4株(3.4%)、腹腔引流液1株(0.8%)。117株PA来自23例患者,其中男15例(65.2%)、女8例(34.8%),年龄70 d~92岁[(54.9±23.8)岁],住院时间均>30天;来自重症医学科10例(43.5%),烧伤整形外科5例(21.7%),中医科5例(21.7%);原发病为颅脑损伤10例(43.5%),大面积烧伤5例(21.7%),重症肺炎4例(17.4%),肿瘤2例(8.7%),脊髓损伤并四肢瘫1例(4.3%),原发性肾病综合征(肾炎型)1例(4.3%);静脉使用广谱抗生素>2周20例(86.9%)、长期静脉使用或口服糖皮质激素[相当于泼尼松0.5 mg /(kg·d)]3例(13.0%),接受侵入性操作(包括气管插管或切开、中心静脉置管、深部吸痰、外科手术)19 例(82.6%)、长期机械通气15例(65.2%);合并糖尿病6 例(26.1%),低蛋白血症(血清白蛋白<35 g/L)20例(86.9%)。主要试剂及仪器:随机引物272(5′-AGCGGGCCAA-3′)[3,4]、Premix TaqTM(TaKaRa TaqTMVersion 2.0 plus dye)和DL 5000 DNA Marker均由Takara公司提供,GoldViewⅠ型核酸染色剂(Solarbio®公司)、DEPC水(Sangon公司)、50×TAE(Sangon公司)、西班牙琼脂糖(BIOWEST)、LB琼脂、LB肉汤。PCR仪(BIO-RAD S1000TMThermal Cycler)、全自动凝胶成像系统(BIO-RAD,Gel Doc XR+)、普通型电泳电源(BIO-RAD,PowerPacTMUniversal)、超微量核酸浓度测定仪(美国Thermo Nanodrop ND-2000)。
1.2 基因分型及结果判断 将PA菌株从-80 ℃超低温冰箱内取出,在LB琼脂培养皿上分区划线,于37 ℃孵育24 h,挑取单个菌落接种于2 mL LB肉汤,置于37 ℃恒温摇床上180 r/min培养16 h。采用煮沸法提取细菌基因组DNA,将1.5 mL菌液5 000 r/min离心5 min后去掉上清;在沉淀中加入无菌生理盐水混匀,重复以上步骤2~3次;在沉淀中加入DEPC水混匀,沸水中煮沸10 min,14 000 r/min离心后取上清即为细菌DNA。采用超微量核酸浓度测定仪检测DNA浓度及纯度,将DNA浓度稀释至100 ng/μL备用。每个菌株独立提取3次DNA,实验独立重复3次。以提取的DNA为模板进行PCR反应,反应体系总体积为20 μL,其中Premix 10 μL、DNA模板2 μL、引物(10 μmol/L)4 μL、DEPC水4 μL。反应条件: 98 ℃预变性2 min,98 ℃ 变性10 s,40 ℃退火5 min,72 ℃延伸5 min,2个循环;98 ℃ 变性10 s,40 ℃退火30 s,72 ℃延伸5 min,共40个循环;最后72 ℃充分延伸10 min。取PCR产物6 μL,置于含GoldViewⅠ型核酸染色剂的2%琼脂糖凝胶上电泳(5 V/cm)25 min,电泳完毕用全自动凝胶成像系统拍照。采用RAPD基因分型技术获得受试菌株的RAPD指纹图谱并进行同源聚类分析。首先确定各反应条带在RAPD指纹图谱上的相对位置,在同一分子量水平上,有条带记作“1”,无条带记作“0”。将所有菌株的反应条带均转换为含有“0”和“1”组成的数据矩阵,利用NTedit软件直接录入数据,文件另存为*.NTS格式文件。将*.NTS文件导入NTSYS pc 2.10软件计算相似系数,并用UPGMA法进行同源性聚类分析。 根据各科室检出PA的RAPD型别是否相同判断是否存在PA爆发流行及同一患者连续感染的PA是否发生变异,通过相似性系数的聚类分析树状图了解PA之间的亲缘关系。如同一科室或不同科室来自不同患者的PA显示相同的RAPD型别,判定为PA医院感染局部爆发流行;如同一科室或不同科室来自不同患者的RAPD型别各不相同,判定为PA医院散发感染。
2 结果
117株PA扩增出A~S共19种基因型(图1),各基因型的条带数目为2~9条,片段为300~3 000 bp,重复实验的分型结果基本一致。其中F型37株(31.6%),为院内主要流行型别;其次为H型29株(24.8%),O型7株(6.0%),C型和I型各6株(5.1%),E型5株(4.3%),其余型别为1~3株不等。重症医学科有8例患者感染相同RAPD型别PA菌株,烧伤整形外科有3例患者感染相同RAPD型别PA菌株,说明我院2013年12月~2014年4月期间发生二起PA爆发流行;除上述二起情况外,其余患者RAPD型别各不相同,表明各个科室之间无交叉感染现象出现,均为PA的医院散发感染。4例患者连续感染的PA指纹图谱发生改变(图2),19例患者不同时间段PA的RAPD指纹图谱未发生改变。基因型相似系数范围为0.64~0.93,基因型A和G、基因型B和R、基因型D和E、基因型M和P相似系数最大,均为0.93,说明它们之间具有高度的同源性,见图3。
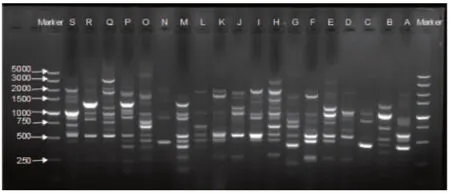
注:Marker 为DNA分子量标志物;A~S为117株PA临床分离株扩增出的19种基因型条带。
图1 PA的RAPD分型指纹图谱
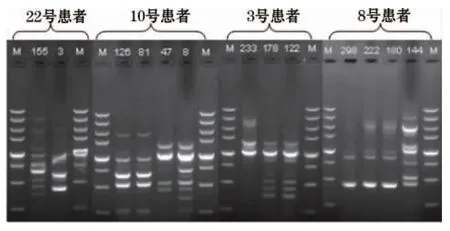
注:M 为DNA分子量标志物。
图2 4例患者连续感染的PA RAPD指纹图谱
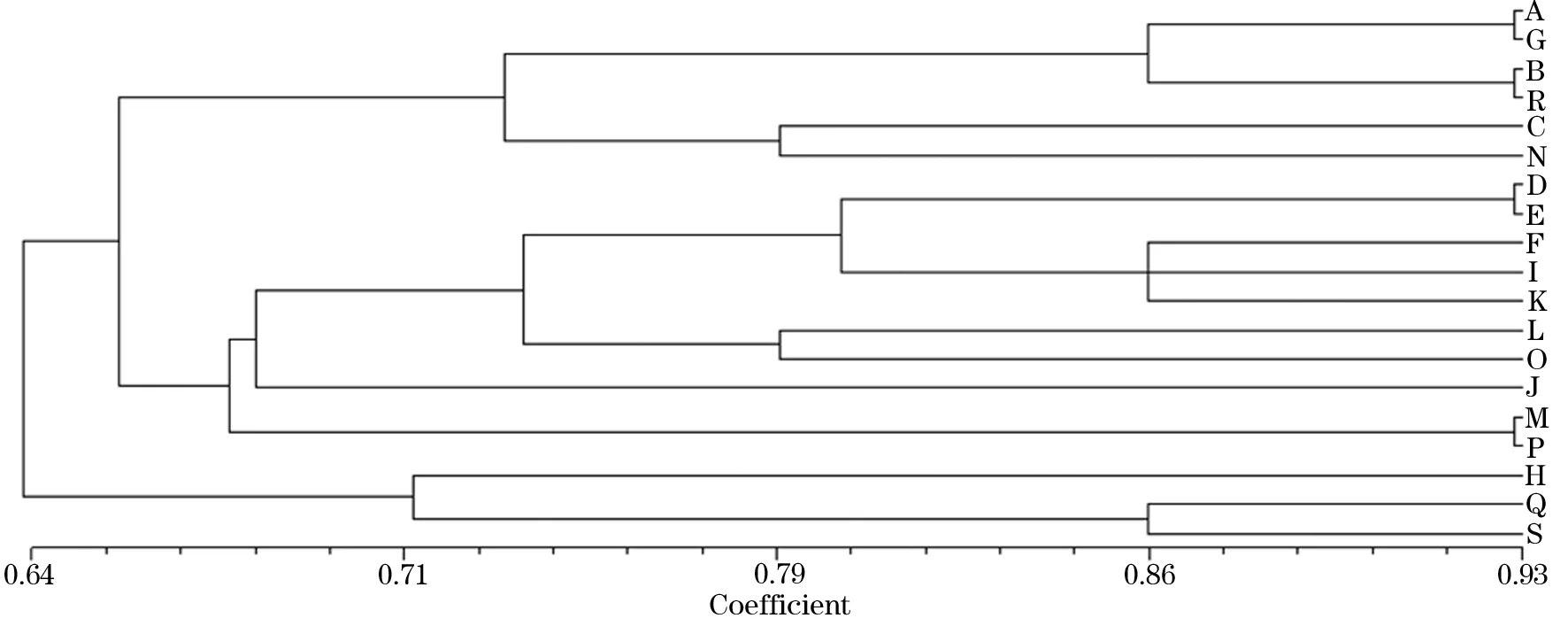
图3 19种PA基因型的聚类分析树状图
3 讨论
PA的传统分型方法主要有血清学分型、噬菌体分型、 菌素绿脓素分型和耐药分型等基于微生物某一特征表达或缺失的表型分型方法, 而迫于生存环境的选择性压力,这些表型可发生改变而导致分型结果失真[5]。近年来随着分子生物学的空前发展给病原菌分型提供了新的技术手段,相对于传统的分型方法,其具有分型能力强、适用范围广、稳定性好等特点[6]。RAPD基因分型技术是1990年由Williams等[7]建立的揭示基因组多态性的分型方法,其扩增出的多态性DNA指纹图谱既可表现种系发育的联系,又可反映不同克隆间的差异,故可从基因水平对微生物进行分型。RAPD基因分型技术较其他分子生物学技术如脉冲场凝胶电泳(PFGE)更简捷、廉价、快速,更适用于大量样本的筛选,且区分能力与PFGE等方法相同[3]。由于RAPD基因分型所需引物为随机多态核苷酸序列(通常为10个碱基对),具有通用性,不需要预先知道基因组的任何序列信息,是目前发展中国家进行PA基因分型最常使用的方法。
本研究利用RAPD基因分型技术将117株PA分为19种基因型,PA呈现出较为明显的多态性(16%),与Nanvazadeh等[8]报道的多态性结果(18%)较为一致。医院感染PA基因型呈现明显多态性与患者免疫力低下、易感染外界环境中各种基因型的菌株有关,这些菌株可能为某些物品的流通或探视人员来往频繁,将外界环境中不同基因型的菌株带入医院病房内,也可能为患者在医院外自身感染的细菌。因此,应加强病房管理,减少人员探访,做好病房内的消毒隔离工作。
回顾病史资料发现,重症医学科是PA检出率最高的临床科室,其次为烧伤整形外科和中医科,且感染患者以下呼吸道感染最为多见。这些患者的原发病主要是严重颅脑损伤和大面积烧伤,共同特点是住院时间较长、基础疾病重、免疫力低下、需要频繁的护理及侵入性治疗操作。PA黏附力极强,易在各类医用材料和器械上黏附而成为贮菌源,同时PA广泛存在于自然环境中,可造成免疫力低下患者感染,甚至引起患者之间的交叉感染。因此,积极治疗患者原发病和下呼吸道感染,妥善处理患者呼吸道分泌物及医疗废物,严格医疗器械消毒、医护人员手消毒以及病房环境消毒对避免PA感染尤为重要。
同一病区或不同病区2例以上患者分离出相同基因型的PA,可确定为医院感染PA局部爆发流行[9]。本研究中重症医学科及烧伤整形外科各发生一起PA爆发流行,国内其他研究也发现PA存在医院内爆发流行现象[10~12]。除上述二起爆发流行外,其余各个科室之间无交叉感染现象出现,均为PA的医院散发感染,应属于患者自身感染的细菌,院内感染的可能性小。Vaez等[13]和Wolska等[14]的研究均表明,大多数患者具有独一无二的RAPD指纹图谱,说明感染起源于患者自身占多数,但在作者调查的医院也存在患者之间的交叉感染,这与本文研究结果较一致。另外,本文通过对同一患者不同时间送检标本的检测发现,19例个体不同时间段PA的RAPD 指纹图谱没有发生改变,而另4例连续感染PA的指纹图谱发生改变,这种不同的指纹图谱是否为不同分型PA感染同一个体,或是环境选择性压力导致细菌基因突变,尚有待进一步研究。
综上所述,医院各科室长期持续感染的PA分离株存在多种基因型,提示PA在感染过程中发生基因变异,存在基因多态性;对有PA感染危险因素的住院患者进行PA的RAPD基因分型检查,对预防和控制院内PA感染和爆发流行具有较好的实用价值。
[1] Rossolini GM, Mantengoli E. Treatment and control of severe infections caused by multiresistant Pseudomonas aeruginosa[J]. Clin Microbiol Infect, 2005,11(Suppl 4):17-32.
[2] Floret N, Bertrand X, Thouverez M, et al. Nosocomial infections caused by Pseudomonas aeruginosa: exogenous or endogenous origin of this bacterium[J]. Pathol Biol (Paris), 2009,57(1):9-12.
[3] Mahenthiralingam E, Campbell ME, Foster J, et al. Random amplified polymorphic DNA typing of Pseudomonas aeruginosa isolates recovered from patients with cystic fibrosis[J]. J Clin Microbiol,1996,34(5):1129-1135.
[4] Saitou K, Furuhata K, Fukuyama M. Genotyping of Pseudomonas aeruginosa isolated from cockroaches and human urine[J]. J Infect Chemother, 2010,16(5):317-321.
[5] Wolska K, Kot B, Jakubczak A. Phenotypic and genotypic diversity of Pseudomonas aeruginosa strains isolated from hospitals in siedlce (Poland)[J]. Braz J Microbiol, 2012,43(1):274-282.
[6] Singh A, Goering RV, Simjee S, et al. Application of molecular techniques to the study of hospital infection[J]. Clin Microbiol Rev, 2006,19(3):512-530.
[7] Williams JG, Kubelik AR, Livak KJ, et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J]. Nucleic Acids Res, 1990,18(22):6531-6535.
[8] Nanvazadeh F, Khosravi AD, Zolfaghari MR, et al. Genotyping of Pseudomonas aeruginosa strains isolated from burn patients by RAPD-PCR[J]. Burns, 2013,39(7):1409-1413.
[9] 龙军,李红玉.重症监护病房铜绿假单胞菌随机扩增多态性DNA研究[J].中国呼吸与危重监护杂志,2006,5(3):172-174.
[10] 潘红玲,刘凤芹,冯永钦.铜绿假单胞菌医院感染现状及分子流行病学研究[J].中国实验诊断学,2012(9):1664-1666.
[11] 庞杏林,李孝权,张欣强,等.ICU铜绿假单胞菌感染暴发的随机扩增多态性DNA分子分型[J].中国感染控制杂志,2009,8(5):315-317,345.
[12] 郭泽兴,李红玉.铜绿假单胞菌随机扩增多态性DNA分子流行病学研究[J].中国烧伤创疡杂志,2008,20(4):273-275.
[13] Vaez H, Faghri J, Nasr Esfahani B, et al. Antibiotic resistance patterns and genetic diversity in clinical isolates of Pseudomonas aeruginosa isolated from patients of a referral hospital, isfahan, iran[J]. Jundishapur J Microbiol, 2015,8(8):e20130.
[14] Wolska K, Kot B. Twitching motility activity, biofilm formation, and genetic typing for clinical isolates of Pseudomonas aeruginosa by random amplified DNA PCR[J]. Acta Microbiol Immunol Hung, 2013,60(3):313-328.
Genotyping of Pseudomonas aeruginosa clinical isolates
ZHOUXiaoqing1,XIEYantong,LIANGHongjie,WANGKe,LIYanan,KONGJinliang
(1TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To analyze the genotypes of Pseudomonas aeruginosa (PA) isolated from inpatients with long-term and continuous infection in various departments of hospital, the and to explore the genetic variation of PA. Methods The strains of PA were collected from specimens of various departments of inpatients, and then we amplified the strains in which the infection lasted for more than 30 days, obtained the RAPD fingerprinting by random amplified polymorphic DNA (RAPD) genotyping technique, analyzed homology by homology clustering, and understood the genetic relationship between PA through the similarity coefficient. At the same time, we compared the RAPD type to determine whether there was an epidemic outbreak and whether there was a variation between the strains from the same patients with continuous infection. Results A total of 293 strains of PA were collected, including 117 strains in which the infection duration was longer than 30 days, and then 19 genotypes were amplified with A-S type, and the classification rate is 100%. The similarity coefficient ranged from 0.64 to 0.93, the similarity coefficient of genotypes A and G, genotypes B and R, genotypes D and E, genotypes M and P was 0.93, indicating a high degree of homology between them. In the intensive care unit and burn plastic surgery, the same RAPD type was detected in different patients, the rest of the patients had different RAPD types. The PA fingerprints of 4 patients who suffered continuous infection changed. Conclusion There are many genotypes in PA isolates from patients in various departments of the hospital, which suggests that PA gene mutation occurs in the process of infection, and there is a genetic polymorphism.
Pseudomonas aeruginosa; random amplified polymorphic DNA; genotypes
国家自然科学基金资助项目(81260663/81460003);广西自然科学基金资助项目(2013GXNSFAA019166)。
周小青(1982-),女,主治医师,研究方向为肺部感染性疾病。E-mail: 82990421@qq.com
简介:孔晋亮(1971-),男,主任医师,研究方向为呼吸系统感染性疾病、胸部肿瘤、胸膜疾病。E-mail: kjl071@163.com
10.3969/j.issn.1002-266X.2016.44.005
R37
A
1002-266X(2016)44-0016-04
2016-07-16)
