聚合物刷与生物分子相互作用的研究进展
2017-01-09王思怿郭旭虹陈凯敏
王思怿, 郭旭虹, 陈凯敏
(1.上海化工研究院检测中心,上海200062; 2.华东理工大学化工学院,化学工程联合国家重点实验室,上海200237; 3.上海工程技术大学化学化工学院,上海201620)
特约综述
聚合物刷与生物分子相互作用的研究进展
王思怿1, 郭旭虹2, 陈凯敏3
(1.上海化工研究院检测中心,上海200062; 2.华东理工大学化工学院,化学工程联合国家重点实验室,上海200237; 3.上海工程技术大学化学化工学院,上海201620)
聚合物刷是由一端紧密接枝在一个曲面或平面的聚合物链组成的大分子结构。近年来,随着聚合物制备方法和表面修饰技术的不断发展,聚合物刷的应用范围也在不断拓宽,相关研究已成为功能高分子材料领域的热点之一。具有特殊结构和功能的聚合物刷在生物分子固定、蛋白质分离、酶催化、药物控释等方面具有广阔的应用前景。本文综述了聚合物刷与生物分子相互作用及应用的最新研究进展,并展望了今后的发展方向。
聚合物刷; 生物分子; 相互作用; 蛋白固定化; 酶催化
上世纪50年代,人们发现在胶体粒子表面接枝聚合物链可有效阻止凝聚效应的发生[1-3],从而避免相邻胶体粒子的团聚,提高胶体粒子的稳定性[4],由此聚合物刷开始引起人们的关注[5]。聚合物刷由一端固定在表面或界面的聚合物链组装而成。当聚合物链间距很小,即接枝密度很高时,体积排除效应使聚合物链的自由端向远离基底表面或界面的方向伸展[6]。聚合物刷的链伸展是平衡条件下无需外加场诱导的自组装行为,该行为不仅影响聚合物刷的空间构象,还催生了许多聚合物刷特有的功能性[7]。
近年来,蛋白质、酶、抗体在固体基质表面的吸附及固定,一直都受到生物医学领域的广泛关注[8-10],该过程能应用于生物分子分离纯化[11-12]、药物控释[13]、细胞黏附、生物传感器[14]等领域。作为生物分子的优良载体必须具备两个前提条件:(1)能够极大地保留生物分子的功能和活性[15];(2)能够提供一个足够大的表面以结合大量的生物分子。在水溶液中,可通过吸附的方法将生物分子固定在一个表面上。Czeslik[16-18]、Kusumo[19]和 de Vos[20-21]等都研究了蛋白质在平面聚合物刷上的吸附,通过调节溶液pH、离子强度、聚合物刷的接枝密度可改变蛋白质的吸附量。平面聚合物刷的吸附会导致酶活性的损失[22],而且难以在生物体内进行运输和传递。
与平面聚合物刷相比,小尺寸的球形聚合物刷具有更大的比表面积,可通过表面修饰选择性地吸附大量的蛋白质、酶、核酸、多糖和脂类等生物分子,而且纳米尺寸的聚合物刷能被注入到人体血液中,并到达目标器官和细胞,实现在体内的应用[23-25]。在各类聚合物刷中,纳米球形聚电解质刷兼具聚电解质和高比表面积的特性,特别适合在溶液中固定生物分子。Ballauff等从物理化学的角度对纳米球形聚合物刷与生物分子的相互作用进行了系统而深入的研究,证实聚合物刷对生物分子的吸附不会引起生物分子结构和功能的改变[26-29]。在适宜的pH和离子强度下,聚合物刷能有效吸附并固定大量的生物分子。通过改变体系的pH或离子强度,聚合物刷还能可控地释放所固定的生物分子[30-33]。制备特殊结构的聚合物刷并对其进行表面修饰能赋予聚合物刷特殊的响应性和功能性,例如磁性聚合物刷能实现生物分子的磁导向分离纯化、催化剂的回收利用[34-37]。温敏性的聚合物刷可通过改变体系温度控制水相中生物分子的传导和运输[38-39]。两性聚电解质刷能抗生物分子吸附,用作抗菌材料。表面修饰后的聚合物刷能选择性地与目标细胞结合,应用于靶向给药、疾病诊断和纳米生物传感器等领域[40-43]。
1 聚合物刷的结构与性能
不同种类的聚合物刷具有不同的结构、特性和功能。根据聚合物刷基体曲率的大小,可以将聚合物刷分为平面聚合物刷、球形聚合物刷和星形聚合物刷(如图1)。当基体表面曲率半径远远大于聚合物链的尺寸时,聚合物刷看似连接在一个平面上,故被称为平面聚合物刷[44-47]。当基体表面曲率半径与聚合物链的尺寸相当时,就形成了球形聚合物刷[48-52]。当聚合物链的尺寸远远大于基体表面曲率半径时,就构成了星形聚合物刷。球形聚合物刷的尺寸介于平面聚合物刷和星形聚合物刷之间,是研究聚合物刷性质的桥梁。
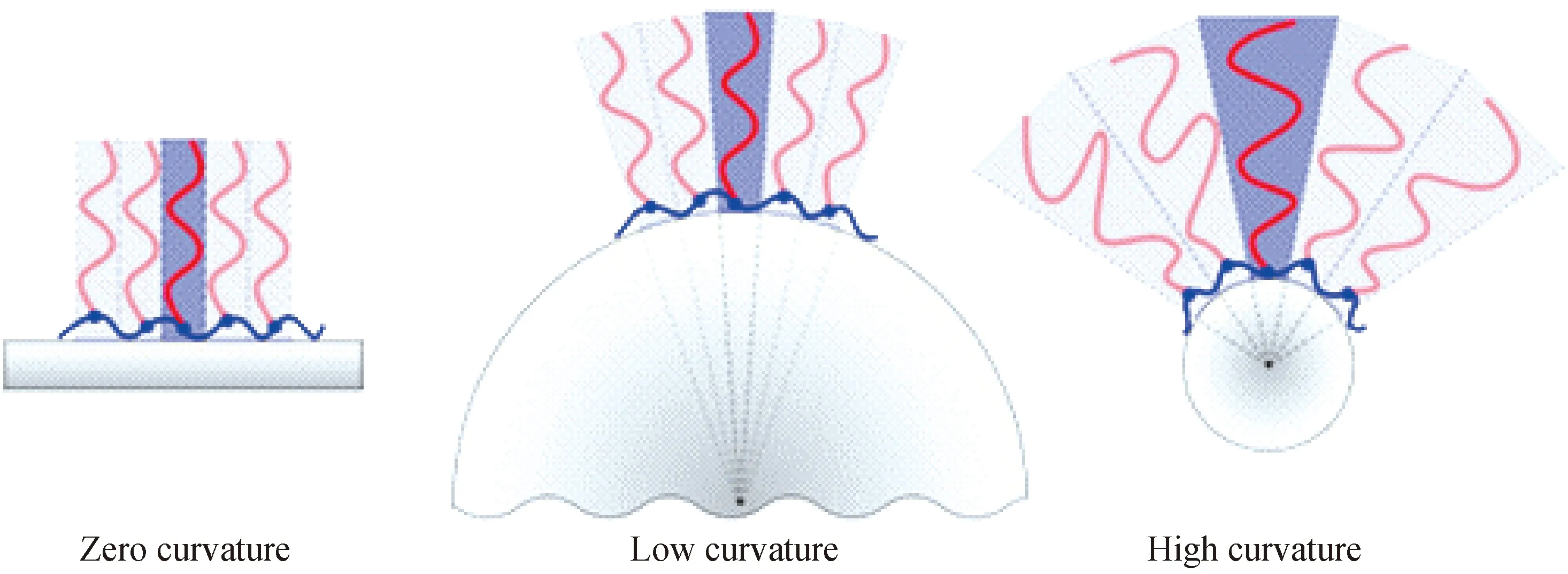
图1 聚合物刷的曲率及其形态[53]Fig.1 Curvature and structure of polymer brushes[53]
为了使聚合物链尽可能地向远离固定端方向伸展,形成厚的聚合物刷层,人们开始关注带电荷的聚电解质刷。除空间位阻效应外,聚电解质刷链间的电荷排斥力和反离子产生的高渗透压使聚电解质链进一步伸展。由于受到静电相互作用、盐离子屏蔽效应等影响,聚电解质刷的链伸展、链层厚度、构象等随体系的pH、盐浓度、反离子价态等外界因素的改变而改变。聚电解质刷的这些特性受到了科学家的高度关注[54],也为其在生物医药领域的应用奠定了基础。近年来,有关聚合物刷的文章平均每篇引用次数从4次增加到了7次,其中,研究聚合物刷与生物分子的文章占到了10%~15%,平均每篇文章的引用次数为10~15次。可见,聚合物刷与生物分子的相互作用已逐步成为研究热点。
1.1 平面聚合物刷
平面聚合物刷是由高密度接枝在平面基质上的聚合物链组装而成的高分子结构。当接枝的聚合物链尺寸均匀且紧密排列在基质表面上时,空间位阻效应使聚合物链垂直于基质平面向外伸展,避免了聚合物链间的重叠,构成了聚合物刷的微观结构。平面聚电解质刷的概念最早由Pincus[55]和Borisov等[56]提出,当接枝的聚合物链为强电解质时,聚电解质刷的链伸展不随溶液pH和离子强度而改变;当接枝弱电解质链时,聚电解质刷的链伸展受电离平衡控制,随溶液pH和离子强度变化。Biesalski等[57]研究了聚氮甲基吡啶平面刷在碘离子存在下的链伸展和塌陷,当聚电解质链层厚度大于100 nm时,聚电解质刷内部束缚的反离子带来高渗透压使聚电解质链伸展。平面聚电解质刷的空间位阻效应和静电相互作用等特性使其在金属离子吸附和生物分子固载等领域得到应用。
1.2 球形聚合物刷
在平面聚合物刷的研究开始不久之后,人们开始对球形聚合物刷的制备及性能展开研究。在胶体颗粒或金属粒子等表面接枝聚合物链可形成球形聚合物刷。当聚合物链与体系介质具有良好相溶性时,聚合物链构成了相对独立的界面,阻碍了胶体颗粒间的接近和团聚。聚合物链的伸展和收缩主要取决于聚合物刷内部空间和外表面区域的能量平衡。这种自发的平衡态使聚合物刷不同于自由状态的聚合物链,表现出不同的特性和功能。1999年,Guo和Ballauff等[50]首次采用光乳液聚合成功制备了纳米球形聚电解质刷,并使用动态光散射(DLS)对球形聚电解质刷的空间尺寸进行了系统的研究[58]。他们通过改变溶液盐浓度,并结合Daoud-Cotton模型,研究了离子强度对强电解质刷和弱电解质刷伸展和塌陷的影响。研究表明:聚电解质刷链层中反离子的富集和释放使聚合物刷的空间结构发生改变,导致聚合物链的伸展和塌陷。与强聚电解质刷相比,弱聚电解质刷的链伸展随pH和盐浓度的变化更明显[59]。束缚于聚电解质刷中的反离子产生高渗透压使聚合物刷“溶胀”,可为反离子富集和生物分子固定提供空间。球形聚电解质刷内部能保持pH和离子强度相对稳定,吸附大量的生物分子后能极大地保留生物分子的功能和活性。与平面聚合物刷相比,纳米球形聚合物刷具有良好的分散性,且尺寸可调,便于在生物体内的传递和运输。
1.3 聚合物刷对环境的响应性能
在基体表面接枝聚合物链能显著改善基体的性能,由此聚合物刷可应用于许多生物和化工领域,例如黏附材料[60]、抗蛋白吸附[61]、色谱仪[62]、润滑剂[63]、表面活性剂[7]和增溶剂等。科研工作者对聚合物刷的结构进行精心设计和修饰,制备了具有特殊响应性和功能性的聚合物刷。聚合物刷作为智能材料受到人们广泛的关注。Ito等报道了pH响应[64]、光敏性[65]、氧化还原敏感性[66]的聚合物刷。Guo等[30,32-36]报道了pH、离子强度响应的聚合物刷。Ballauff等[38-39]报道了温敏性的纳米交联聚合物刷。Chen等[34-35]报道的磁响应性聚合物刷,可应用于核磁共振成像、磁导向生物分离、靶向给药、高热磁疗等领域。
1.3.1 pH响应性聚合物刷 聚电解质刷不同于非离子型聚合物刷,其结构中带有可电离的电荷,强聚电解质刷在水溶液中完全电离,而弱聚电解质刷的电离程度随体系pH改变[50,58,68-69]。弱聚电解质刷对pH极其敏感,可通过改变体系pH来调控电荷密度及聚电解质间的相互作用(见图2)。当聚电解质刷达到电离平衡时,整个体系以聚合物链间的排斥作用为主导力,促进了聚合物链的伸展,保证了体系的稳定性,有利于纳米金属颗粒富集及生物分子吸附。当外界溶液的pH或离子强度发生改变时,原本的电离平衡被打破,聚合物链层的电荷及反离子重新分布,最终达到新的电荷平衡。通过改变体系的pH或离子强度,pH响应性的聚合物刷能在溶液中对生物分子进行可控的吸附和脱附。
1.3.2 温度响应性聚合物刷 温度能够控制一些聚合物链在溶液中的溶解性,从而影响聚合物的构象变化和聚合物刷与生物分子的相互作用。Lu等[38]采用光乳液聚合方法将温敏性的聚N-异丙基丙烯酰胺链(PNIPA)紧密地接枝在聚苯乙烯核表面,通过加入交联剂N,N-亚甲基双丙烯酰胺(BIS),使PNIPA发生交联并形成网状结构,制备了温敏性的PS@PNIPA纳米球形聚合物刷。该温敏性聚合物刷的合成路线如图3所示。温敏性聚合物刷具有一个最低临界溶解温度(LCST)。当体系温度低于LCST时,温敏性聚合物刷具有良好的水溶性,聚合物链呈现伸展状态,可在此状态下吸附生物分子。而当体系温度高于LCST时,PNIPA结构中的氢键力减弱,疏水力增强,使聚合物链发生收缩,可将吸附的生物分子固定在聚合物链层。
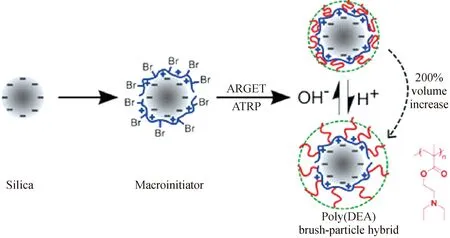
图2 聚电解质刷的pH响应性[67]Fig.2 pH response of polyelectrolyte brushes[67]
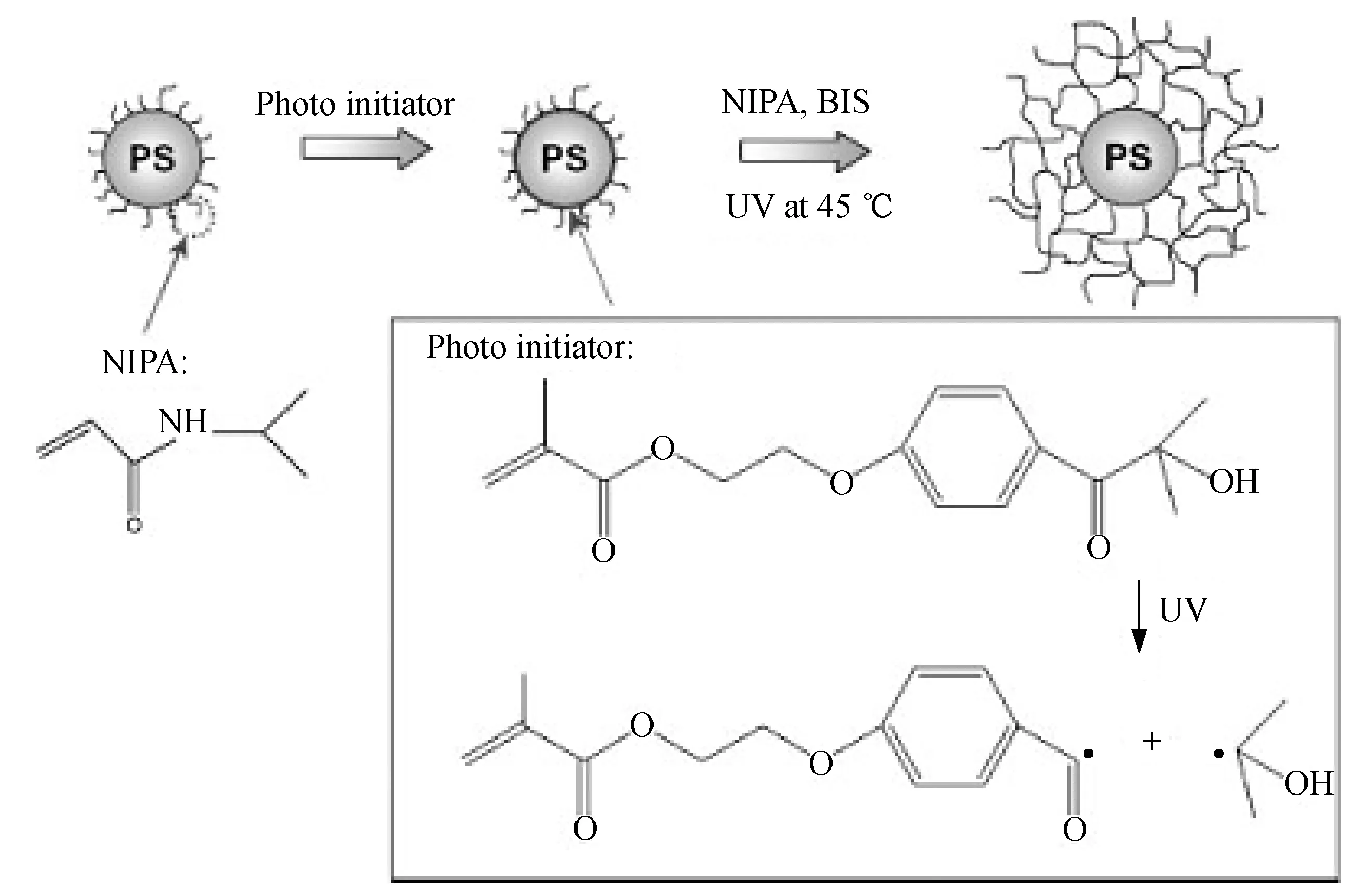
图3 交联的温敏性聚合物刷的合成路线[38]Fig.3 Synthetic scheme of cross-linked thermosensitive polymer brushes[38]
1.3.3 磁响应性聚合物刷 Chen等首次在纳米球形聚合物刷的核内部引入磁性粒子,使聚合物刷具有良好的磁响应性。聚合物刷的磁功能化拓宽了聚合物刷的应用范围。比如,利用聚合物刷可吸附水溶液中的金属离子[70-72],但吸附后的分离难以进行。在聚合物刷内部引入磁性颗粒后,在外加磁场下磁性聚合物刷可进行富集和回收(如图4)[73]。移除外加磁场后,脱附金属离子后的磁性聚合物刷仍能保持良好的分散性。采用磁性聚合物刷吸附特定的生物分子能大大提高生物分子的分离效率[36-37]。另一方面,催化剂的回收再利用可以降低工业催化的成本。在球形聚合物刷层中原位合成的纳米粒子具有很高的催化活性[63-64,67-69]。在水相催化体系中,采用磁性聚合物刷固载催化剂,在催化反应结束后通过磁导向富集可实现催化剂的回收及循环使用。
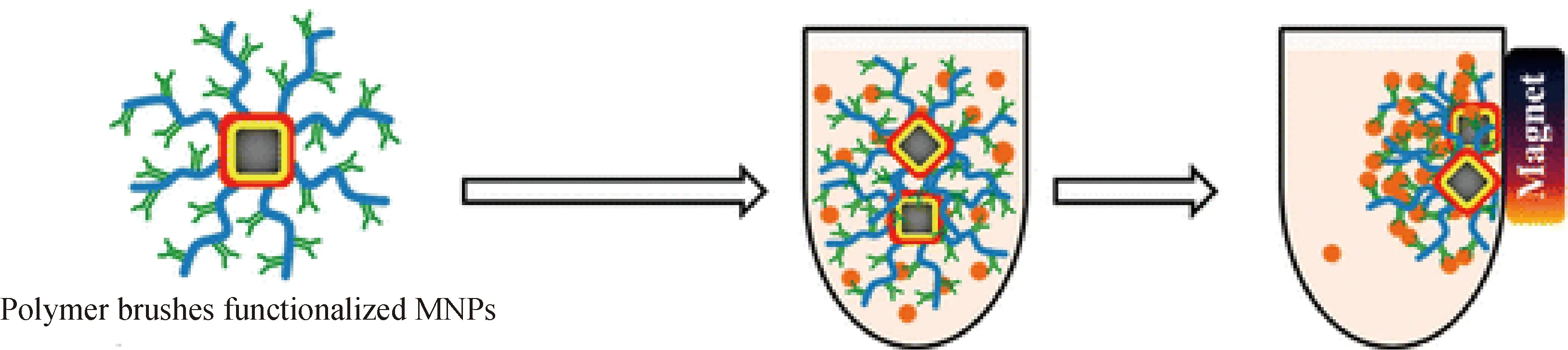
图4 聚合物刷的磁响应性[73]Fig.4 Magnetic response of polymer brushes[73]
2 聚合物刷与生物分子相互作用的表征方法
2.1 浊度滴定
1980年,Kokufuta等[74]采用“胶体浊度滴定”的方法,通过观察体系的浊度变化来研究聚电解质与蛋白质的缔合作用[75]。随着聚电解质与蛋白质缔合作用的增强,出现相分离的凝聚层,因为体系浊度取决于溶解相中聚集态大分子的数量和尺寸。浊度的最大值与体系的pH、离子强度、主-客体分子的化学计量比有关[76]。pH和离子强度控制着电荷的化学计量比,通过改变大分子的电荷数量,可以控制主-客体分子结合的程度以及电中和的程度。
浊度(τ)通常采用透光率进行表达,即τ=-lnT/x=2.3A/x(其中:T为透光率,A为吸光度,x为透光距离(cm))。测量时的光学精度为±0.001,因此浊度的灵敏度为%T±0.02,能用于检测蛋白质二聚体的形成[77]。利用比色计探头获得的平均检测信号可观察聚电解质-蛋白质复合物的形成。当浊度随pH变化曲线的斜率偏离零时,即聚电解质与蛋白质形成了可溶性复合物。该点的pH被定义为pHc,而形成不溶性凝聚物的临界pH则被定义为pHφ。当体系中不存在聚电解质时,浊度法还能用于检测蛋白质的自聚[78]。Wang等[30,32-33]通过观察体系浊度随pH的变化,分析了聚合物刷与蛋白质相互作用的过程(见图5),研究表明两者的相互作用在不同的pH区域可分为吸附平衡、复合物聚集、蛋白质释放及聚集体分解4种状态。通过调节体系的pH、盐浓度、化学计量比,聚合物刷能可控地吸附及脱附生物分子,而体系的稳定性及生物分子的活性并未受到影响。
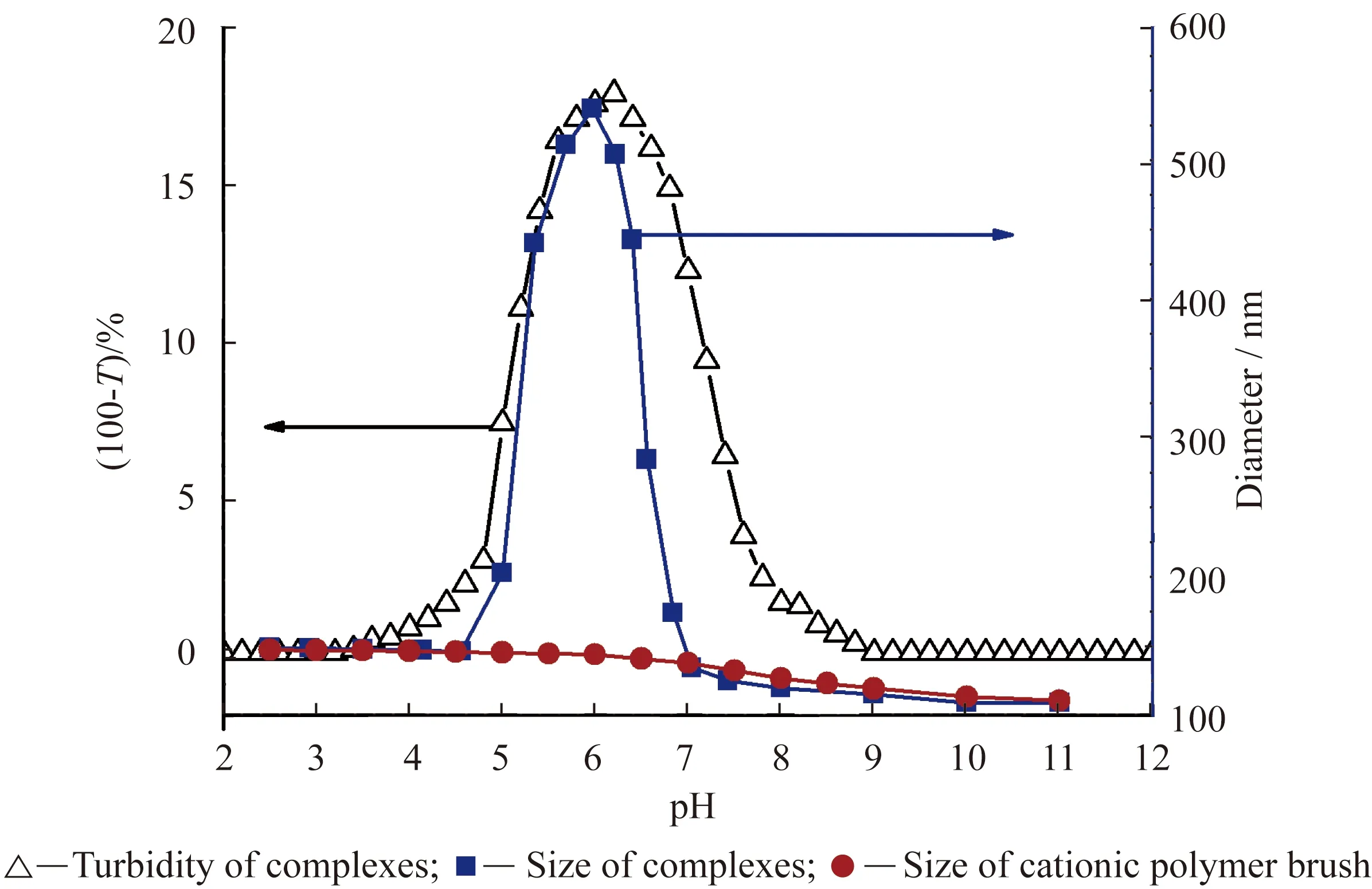
图5 阳离子聚合物刷与牛血清蛋白混合溶液的浊度和粒径随pH的变化[32]Fig.5 Turbidity and size change of cationic polymer brush and BSA complexes as a function of pH[32]
2.2 动态光散射
动态光散射(DLS)是研究大分子间相互作用的重要方法,约35%的已发表论文采用DLS研究聚合物与生物分子的缔合作用。DLS能用于检测自由状态的生物分子、聚合物-生物分子复合物、聚合物间的可溶性聚集体在溶液中的尺寸。Boeris等[79]研究表明,当pH为3.0时,壳聚糖与胃蛋白酶的缔合作用不会使壳聚糖的尺寸(400 nm)发生改变;而当pH为4.0时,缔合作用使壳聚糖的尺寸减小了2倍。
DLS还能检测聚合物纳米粒子的粒径和粒径分布,用于研究聚合物刷与生物分子相互作用对微观结构的影响。如图5所示,DLS与浊度滴定的观察结果保持高度一致。在无相互作用和吸附动态平衡的pH区域内,聚合物刷-蛋白质复合物的尺寸与空白聚合物刷的粒径基本一致。随着相互作用的增强,聚合物刷-蛋白质复合物之间形成大的聚集态使复合物的粒径迅速增加[30,32-33]。然而,进一步改变体系pH,蛋白质释放和聚集态分解的共同作用使复合物的粒径显著减小。由于分辨率的关系,DLS无法区分吸附动态平衡区域内,聚合物刷吸附蛋白质后尺寸上的细微变化。浊度滴定法虽然可以检测出吸附动态平衡区,也不能给出具体的吸附细节。动态平衡区聚合物刷与生物分子的相互作用,可以利用小角X光散射进行表征和分析。
2.3 小角X光散射
小角X光散射(SAXS)能用于表征聚合物刷-蛋白质复合体系的结构和尺寸,其所能达到的测量范围是静态光散射所无法比拟的。由于SAXS提供了非常宽泛的散射因子(矢量)(q)范围,远超于静态光散射的范围,所以SAXS能十分有效地提供复合物的结构信息,其中,q=4πsinθ/λ,q是入射峰与散射峰波矢之差的模,散射峰强度为I(q),θ为X射线散射角,λ为入射光波长。通过选择不同的模型,SAXS还能给出被测体系的形态信息,例如单体液珠、聚合物链和聚集体。SAXS现已被广泛地应用在分析聚合物刷吸附生物分子的研究中[25,77,80]。通常情况下,当聚合物刷吸附蛋白质后会引起散射曲线的明显变化,通过散射强度和电子密度数据的变化能揭示蛋白质在聚合物刷中的径向分布和蛋白质吸附总量(τads)。将SAXS数据与其他表征数据相结合[28,76],可以更深入地了解聚合物刷与生物分子的相互作用过程。
图6显示了球形聚合物刷吸附牛血清蛋白的SAXS测试结果。聚合物刷吸附蛋白质后,聚合物链层的电子密度显著增加[25],导致SAXS的散射信号增强,即散射峰强度I(q)增加。同时,散射曲线左边第1个峰的峰值向q值减小的方向迁移,说明蛋白质的吸附使聚合物刷的回转半径有所增加。
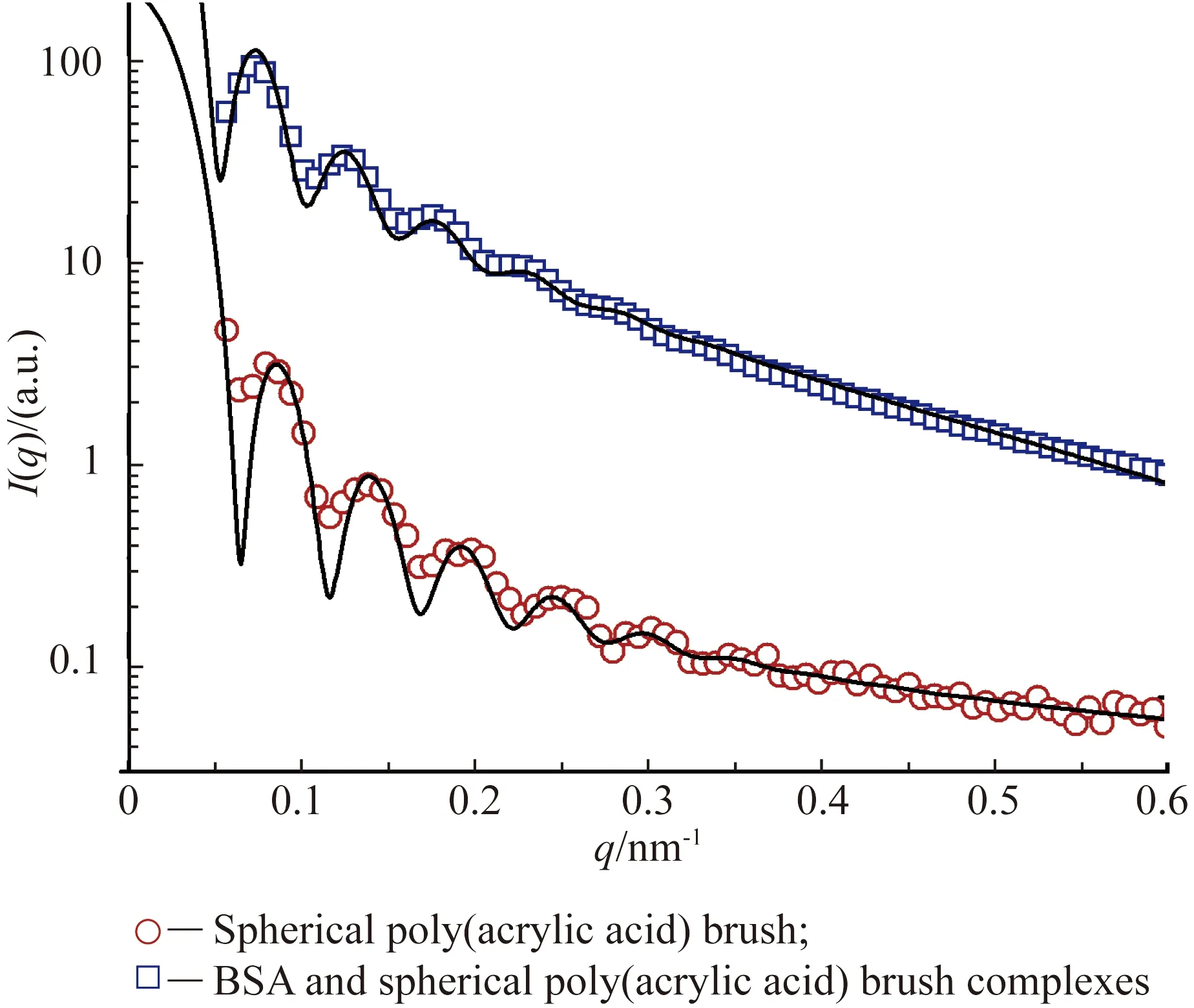
图6 球形聚丙烯酸刷吸附牛血清蛋白的SAXS曲线[33]Fig.6 SAXS curves of spherical poly(acrylic acid) brush and its complexes with BSA[33]
2.4 等温滴定量热
等温滴定量热法(ITC)能精准地检测出聚合物刷吸附生物分子过程中热力学参数的变化,获得的等温吸附线能揭示相互作用的本质[81]。当每一滴蛋白质注入到聚合物刷溶液中时,结合产生的热量(Q)随时间而变化。ITC可检测生物分子-聚合物刷浓度比与热量变化(ΔQ)之间的关系。由于一个聚合物刷能吸附大量的生物分子,且每个聚合物刷上含有许多能与生物分子相结合的点,可以假设每个生物分子与聚合物刷结合产生的热量都是相等的。基于这些假设,采用独立结合模型对ITC热力学数据进行拟合,就能计算出焓变(ΔH)、结合常数(Kb)、结合浓度比(N)[82-83],从而得到每根聚合物链上结合的蛋白质数量[84]。ΔH反映出配体与基质的结合能力[85],再由ΔH和ΔG可以计算得到结合熵(ΔS)。原则上,Kb随温度变化的关系可由范德霍夫方程计算得到:
(dln Kd/dT-1)p=-ΔH/R
(1)
ΔS由温度与吉布斯自由能推得:
dΔG/dT=-ΔS
(2)
ΔG=ΔH - TΔS
(3)
通过分析这些热力学参数,可以找到聚合物刷与生物分子相互作用过程的驱动力。静电相互作用和疏水作用是放热的过程。如果吸附过程中不存在疏水作用,那么放热过程通常由静电作用引起。对此有大量相关的研究及文献报道[86-87]。
Karayianni、Romanini和Braia等通过研究聚丙烯酸(PAA)-溶菌酶、聚乙烯硫酸(PVS)-溶菌酶[89]和PVS-胰蛋白酶体系[90],观察到聚电解质与蛋白质的相互作用是强烈的静电作用,该过程放热并伴随熵减。与弱聚电解质PAA相比,强聚电解质PVS与蛋白质的静电作用更强,结合的放热量更大。他们还研究了带有疏水基团的阴离子PAA树脂L100,其疏水作用导致了明显的放热过程[91]。然而,Welsch等[88]使用ITC观察到溶菌酶与负电性的微凝胶结合是熵驱动的过程(图7),主要由微凝胶层中溶菌酶的质子化作用引起,且离子强度能影响结合强度,这说明结合过程中也涉及到静电相互作用。总之,ITC为聚合物刷与生物分子相互作用的热力学研究提供了有效的途径。
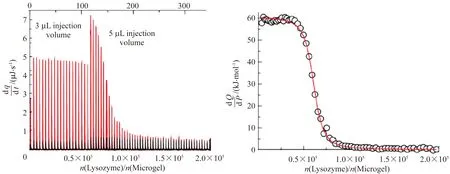
图7 在298 K、pH 7.2、10 mmol/L MOPS缓冲溶液中,负电性的微凝胶吸附溶菌酶的等温滴定量热曲线[88]Fig.7 ITC data of binding of lysozyme to negatively charged microgel particles at 298 K in 10 mmol/L MOPS buffer with pH 7.2[88]
2.5 显微镜技术
用于研究聚合物刷-生物分子复合体系的形态和动力学规律的常规显微镜技术包括原子力显微镜(AFM)、电子显微镜(EM)和透射电镜(TEM)等。其中,AFM是最常用的表面结构表征手段,具有纳米级的分辨率[92]。平均表面粗糙度(rms)可定性研究生物分子吸附于聚合物刷表面的情况(图8)。此外,吸附于AFM表面的大颗粒三维特征能用于定量分析[93]。AFM所测得的力与距离的曲线能用于研究生物分子的吸附和表面柔软度。测试时使探针带有与基质相同的聚合物链,测得的力与距离曲线用于分析蛋白质吸附于表面时的分子间相互作用力[94]。Olanya等[95]使用AFM测定力与距离之间的关系,研究表明吸附于低电荷密度聚合物多层膜表面上的溶菌酶与AFM的吸引力更大,说明低电荷密度表面的电荷排斥力较小,因此能吸附更多的溶菌酶分子。
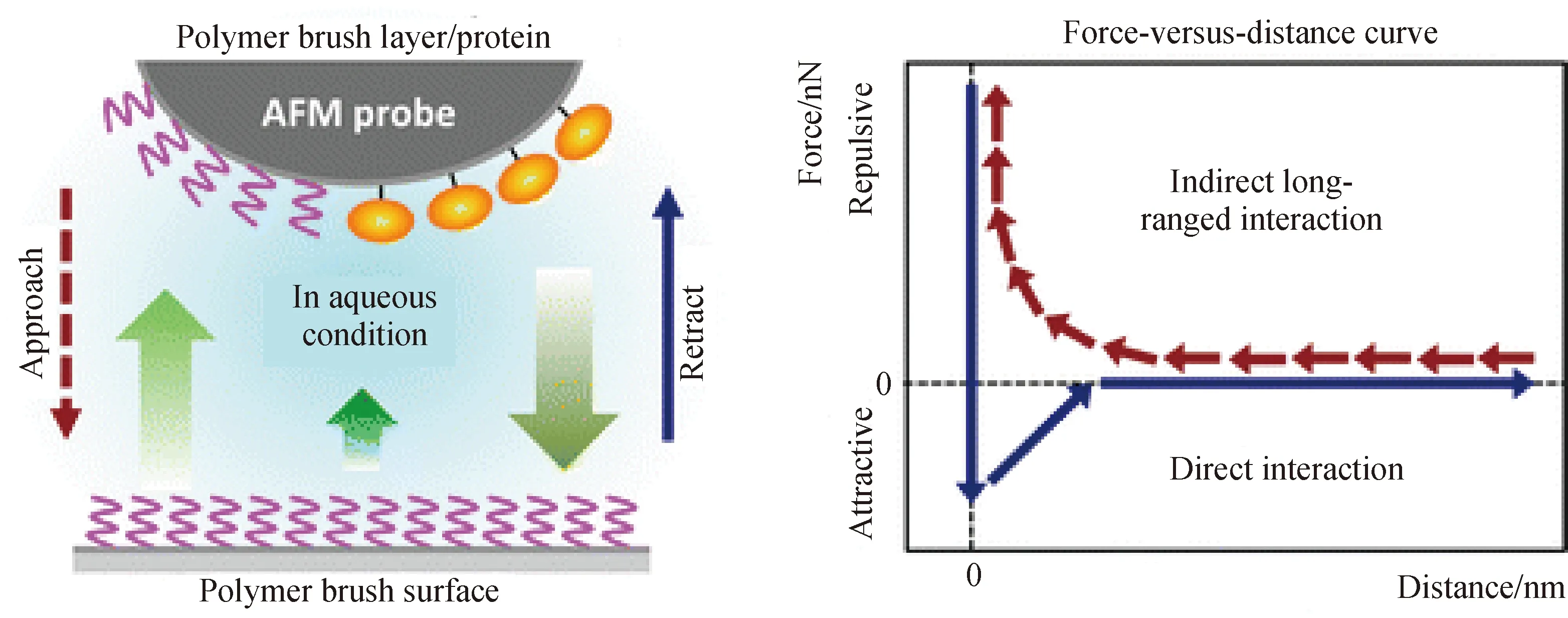
图8 AFM观察蛋白质在聚合物刷表面的吸附[94]
采用EM测试时,样品通常需要通过染色来提高对比度。EM的分辨率要比普通的光学显微镜高得多,因此被广泛地用于直接观察聚合物刷-生物分子复合体系[96]。近年来,TEM也逐渐成为研究聚合物刷-生物分子复合物的重要表征方法。尤其与冷冻技术相结合时,冷冻TEM能为聚合物刷-生物分子复合体系提供原位的结合信息。Gummel等[97]报道了利用冷冻TEM观察聚电解质刷-蛋白质复合物的紧密球形结构。Kayitmazer等[98]也采用冷冻TEM观察牛血清蛋白-PDADMAC复合物的致密结构。在高分辨率下,他们还进一步观察到牛血清蛋白-PDADMAC复合物聚集态的大小约为50 nm。
3 聚合物刷在生物医药领域的应用进展
相比于传统的基材或自由线型聚合物,聚合物刷具有特殊的结构和功能,它具有可调控的接枝密度和功能基团数量,快速的pH、温度、磁响应性。这些优越的特性使聚合物刷在生物医药领域具有广泛的应用,例如蛋白质的吸附或抗吸附、药物输送、生物传感器等。
3.1 蛋白质的固定化及其分离纯化
经聚合物刷固定后,生物分子的自聚被抑制,避免了生物分子的沉淀和变性,提高了生物分子的稳定性并保持了其生物活性。Tran等[99]报道了无论在聚电解质内部还是外部,金纳米粒子表面修饰的多层聚合物刷能抑制朊蛋白沉淀的发生[99]。de Vos[20-21]、Czeslik[16-18]、Kusumo[19]等系统研究了牛血清蛋白、α-乳球蛋白、溶菌酶和胰岛素在平面聚合物刷上的吸附,发现固定在平面聚合物刷内的蛋白质,其二级结构得到了很好的保留[17]。红外光谱检测结果也证实了吸附于球形聚合物刷内部的牛血清蛋白、β-乳球蛋白、核糖核酸酶的二级结构没有发生变化,生物分子的生物活性也得到了保持[22]。Ballauff课题组对球形聚合物刷固载不同的生物分子(如牛血清蛋白[100-105]、牛血红蛋白[28]、β-乳球蛋白[106]、荧光蛋白[31])和酶(葡萄糖化酶[107]、β-葡萄苷酶[108-109]、核糖核酸酶[22])进行了全面而深入的研究,他们采用荧光光谱观察不同离子强度下荧光蛋白(mEosFP)在聚合物刷表面的吸附及脱附行为,发现在低离子强度下聚合物刷能大量且自发地吸附荧光蛋白[31]。但随着体系离子强度的上升,荧光蛋白逐步从聚合物刷内部脱附到溶液中。同时,利用SAXS证实了生物分子均匀地固定于聚合物刷内部[103]。
通常,工业化的蛋白质分离过程耗时耗力耗财,如液相层析色谱和膜分离法。而且当蛋白质等电点的差异小于0.5个pH单位时,基于这些技术的分离效果显著变差。聚合物刷能选择性地与蛋白质形成复合物,能对结构相似或等电点相近的蛋白质进行分离[39]。Chen[110]等观察到低聚物修饰的纳米金聚合物刷能选择性地吸附β-乳球蛋白(BLG)的2个变体(BLG-A和BLG-B),从而实现BLG-A与BLG-B的分离和纯化。Boeris等[111]利用酶与壳聚糖形成聚集态沉淀,使胃蛋白酶的纯化率达到90%。Aravind等[112]研究表明,当pH为8.8时,卵清蛋白在壳聚糖-聚苯乙烯磺酸盐多分子层刷上的吸附率达到了100%。Wang等[30]研究表明,阳离子球形聚电解质刷与牛血清蛋白、β-乳球蛋白、木瓜蛋白酶的结合行为有明显的差异,由ITC和UV测定的结合能、结合强度、结合数量,表明它们的结合能力依次为β-乳球蛋白 > 牛血清蛋白 > 木瓜蛋白酶。通过调节体系的pH、离子强度、化学计量比,并利用聚合物刷与蛋白形成的聚集态,阳离子球形聚合物刷能对牛血清蛋白、β-乳球蛋白、木瓜蛋白酶进行分离。Qin等[34]研究表明,磁性阳离子聚合物刷能选择性吸附牛血清蛋白和β-乳球蛋白,实现对不同蛋白的磁导向分离。总的来说,聚合物刷是生物分子的优良载体,能在水相中可控地吸附及脱附生物分子,通过接枝功能化的聚合物链,聚合物刷能选择性地结合目标分子,实现生物分子的固定、分离和纯化。
3.2 酶固定催化
酶是功能性的蛋白质,具有很高的催化效率。越来越多的研究关注利用聚电解质与蛋白质的缔合作用来保持酶的活性,并应用于酶催化反应。基于聚电解质刷与蛋白质的相互作用,聚电解质刷能作为酶固定的优良载体。平面聚合物刷的吸附会引起核糖核酸酶活性的损失[22],而球形聚合物刷不仅具有更高的结合量,还能提高酶的活性[26-27,29,113]。Ballauff等[85]采用温敏性球形聚合物刷(PS@PNIPA)固载β-D-葡萄糖苷酶,并对催化反应活性进行定量研究。研究表明:固定在球形聚合物刷上的酶催化活性相比于溶液中自由状态的酶活性增大3倍以上。Kudina等[114]利用球形PAA刷(100 nm)固载纤维素酶(CEL)形成一个酶-微凝胶生物催化体系。由于体系的负载能力、酶活性、接触面积和酶流动性有了提高,催化效率也得到了显著的增加。酶-微凝胶体系在生物燃料和生物医药领域具有潜在的应用,因为固载后的纤维素酶(CEL)能高效地将纤维素转化成葡萄糖。Xu等[36]制备了一种磁性PAA刷用于酶固定,达到了高效的催化性能(如图9),并能有效地回收酶,因此在酶催化、分离、纯化和再利用方面具有巨大的应用前景。RNase A通过共价键和氢键等相互作用可以固定于纳米球形聚合物刷内部[115]。RNase A的RNA基质是一个大分子,通过增加酶的结合力可以增大基质的扩散层。因此,通过优化酶的结合力能使聚合物刷-酶复合物的催化效率达到最大值。这也充分证明了聚合物刷是良好的生物酶载体,具有巨大的应用潜力,能作为纳米级生物反应器应用于生物催化领域。
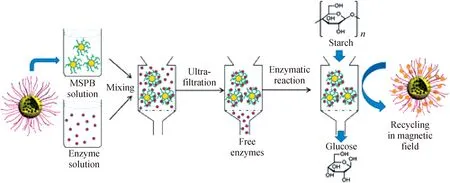
图9 磁性聚合物刷固载葡糖淀粉酶催化淀粉水解反应[36]Fig.9 Amylolysis catalyzed by amyloglucosidase immobilized in magnetic polymer brushes[36]
3.3 药物控释和传递
生物分子-聚电解质复合物的形成和分解随体系的pH和离子强度而改变。在复合物的形成和分解过程中,目标生物分子得以固定和释放。例如,在极端的pH条件下,许多的复合物会经历溶胀的过程。当复合物处于强酸性的消化液中时,复合物溶胀的特性就会被激发,于是生物分子会被释放出来。相同的生物分子释放过程也可发生在高离子强度下,例如在生理盐浓度下。生物分子-聚电解质复合物的结构决定了生物分子的吸附和运输效率。近年来,利用凝聚物形成的微型聚合物胶囊一直被广泛应用在食品中[116]。利用疏水改性后的藻朊酸盐和疏水改性后的蚕丝蛋白间形成的凝聚物可以诱捕模型药物荧光右旋糖酐。随着pH的增加,凝聚物的溶解使荧光右旋糖酐得以释放[117]。最近,也有研究将复合物形成的微型胶囊用于药物的刺激-响应控释(见图10)[118]。
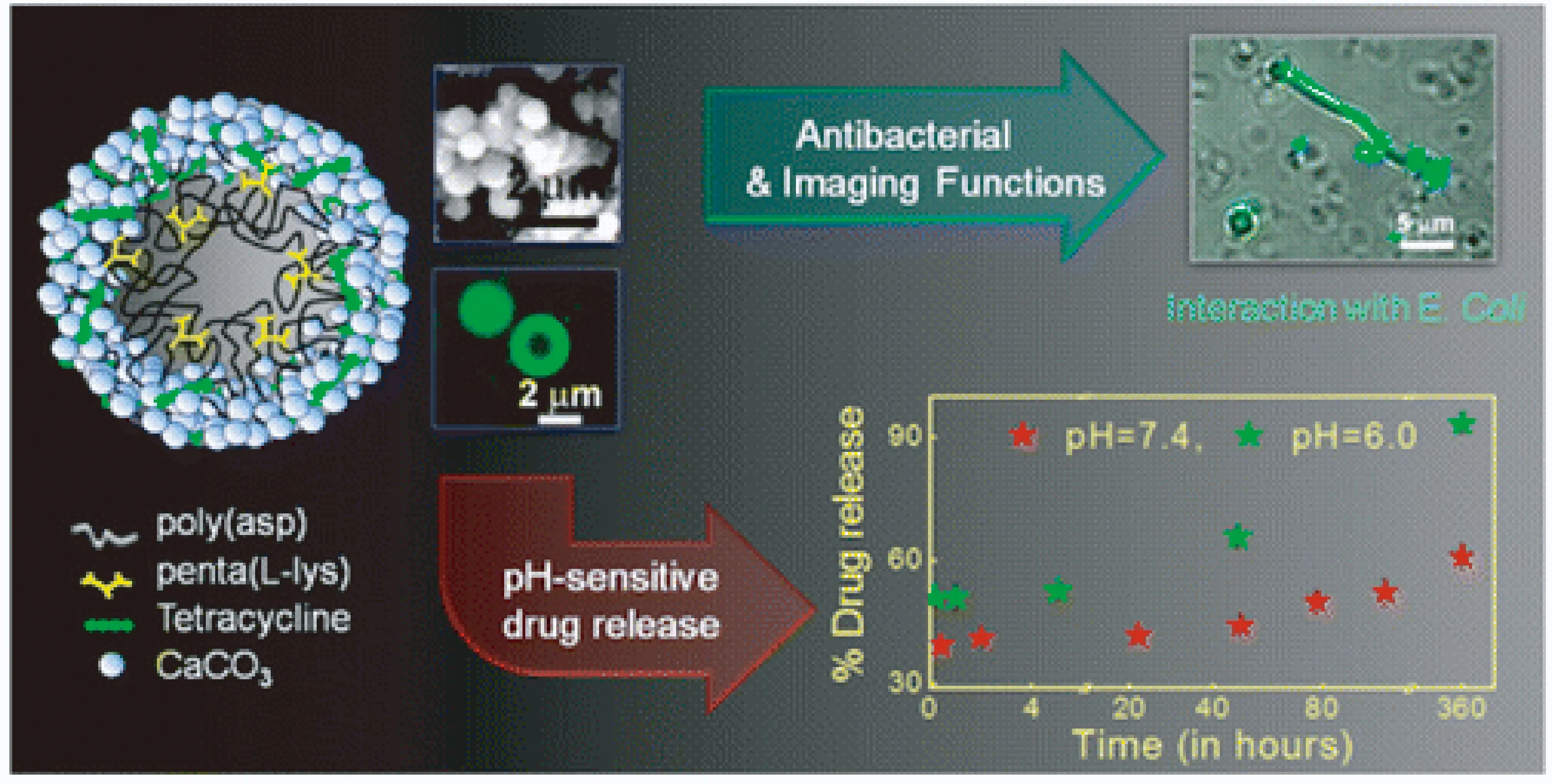
图10 聚合物改性的碳酸钙微囊用于药物的pH响应释放[118]Fig.10 Encapsulation of CaCO3 modified by polymers for pH-sensitive drug release application [118]
在多孔颗粒表面接枝具有响应性聚合物链就形成了可控释放的智能体系,而这些具有响应性的聚电解质刷就充当了分子信息传递者[119-122]的角色。尤其是以介孔硅颗粒(MSN)为核的丙烯酸刷能作为高效的pH响应性体系用于固定或释放客体分子(如药物、荧光分子或者DNA)[123]。另外,药物可以固载于聚合物刷链层中[124],PAA刷进一步与靶向制剂结合能建立靶向给药的机制[125]。将具有pH和温度双重响应性的PNIPA-PAA聚合物刷作为载体可用于药物控释和靶向给药等领域,在癌症的治疗方面具有潜在的应用价值。此外,Motornov等[126]证实了混合的PAA-聚乙烯基吡啶刷具有两性聚电解质的特性,通过调节体系的pH能可控地捕获阳离子或阴离子。因此,聚电解质刷能作为一种智能的药物控释体系。球形聚合物刷也是一种优良的药物载体,引入磁性粒子后,载药后的聚合物刷可以在磁场控制下,把药物输送到生物体内的病灶位置,实现靶向给药。二氧化硅中空微球在药物控释、活性物质储存方面具有潜在的应用前景[127]。Huang等[128]通过Stöber方法将二氧化硅沉积在球形聚电解质刷表面,形成厚度均匀的壳层,再利用有机溶剂除去核得到规则的二氧化硅空心微球刷。这种中空微球能包覆药物,应用于药物控释。功能化的聚合物刷能为药物缓释、靶向给药提供新的途径[129]。
3.4 生物传感
1962年,人们首次提出了生物传感器的概念[130],这类传感器主要包含两个部分:(1)可以结合目标体的生物识别元素(通常叫作生物受体);(2)能够基于结合事件发出相应信号的传导元素,这个信号通常和分析物的浓度成比例。最新的纳米技术提供了大量如何设计和制备可控纳米结构的素材,这将大大地提高生物传感器的性能[131-133]。聚合物刷能吸附多层生物分子[134],且拥有特殊的功能性,例如比色传感[135]、荧光传感[136]、电化学传感[137]等响应性,因此聚合物刷能作为一个典型的生物传感器载体。
利用聚电解质刷的三维结构,通过改变聚合物的结构形态和固载能力可以优化其对生物分子的吸附及固定[138]。球形PAA刷比普通的平面刷和传统的二维平面更适合于固定免疫球蛋白(IgG),以及之后的anti-IgG抗体的识别[139]。同时,在生理条件下,PAA刷或聚甲基丙烯酸(PMAA)刷吸附生物分子,作为生物传感器能降低背景信号的强度。此外,聚电解质链的伸缩和弯曲使聚合物刷表面特性发生改变,赋予其不同的生物功能性。Ma等[140]制备了一种双功能的双层聚合物刷(PEGMA-PAA),上层的PAA层促进抗体的固定,而下层的聚乙二醇甲基丙烯酸酯(PEGMA)层则抑制非特异性吸附。Hess等[141]在石墨烯表面接枝了PDMAEMA-PAA嵌段聚合物刷作为生物传感器体系。PAA端用于固定酶,而聚甲基丙烯酸N,N-二甲基氨基乙酯(PDMAEMA)端对pH具有响应性,酶反应使体系pH发生变化从而产生信号。
球形PAA刷可作为另一种新的生物传感器。Gu等[143]证明了在超敏感ELISA体系中,功能的球形PAA刷可替代传统的酶标记抗体(图11)。
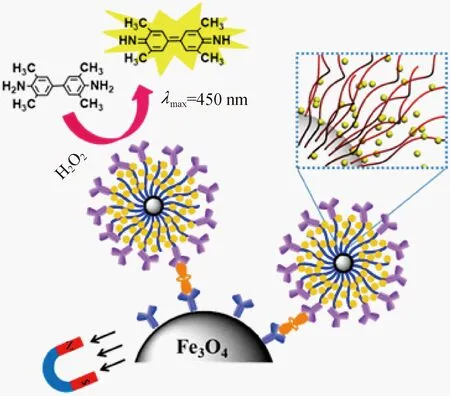
图11 酶或抗体功能化的球形PAA刷作为生物传感器领域中的信号放大器[142]
静电捕获后,通过化学偶联(CCEE)的方法把荧光分子和抗体分别化学固定在PAA刷的内部和外部空间,赋予聚合物刷双重功能,用于待测物的识别并产生检测信号。作为一种高效的酶载体,PAA刷能将检测信号放大,检测灵敏度能提高267倍。相比于传统的相同尺寸的硅纳米颗粒[144-146],以及其他的用于增大酶负载量的功能标记颗粒(例如介孔硅颗粒[142]、中空颗粒[147-148],或者微米级的磁珠[149]),PAA刷的检测信号放大效应更明显。PAA刷标记物可作为生物传感器领域中多功能的信号放大器。另外,Liu等[150]利用杂化乳液聚合法将荧光量子点引入到球形聚合物刷的核内,成功制备了具有荧光特性的聚合物刷,可作为新型的纳米探针用于生物医学诊断和治疗。
3.5 细胞黏附和抗吸附
细胞黏附和扩散是当今各种生物技术的核心课题,例如组织工程学和生物传感器领域[151]。随着表面修饰和聚合技术的不断进步,结构和功能被精心设计的聚合物刷能作为细胞-基质相互作用的优良载体。通常情况下,PMAA刷是抗细胞吸附[152]的材料,但通过加入细胞外基质(ECM)蛋白质(例如胶原蛋白[153])或者多肽(例如RGD),使PMAA刷具有细胞黏附的特性,细胞黏附量随空间上RGD密度的增加而上升。半乳糖是肝细胞脱唾液酸糖蛋白受体的特殊配体,将半乳糖吸附于PMAA刷上能促进肝细胞的黏附[154]。由SI-ATRP方法制备的具有梯度PAA链层的PNIPA-PAA共聚刷,在加入RGD功能化后能用于黏附HepG2细胞基质。细胞基质的拓扑结构和表面特性对细胞的行为、功能及形态影响很大[155]。短链聚合物刷比长链聚合物刷更易于细胞黏附和扩散。温敏性的PNIPA聚合物刷能在不同温度下方便可控地黏附和释放细胞。因此,聚合物刷可作为优异的模型材料用于细胞黏附。
另一方面,抗生物分子吸附材料一直受到食品工业、卫生材料、日化产品和生物制药的广泛关注,因为这些功能性聚合物能应用于抗菌领域(见图12)。迄今为止,聚合物刷在抗菌材料方面的应用还很少。抗蛋白吸附由水合层引起[157],因此两性聚合物刷引起了人们的关注。阴离子PMAA刷在一定程度上能防止细菌的黏附[158],而进一步功能化的PMAA刷能实现抗细菌滋生。具有仿生结构的阴离子聚合物刷也可应用于细胞外基质或细胞表面进行抗蛋白质的非特异性吸附[159]。该阴离子聚合物刷的结构类似于黏多糖,其聚合物链与肝素相似。采用PAA刷对纤维素纸进行表面修饰,其抗菌(E.coli)效果优于原本的PAA刷和普通的纤维素纸[160]。Chiang等[161]通过改变聚合物刷的尺寸、聚合物链层厚度及构象,能在抗细胞吸附和细胞黏附之间进行切换。另外,Wu等[162]以磁性聚合物刷为反应器,原位制备了纳米金属银,这种负载银纳米粒子的功能聚合物刷可应用于抗菌领域。深入探索细胞对于三维聚合物刷表面的黏附行为,无论是对基础研究还是应用研究都具有重要的意义。
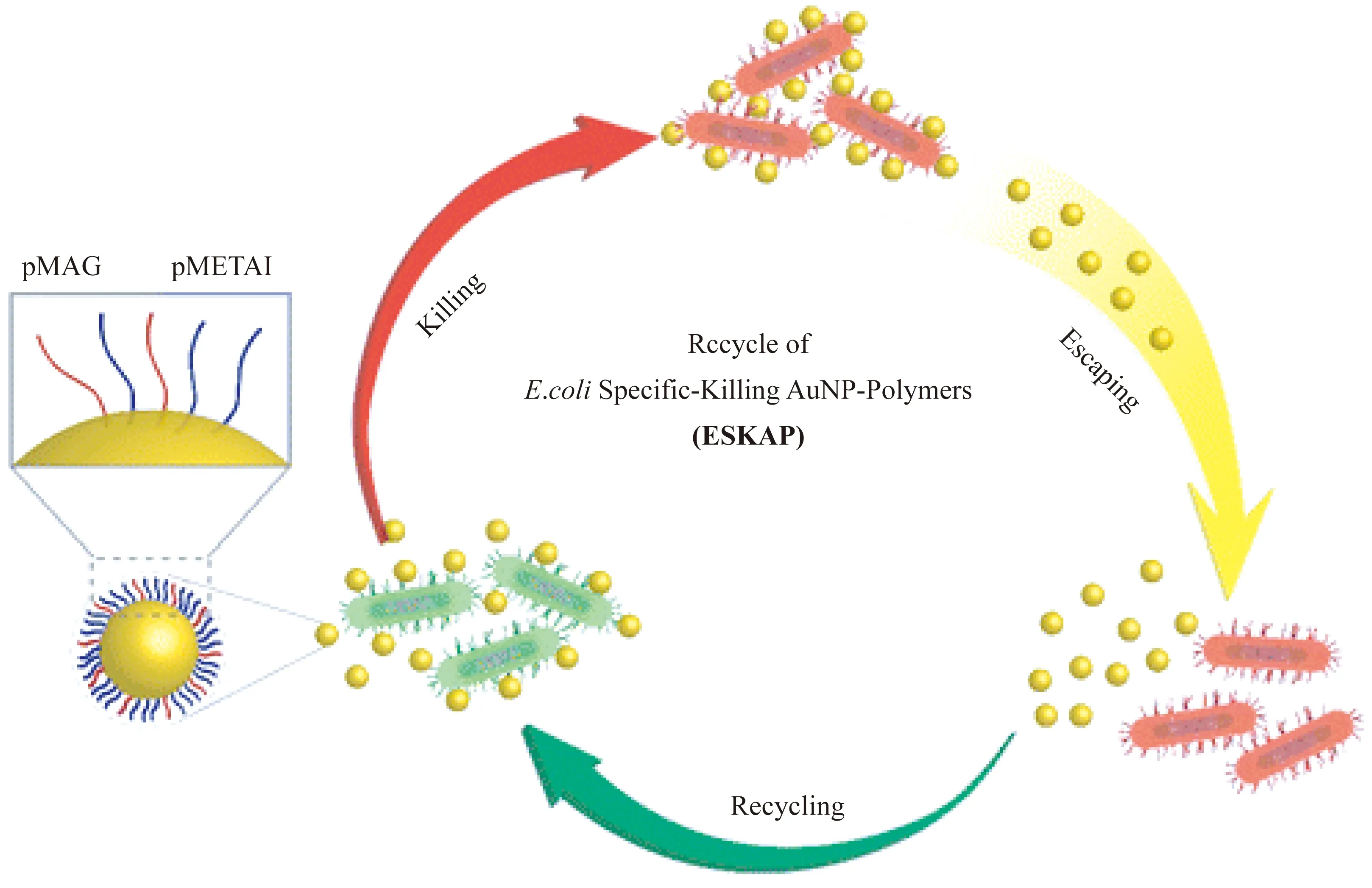
图12 聚合物刷抗菌材料[156]Fig.12 Antibacterial polymer brushes material[156]
4 总结与展望
近十几年来聚合物刷的合成及其应用迅速发展,尤其在生物分子固定和相关生物医药方面的应用研究正在快速发展。表面修饰技术的发展使聚合物刷能可控地与生物分子结合。近年来的研究主要集中于同时具有多功能的聚合物混合刷,它们具有不同的结构形态和特殊的响应性,接枝的多种官能团使其产生多种功能和刺激响应性。科研工作者们对聚合物刷与生物分子相互作用的机理进行了大量的研究,但对于聚合物刷与细胞、细菌、复合生物分子的相互作用还有待进一步探索。精心设计的聚合物刷能可控地固载药物,具有蛋白质吸附、细胞黏附、抗菌、防污等功能性。未来随着合成技术的不断进步,更多的智能化、多功能的聚合物刷会不断涌现。聚合物刷应用于生物医药领域的研究才刚刚起步。预计在不久的将来,材料化学、物理化学和生物医学领域的大量相关研究成果将不断推动聚合物刷在生物和医学领域的应用。
[1] der WAARDEN M V.Micelle formation of sulfonates in hydrocarbons[J].Journal of Colloid Science,1950,5(5):448-457.
[2] der WAARDEN M V.Adsroption of aromatic hydrocarbons in nonaromatic media on carbon black[J].Journal of Colloid Science,1951,6(5):443-449.
[3] MACKOR E L.The colloid-chemical stability of dispersions in hydrocarbons[J].Journal of Colloid Science,1951,6(5):492-495.
[4] der WAARDEN M V.Stabilization of carbon-black dispersions in hydrocarbons[J].Journal of Colloid Science,1950,5(4):317-325.
[5] RUHE J,BALLAUFF M,BIESALSKI M,etal.Polyelectrolyte brushes[J].Advances in Polymer Science,2004,165:79-150.
[6] ZHAO B,BRITTAIN W J.Polymer brushes:Surface-immobilized macromolecules[J].Progress in Polymer Science,2000,25(5):677-710.
[7] MILNER S T.Polymer brushes[J].Science,1991,251(4996):905-914.
[8] LI X,ZHANG J,GU H.Adsorption and desorption behaviors of DNA with magnetic mesoporous silica nanoparticles[J].Langmuir,2011,27(10):6099-6106.
[9] LI X,XIE Q R,ZHANG J,etal.The packaging of siRNA within the mesoporous structure of silica nanoparticles[J].Biomaterials,2011,32(35):9546-9556.
[10] LI X,CHEN Y,WANG M,etal.A mesoporous silica nanoparticle-PEI-Fusogenic peptide system for siRNA delivery in cancer therapy[J].Biomaterials,2013,34(4):1391-1401.
[11] BAO J,CHEN W,LIU T,etal.Bifunctional Au-Fe3O4nanoparticles for protein separation[J].ACS Nano,2007,1(4):293-298.
[12] GU H,XU K,XU C,etal.Biofunctional magnetic nanoparticles for protein separation and pathogen detection[J].Chemical Communications,2006,37(9):941-949.
[13] LIU G,CHEN C,JI J.Biocompatible and biodegradable polymersomes as delivery vehicles in biomedical applications[J].Soft Matter,2012,8(34):8811-8821.
[14] HASANZADEH M,SHADJOU N,OMIDINIA E.Mesoporous silica (MCM-41)-Fe2O3as a novel magnetic nanosensor for determination of trace amounts of amino acids[J].Colloids and Surfaces B:Biointerfaces,2013,108(108C):52-59.
[15] BOYER C,HUANG X,WHITTAKER M R,etal.An overview of protein-polymer particles[J].Soft Matter,2011,7(5):1599-1614.
[16] CZESLIK C.Factors ruling protein adsorption[J].Zeitschrift für Physikalische Chemie,2004,218(7):771-801.
[17] REICHHART C,Czeslik C.Native-like structure of proteins at a planar poly(acrylic acid) brush[J].Langmuir,2009,25(2):1047-1053.
[18] HOLLMANN O,Steitz R,Czeslik C.Structure and dynamics of α-lactalbumin adsorbed at a charged brush interface[J].Physical Chemistry Chemical Physics,2008,10(10):1448-1456.
[19] KUSUMO A,BOMBALSKI L,LIN Q,etal.High capacity,charge-selective protein uptake by polyelectrolyte brushes[J].Langmuir,2007,23(8):4448-4454.
[20] de VOS W M,BIESHEUVEL P M,de KEIZER A,etal.Adsorption of the protein bovine serum albumin in a planar poly(acrylic acid) brush layer as measured by optical reflectometry[J].Langmuir,2008,24(13):6575-6584.
[21] de VOS W M,LEERMAKERS F A M,de KEIZER A,etal.Field theoretical analysis of driving forces for the uptake of proteins by like-charged polyelectrolyte brushes:Effects of charge regulation and patchiness[J].Langmuir,2009,26(1):249-259.
[22] WITTEMANN A,BALLAUFF M.Temperature-induced unfolding of ribonuclease a embedded in spherical polyelectrolyte brushes[J].Macromolecular Bioscience,2005,5(1):13-20.
[23] DE M,GHOSH P S,ROTELLO V M.Applications of nanoparticles in biology[J].Advanced Materials,2008,20(22):4225-4241.
[24] GHOSH P,HAN G,DE M,etal.Gold nanoparticles in delivery applications[J].Advanced Drug Delivery Reviews,2008,60(11):1307-1315.
[25] SANDHU K K,MCLNT OSH C M,SIMARD J M,etal.Frontiers gold nanoparticle-mediated transfection of mammalian cells[J].Bioconjugate Chemistry,2002,13(1):3-6.
[26] HAUPT B,NEUMANN T,WITTEMANN A,etal.Activity of enzymes immobilized in colloidal spherical polyelectrolyte brushes[J].Biomacromolecules,2005,6(2):948-955.
[27] WITTEMANN A,BALLAUFF M.Secondary structure analysis of proteins embedded in spherical polyelectrolyte brushes by FT-IR spectroscopy[J].Analytical Chemistry,2004,76(10):2813-2819.
[28] HENZLER K,WITTEMANN A,Breininger E,etal.Adsorption of bovine hemoglobin onto spherical polyelectrolyte brushes monitored by small-angle X-ray scattering and Fourier transform infrared spectroscopy[J].Biomacromolecules,2007,8(11):3674-3681.
[29] WELSCH N,WITTEMANN A,BALLAUFF M.Enhanced activity of enzymes immobilized in thermoresponsive core-shell microgels[J].The Journal of Physical Chemistry B,2009,113(49):16039-16045.
[30] WANG S,CHEN K,LI L,etal.Binding between proteins and cationic spherical polyelectrolyte brushes:Effect of pH,ionic strength,and stoichiometry[J].Biomacromolecules,2013,14(3):818-827.
[31] ANIKIN K,ROCKER C,WITTEMANN A,etal.Polyelectrolyte-mediated protein adsorption:Fluorescent protein binding to individual polyelectrolyte nanospheres[J].The Journal of Physical Chemistry B,2005,109(12):5418-5420.
[32] WANG S,CHEN K,KAYITMAZER A B,etal.Tunable adsorption of bovine serum albumin by annealed cationic spherical polyelectrolyte brushes[J].Colloids and Surfaces B:Biointerfaces,2013,107(1):251-256.
[33] WANG S,CHEN K,XU Y,etal.Protein immobilization and separation by anionic/cationic spherical polyelectrolyte brushes based on charge anisotropy[J].Soft Matter,2013,9:11276-11287.
[34] CHEN K,ZHU Y,LI L,etal.Recyclable spherical polyelectrolyte brushes containing magnetic nanoparticles in core[J].Macromolecular Rapid Communications,2010,31(16):1440-1443.
[35] CHEN K,ZHU Y,ZHANG Y,etal.Synthesis of magnetic spherical polyelectrolyte brushes[J].Macromolecules,2011,44(3):632-639.
[36] XU Y,WANG S,HAN H,etal.Enhancement of enzymatic activity by magnetic spherical polyelectrolyte brushes:A potential recycling strategy for enzymes[J].Langmuir,2014,30:11156-11164.
[37] QIN L,XU Y,HAN H,etal.β-Lactoglobulin (BLG) binding to highly charged cationic polymer-grafted magnetic nanoparticles:Effect of ionic strength[J].Journal of Colloid and Interface Science,2015,460:221-229.
[38] LU Y,WITTEMANN A.Preparation of polystyrene-poly(N-isopropylacrylamide) (PS-PNIPA) core-shell[J].Macromolecular Rapid Communications,2006,27:1137-1141.
[39] BALLAUFF M,LU Y.“Smart” nanoparticles:Preparation,characterization and applications[J].Polymer,2007,48:1815-1823.
[40] BELEGRINOU S,MENON S,DOBRUNZ D,etal.Solid-supported polymeric membranes[J].Soft Matter,2011,7(6):2202-2210.
[41] RASTOGI L,ARUNACHALAM J.Synthesis and characterization of bovine serum albumin-copper nanocomposites for antibacterial applications[J].Colloids and Surfaces B:Biointerfaces,2013,108(8):134-141.
[42] SENARATNE W,ANDRUZZI L,OBER C K.Self-assembled monolayers and polymer brushes in biotechnology:Current applications and future perspectives[J].Biomacromolecules,2005,6(5):2427-2448.
[43] BOMBOI F,TARDANI F,GAZZOLI D,etal.Lysozyme binds onto functionalized carbon nanotubes[J].Colloids and Surfaces B:Biointerfaces,2013,108(8C):16-22.
[44] BIESALSKI M,RUHE J.Preparation and characterization of a polyelectrolyte monolayer covalently attached to a planar surface[J].Macromolecules,1999,32(7):2309-2316.
[45] AHRENS H.FORSTER S,HELM C.Polyelectrolyte brushes grafted at the air/water interface[J].Macromolecules,1997,30(26):8447-8452.
[46] CURRIE E P K,SIEVAL A B,AVENA M,etal.Weak polyacid brushes:preparation by LB deposition and optically detected titration[J].Langmuir,1999,15(21):7116-7118.
[47] BENDEJACQ D,PONSINET V,JOANNICOT M.Water-dispersed lamellar phases of symmetric poly(styrene)-block-poly(acrylic acid) diblock copolymers:Model systems for flat dense polyelectrolyte brushes[J].European Physical Journal E,2004,13(1):3-13.
[48] BIVER C,HARIHARAN R,MAYS J W,etal.Neutral and charged polymer brushes:A model unifying curvature effects from micelles to flat surfaces[J].Macromolecules,1997,30(6):1787-1792.
[49] ZHANG L,XU K,EISENBERG A.Ion-induced morphological changes in “crew-cut” aggregates of amphiphilic block copolymers[J].Science,1996,272(5269):1777-1779.
[50] GUO X,WEISS A,BALLAUFF M.Synthesis of spherical polyelectrolyte brushes by photo-emulsion polymerization[J].Macromolecules,1999,32(19):6043-6046.
[51] MULLER F,FONTAINE P,DELSANTI M,etal.Counterion distribution in a spherical charged sparse brush[J].European Physical Journal E,2001,6(2):109-115.
[52] LEE A S,BUTUN V,VAMVAKAKI M,etal.Structure of pH-dependent block copolymer micelles:Charge and ionic strength dependence[J].Macromolecules,2002,35(22):8540-8551.
[53] CHEESMAN B T,ALEXANDER J,NEILSON G,etal.Effect of colloidal substrate curvature on pH-responsive polyelectrolyte brush growth[J].Langmuir,2013,29(20):6131-6140.
[54] ZHULINA E B,BORISOV O V.Structure and interaction of weakly charged polyelectrolyte brushes:Self-consistent field theory[J].The Journal of Chemical Physics,1997,107(15):5952-5967.
[55] PINCUS P.Colloid stabilization with grafted polyelectrolytes[J].Macromolecules,1991,24(10):2912-2919.
[56] BORISOV O V,BIRSHTEIN T M,AHULINA E B.Collapse of grafted polyelectrolyte layer[J].Journal de Physique Ⅱ (France),1991,1(6):521-526.
[57] BIESALSKI M,JOHANNSMANN D,RUHE J.Electrolyte-induced collapse of a polyelectrolyte brush[J].Journal of Chemical Physics,2004,120(18):8807-8814.
[58] GUO X H,BALLAUFF M.Spatial dimensions of colloidal polyelectrolyte brushes as determined by dynamic light scattering[J].Langmuir,2000,16(23):8719-8726.
[59] GUO X H,BALLAUFF M.Spherical polyelectrolyte brushes:Comparison between annealed and quenched brushes[J].Physical Review E,2001,64:051406.
[60] RAPHAEL E,de GENNES P G.Rubber-rubber adhesion with connector molecules[J].The Journal of Physical Chemistry,1992,96(10):4002-4007.
[61] AMIJI M,PARK K.Surface modification of polymeric biomaterials with poly(ethylene oxide),albumin,and heparin for reduced thrombogenicity[J].Journal of Biomaterials Science(Polymer Edition),1993,4(3):217-234.
[62] van ZANTEN J H.Terminally anchored chain interphases:Their chromatographic properties[J].Macromolecules,1994,27(23):6797-6807.
[63] JOANNY J F.Lubrication by molten polymer brushes[J].Langmuir,1992,8(3):989-995.
[64] ITO Y,OCHIAI Y,PARK Y S,etal.pH-sensitive gating by conformational change of a polypeptide brush grafted onto a porous polymer membrane[J].Journal of the American Chemical Society,1997,119(7):1619-1623.
[65] ITO Y,PARK Y S,IMANISHI Y.Visualization of critical pH-controlled gating of a porous membrane grafted with polyelectrolyte brushes[J].Journal of the American Chemical Society,1997,119(11):2739-2740.
[66] ITO Y,NISHI S,PARK Y S,etal.Oxidoreduction-sensitive control of water permeation through a polymer brushes-grafted porous membrane[J].Macromolecules,1997,30(19):5856-5859.
[67] CHEESMAN B T,WILLOTT J D,WEBBER G B,etal.pH-responsive brush-modified silica hybrids synthesized by surface-initiated ARGET ATRP[J].ACS Macro Letters,2012,1(10):1161-1165.
[68] BALLAUFF M,BORISOV O.Polyelectrolyte brushes[J].Current Opinion Colloid and Interface Science,2006,11:316-323.
[69] BALLAUFF M.Spherical polyelectrolyte brushes[J].Progress Polymer Science,2007,32(10):1135-1151.
[70] MEI Y,BALLAUFF M.Effect of counterions on the swelling of spherical polyelectrolyte brushes[J].European Physical Journal E,2005,16(3):341-349.
[71] MEI Y,LAUTERBACH K,HOFFMANN M,etal.Collapse of spherical polyelectrolyte brushes in the presence of multivalent counterions[J].Physical Review Letters,2006,97:15830115.
[72] MEI Y,HOFFMANN M,BALLAUFF M,etal.Spherical polyelectrolyte brushes in the presence of multivalent counterions:The effect of fluctuations and correlations as determined by molecular dynamics simulations[J].Physical Review E,2008,77:0318053.
[73] FARRUKH A,AKRAM A,GHAFFAR A,etal.Design of polymer-brush-grafted magnetic nanoparticles for highly efficient water remediation[J].ACS Applied Materials and Interfaces,2013,5(9):3784-3793.
[74] KOKUFUTA E,SHIMIZU H,NAKAMURA I.Stoichiometric complexation of human serum albumin with strongly acidic and basic polyelectrolytes[J].Macromolecules,1982,15(6):1618-1621.
[75] XIA J,DUBIN P L.Macromolecular Complexes in Chemistry and Biology[M].Berlin Heidelberg:Springer-Verlag,1994.
[76] SEREFOGLOU E,OBERDISSE J,STAIKOS G.Characterization of the soluble nanoparticles formed through coulombic interaction of bovine serum albumin with anionic graft copolymers at low pH[J].Biomacromolecules,2007,8(4):1195-1199.
[77] FLORY P J.Principles of Polymer Chemistry[M].Ithaca N Y:Cornell University Press,1953.
[78] XU Y,SEEMAN D,YAN Y,etal.Effect of heparin on protein aggregation:Inhibition versus promotion[J].Biomacromolecules,2012,13(5):1642-1651.
[79] BOERIS V,MICHELETTO Y,LIONZO M,etal.Interaction behavior between chitosan and pepsin[J].Carbohydrate Polymers,2011,84(1):459-464.
[80] HENZLER K,HAUPT B,ROSENFELDT S,etal.Interaction strength between proteins and polyelectrolyte brushes:A small angle X-ray scattering study[J].Physical Chemistry Chemical Physics,2011,13(39):17599-17605.
[81] BALL V,MAECHLING C.Isothermal microcalorimetry to investigate non-specific interactions in biophysical chemistry[J].International Journal of Molecular Sciences,2009,10:3283-3315.
[82] BECKER A L,WELSCH N,SCHNEIDER C,etal.Adsorption of RNase A on cationic polyelectrolyte brushes:A study by isothermal titration calorimetry[J].Biomacromolecules 2011,12(11):3936-3944.
[83] EVERS F,REICHHART C,STEITZ R,etal.Probing adsorption and aggregation of insulin at a poly(acrylic acid) brush[J].Physical Chemistry Chemical Physics,2010,12(17):4375-4382.
[84] BAIER G,COSTA C,ZELLER A,etal.BSA adsorption on differently charged polystyrene nanoparticles using isothermal titration calorimetry and the influence on cellular uptake[J].Macromolecular Bioscience,2011,11(5):628-638.
[85] HSU C,LIN H,THOMAS J L,etal.The microcontact imprinting of proteins:The effect of cross-linking monomers for lysozyme,ribonuclease A and myoglobin[J].Biosensors and Bioelectronics,2006,22(4):534-543.
[86] HORN J R,RUSSELL D,LEWIS E A,etal.Van’t Hoff and calorimetric enthalpies from isothermal titration calorimetry:Are there significant discrepancies[J].Biochemistry,2001,40(6):1774-1778.
[87] HORN J R,BRANDTS J F,MURPHY K P.Van’t Hoff and calorimetric enthalpies Ⅰ:Effects of linked equilibria[J].Biochemistry,2002,41(23):7501-7507.
[88] WELSCH N,BECKER A L,DZUBIELLA J,etal.Core-shell microgels as “smart” carriers for enzymes[J].Soft Matter,2012,8(5):1428-1436.
[89] ROMANINI D,BRAIA M,ANGARTEN R G,etal.Interaction of lysozyme with negatively charged flexible chain polymers[J].Journal of Chromatography B,2007,857(1):25-31.
[90] BRAIA M,PORFIRI M C,FARRUGGIA B,etal.Complex formation between protein and poly vinyl sulfonate as a strategy of proteins isolation[J].Journal of Chromatography B,2008,873(2):139-143.
[91] BRAIA M,TUBIO G,NERLI B,etal.Analysis of the interactions between eudragit®L100 and porcine pancreatic trypsin by calorimetric techniques[J].International Journal of Biological Macromolecules,2012,50(1):180-186.
[92] CHANNASANON S,GRAISUWAN W,KIATKAMJORNWONG S,etal.Alternation bioactivity of multilayer thin films assembled from charged derivatives of chitosan[J].Journal of Colloid and Interface Science,2007,316(2):331-343.
[93] MAO S,BAKOWSKY U,JINTAPATTANAKIT A,etal.Self-assembled polyelectrolyte nanocomplexes between chitosan derivatives and insulin[J].Journal of Pharmaceutical Sciences,2006,95(5):1035-1048.
[94] SAKATA S,INOUE Y,ISHIHARA K.Molecular interaction forces generated during protein adsorption to well-defined polymer brush surfaces[J].Langmuir,2015,31(10):3108-3114.
[95] OLANYA G,THORMANN E,VARGE I,etal.Protein interactions with bottle-brush polymer layers:Effect of side chain and charge density ratio probed by QCM-D and AFM[J].Journal of Colloid and Interface Science,2010,349(1):265-274.
[96] FAN Y F,WANG Y N,FAN Y G,etal.Preparation of insulin nanoparticles and their encapsulation with biodegradable polyelectrolytes via the layer-by-layer adsorption[J].International Journal of Pharmaceutics,2006,324(2):158-167.
[97] GUMMEL J,COUSIN F,BOUÉ F.Counterions release from electrostatic complexes of polyelectrolytes and proteins of opposite charge:A direct measurement[J].Journal of American Chemical Society,2007,129(18):5806-5807.
[98] KAYITMAZER A B,STRAND S P,TRIBET C,etal.Effect of polyelectrolyte structure on protein-polyelectrolyte coacervates:Coacervates of bovine serum albumin with poly(diallyldimethylammonium chloride) versus chitosan[J].Biomacromolecules,2007,8(11):3568-3577.
[99] TRAN H N A,SOUSA F,MODA F,etal.A novel class of potential prion drugs:Preliminaryinvitroandinvivodata for multilayer coated gold nanoparticles[J].Nanoscale,2010,2(12):2724-2732.
[100] WITTEMANN A,HAUPT B,BALLAUFF M.Adsorption of proteins on spherical polyelectrolyte brushes in aqueous solution[J].Physical Chemistry Chemical Physics,2003,5(8):1671-1677.
[101] WITTEMANN A,BALLAUFF M.Secondary structure analysis of proteins embedded in spherical polyelectrolyte brushes by FT-IR spectroscopy[J].Analytical Chemistry,2004,76(10):2813-2819.
[102] CZESLIK C,JACKLER G,HAZLETT T,etal.Salt-induced protein resistance of polyelectrolyte brushes studied using fluorescence correlation spectroscopy and neutron reflectometry[J].Physical Chemistry Chemical Physics,2004,6(24):5557-5563.
[103] ROSENFELDT S,WITTEMANN A,BALLAUFF M,etal.Interaction of proteins with spherical polyelectrolyte brushes in solution as studied by small-angle X-ray scattering[J].Physical Review E,2004,70:0614036.
[104] WITTEMANN A,BALLAUFF M.Interaction of proteins with linear polyelectrolytes and spherical polyelectrolyte brushes in aqueous solution[J].Physical Chemistry Chemical Physics,2006,8(45):5269-5275.
[105] HENZLER K,ROSENFELDT S,WITTEMANN A,etal.Directed motion of proteins along tethered polyelectrolytes[J].Physical Review Letters,2008,100:15830115.
[106] HENZLER K,HAUPT B,LAUTERBACH K,etal.Adsorption of beta-lactoglobulin on spherical polyelectrolyte brushes:Direct proof of counterion release by isothermal titration calorimetry[J].Journal of the American Chemical Society,2010,132(9):3159-3163.
[107] NEUMANN T,HAUPT B,BALLAUFF M.High activity of enzymes immobilized in colloidal nanoreactors[J].Macromolecular Bioscience,2004,4(1):13-16.
[108] HENZLER K,HAUPT B,BALLAUFF M.Enzymatic activity of immobilized enzyme determined by isothermal titration calorimetry[J].Analytical Biochemistry,2008,378(2):184-189.
[109] WELSCH N,WITTEMANN A,BALLAUFF M.Enhanced activity of enzymes immobilized in thermoresponsive core-shell microgels[J].Journal of Physical Chemistry B,2009,113(49):16039-16045.
[110] CHEN K,RANA S,MOYANO D F,etal.Optimizing the selective recognition of protein isoforms through tuning of nanoparticle hydrophobicity[J].Nanoscale,2014,6(12):6492-6495.
[111] BOERIS V,SPELZINI D,FARRUGGIA B,etal.Aqueous two-phase extraction and polyelectrolyte precipitation combination:A simple and economically technologies for pepsin isolation from bovine abomasum homogenate[J].Process Biochemistry,2009,44(11):1260-1264.
[112] ARAVIND U K,MATHEW J,ARAVINDAKUMAR C T.Transport studies of BSA,lysozyme and ovalbumin through chitosan/polystyrene sulfonate multilayer membrane[J].Journal of Membrane Science,2007,229(1):146-155.
[113] NEUMANN T,HAUPT B,BALLAUFF M.High activity of enzymes immobilized in colloidal nanoreactors[J].Macromolecular Bioscience,2004,4(1):13-16.
[114] KUDINA O,ZAKHARCHENKO A,TROTSENKO O,etal.Highly efficient phase boundary biocatalysis with enzymogel nanoparticles[J].Angewandte Chemie International Edition,2014,53(2):483-487.
[115] CULLEN S P,LIU X,MANDEL I C,etal.Polymeric brushes as functional templates for immobilizing ribonuclease A:Study of binding kinetics and activity[J].Langmuir,2008,24(3):913-920.
[116] LECLERCQ S,MILO C,REINECCIUS G A.Effects of cross-linking,capsule wall thickness,and compound hydrophobicity on aroma release form complex coacervate microcapsules[J].Journal of Agricultural and Food Chemistry,2009,57:1426-1432.
[117] BAYES-GARCIA L,VENTOLA L,CORDOBILLA R,etal.Phase change materials (PCM) microcapsules with different shell compositions:Preparation,characterization and thermal stability[J].Solar Energy Materials and Solar Cells,2010,94(7):1235-1240.
[118] Begum G,Reddy T N,Kumar K P,etal.Insitustrategy to encapsulate antibiotics in a bioinspired CaCO3structure enabling pH-sensitive drug release apt for therapeutic and imaging applications[J].ACS Appl Mater Interfaces,2016,8(34):22056-22063.
[119] AZZARONI O.Polymer brushes here,there,and everywhere:Recent advances in their practical applications and emerging opportunities in multiple research fields[J].Journal of Polymer Science Part A:Polymer Chemistry,2012,50(16):3225-3258.
[120] SUN J T,HONG C Y,PAN C Y.Fabrication of PDEAEMA-coated mesoporous silica nanoparticles and pH-responsive controlled release[J].The Journal of Physical Chemistry C,2010,114(29):12481-12486.
[121] HONG C Y,LI X,PAN C Y.Smart core-shell nanostructure with a mesoporous core and a stimuli-responsive nanoshell synthesized via surface reversible addition-fragmentation chain transfer polymerization[J].The Journal of Physical Chemistry C,2008,112(39):15320-15324.
[122] SUN J T,YU Z Q,HONG C Y,etal.Biocompatible zwitterionic sulfobetaine copolymer-coated mesoporous silica nanoparticles for temperature-responsive drug release[J].Macromolecular Rapid Communications,2012,33(9):811-818.
[123] HONG C Y,LI X,PAN C Y.Fabrication of smart nanocontainers with a mesoporous core and a pH-responsive shell for controlled uptake and release[J].Journal of Materials Chemistry,2009,19(29):5155-5160.
[124] SAHOO B,DEVI K S P,BANERJEE R,etal.Thermal and pH responsive polymer-tethered multifunctional magnetic nanoparticles for targeted delivery of anticancer drug[J].ACS Applied Materials and Interfaces,2013,5(9):3884-3893.
[125] RUTNAKORNPITUK M,PUANGSIN N,Theamdee P,etal.Poly(acrylic acid)-grafted magnetic nanoparticle for conjugation with folic acid[J].Polymer,2011,52(4):987-995.
[126] MOTORNOV M,TAM T K,PITA M,etal.Switchable selectivity for gating ion transport with mixed polyelectrolyte brushes:Approaching “smart” drug delivery systems[J].Nanotechnology,2009,20(43):434006.
[127] KE R,YANG W,XIA X,etal.Tandem conjugation of enzyme and antibody on silica nanoparticle for enzyme immunoassay[J].Analytical Biochemistry,2010,406(1):8-13.
[128] YANG M,LI H,JAVADI A,etal.Multifunctional mesoporous silica nanoparticles as labels for the preparation of ultrasensitive electrochemical immunosensors[J].Biomaterials,2010,31(12):3281-3286.
[129] TANG D,REN J.Insituamplified electrochemical immunoassay for carcinoembryonic antigen using horseradish peroxidase-encapsulated nanogold hollow microspheres as labels[J].Analytical Chemistry,2008,80(21):8064-8070.
[130] SANKHE A Y,HUSSON S M,KILBEY S M.Effect of catalyst deactivation on polymerization of electrolytes by surface-confined atom transfer radical polymerization in aqueous solutions[J].Macromolecules,2006,39(4):1376-1383.
[131] LI D,SONG S P,FAN C H.Target-responsive structural switching for nucleic acid-based sensors[J].Accounts of Chemical Research,2010,43(5):631-641.
[132] PEI H,ZUO X L,ZHU D,etal.Functional DNA nanostructures for theranostic applications[J].Accounts of Chemical Research,2014,47(2):550-559.
[133] SHEN J,LI Y,GU H,etal.Recent development of sandwich assay based on the nanobiotechnologies for proteins,nucleic acids,small molecules,and ions[J].Chemical Reviews,2014,114(15):7631-7677.
[134] DAI J,BAO Z,SUN L,etal.High-capacity binding of proteins by poly(acrylic acid) brushes and their derivatives[J].Langmuir,2006,22(9):4274-4281.
[135] LI L,DAVIDSON J L,LUKEHART C M.Surface functionalization of nanodiamond particles via atom transfer radical polymerization[J].Carbon,2006,44(11):2308-2315.
[136] TUGULU S,BARBEY R,HARMS M,etal.Synthesis of poly(methacrylic acid) brushes via surface-initiated atom transfer radical polymerization of sodium methacrylate and their use as substrates for the mineralization of calcium carbonate[J].Macromolecules,2006,40(2):168-177.
[137] TUGULU S,HARMS M,FRICKE M,etal.Polymer brushes as ionotropic matrices for the directed fabrication of microstructured calcite thin films[J].Angewandte Chemie International Editon,2007,45(44):7458-7461.
[138] AKKAHAT P,HOVEN V P.Introducing surface-tethered poly(acrylic acid) brushes as 3d functional thin film for biosensing applications[J].Colloids and Surfaces B:Biointerfaces,2011,86(1):198-205.
[139] WANG Y M,CUI Y,CHENG Z Q,etal.Poly(acrylic acid) brushes pattern as a 3D functional biosensor surface for microchips[J].Applied Surface Science,2013,266:313-318.
[140] MA J,LUAN S,SONG L,etal.Fabricating a cycloolefin polymer immunoassay platform with a dual-function polymer brush via a surface-initiated photoiniferter-mediated polymerization strategy[J].ACS Applied Materials and Interfaces,2014,6(3):1971-1978.
[141] HESS L H,LYULEEVA A,BLASCHKE B M,etal.Graphene transistors with multifunctional polymer brushes for biosensing applications[J].ACS Applied Materials and Interfaces,2014,6(12):9705-9710.
[142] QU Z,XU H,GU H.Synthesis and biomedical applications of poly((meth)acrylic acid) brushes[J].ACS Applied Materials and Interfaces,2015,7(27):14537-14551.
[143] QU Z,XU H,XU P,etal.Ultrasensitive ELISA using enzyme-loaded nanospherical brushes as labels[J].Analytical Chemistry,2014,86(19):9367-9371.
[144] NILSSON K G.Preparation of nanoparticles conjugated with enzyme and antibody and their use in heterogeneous enzyme immunoassays[J].Journal of Immunological Methods,1989,122(2):273-277.
[145] WU Y,CHEN C,LIU S.Enzyme-functionalized silica nanoparticles as sensitive labels in biosensing[J].Analytical Chemistry,2009,81(4):1600-1607.
[146] KE R,YANG W,XIA X,etal.Tandem conjugation of enzyme and antibody on silica nanoparticle for enzyme immunoassay[J].Analytical Biochemistry,2010,406(1):8-13.
[147] TANG D,REN J.Insituamplified electrochemical immunoassay for carcinoembryonic antigen using horseradish peroxidase-encapsulated nanogold hollow microspheres as labels[J].Analytical Chemistry,2008,80(21):8064-8070.
[148] WU D,LI R,WANG H,etal.Hollow mesoporous silica microspheres as sensitive labels for immunoassay of prostate-specific antigen[J].Analyst,2012,137(3):608-613.
[149] MANI V,WASALATHANTHRI D P,JOSHI A A,etal.Highly efficient binding of paramagnetic beads bioconjugated with 100 000 or more antibodies to protein-coated surfaces[J].Analytical Chemistry,2012,84(23):10485-10491.
[150] LIU X,XU Y,MA S,etal.Encapsulation of quantum dot clusters in stimuli-responsive spherical polyelectrolyte brushes[J],Industrial and Engineering Chemistry Research,2014,53(28):11326-11332.
[151] JEON H,SIMON C G,KIM G.A mini-review:Cell response to microscale,nanoscale,and hierarchical patterning of surface structure[J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2014,102(7):1580-1594.
[152] BISSON I,KOSINSKI M,RUAULT S,etal.Acrylic acid grafting and collagen immobilization on poly(ethylene terephthalate) surfaces for adherence and growth of human bladder smooth muscle cells[J].Biomaterials,2002,23(15):3149-3158.
[153] CHENG Z,TEOH S H.Surface modification of ultra-thin poly (ε-caprolactone) films using acrylic acid and collagen[J].Biomaterials,2004,25(11):1991-2001.
[154] YING L,YIN C,ZHUO R X,etal.Immobilization of galactose ligands on acrylic acid graft-copolymerized poly(ethylene terephthalate) film and its application to hepatocyte culture[J].Biomacromolecules,2002,4(1):157-165.
[155] HE X L,NIE P P,SUN Y K,etal.Immobilization of galactose ligands on thermoresponsive culture surface and its influence on cell adhesion/detachment[J].Journal of Colloid Interface Science,2010,350(2):471-479.
[156] Yuan Y,Liu F,Xue L,etal.Recyclable escherichia coli-specific-killing AuNP-polymer(ESKAP)nanocomposites[J].ACS Appl Mater Interfaces,2016,8(18):11309-11317.
[157] LADD J,ZHANG Z,CHEN S,etal.Zwitterionic polymers exhibiting high resistance to nonspecific protein adsorption from human serum and plasma[J].Biomacromolecules,2008,9(5):1357-1361.
[158] YANG J M,LIN H T,WU T H,etal.Wettability and antibacterial assessment of chitosan containing radiation-induced graft nonwoven fabric of polypropylene-g-acrylic acid[J].Journal of Applied Polymer Science,2003,90(5):1331-1336.
[159] AYRES N,HOLT D J,JONES C F,etal.Polymer brushes containing sulfonated sugar repeat units:Synthesis,characterization,andinvitrotesting of blood coagulation activation[J].Journal of Polymer Science Part A:Polymer Chemistry,2008,46(23):7713-7724.
[160] TANG F,ZHANG L,ZHANG Z,etal.Cellulose filter paper with antibacterial activity from surface-initiated ATRP[J].Journal of Macromolecular Science Part A:Pure and Applied Chemistry,2009,46(10):989-996.
[161] CHIANG E N,DONG R,OBER C K,etal.Cellular responses to patterned poly (acrylic acid) brushes[J].Langmuir,2011,27(11):7016-7023.
[162] WU S,KAISER J,GUO X,etal.Recoverable platinum nanocatalysts immobilized on magnetic spherical polyelectrolyte brushes[J].Industrial and Engineering Chemistry Research,2012,51(15):5608-5614.
Progress in Interaction between Polymer Brushes and Biomolecules
WANG Si-yi1, GUO Xu-hong2, CHEN Kai-min3
(1.Testing Center,Shanghai Research Institute of Chemical Industry,Shanghai 200062,China;2.State Key Laboratory of Chemical Engineering,School of Chemical Engineering,East China University of Science and Technology,Shanghai 200237,China; 3.College ofChemistry and Chemical Engineering,Shanghai University of Engineering Science,Shanghai 201620,China)
Polymer brush is a structure with polymer chains attached with one end to a curved or planar surface.In recent years,with the development of polymer preparation methods and surface modification technology,the application range of polymer brush is continuously expanded.Relevant researches of polymer brush become one of the hotpots in the area of functional polymeric materials.Polymer brushes with unique structure and surface properties become suitable candidates in the application of biomolecule immobilization,protein separation,enzymatic catalyst and controlled drug delivery.In this review,the latest progress in interactions between polymer brushes and biomolecules is systematically described,and some possible directions for further research are forecasted.
polymer brush; biomolecule; interaction; protein immobilization; enzymatic catalyst
1008-9357(2016)04-0359-018
10.14133/j.cnki.1008-9357.2016.04.001
2016-08-24
国家自然科学基金(21504052);上海市青年科技英才扬帆计划(15YF1404800)
王思怿(1986-),女,上海人,博士,研究方向为新型聚合物材料及化学品安全性评价。E-mail:wsymsds@163.con
郭旭虹,E-mail:guoxuhong@ecust.edu.cn;陈凯敏,E-mail:kmchen@sues.edu.cn
O63
