剂量密集型新辅助化疗治疗局部晚期宫颈癌的临床分析
2017-01-07何文静伏晓月崔慢慢
苏 丹,何文静,刘 屹,伏晓月,崔慢慢,谢 兰
电子科技大学附属医学院·四川省人民医院(成都 610000)
·论 著·
剂量密集型新辅助化疗治疗局部晚期宫颈癌的临床分析
苏 丹,何文静,刘 屹,伏晓月,崔慢慢,谢 兰△
电子科技大学附属医学院·四川省人民医院(成都 610000)
目的 比较剂量密集型新辅助化疗(10日疗法)与传统新辅助化疗(21日疗法)治疗宫颈癌的临床疗效。方法 回顾性收集局部晚期宫颈癌进行新辅助化疗+手术患者的临床病理资料。剂量密集型组采用紫杉醇60 mg/m2+顺铂60 mg/m2静脉滴注,间隔10 d。传统化疗组采用紫杉醇135 mg/m2+顺铂70 mg/m2静脉滴注,间隔21 d。比较两组患者临床疗效的差异。结果 所有患者在接受新辅助化疗后2周进行评估,剂量密集型组患者临床缓解率为78.6%、化疗后手术率为89.3%,与传统化疗组(75.0%及93.8%)比较,差异无统计学意义(P>0.05)。两组患者术后病检测量的肿瘤直径均较化疗前CT测量直径缩小[化疗前:剂量密集型组:(4.5±1.4) cm,传统化疗组:(4.6±1.3) cm;化疗后:剂量密集型组:(2.2±1.4) cm,传统化疗组:(2.3±1.5) cm]。术后病理结果显示,两组淋巴结阳性率、宫旁浸润率、脉管浸润率及深肌层浸润率比较,差异无统计学意义(P>0.05)。剂量密集型组患者术后放疗率及3年累积生存率分别为60.0%及76.0%,传统化疗组患者术后放疗率及3年累积生存率分别为55.6%及82.0%,差异无统计学意义(P>0.05)。两组化疗副反应发生率比较,差异无统计学意义(P>0.05)。结论 剂量密集型新辅助化疗与传统新辅助化疗对宫颈癌患者的临床效果相似,且可缩短手术前化疗时间,是一种治疗宫颈癌的有效新辅助化疗方法。
新辅助化疗; 宫颈癌; 剂量密集型
宫颈癌是最常见的妇科恶性肿瘤之一,其发病率在妇女的恶性肿瘤中位居第二[1].其中,局部晚期宫颈癌(locally advanced cervical cancer, LACC, 肿瘤直径≥4cm,FIGO ⅠB2、ⅡA2及ⅡB期)常伴盆腔淋巴结转移,预后差。国外治疗方法多以放、化疗为主,但我国由于放疗设备有限,新辅助化疗(neoadjuvant chemotherapy)联合手术治疗仍是其主要治疗方法之一。新辅助化疗是在手术前给予全身化疗,其目的是减少肿瘤负荷和消灭微小转移灶[2],为患者提供手术机会。最常用的化疗方案是以铂类药物为主的21日疗法[3]。为了缩短新辅助化疗时间,有学者提出了剂量密集型化疗方案,如 10日疗法等[4]。本研究比较剂量密集型新辅助化疗(10日疗法)和传统新辅助化疗(21日疗法)对LACC的临床治疗效果。
1 资料与方法
1.1 临床资料
回顾性选取2009年1月至2015年12月在四川省人民医院收治并病理确诊的LACC患者76例。 纳入标准:1)原发肿瘤;2)病理活检证实为宫颈癌;3)未接受过抗肿瘤治疗;4)按照国际妇产科联盟FIGO分期为ⅠB2,ⅡA2及ⅡB期;5)妇科查体子宫颈局部肿瘤直径≥4 cm;6)患者年龄20~70 岁;7)健康状态评分为WHO 0~2分;8)骨髓功能良好(血常规结果:中性粒细胞≥2×109/L,血小板≥100×109/L),肝肾功能正常,心电图正常。排除标准:1)原发宫颈癌曾进行过其他治疗;2)严重疾病进展期(包括心脏病、糖尿病未控制理想、重度高血压、有出血倾向等);3)传染病、双癌、曾有化疗药物过敏史;3)妊娠期和哺乳期妇女。化疗前患者行常规检查,并行盆、腹腔CT检查测定术前肿瘤直径。根据患者入院日期的奇、偶数将其随机分入剂量密集型组(10日疗法)及传统化疗组(21日疗法)。
1.2 治疗方法
1.2.1 化疗方案 患者采用顺铂(cisplatin,豪森制药集团)+紫杉醇(paclitaxel,太极制药集团)化疗,即TP方案,用药间隔分为10日疗法及21日疗法两种。10日疗法用药方法:紫杉醇60 mg/m2静脉滴注,第1天;顺铂60 mg/m2静脉滴注,第1天。21日疗法用药方法:紫杉醇135 mg/m2静脉滴注,第1天;顺铂70 mg/m2静脉滴注,第1天。两种用药方案均使用两个疗程。
1.2.2 化疗疗效及副反应评价 疗效评定按世界卫生组织(WHO)实体瘤的评定标准[3],完全缓解(complete response,CR):肿瘤病灶完全消失;部分缓解(partial response,PR):肿瘤病灶缩小50%;肿瘤稳定(stable disease,SD):肿瘤病灶无明显变化;肿瘤进展(progressive disease,PD):肿瘤病灶较前增大。以完全缓解和部分缓解为有效,以无变化和肿瘤进展为无效。化疗副反应按美国国立癌症研究所(NCI)常见毒性分级标准进行评价。统计两组3~4度消化道反应(恶心严重,不能明显进食;呕吐≥6次/24 h;腹泻≥7次/24 h或严重腹痛或需胃肠外支持治疗)、3~4度骨髓抑制(WBC<2.0×109/L, PLT<50×109/L,NEU<1.0×109/L,Hb<80 g/L)、3~4度便秘(严重或肠绞痛>96 h)、≥2度非感染性发热(体温≥38.1 ℃)的患者人数,并进行比较。
1.2.3 手术方法及病理检查 化疗结束2周后根据妇科检查、B超、CT等情况综合判定局部肿瘤变化情况,并决定能否手术。不能手术者建议放疗,其余能手术者均行广泛子宫全切术+盆腔淋巴结清扫术+腹主动脉旁淋巴结取样或切除术。年龄≤40岁的鳞癌患者,保留卵巢行卵巢移位术。术后病理结果分析包括:肿瘤直径、淋巴结浸润、宫旁浸润、脉管浸润及深肌层浸润等。
1.2.4 术后治疗 术后根据患者病理结果决定是否补充放疗。若患者有淋巴结浸润、阴道断端阳性、脉管浸润或宫旁浸润等,建议补充放疗。其余患者术后均接受2~4个疗程化疗。
1.3 随访
随访期限设定为从首次诊断为宫颈癌至2015年12月。从开始治疗至患者死于宫颈癌(或存活者至末次随访)时间为总生存时间。随访期间行妇科检查、浅表淋巴结触诊、宫颈断端细胞学检查、盆腹腔B超、盆腹腔CT等。未规律复查者行电话随访。用3年累积生存率进行评价。
1.4 统计学方法
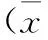
2 结果
2.1 两组一般资料比较
两组年龄、临床分期、病理学类型及组织学分型比较,差异均无统计学意义(P>0.05)(表1)。
表1 两组一般资料比较
2.2 两组疗效比较
化疗前根据盆腹腔CT测得肿瘤直径:剂量密集型组为(4.5±1.4) cm,传统化疗组为(4.6±1.3) cm,两组比较,差异无统计学意义(P>0.05)。化疗后根据病理结果测定肿瘤直径:剂量密集型组为(2.2±1.4) cm,传统化疗组为(2.3±1.5) cm,均较术前明显减小(P<0.05)。
剂量密集型组化疗有效率为78.6%(22/28),传统化疗组为75.0%(36/48),两组比较,差异无统计学意义(2=1.402,P=0.705)(表2)。化疗后手术率:剂量密集型组有25例可以手术,传统化疗组有45例可以手术,两组手术率分别为89.3%(25/28)及93.8%(45/48),差异无统计学意义(2=0.485,P=0.664)。两组各有3例不能手术,原因在于局部肿瘤化疗后无明显改变,无法手术。这6名患者行放疗。手术后放疗:术后根据患者病理结果,剂量密集型组有15例行术后放疗,传统化疗组有25例,其放疗率分别为60.0%(15/25)和55.6%(25/45),差异无统计学意义(2=0.128,P=0.721)。
2.3 两组病理结果分析
两组淋巴结阳性率、宫旁浸润率、脉管浸润率及深肌层浸润率比较,差异均无统计学意义(P>0.05)(表3)。

表2 两组化疗疗效比较[n(%)]
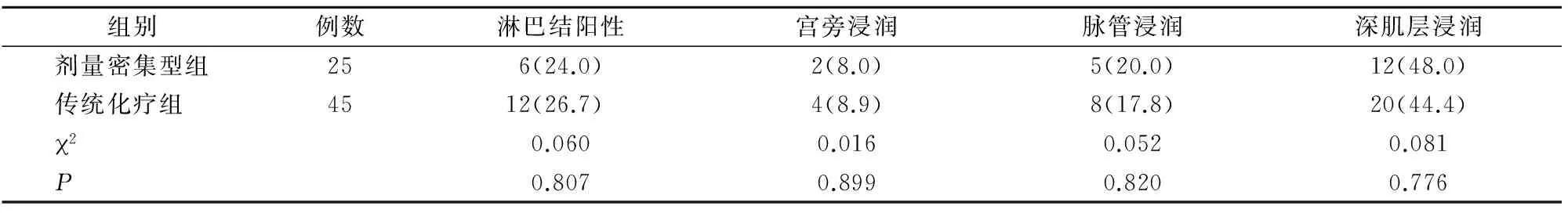
表3 两组病理结果比较[n(%)]
2.4 两组生存分析
两组共76例患者,随访期内失访7例;另有6例化疗后不能手术,未按原计划行新辅助化疗+手术治疗,按删失数据处理;随访期内死于其他疾病的有5例,部分患者与上述删失患者重叠;删失数据共14例。死亡共10例,生存时间5个月~69个月。剂量密集型组和传统化疗组3年累积生存率分别为76.0%和82.0%,其差异无统计学意义(2=0.870,P=0.351)。其中第1年死亡人数:剂量密集型组和传统化疗组各2例;第2~3年分别为1例及3例;3年以上各1例,两组比较,差异无统计学意义(2=0.314,P=0.623)(图1)。
2.5 两组安全性分析
两组所有患者均出现不同程度的化疗副反应,给予对症治疗后,患者临床症状明显改善,无1例死亡或因副反应放弃治疗。两组各种副反应发生率比较,差异均无统计学意义(P>0.05)(表4)。
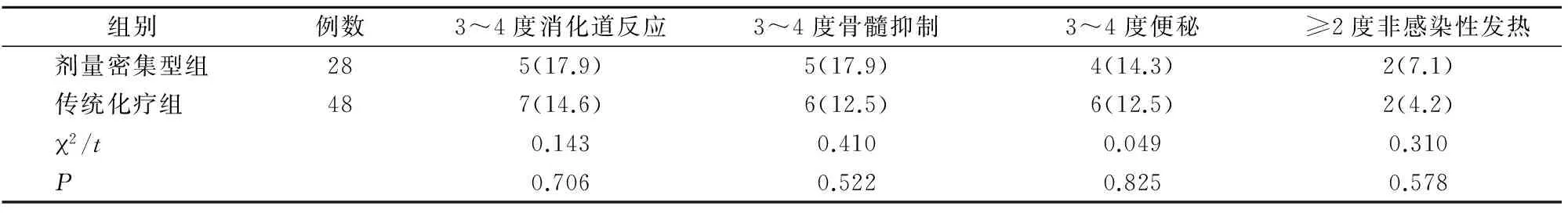
表4 两组化疗副反应比较[n(%)]
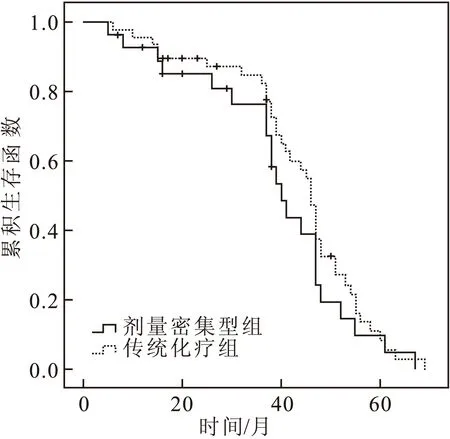
图1 两组宫颈癌患者生存曲线图
3 讨论
宫颈癌是全球妇女发病率第二高的恶性肿瘤。全世界每年新发病例约5千万,中国约占29%[5]。近年来,LACC的发病率逐年上升,且其发病越来越年轻化。在发达国家和地区,LACC的治疗方式是放化疗为主,但中国部分地区缺少放疗设备,并且部分患者担心放疗副反应,如严重损害女性的卵巢及阴道功能等,因此选择新辅助化疗联合手术治疗的患者仍很多。世界上除了中国外,其余亚洲国家、部分南美国家、意大利等国对LACC患者也仍采用新辅助化疗联合手术治疗[6-7]。2015年NCCN宫颈癌治疗指南也肯定了新辅助化疗的效果。
目前仍无公认的宫颈癌新辅助化疗最佳方案。Osman 等[8]在1项包含30个临床试验的Meta分析中发现,博来霉素+长春新碱+顺铂治疗宫颈癌的5年无进展生存率和5年累积生存率分别为56.5%~78.7%和61%~82%;吉西他滨+顺铂方案的2年无进展生存率和2年累积生存率分别为65%~81%和69%~88.9%;5-氟尿嘧啶+顺铂方案的5年无进展生存率和5年累积生存率分别为71%~72.7%和76.4%~84.6%;紫杉醇+顺铂+异环磷酰胺的2年无进展生存率和累积生存率分别为87.5%和90%;由此可见紫杉醇+顺铂+异环磷酰胺的患者预后最好。而Li等[9]将紫杉醇+顺铂和紫杉醇+顺铂+异环磷酰胺进行比较后发现,两者效果接近。紫杉醇+顺铂能获得较高的有效率和完全缓解率(86.1%和27.8%)。Yang 等[10]报道,紫杉醇+卡铂的临床有效率是71.3%,完全缓解率是15.7%,化疗后手术率是89.2%,5年累积生存率为85%。本研究剂量密集型组(紫杉醇+顺铂)的有效率是78.6%,3年累积生存率是76.0%,与上述报道的临床效果接近。
目前主要的新辅助化疗方案是以紫杉醇+铂类药物为主。大多数紫杉醇+顺铂的新辅助化疗方法采用的是21日疗法,共使用2~3个疗程[3],整个新辅助化疗完成需约2个月。研究[1]报道,对于通过新辅助化疗能获得临床缓解的患者,2个月可能使她们获得手术机会,提高治疗效果;而对于不能获得临床缓解的患者,2个月的化疗推迟了她们的手术时间,可能耽误病情。曾有报道[11]显示,间隔周期<14 d,顺铂剂量每周 > 25 mg/m2即可延长LACC患者的生存率。因此,有学者提出了剂量密集型化疗。本研究采用TP方案10日疗法,从化疗开始距手术时间约为35 d,较21日疗法缩短近1个月。与传统21日疗法比较,结果显示:化疗后两组患者临床缓解率、手术率、化疗副反应发生率等比较,差异均无统计学意义(P>0.05)。对化疗后行手术患者的病理结果进行分析后发现,两组患者的病理特征,如肿瘤直径、淋巴结阳性率、宫旁浸润、脉管浸润、深肌层浸润等方面比较,差异无统计学意义(P>0.05)。术后两组放疗率比较,差异也无统计学意义(P>0.05)。对患者的长期随访显示,两组的3年累积生存率相近。
目前,对不同时间间隔的宫颈癌剂量密集型新辅助化疗均有文献报道。Chou等[12]就将40 mg/m2顺铂和4种不同剂量的紫杉醇(50,60,70,80 mg/m2)联用对ⅠB2~ⅡA2期宫颈癌患者行新辅助化疗,时间间隔选用7日,共3个疗程,结果显示,缓解率为50%,此外,58.3%患者进行了术后放疗。10日疗法也有部分文献报道。Eddy等[13]用VP 方案(长春新碱1 mg/m2和顺铂 50 mg/m2)进行10日疗法,共3个疗程,最后临床缓解率仅52%。本研究利用TP方案10日疗法,两个疗程后临床缓解率为78.6%。另有研究[14]报道的TP方案10日疗法(紫杉醇 60 mg/m2和 顺铂 60 mg/m2,5个疗程)治疗ⅠB2~ⅢB期患者,其临床缓解率为52.6%,手术率为86.4%,3~4级骨髓抑制率为18%。本研究的手术率和临床缓解率较高,其原因可能为本研究纳入患者为ⅠB2~ⅡB期,病情较上述报道轻。有研究进行了5个疗程新辅助化疗,有91%的患者坚持完成了治疗,部分患者中途放弃。本试验进行了两个疗程,全部患者均完成了整个治疗。化疗疗程短使患者治疗完成率高,依从性增强。
影响宫颈癌预后的因素包括:宫颈深肌层浸润、宫旁浸润、盆腔淋巴结转移、阴道切缘是否阳性以及脉管癌栓等。这些高危因素明显增加了宫颈癌术后复发风险,并影响患者生存[14]。Wang等[15]报道,未行术后放化疗的患者,其术后复发率增高,术后化疗是宫颈癌复发的独立影响因素。因此,本研究所有术后患者均进行了化疗。本研究两种疗法对这些高危因素作用效果相似,新辅助化疗后手术率、术后放疗率及3年累积生存率均相似,说明可以在临床中使用紫杉醇+顺铂10日疗法进行新辅助化疗。但本研究样本量较小,仍需扩大样本进一步验证。
综上所述,采用紫杉醇联合顺铂对LACC患者实施10日疗法的新辅助化疗与传统的21日疗法在临床缓解率、化疗后手术率、手术病理特征及患者预后方面效果相似,同时可缩短化疗时间,使新辅助化疗后患者手术时间提前,为患者争取更好的治疗效果。
[1]Chen H, Liang C, Zhang L,etal. Clinical efficacy of modified preoperative neoadjuvant chemotherapy in the treatment of locally advanced (stage IB2 to IIB) cervical cancer: a randomized study[J]. Gynecologic Oncology, 2008, 110(3): 308-315.
[2]Kim H S, Sardi J E, Katsumata N,etal. Efficacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: an international collaborative meta-analysis[J]. Eur J Surg Oncol, 2013, 39(2):115-124.
[3]Yang Z, Chen D, Zhang J,etal. The efficacy and safety of neoadjuvant chemotherapy in the treatment of locally advanced cervical cancer: A randomized multicenter study[J]. Gynecol Oncol, 2016, 141(2): 231-239.
[4]Benedetti Panici P, Palaia I, Marchetti C,etal. Dose-Dense Neoadjuvant Chemotherapy plus Radical Surgery in Locally Advanced Cervical Cancer: A Phase II Study[J]. Oncology, 2015, 89(2):103-110.
[5]Kim K, Zang R, Choi S C,etal. Current status of gynecological cancer in China[J]. J Gynecol Oncol, 2009, 20(2):72-76.
[6]González-Martín A, González-Cortijo L, Carballo N,etal. The current role of neoadjuvant chemotherapy in the management of cervical carcinoma[J]. Gynecologic Oncology, 2008, 110(2): 36-40.
[7]Lissoni A A, Colombo N, Pellegrino A,etal. A phase II, randomized trial of neo-adjuvant chemotherapy comparing a three-drug combination of paclitaxel, ifosfamide, and cisplatin (TIP) versus paclitaxel and cisplatin (TP) followed by radical surgery in patients with locally advanced squamous cell cervical carcinoma: the Snap-02 Italian Collaborative Study[J]. Ann Oncol, 2009, 20(4):660-665.
[8]Osman M. The role of neoadjuvant chemotherapy in the management of locally advanced cervix cancer: a systematic review[J]. Oncol Rev, 2014, 8(250):60-66.
[9]Li Y, Wang X, Li J,etal. Combination therapy of liposomal paclitaxel and cisplatin as neoadjuvant chemotherapy in locally advanced cervical cancer[J]. Eur J Gynaecol Oncol, 2014, 36(1): 54-58.
[10] Yang L, Guo J, Shen Y,etal. Clinical efficacy and safety of paclitaxel plus carboplatin as neoadjuvant chemotherapy prior to radical hysterectomy and pelvic lymphadenectomy for Stage ⅠB2-ⅡB cervical cancer[J]. Int J Clin Exp Med, 2015, 8(8):13690-13698.
[11] Neoadjuvant Chemotherapy for Cervical Cancer Meta-Analysis Collaboration (NACCCMA) Collaboration. Neoadjuvant chemotherapy for locally advanced cervix cancer[J]. Cochrane Database Syst Rev, 2004(2): CD001774.
[12] Chou H H, Huang H J, Lin H,etal. Phase I Dose-Escalation Study of Weekly Paclitaxel and Cisplatin Followed by Radical Hysterectomy in Stages IB2 and IIA2 Cervical Cancer[J]. Am J Clin Oncol, 2014, [Epub ahead of print].
[13] Eddy G L, Bundy B N, Creasman W T,etal. Treatment of (“bulky”) stage IB cervical cancer with or without neoadjuvant vincristine and cisplatin prior to radical hysterectomy and pelvic/para-aortic lymphadenectomy: a phase III trial of the gynecologic oncology group[J]. Gynecologic Oncology, 2007, 106(2): 362-369.
[14] Liu M T, Hsu J C, Liu W S,etal. Prognostic factors affecting the outcome of early cervical cancer treated with radical hysterectomy and post-operative adjuvant therapy[J]. Eur J Cancer Care, 2008,17(2):174-181.
[15] Wang H, Zhu L, Lu W,etal. Clinicopathological risk factors for recurrence after neoadjuvant chemotherapy and radical hysterectomy in cervical cancer[J]. World J Surg Oncol, 2013, 11:301.
A Study on the Clinical Efficacy of High-dose density Neoadjuvant Chemotherapy on Locally Advanced Cervical Cancer
SuDan,HeWenjing,LiuYi,FuXiaoyue,CuiManman,XieLan△.
SchoolofMedicineofUESTC,SichuanProvincialPeople′sHospital,Chengdu610000,China
Objective To compare the clinical efficacy of high-dose density neoadjuvant chemotherapy (HDNC) and classic neoadjuvant chemotherapy (CNC) on locally advanced cervical carcinoma. Methods 76 patients with locally advanced cervical carcinoma were treated with operations and neoadjuvant chemotherapy between January of 2009 and December of 2015 in Sichuan Provincial People′s Hospital and selected as research subjects in this study. The clinicopathological data were analyzed retrospectively. The patients were divided into the HDNC group, in which the patients received 2 cycles of intravenous drip of 60 mg/m2cisplatin and 60 mg/m2paclitaxel with 10-day intervals, and the CNC group, in which the patients received 2 cycles of intravenous drip of 70 mg/m2cisplatin and 135 mg/m2paclitaxel with 21-day intervals. The data were compared to analyze the differences of clinical efficacy between the two groups. Results After all the patients received neoadjuvant chemotherapy for 2 weeks, the clinical remission rate and the surgical rate of the HDNC group were 78.6% and 89.3% respectively, while those of the CNC group were 75% and 93.7% respectively, which showed no statistical significance between the two groups. The diameter of the tumors was reduced after neoadjuvant chemotherapy. The postoperative pathological results showed that there were no significant differences between the two groups in the positive rate of lymph node and the rate of the parametrial infiltration, the lymphovascular space invasion and the deep stromal invasion. The postoperative radiotherapy rate and the 3-year cumulative survival rate of the HDNC group were 60% and 76% respectively, while those of the CNC group were 55.6% and 82%, which showed no significant differences between the two groups. Conclusion The neoadjuvant chemotherapy with high-dose density of cisplatin and paclitaxel for the patients with locally advanced cervical carcinoma has the same clinical efficacy as the classic neoadjuvant chemotherapy, but it can shorten the chemotherapy time before operation. Therefore, it is an effective neoadjuvant chemotherapy for locally advanced cervical carcinoma.
Nneoadjuvant chemotherapy; Cervical cancer; High-dose density
http://www.cnki.net/kcms/detail/51.1705.R.20160825.0835.002.html
10.3969/j.issn.1674-2257.2016.06.012
R711
A
△通信作者:谢兰,E-mail:841423692@qq.com
