硫氢化钠对肝硬化大鼠肝细胞凋亡及肝组织Bax、Bcl-2表达的影响
2017-01-06刘浩陈卫刚郑勇
刘浩,陈卫刚,郑勇
(石河子大学医学院第一附属医院,新疆石河子832008)
硫氢化钠对肝硬化大鼠肝细胞凋亡及肝组织Bax、Bcl-2表达的影响
刘浩,陈卫刚,郑勇
(石河子大学医学院第一附属医院,新疆石河子832008)
目的 探讨硫氢化钠(NaHS)对肝硬化大鼠的肝保护作用及其机制。方法 选择雌性SD大鼠40只,随机分为正常对照组、肝硬化组、炔丙基甘氨酸(PPG)组、NaHS组,每组10只。肝硬化组、PPG组、NaHS组采用四氯化碳复合因素法制备肝硬化模型。PPG组腹腔注射PPG 30 mg/(kg·d),NaHS组腹腔注射NaHS 56 μmol/(kg·d),正常对照组和肝硬化组腹腔注射等量生理盐水,共注射7天。末次注射次日处死大鼠,留取肝组织,免疫组化法检测肝组织Bax、Bcl-2表达,脱氧核苷酸末端转移酶介导缺口末端标记法测定肝细胞凋亡指数(AI)。结果 肝组织Bax、Bcl-2蛋白均定位于细胞质,染色后呈棕黄色颗粒状,凋亡肝细胞细胞核呈棕黄色或黄褐色。与正常对照组比较,肝硬化组AI明显升高(P<0.05);与肝硬化组比较,NaHS组Bax表达及AI均明显降低(P均<0.05),PPG组Bax表达及AI均明显升高(P均<0.05);各组间Bcl-2表达比较差异均无统计学意义(P均>0.05)。结论 NaHS对肝硬化大鼠具有肝保护作用,可抑制肝细胞凋亡;其机制可能与下调Bax表达有关。
肝硬化;硫氢化钠;硫化氢;细胞凋亡;Bax;Bcl-2
硫化氢(H2S)是继NO、CO之后发现的第三种新型气体信号分子,在体内主要通过细胞胱硫醚β合成酶(CBS)、细胞胱硫醚γ裂解酶(CSE)催化L-半胱氨酸而产生,具有扩张血管、心肌保护、抗炎等作用[1~4]。近年研究发现,其在肝纤维化及门脉高压的发生、发展过程中具有重要作用[5~9]。本课题前期研究证实,腹腔注射硫氢化钠(NaHS)可改变大鼠体内H2S的含量。2013年6月~2014年1月,我们观察了NaHS对肝硬化大鼠肝细胞凋亡及肝组织Bax、Bcl-2表达的影响,现分析结果,探讨NaHS在肝硬化发生、发展中的作用。
1 材料与方法
1.1 材料 健康、SPF级、雌性SD大鼠40只,体质量(210±10)g,购自新疆医科大学实验动物中心,为同期出生的纯种系。饲养环境:温度20~25 ℃,湿度50%左右。主要仪器:RM2135型石蜡切片机,德国LEICA公司;免疫组化图像分析系统,日本OLYMPUS株式会社。主要试剂:兔抗鼠Bcl-2多克隆一抗,英国Abcam公司;兔抗鼠Bax多克隆一抗,武汉博士德生物工程有限公司;脱氢核苷酸末端转移酶介导缺口端标记(TUNEL)试剂盒,瑞士Roche公司;二抗检测试剂盒,北京中杉金桥有限责任公司;硫氢化钠(NaHS)、炔丙基甘氨酸(PPG),美国Sigma公司;其余试剂为国产分析纯。
1.2 模型制备及干预 将40只大鼠随机分为正常对照组、肝硬化组、PPG组、NaHS组,每组10只。肝硬化组、PPG组、NaHS组采用四氯化碳复合因素法制备肝硬化模型:大鼠适应性喂养1周,皮下注射40%四氯化碳植物油溶液,首次剂量为0.5 mL/100 g,以后每隔4天注射1次,剂量为0.3 mL/100 g,共注射13次。造模期间各组以30%乙醇溶液作为惟一饮用液体;前2周用20%猪油+80%玉米面饲养,之后用0.5%胆固醇粉+玉米面饲养至造模结束。正常对照组同期皮下注射等量生理盐水,喂养饲料为复合饲料,饮用水为自来水。52天后处死大鼠,肝硬化组、PPG组、NaHS组均造模成功。造模结束PPG组腹腔注射PPG 30 mg/(kg·d),NaHS组腹腔注射NaHS 56 μmol/(kg·d),正常对照组、肝硬化组同期腹腔注射等量生理盐水,共注射7天。
1.3 相关指标观察
1.3.1 肝组织Bax、Bcl-2蛋白表达 采用免疫组化法。末次注射次日采用颈椎脱臼法处死大鼠,取部分肝组织置于10%甲醛溶液中固定,石蜡包埋,4 μm厚切片。切片常规脱蜡至水,3%双氧水甲醇中浸泡10 min。枸橼酸修复液微波炉中高火修复至冒泡后再低火修复20 min,冷却至室温,加Bax、Bcl-2一抗,置于4 ℃冰箱过夜。次日PBS冲洗5 min×3次,滴加二抗(两步法),37 ℃孵育30 min,PBS冲洗,DAB显色,苏木素复染,脱水,透明,中性树胶封片,显微镜下观察。Bax、Bcl-2蛋白表达阳性部位在细胞质,显棕黄色。每张标本切片随机选择5个高倍视野区域,计数阳性细胞数和总细胞数,计算阳性表达率。阳性表达率=阳性细胞数/总细胞数×100%。
1.3.2 肝细胞凋亡指数(AI) 石蜡切片常规脱蜡至水,3%双氧水甲醇中浸泡10 min,PBS冲洗5 min×3次;蛋白酶K(15 μg/mL)37 ℃温箱中孵育7 min;20%胎牛血清室温下封闭20 min;用滤纸吸去残留液后滴加反应液50 μL(TdT 3 μL,荧光素连接的核苷酸混合缓冲液47 μL,阴性对照片不加TdT),37 ℃温箱中孵育45 min,PBS冲洗5 min×3;20%山羊血清室温下封闭20 min,加POD转换剂(原液1∶2稀释),置于37 ℃温箱中孵育30 min,显微镜下DAB显色,苏木素复染,脱水,透明,封片。阳性部位在细胞核,显棕黄色或棕褐色。计数5个高倍镜视野下100个肝细胞核中阳性细胞的个数,取其均值为AI。

2 结果
各组肝组织Bax、Bcl-2蛋白均定位于细胞质,染色后呈颗粒状棕黄色。见插页Ⅰ图4、5。与正常对照组比较,肝硬化组AI明显升高(P<0.05);与肝硬化组比较,NaHS组Bax表达及AI均明显降低(P均<0.05),PPG组Bax表达及AI均明显升高(P均<0.05);各组间Bcl-2表达比较差异无统计学意义(P均>0.05)。见表1。
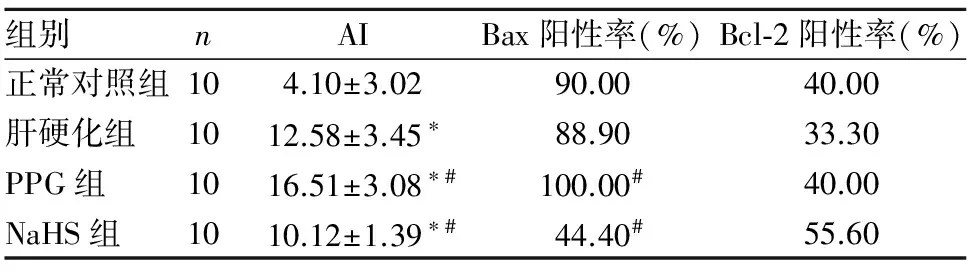
表1 各组肝细胞AI及肝组织Bax、Bcl-2阳性率比较
注:与正常对照组比较,*P<0.05;与肝硬化组比较,#P<0.05。
3 讨论
腹腔注射NaHS可改变体内H2S含量。早期研究发现,H2S是一种存在于脑内的神经递质,对神经系统海马的长时程增强功能具有调节作用;随着研究的深入,人们陆续发现其对自发性高血压、阿尔茨海默病及肝硬化等疾病均具有调节作用。本课题组前期研究发现,H2S在肝硬化的发生、发展过程中及调节门静脉压力方面发挥重要的保护性作用[5~10]。有报道显示,H2S作为第三种气体信号分子与NO、CO气体信号分子存在相互作用[11]。
肝细胞凋亡是肝脏疾病最重要的发病原因之一,在正常肝脏发育及多种肝脏疾病的发生过程中具有重要作用[12,13]。肝脏在受到损伤因素,如病毒感染、酒精刺激等作用时,原本存在于体内的肝细胞死亡程序可能被激活,进而引起肝细胞的程序性死亡(凋亡),并产生大量的凋亡小体。凋亡小体被肝脏中主要吞噬细胞-枯否细胞吞噬后产生大量的促炎症因子和凋亡受体,可进一步促进肝细胞的凋亡并能引发炎症反应;凋亡小体还可通过以下途径激活肝星状细胞:①直接刺激肝星状细胞的激活;②刺激枯否细胞活化而间接刺激肝星状细胞的活化;③刺激MMP-2/9活性而间接刺激肝星状细胞活化;活化后的肝星状细胞可产生大量的细胞外基质及胶原蛋白,最终导致肝纤维化的形成。因此认为,肝细胞病理性凋亡和肝纤维化发生密切相关,病理性肝细胞凋亡启动并促进了肝纤维化的发生。
Bcl-2家族是目前研究较多的凋亡相关基因,其家族成员包括两类:一类是凋亡促进基因,包括Bax、Bad、Bak等;另一类是以Bcl-2为代表的凋亡抑制基因。Bcl-2蛋白主要分布在线粒体外膜、细胞膜内表面、内质网膜及核膜等。Bax的表达更为广泛,可出现在肝细胞、血管平滑肌细胞等。研究发现,Bax与Bcl-2的比例(Bax/Bcl-2)关系是决定其对细胞凋亡抑制作用强弱的关键因素。有研究表明,H2S可通过影响Bax的表达发挥其对心肌缺血再灌注损伤的保护性作用[14];H2S在肝脏缺血再灌注损伤时通过抑制肝细胞凋亡发挥其保护性作用[15]。本研究结果显示,各组肝组织中均有Bax、Bcl-2表达,但Bax阳性率远高于Bcl-2,表明Bcl-2在肝脏中表达较少,甚至有研究认为其在肝组织中无表达。与肝硬化组比较,NaHS组Bax表达明显降低,PPG组Bax表达明显升高;各组间Bcl-2表达比较差异无统计学意义。此外,肝硬化组肝细胞凋亡增加,NaHS组肝细胞凋亡减少,PPG组肝细胞凋亡增加。与正常对照组比较,肝硬化组AI明显升高;与肝硬化组比较,NaHS组AI明显降低,PPG组AI明显升高;进一步证实了上述观点。
综上所述,NaHS在大鼠肝硬化的发生、发展过程中具有保护性作用,其作用机制可能为下调Bax表达。
[1] Melnik AV, Voloshchouk NI, Pentyuk NO. Role of hydrogen sulfide and sulfur-containing amino acids in regulation of tone of smooth muscles of the vascular wall in rats[J]. J Neurophysiol, 2010,42(2):104-109.
[2] Chuah SC, Moore PK, Zhu YZ. S-allylcysteine mediates cardioprotection in an acute myocardial infarction rat model via a hydrogen sulfide-mediated pathway[J]. Am Physiol Heart Circ Physiol, 2007,293(5):H2693-H2701.
[3] Sidhapuriwala JN, Ng SW, Bhatia M. Effects of hydrogen sulfide on inflammation in caerulein-induced acute pancreatitis[J]. J Inflamm (Lond), 2009(6):35.
[4] Hirata I, Naito Y, Takagi T, et al. Endogenous hydrogen sulfide is an anti-inflammatory molecule in dextran sodium sulfate-induced colitis in mice[J]. Dig Dis Sci, 2011,56(5):1379-1386.
[5] 张宁,郑勇,陈卫刚,等.内源性硫化氢在不同时期大鼠肝硬化中的作用[J].世界华人消化杂,2009,17(3):307-311.
[6] 何春萍,田德安,王波,等.硫化氢供体对实验性门静脉高压及内源性一氧化氮/一氧化氮合酶体系的影响[J].胃肠病学和肝病学杂志,2007,16(6):572-575.
[7] 陈卫刚,郑勇,宋丽秀,等.内源性H2S对大鼠实验性肝硬化门脉高压的影响[J].世界华人消化杂志,2011,19(5):467-471.
[8] 刘维国,郑勇,李文娟,等.硫化氢对大鼠实验性肝硬化门静脉压力的影响[J].山东医药,2010,50(24):39-40.
[9] 陈卫刚,郑勇,张宁,等.硫化氢对肝硬化大鼠门静脉压力及肝细胞增殖的影响[J].山东医药,2013,53(6):18-20.
[10] 张宁,郑勇,李睿,等.不同时期肝硬化大鼠门静脉血与下腔静脉血中内源性硫化氢的比较[J].石河子大学学报:自然科学版,2009,27(1):51-54.
[11] 宋丽秀,郑勇,陈卫刚,等.大鼠肝硬化形成中气体信号分子一氧化氮、一氧化碳对硫化氢/胱硫醚-γ-裂解酶体系的影响[J].现代生物医学进展,2010,10(7):1213-1216.
[12] Kilicarslan A, Kahraman A, Akkiz H, et al. Apoptosis in selected liver diseases[J]. Turk J Gastroenterol, 2009,20(3):171-179.
[13] Guicciardi ME, Gores GJ. Apoptosis as a mechanism for liver disease progresssion[J]. Semin Liver Dis, 2010,30(4):402-410.
[14] 黄晓伟,姚玲玲,朱依纯,等.外源性H2S在大鼠心肌缺血再灌注损伤中的作用[J].复旦学报:医学版,2008,35(2):216-219.
[15] 康凯,姜洪池,赵鸣雁,等.胱硫醚-γ-裂解酶/硫化氢系统在大鼠肝脏缺血再灌注损伤中的保护作用[J].中华外科杂志,2010,48(12):294-298.
国家自然科学基金资助项目(81170402)。
郑勇(E-mail: zy2850@126.com)
10.3969/j.issn.1002-266X.2016.44.012
R575.2
A
1002-266X(2016)44-0038-03
2015-11-30)
