利拉鲁肽对糖尿病大鼠肾损伤的影响及机制
2017-01-06夏小慧陈娟张日东章向成张红李伟
夏小慧,陈娟,张日东,章向成,张红,李伟
(1徐州医学院,江苏徐州221000;2南京医科大学附属淮安第一人民医院;3徐州医学院附属医院)
·基础研究·
利拉鲁肽对糖尿病大鼠肾损伤的影响及机制
夏小慧1,陈娟2,张日东2,章向成2,张红2,李伟3
(1徐州医学院,江苏徐州221000;2南京医科大学附属淮安第一人民医院;3徐州医学院附属医院)
目的 探讨利拉鲁肽对糖尿病大鼠肾损伤的影响及其作用机制。方法 将40只雄性SD大鼠随机均分为四组,模型组及观察组给予一次性腹腔注射链脲佐菌素(60 mg/kg)建立糖尿病模型,观察组、利拉鲁肽组给予腹腔注射利拉鲁肽200 μg/(kg·d),模型组和对照组腹腔注射等量生理盐水,均连续注射8周。药物干预8周结束时收集各组24 h尿液,计算尿白蛋白/肌酐、体质量及血清糖化血红蛋白(HbA1c),采用HE、六胺银染色观察肾组织形态,采用免疫组化法检测肾小球及肾小管CD14阳性细胞的累积光密度(IOD)值,采用ELISA法检测血清TNF-α、IL-1β、IL-6,采用Western blotting法检测核转录因子κB(NF-κB)、细胞黏附因子1(ICAM-1)及胰高血糖素样肽1受体(GLP-1R)蛋白表达。结果 与对照组和利拉鲁肽组比较,模型组和观察组体质量减低、血清HbA1c水平及尿白蛋白/肌酐升高(P均<0.01),且观察组尿白蛋白/肌酐低于模型组(P<0.01)。光镜下观察到模型组肾小球体积增大,肾小球及肾小管细胞数目增多;观察组肾小管和肾小球损害明显减轻,肾小球及肾小管细胞数量下降,银染颗粒明显减少。模型组肾组织CD14的IOD值及血清TNF-α、1L-6、IL-1β水平均较对照组、利拉鲁肽组升高,观察组上述指标均较模型组降低(P<0.05或<0.01)。与模型组比较,观察组肾组织NF-κB、ICAM-1蛋白相对表达量减低,GLP-1R蛋白相对表达量升高;组间比较P均<0.05。结论 利拉鲁肽可抑制糖尿病大鼠肾损伤,抑制NF-κB活化后介导的炎症反应、促进GLP-1R分泌可能是其作用机制。
糖尿病肾病;利拉鲁肽;核转录因子κB;细胞黏附因子1;胰高血糖素样肽1受体;大鼠
糖尿病肾病(DKD)是导致糖尿病患者致残和致死的主要原因之一[1],其发生机制主要包括高血糖直接损伤肾脏、晚期糖基化终末产物堆积、多元醇通路激活、氧化应激及蛋白激酶通路激活等[2,3];此外,高血糖所致炎症反应可加速细胞外基质的分泌及肾脏细胞的损伤,参与DKD的发生、发展[4]。胰高血糖素样肽1(GLP-1)是由末端空肠、回肠和结肠L细胞分泌,通过与其受体(GLP-1R)结合而发挥降糖作用,但半衰期仅2 min[5]。利拉鲁肽是一种长效GLP-1类似物,半衰期长达10 h。研究发现,给予正常人GLP-1激动剂可以上调GLP-1R表达,延缓肾损害,但具体作用机制尚不明确[6,7]。2014年10月~2015年6月,本研究观察了利拉鲁肽对糖尿病大鼠肾损伤的影响,现分析结果,探讨其作用机制。
1 材料与方法
1.1 材料 SPF级8周龄雄性SD大鼠40只,体质量180~200 g,购自上海西普尔-必凯实验动物有限公司[动物许可证号:(SCXK(沪)2013-0016]。利拉鲁肽,诺和诺德公司;链脲佐菌素(STZ),Sigma公司;ELISA试剂盒,Bender Med Systems GmbH公司;CD14、细胞黏附因子1(ICAM-1)、核转录因子κB(NF-κB)一抗,CST公司;GLP-1R一抗,Abcam公司;羊抗兔二抗,优宁维公司。
1.2 动物分组及处理 将SD大鼠随机分为对照组、模型组、利拉鲁肽组、观察组,每组10只。模型组及观察组给予一次性腹腔注射STZ(60 mg/kg)建立糖尿病模型(给予STZ 72 h后检测空腹血糖,空腹血糖≥16.7 mmol/L确定为糖尿病大鼠模型建立成功,两组模型制备均成功),观察组、利拉鲁肽组给予腹腔注射利拉鲁肽200 μg/(kg·d),模型组和对照组腹腔注射等量生理盐水,均连续注射8周。
1.3 相关指标观察
1.3.1 尿白蛋白/肌酐、体质量和血清糖化血红蛋白(HbA1c) 药物干预8周结束时使用代谢笼收集各组24 h尿液,应用双缩脲比色法测定尿白蛋白和肌酐,计算尿白蛋白/肌酐;测定大鼠体质量;经腹主动脉采血后处死大鼠,采用亲和层析法检测HbA1c水平。
1.3.2 血清TNF-α、IL-1β、IL-6水平 采用ELISA法。取各组血清,采用ELISA试剂盒检测TNF-α、IL-1β、IL-6,酶标仪检测450 nm波长处各组吸光度(A)值,通过标准曲线计算血清TNF-α、IL-1β、IL-6水平。严格按试剂盒说明书操作。
1.3.3 肾组织形态 取出大鼠双侧肾脏,生理盐水充分灌洗,滤纸吸干水分,去除包膜及结缔组织,切割成5 mm×5 mm×5 mm大小组织块;取一部分组织经10%甲醛固定2 h,梯度乙醇脱水,石蜡包埋,4~5 μm厚连续切片;分别进行HE、六胺银染色,乙醇脱水,二甲苯透明,中性树胶封固,光学显微镜下观察肾组织形态。
1.3.4 肾组织CD14表达 采用免疫组化法。取各组肾组织石蜡切片,二甲苯脱蜡,抗原修复,去离子水孵育10 min,BSA封闭15 min,加入CD14一抗4 ℃孵育过夜,37 ℃复温1 h,加入二抗室温孵育15 min,DAB显色后脱水,透明,中性树胶封片。CD14位于肾细胞胞质中,以呈棕黄色为阳性。在200倍显微镜下随机采集肾脏皮质区10个视野,采用Image pro plus6.0软件测量肾小球及肾小管CD14阳性细胞的累积光密度(IOD)值,作为CD14的相对表达量。
1.3.5 肾组织NF-κB、ICAM-1及GLP-1R蛋白表达 采用Western blotting法。取肾组织加入RIPA裂解液和PMSF后充分匀浆研磨,冰上裂解30 min,4 ℃ 12 000 r/min离心10 min,测定蛋白浓度,采用PBS配平各组蛋白。配制10%分离胶,采用SDS-PAGE电泳仪在恒压65 V下电泳1 h,再恒压110 V、2 h,半干转膜,BSA封闭2 h;分别加入NF-κB、ICAM-1及GLP-1R一抗4 ℃孵育过夜;TBST洗膜10 min×3次,加入二抗室温孵育2 h;TBST洗膜10 min×3次,BCIP/NBT试剂盒显色;采用Image J分析NF-κB、ICAM-1及GLP-1R蛋白灰度值。

2 结果
2.1 尿白蛋白/肌酐、体质量和血清HbA1c水平 与对照组和利拉鲁肽组比较,模型组和观察组体质量减低、血清HbA1c水平及尿白蛋白/肌酐升高(P均<0.01),且观察组尿白蛋白/肌酐低于模型组(P<0.01)。见表1。
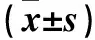
表1 各组尿白蛋白/肌酐、体质量和血清HbA1c水平比较
注:与对照组比较,*P<0.01;与利拉鲁肽组比较,△P<0.01;与模型组比较,#P<0.01。
2.2 血清TNF-α、1L-6、IL-1β水平 模型组血清TNF-α、1L-6、IL-1β水平均明显高于对照组和利拉鲁肽组(P均<0.05),观察组均明显低于模型组(P均<0.05)。见表2。
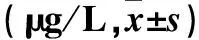
表2 各组血清TNF-α、1L-6、IL-1β水平比较
注:与对照组比较,*P<0.05;与利拉鲁肽组比较,△P<0.05;与模型组比较,#P<0.01。
2.3 肾组织形态改变 光镜下观察到对照组和利拉鲁肽组肾小球及肾小管大小正常、形态结构清晰,肾小管上皮细胞排列整齐,基底膜完整,肾小球及肾小管中银染颗粒较少;模型组肾小球体积增大,肾小球及肾小管细胞数目增多,可见肾小管上皮细胞变性,部分肾小管管腔轻度扩张、上皮细胞萎缩、毛细血管狭窄,部分甚至闭塞,肾小球和肾小管中可见大量银染颗粒;与模型组比较,观察组肾小管和肾小球损伤明显减轻,肾组织细胞数量下降,银染颗粒明显减少。见插页Ⅰ图2、3。
2.4 肾组织CD14表达 模型组肾组织CD14表达明显高于对照组、利拉鲁肽组(P均<0.01),观察组明显低于模型组(P<0.01)。见表3。
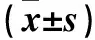
表3 各组肾小球和肾小管CD14表达比较
注:与对照组比较,*P<0.01;与利拉鲁肽组比较,△P<0.01;与模型组比较,#P<0.01。
2.5 肾组织NF-κB、ICAM-1及GLP-1R蛋白表达 与对照组和利拉鲁肽组比较,模型组肾组织NF-κB、ICAM-1蛋白相对表达量升高,GLP-1R蛋白相对表达量降低;与模型组比较,观察组肾组织NF-κB、ICAM-1蛋白相对表达量减低,GLP-1R蛋白相对表达量升高;组间比较P均<0.05。见表4。
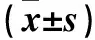
表4 各组肾组织NF-κB、ICAM-1及GLP-1R蛋白相对表达量比较
注:与对照组比较,*P<0.05;与利拉鲁肽组比较,△P<0.05;与模型组比较,#P<0.05。
3 讨论
早期DKD病理学改变主要为肾脏肥大、肾小管和肾小球基底膜增厚、系膜区为主的细胞外基质(ECM)进行性积聚,最终导致结节性或节段性肾小球硬化。高血糖作为糖尿病最基本的病因可直接损伤肾脏,也可通过炎症反应、细胞因子、晚期糖基化终末产物堆积等多种途径进一步促进DKD的发生、发展[8]。本研究结果显示,糖尿病大鼠血清HbA1c水平较对照组显著升高,体质量明显减轻,尿白蛋白及肌酐排泄增多;经过利拉鲁肽腹腔连续注射8周,尿蛋白及肌酐水平显著下降,但血清HbA1c及体质量无明显改变;此外,本研究HE及六胺银染色发现糖尿病大鼠肾小球体积增大、结构模糊,肾小球、肾小管细胞明显增多,毛细血管上皮细胞排列紊乱且肿胀,可见毛细血管管腔狭窄,基底膜显著增厚,肾小管呈空泡样变性,而观察组肾组织病理改变较模型组明显好转;提示利拉鲁肽对糖尿病大鼠肾组织损伤具有一定保护作用,且不依赖于血糖及体质量的降低。
近年研究表明,肾脏炎症反应在糖尿病肾病的发病过程中发挥重要作用,代谢及血流动力学紊乱等多种因素均可激活炎症反应[9,10]。炎性环境下ECM可由肾小球系膜细胞异常分泌增多,积聚在肾小球内,使肾毛细血管狭窄,甚至闭塞,进一步导致弥漫性或结节性肾小球硬化。巨噬细胞是糖尿病肾病中调节肾脏炎症反应的关键炎症细胞,其活化后可大量释放促纤维化因子、促炎因子等[11]。CD14主要分布于单核-巨噬细胞表面,可作为大鼠肾脏单核-巨噬细胞特异性标志物,通过与脂多糖结合蛋白特异性结合启动单核-巨噬细胞系统,释放多种细胞因子,导致系膜细胞合成ECM增加并使之在肾小球沉积,促进系膜扩张、基底膜增厚;同时CD14还促进足细胞凋亡,抑制ECM降解酶合成,从而促进肾小球硬化[12]。本研究结果显示,模型组肾组织CD14表达明显高于对照组,利拉鲁肽治疗后CD14表达被抑制,提示利拉鲁肽可能通过抑制炎症反应而发挥预防和治疗糖尿病肾病的作用。
已有研究证实,高血糖可直接刺激肾小球系膜细胞增生、分泌炎性介质、介导肾脏炎症损伤,还可以通过刺激单核-巨噬细胞、淋巴细胞等,使炎症因子、趋化因子、细胞黏附因子等表达增加,释放前炎症细胞因子如TNF-α、1L-6、IL-1β、趋化因子、致纤维化因子TGF-β等,进一步促进肾脏固有细胞炎症损伤,使NF-κB与其抑制蛋白I-κB解离进入到细胞中,从而正反馈促进炎症相关因子的表达,导致炎症反应的进一步扩大[13]。ICAM-1属于免疫球蛋白超家族成员,正常情况下呈低表达,高血糖刺激NF-κB活化后,与ICAM-1结合,并使其转录增加,刺激炎症细胞浸润并黏附于血管内皮,诱导血管内皮炎性损伤,导致肾间质纤维化及肾小球硬化[14]。Okada等[15]研究发现,ICAM-1基因敲除的db小鼠肾组织中巨噬细胞浸润减少、ECM积聚抑制,导致尿蛋白排出明显减低。本研究糖尿病大鼠肾脏细胞核中NF-κB明显增多,TNF-α、1L-6、IL-1β分泌增多;利拉鲁肽治疗后NF-κB表达减低,炎症相关因子分泌降低;说明利拉鲁肽可能通过抑制NF-κB表达减弱炎症反应而发挥肾脏保护作用。
综上所述,利拉鲁肽可抑制糖尿病大鼠肾损害;抑制NF-κB活化后介导的炎症反应、促进GLP-1R分泌可能是其作用机制。
[1] Yang SH, Dou KF, Song WJ. Prevalence of diabetes among men and women in China [J]. N Engl J Med, 2010,362(25):2425-2426.
[2] Ma RX, Zhao N, Zhang W. The effects and mechanism of Tripterygium wilfordii Hook F combination with irbesartan on urinary podocyte excretion in diabetic nephropathy patients[J]. Zhonghua Nei Ke Za Zhi, 2013,52(6):469-473.
[3] 蒋伟,刘丽秋.糖尿病肾病发病机制研究进展[J].山东医药,2008,48(10):107-108.
[4] Wada J, Makino H. Inflammation and the pathogenesis of diabetic nephropathy[J]. Clinical Science, 2013,124(3):139-152.
[5] Drucker DJ. The biology of incretin hormones[J]. Cell Metabolism, 2006,3(3):153-165.
[6] Park CW, Kim HW, Ko SH, et al. Long-term treatment of glucagon-like peptide-1 analog exendin-4 ameliorates diabetic nephropathy through improving metabolic anomalies in db/db mice [J]. J Am Soc Nephrol, 2007,18(4):1227-1238.
[7] Park J, Lai L, Samuel M, et al. Altered gene expression profiles in the brain, kidney, and lung of one-month-old cloned pigs[J]. Cell Reprogram, 2011,13(3):215-223.
[8] Ma R, Xu Y, Jiang W, et al. Combination of Tripterygium wilfordii Hook F and angiotensin receptor blocker synergistically reducesexcretion of urinary podocytes in patients with type 2 diabetic kidney disease[J]. Biotechnol Biotechnol Equip, 2015,29(1):139-146.
[9] 李建英,路文盛,颜晓东,等.老年早期糖尿病肾病患者血清炎症因子、外周血NF-κB活性变化及阿托伐他汀的治疗作用[J].山东医药,2011,51(17):7-9.
[10] Dalla Vestra M, Mussap M, Gallina P, et al. Acute-phase markers of inflammation and glomerular structure in patients with type 2 diabetes[J]. J Am Soc Nephrol, 2005,16Suppl (1):78-82.
[11] Moon JY, Jeong KH, Lee TW, et al. Aberrant recruitment and activation of T cells in diabetic nephropathy[J]. Am J Nephrol, 2012,35(2):164-174.
[12] 郑寿焕,金光明,柳明洙.CD14启动子-159位点基因多态性与糖尿病肾病的相关性研究 [J].中华内分泌代谢杂志,2009,25(4):409-411.
[13] Duran-Salgado MB, Rubio-Guerra AF. Diabetic nephropathy and inflammation[J]. World J Diabetes, 2014,5(3):393-398.
[14] Luis-Rodriquez-D, Martinez-Castelao A, Gorriz JL, et al. Pathophysiological role and therapeutic implications of inflammation in diabetic nephropathy[J]. World Diabetes, 2012,3(1):7-18.
[15] Okada S, Shikata K, Matsuda M, et al. Intercellular adhesion molecule-1 deficient mice are resistant against renal injury after induction of diabetes[J]. Diabetes, 2003,52(10):2586-2593.
国家自然科学基金资助项目(81200595/81400807);江苏省卫计委科研项目(H201253/H201554);江苏省六大人才高峰项目(WSN-101)。
张红(E-mail: zhh79318@163.com);李伟(E-mail: liwei.190@hotmail.com)
10.3969/j.issn.1002-266X.2016.44.008
R587.1
A
1002-266X(2016)44-0027-04
2016-03-02)
