TRPC6在结节性硬化症癫痫患者皮层脑组织中的表达
2017-01-03赵湧频余思逊刘伟民
赵湧频 余思逊 刘伟民
(1.贵阳市第一人民医院神经内科,贵州 贵阳 550002;2.成都军区总医院神经外科,四川 成都 610000 )
TRPC6在结节性硬化症癫痫患者皮层脑组织中的表达
赵湧频1余思逊2刘伟民1
(1.贵阳市第一人民医院神经内科,贵州 贵阳 550002;2.成都军区总医院神经外科,四川 成都 610000 )
目的 研究瞬时受体电位通道蛋白C6(TRPC6)在结节性硬化症(TSC)癫痫患者皮层脑组织的表达与分布,探讨TRPC6通道参与结节性硬化致痫的可能机制。方法收集手术切除并经病理检测证实是TSC癫痫患者的皮层脑组织标本18例,与7例正常对照皮层脑组织比较,通过采用Western blot、免疫组化、免疫荧光双标,检测TRPC6在正常脑组织与TSC病理标本中的表达分布情况。结果Western blot蛋白检测结果显示,在TSC和对照大脑皮质(CTX)TRPC6均在相应的分子量94KDa处有特异性蛋白条带,与CTX比较,TSC组TRPC6条带与内参GAPDH条带灰度值之比显著增高(P<0.05);免疫组化及免疫荧光双标结果显示,TRPC6在TSC病灶中免疫强度明显增高,且特异性高表达于皮层损伤区致痫灶中的异构神经元,包括特征性的巨形细胞(GCs)、异形神经元(DNs)。结论TRPC6在结节性硬化症患者致痫皮层脑组织中表达异常增高,特异性的细胞分布模式可能与癫痫发病密切相关。
瞬时受体电位通道蛋白C6; 结节性硬化症; 癫痫
结节性硬化症 (TSC)是由TSC1(蛋白产物为hamartin)或TSC2(蛋白产物为tuberin)基因突变所引起的常染色体显性遗传的多系统疾病,其临床主要表现为癫痫、智力低下和皮脂腺腺瘤(Vogt三联征)[1-2]。目前,TSC已成为儿童药物难治性癫痫的重要病因之一。TSC癫痫患者皮质病灶区的皮质结节是其脑损害最典型的病理性标志,临床电生理研究发现,在皮质结节出现的异形神经元(DNs)和巨形细胞(GCs)可能作为TSC病灶癫痫发作的起搏点[3-4],并有研究发现在TSC致痫病灶区的细胞中存在钙离子内流而引起的神经元电活动异常。传统型TRP通道(TRPC) 作为一类可调节细胞内钙浓度非特异性阳离子通道,目前其功能研究倍受关注[5-6]。TRPC6作为TRPC家族中的一个亚型,主要在哺乳动物的中枢神经系统表达[7],参与细胞膜受体激活磷脂酶C后所介导的钙离子内流。近年来有研究报道,TRPC6在难治性癫痫患者颞叶组织中表达上调,并推测TRPC6参与了颞叶难治性癫痫的发生,但TRPC通道在TSC癫痫患者的致痫皮层中的表达情况还未见报道。在本研究中,我们利用Western blot、免疫组化及免疫荧光双标检测TRPC6在结节性硬化患者病灶皮层脑组织中的表达分布情况,探讨其在癫痫发作中的可能作用。
1 资料与方法
1.1 标本来源及临床资料
收集2008年6月至2010年12月于第三军医大学新桥医院神经外科手术切除并经病理检测证实是TSC的脑组织皮层损伤区标本18例,其中男7例,女11例,年龄0.5~13岁,平均3.5岁。对照组正常脑组织皮层标本7例来源于2008年1月至2010年12月第三军医大学新桥医院神经外科进行尸检的患者,尸检平均年龄3.8岁。本实验经医院伦理委员会许可,获得使用人体组织的书面同意书,医疗记录仅用于研究目的。所有组织的获取与使用符合赫尔辛基申明的要求。将收集的病理标本中出血、电灼的组织除去,等渗盐水冲洗干净后一部分用甲醛溶液固定,石蜡包埋,所有载玻片经多聚赖氨酸包被处理以防脱片,连续切取约5.0 μm的切片备用。另一部分组织液氮速冻后存入-80 ℃冰箱,用于分子生物学实验。
1.2 试剂
兔抗人TRPC6多克隆抗体购自美国Abgent公司;小鼠抗人NeuN购自美国Millipol公司;DAPI、小鼠抗人波形蛋白(Vimentin)和小鼠抗人神经丝蛋白(NF200)购自武汉博士德公司;兔抗人GAPDH单克隆抗体购自美国Cell signal公司;Cy3标记小鼠抗人神经胶质酸性蛋白(GFAP)购自美国Sigma公司;CY5标记羊抗小鼠IgG购自上海碧云天公司;异硫氰酸荧光素(FITC)标记山羊抗兔IgG购自北京中杉公司;辣根过氧化物酶(HRP)标记羊抗兔IgG购自中杉公司;Hoechst-33258购自美国Sigma公司;羊抗兔SABC免疫组化试剂盒、DAB显色试剂盒及Western blot试剂盒购自武汉博士德公司。
1.3 实验方法
1.3.1 Western blot检测脑组织中TRPC6的表达 取对照组及病灶组脑组织各100 mg放入研磨器中,研磨至无肉眼可见碎片(冰上操作)。加入1 000 μL裂解液+10 μL蛋白酶抑制剂,继续研磨保证充分接触,吸取组织悬液至EP管中,冰上静置30 min,离心12 000×g,20 min, 4 ℃; 取上清测定蛋白浓度。将备好的样品按60 μg/道上样于10%聚丙烯酰胺凝胶(体积分数)电泳后转移至聚偏氟乙烯(PVDF)膜;5%脱脂牛奶(质量体积分数)室温封闭1 h,Tris-盐酸+吐温缓冲液(TBST)稀释的兔抗人TRPC6多克隆抗体(1∶600)和兔抗人GAPDH抗体(1∶1 000),4 ℃过夜;用TBST缓冲液稀释的辣根酶标记的山羊抗兔IgG(1∶3 000)孵育,室温1 h;TBST漂洗后,利用凝胶成像系统进行化学发光并记录(英国,SYNGENE公司,G:BOX凝胶成像系统)。扫描后采用Quantity One软件测定各条带(待测蛋白与内参蛋白GAPDH)的灰度值,比较二者的比值。
1.3.2 链霉亲和素—生物素—过氧化物酶复合物(SABC)法免疫组织化学实验检测脑组织中TRPC6的分布 石蜡切片常规脱蜡至水,3%双氧水(体积分数)+10%甲醛(体积分数)消除内源性过氧化物酶,微波抗原修复,中火,20 min。自然冷却后正常山羊血清+0.3% Triton X-100(体积分数)室温封闭1 h,加入抗体(TRPC6,1∶300)4 ℃过夜。室温复温1 h,0.01 mol/L PBS 漂洗3次,每次10 min。SABC试剂盒中山羊抗兔二抗,37 ℃孵育1 h,漂洗3次,加入SABC试剂,37 ℃孵育45 min。显色试剂为高敏感二氨基联苯胺(DAB)。苏木精复染细胞核,脱水透明封片,显微镜下观察。以上各步骤结束,均使用0.01 mol/L PBS冲洗。阴性对照取相同量的一抗稀释液代替TRPC3抗体,其余步骤同前。
1.3.3 免疫荧光双标记检测TRPC6的细胞定位 切片之前处理相同,兔抗TRPC6抗体(1∶300)分别与小鼠抗GFAP(1∶500)、小鼠抗NeuN(1∶100)、小鼠抗Vimentin(1∶50)、小鼠抗NF-200(1∶100)混合后加入切片,4 ℃冰箱孵育过夜。室温复温1 h,0.01 mol/L PBS 漂洗3次。CY5标记山羊抗小鼠IgG(1∶500)与FITC标记山羊抗兔IgG(1∶500)混合后加入,37 ℃孵育1 h。使用Hoechst-33258复染细胞核,避光晾干后使用抗荧光淬灭封片剂封片。使用激光共聚焦显微镜(Leica TCS-TIV,德国)扫描并拍照。
1.4 免疫染色结果评价
每个标本选取非连续的5张切片,×200镜下每张切片取5个不重叠的视野。异构神经元在镜下容易识别,只有核染色的异构神经元列入统计。免疫染色强度的分级标准:(—),阴性;(+),弱阳性;(++),中度阳性;(+++),强阳性。通过对所有目的视野染色情况平均后得出免疫强度评分,代表该切片整体染色的情况即蛋白表达情况。
1.5 统计学处理
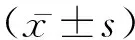
2 结 果
2.1 临床TSC标本病理结果分析
TSC结节典型的病理特征为皮质板层结构紊乱消失,出现异构神经元,包括:(1)DNs,神经元形状为多角形,极性异常紊乱,胞体尼氏染色致密聚集、神经丝丰富;(2)GCs,细胞体形巨大,卵圆形或椭圆形,HE 染色上成胞质呈均质的毛玻璃样,胞核形状怪异、偏心性分布,可有双核。见图1。

A:正常对照皮质(CTX);B:TSC皮质结节;C:TSC皮质结节中的DNs;D:TSC皮质结节中的GCs。A标尺:50 μm;C-D标尺:25 μm。图1 正常对照皮层、TSC皮质结节的HE染色
2.2 Western blot检测TRPC6的表达水平
Western blot检测结果显示,在TSC病理组织和正常脑组织中,在94KDa处均有特异性蛋白条带。TRPC6条带与内参GAPDH条带灰度值之比提示,TSC病理组织中TRPC6表达较正常组织增高(P<0.05)。见图2。

图2 Western blot检测TRPC6在TSC病理组织和正常脑组织中的表达
2.3 TRPC6在TSC结节中的细胞定位分布情况
2.3.1 免疫组化染色结果提示在TSC组及CTX皮层组织中,TRPC6的免疫反应物为棕褐色;在TSC结节中,TRPC6中或强度表达于DNs和GCs,且在异构神经元胞体的胞膜及胞质,神经元突起中均有表达,同时可见TRPC6少量表达于星形胶质细胞。18例结节性硬化症的平均染色强度为(2.33±0.16),7例正常对照大脑皮质平均染色强度为(1.12±0.13),P<0.05。见表1,图3。
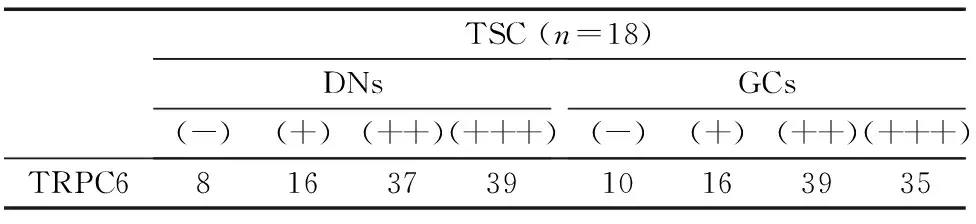
表1 TRPC6在TSC皮层结节中的表达/%
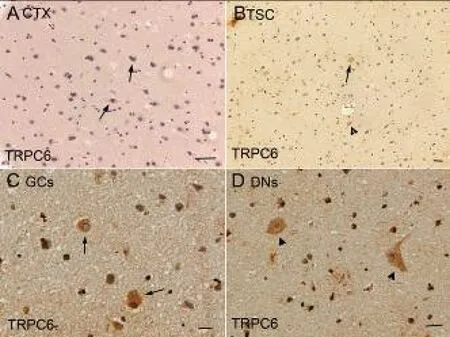
A:TRPC6在正常皮层脑组织中的表达,箭头所示为正常神经元(标尺25 μm);B:TRPC6在TSC病理皮层脑组织中的表达,箭头所示为GCs,三角所示为DNs(标尺25 μm); C:TRPC6在GCs上强表达(标尺20 μm);D:TRPC6在DNs上强表达(标尺10 μm)。图3 TRPC6在正常脑组织和TSC病理组织中的表达
2.3.2 免疫荧光双标结果表明,TRPC6阳性的MNs(包括GCs和DNs)与神经元标记物NeuN、NF-200均存在共表达,TRPC6表达阳性的胶质细胞与Vimentin共表达,但未观察到TRPC6表达阳性的DNs及GCs与胶质细胞标记物GFAP、Vimentin共表达。见图4。
3 讨 论
癫痫是多种病因引起的大脑神经元突发性异常放电,并导致短暂的大脑功能障碍的一种慢性疾病。从神经电生理角度看,癫痫发作指脑神经元异常和过度超同步化放电所造成的临床现象。临床常用抗癫痫药的主要作用靶点之一是针对选择性离子通道研发的,而对于非选择性离子通道的研究甚少。最近的研究[8]显示,非选择性阳离子通道的激活可使细胞膜持续去极化,参与簇状放电、突触传递和信号转导等多项生理功能。已有研究[9]指出,非选择性离子通道参与一些神经系统的疾病(如缺血性脑损伤、帕金森病等)的病理过程。
瞬时感受器电位(TRP)通道是位于细胞膜或胞内细胞器膜上的一类非选择性阳离子通道蛋白超家族,其中TRPC通道是TRP家族重要成员,包括TRPC1~7共7个亚型,其中TRPC2只表达于大鼠和小鼠,在人类是伪基因,TRPC通道在哺乳动物的中枢神经系统中广泛表达,主要通透钙离子、钠离子和镁离子。文献[10]显示,TRPC通道作为具有多种功能的细胞感受器,几乎参与机体各系统众多的基本生理过程,如参与受体介导的钙依赖性分泌、调节神经细胞的分化、影响血管收缩、参与淋巴细胞免疫反应、调节钠钙交换耦联、诱导神经元生长锥的方向、影响脑的发育、启动血小板聚集等。
近年来的研究显示,TRPC与BDNF的关系密切,Montell等[11]揭示了TRPC通道和脑源性神经营养因子(BDNF)存在上下游关系,BDNF/TRPC通路在中枢神经系统生理及病理过程中的作用正逐步引起人们的广泛重视。
目前的观念认为,神经元丢失、继发性神经发生(异常的神经细胞增殖与分化)、突触结构重塑及异常的突触传递是癫痫发生的主要病因学要素,据此,我们认为BDNF/TRPC通道的激活可能是TSC癫痫点燃过程的重要调控因素,主要依据:(1)Kim等[12]报道,BDNF受体TrkB高表达于FCD皮质致痫灶中的异构神经元,而通过本研究发现TSC与FCD具有相同的病理特征,即在皮质致痫灶中出现异构神经元,如DNs、GCs,并检测到TRPC6在TSC的致痫灶中表达上调,且特异性高表达于异构神经元(细胞膜、细胞质及突起均有表达),因此表明BDNF/TRPC通路具有发挥其生物学功能的形态学基础。(2)文献[13-14]显示,在哺乳动物发育的早期阶段即可在中枢神经系统内检测到BDNF、TRPC的表达,BDNF、TRPC可通过多种途径影响神经系统的发育过程。BDNF还可促进小脑颗粒细胞的迁移,通过激活TRPC通道调节神经元生长锥的生长方向。因此说明BDNF/TRPC通道具有影响神经系统发育、调节神经发生的功能学基础。(3)BDNF/TRPC通道的激活可影响神经网络的兴奋状态,促进突触结构的重塑。Amaral等[15]研究发现,在海马CA1锥体神经元上,BDNF通过TRPC的介导诱导产生内向型阳离子电流IBDNF以维持神经元处于去极化状态,并通过此机制促进树突棘数量的增加,重塑突触结构。文献[14]指出,TRPC6通道在兴奋性突触,特别是突触后大量表达,促进神经元树突棘密度增加。树突棘是神经元突起上的一种微小结构,是形成兴奋性突触的重点位点。研究者发现,TRPC6通道的激活可促进兴奋性突触的形成,提高小鼠空间学习和记忆力。(4)BDNF/TRPC通道可调节神经递质的分泌,影响突触的传递。BDNF通过激活TRPC引起细胞内钙离子浓度增高,继而激发钙依赖性分泌活动的发生。另一方面,一些兴奋性神经递质如谷氨酸,可直接诱导神经元分泌BDNF的分泌,BDNF作用于突触后膜的TrkB受体进而激活胞内钙库的释放及TRPC通道的激活,进一步促进神经元分泌兴奋性神经递质,从而引起整个神经网络的同步兴奋。
在本研究中,我们利用Western blot、免疫组化及免疫荧光双标实验检测到TRPC6在结节性硬化症癫痫患者病灶皮层脑组织中表达上调,并特异性高表达于异构神经元(可表达在异构神经元的胞膜、胞质及突起)。因此,结合上述科学研究证据和本次研究的结果,我们大胆推测TRPC通道的异常表达及特异性的分布模式参与了TSC的致痫机制。
[1] Chu-Shore CJ,Major P,Camposano S, et al. The natural history of epilepsy in tuberous sclerosis complex[J]. Epilepsia,2010,51(7):1236-1241.
[2] Curatolo P,Bombardieri R, Jozwiak S. Tuberous sclerosis[J].Handb Clin Neurol,2008,87:129-151.
[3] Montell C,Rubin GM. Molecular characterization of the Drosophila trp locus:a putative integral membrane protein required for phototransduction[J].Neuron,1989,2(4):1313-1323.
[4] Hardie RC,Minke B.The trp gene is essential for a light-activated Ca2+channel in Drosophila photoreceptors[J].Neuron,1992,8(4):643-651.
[5] Gallagher A,Chu-Shore CJ,Montenegro MA,et al.Associations between electroencephalographic and magnetic resonance imaging findings in tuberous sclerosis complex[J]. Epilepsy Res,2009,87(2-3): 197-202.
[6] Ramsey IS,Delling M,Claphamde.An introduction to TRP channels[J].Annu Rev physiol,2006,68:619-647.
[7] Corey DP.New TRP channels in hearing and mechanosensation[J].Neuron,2003,39(4):585-588.
[8] Pena F, Ordaz B.Non-selective cation channel blockers: potential use in nervous system basic research and therapeutics[J]. Mini Rev Med Chem,2008, 8(8):812-819.
[9] Simard JM, Chen M, Tarasov KV, et al.Newly expressed SUR1-regulated NC(Ca-ATP) channel mediates cerebral edema after ischemic stroke[J].Nat Med,2006,12(4):433-440.
[10] Ramsey IS,Delling M,Clapham DE.An introduction to TRP channels[J].Annu Rev Physiolo,2006,68:619-647.
[11] Montell C, Bimbaumer L, Flockerzi V. The TRP channels, a remarkably functional family[J]. Cell, 2002, 108(5): 595-598.
[12] Kim JY,Roh JK,Lee SK,et al.Neurotrophin receptor immunoreactivity in severe cerebral cirtical dyplasia[J].Epilepsia,2002,43(Suppl 5):220-226.
[13] Bartkowska K,Turlejski K,Djavadian RL.Neurotrophins and their receptors in early development of the mammalian nervous system[J].Acta Neurobiol xp(Wars),2010,70(4):454-467.
[14] Zhou J,Du W,Zhou K,et al.Critical role of TRPC6 channels in the formation of excitatory synapses[J].Nat Neurosci,2008,11(7):741-743.
[15] Amaral MD,Pozzo-Miller L.TRPC3 channels are necessary for brain-derived neurtrophic factor to activate a nonselective cationic current and to induce dendritic spine formation[J].J Neurosci,2007,27(19):5179-5189.
Expression of TRPC6 in the cortical focus of patients with epilepsy from tuberous sclerosis complex
ZhaoYongpin1,YuSixun2,LiuWeimin1.
1.DepartmentofNeurology,TheFirstPeople'sHospital,Guiyang550002,Guizhou,China. 2.DepartmentofNeurosurgery,GeneralHospitalofChengduMilitaryRegion,Chengdu610000,Sichuan,China.
Objective To detect the expression of TRPC6 in the cortical lesions of patients with epilepsy from tuberous sclerosis complex. Methods 18 clinical cases of TSC and 7 cases of non-epileptic brain tissues were enrolled in our study, and the expression pattern of TRPC6 was observed by immunohistochemistry and western blot (WB) analysis. Results WB analysis result was showed that TRPC6 expression tended to be higher in TSC compared with CTX immunohistochemistry and immune fluorescent double labeling analysis showed that immune strength of TRPC6 tended to be higher in TSC compared with CTX and TRPC6 was moderate-strong expressed in misshapen cells, including dysmorphic neurons (DNs) and giant cells (GCs).Conclusion The increased expression of TRPC6 in epileptic cortex might be closely involved in the pathogenesis of intractable epilepsy.
TRPC6; Tuberous sclerosis complex; Epilepsy
R742.1
A
1000-744X(2016)10-1036-04
2016-02-29)
