程序性死亡配体-1与白细胞介素-10在喉鳞状细胞癌中的表达及意义
2017-01-03叶惠平梁文卿李芊芊张安琪吴哲丹喻国冻
叶惠平 梁文卿 李芊芊 张安琪 吴哲丹 喻国冻
(贵州医科大学附属医院耳鼻喉科,贵州 贵阳 550004)
程序性死亡配体-1与白细胞介素-10在喉鳞状细胞癌中的表达及意义
叶惠平 梁文卿 李芊芊 张安琪 吴哲丹 喻国冻
(贵州医科大学附属医院耳鼻喉科,贵州 贵阳 550004)
目的 通过检测程序性死亡配体-1(PD-L1)和白细胞介素-10(IL-10)在喉鳞状细胞癌中的表达情况,分析与喉鳞癌的肿瘤部位、病理分级、TNM分期、淋巴结转移等之间的关系。方法应用免疫组化二步法检测30例喉鳞状细胞癌组织(观察组)和15例癌旁正常组织(对照组)中PD-L1及IL-10的表达情况,分析二者与喉鳞状细胞癌临床病理参数的关系及二者表达的相关性。结果(1)PD-L1在喉鳞状细胞癌组织(56.67%)中的表达明显高于癌旁正常组织(13.33%);喉鳞状细胞癌组织中PD-L1的阳性表达与病理分级、临床分期(TNM分期)、T分期、肿瘤局部淋巴结转移有关(P<0.05),与肿瘤分区、患者年龄无明显相关性。(2)IL-10在喉鳞状细胞癌组织(63.33%)中的表达明显高于癌旁正常组织(20.00%);喉鳞状细胞癌组织中IL-10的阳性表达与TNM分期、T分期、肿瘤局部淋巴结转移有关(P<0.05),与病理分级、肿瘤分区、患者年龄无明显相关性。(3)喉鳞状细胞癌组织中PD-L1、IL-10的表达呈正相关(r=0.522,P<0.05)。结论(1)PD-L1与IL-10的高表达可能与喉鳞状细胞癌的发病相关,两者参与了肿瘤的发展及转移;(2)免疫卡控点的调控和抑制性细胞因子与肿瘤的免疫逃逸密切相关,PD-L1与IL-10在喉鳞状细胞癌中的表达呈正相关,两者可能协同参与喉鳞状细胞癌的免疫逃逸;(3)联合检测PD-L1与IL-10在喉鳞状细胞癌组织中的表达对喉鳞癌的临床评估有一定价值;为喉鳞癌的免疫治疗提供理论支持。
程序性死亡配体-1; 白细胞介素-10; 喉鳞状细胞癌
喉癌为耳鼻咽喉头颈外科常见恶性肿瘤,发病率约占全身恶性肿瘤的1%~5%,近年来喉癌的发病有明显升高及年轻化趋势[1]。晚期喉癌由于浸润和转移,治疗效果较差,其5年生存率约在60%以下[2]。近十年来免疫卡控点的研究,通过调控机体T细胞的免疫治疗,使转移性恶性肿瘤的治疗获得重大突破[3]。本研究以PD-L1及IL-10为对象,探讨相关免疫指标在喉鳞状细胞癌组织中的表达以及与喉鳞状细胞癌患者临床病理特征的相关性研究,为喉鳞状细胞癌的免疫治疗提供理论依据和思路。
1 资料与方法
1.1 组织标本 选取贵州医科大学附属医院耳鼻咽喉头颈外科2014年11月至2015年11月,经手术活检后病理确诊为喉鳞状细胞癌标本,且术前均未行其它治疗。男29例,女1例,年龄46~76岁,平均(62.17±11.18)岁。声门上型9例,声门型16例,声门下型2例,贯声门型3例。低分化1例,中分化17例,高分化12例。同时记录患者TNM分期和淋巴结转移情况。喉癌组织和癌旁正常黏膜置于10%中性缓冲福尔马林固定,包埋及免疫组化检测。
1.2 试剂与方法 兔抗人PD-L1单克隆抗体(ZA-0629)及免疫组化试剂盒(PV-6001)购自北京中杉金桥生物技术有限公司;兔抗人IL-10多克隆抗体(bS-0698)购自北京博奥森生物技术有限公司。本实验采用非生物素二步法。
1.3 结果判断 PD-L1和IL-10染色标准:本实验观察到PD-Ll及IL-10阳性染色主要定位于细胞膜及细胞质内。在400倍光学显微镜下随机选择5个无重复视野进行细胞计数,计算阳性细胞的比例,取其平均值。阳性细胞的百分比分级标准:阳性细胞≤10%为阴性(-),阳性细胞数≤30%为弱阳性(+),阳性细胞数≤60%为阳性(++),阳性细胞数>60%为强阳性(+++)。统计时将(+ ) ~(+++)均作为表达阳性。
1.4 统计学处理 采用SPSS 20.0统计软件,组间差异比较用χ2检验,PD-L1与IL-10表达的相关性分析采用非参数Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PD-L1、IL-10在喉鳞状细胞癌组织和癌旁正常组织中表达 PD-L1阳性显色表现呈棕黄色或棕褐色着色,喉鳞状细胞癌组织中细胞膜和胞质中棕黄色颗粒大量聚集,肿瘤细胞着色明显(图1a),在部分正常组织中,亦发现PD-L1低表达,着色较浅,散在分布(图1b);IL-10阳性显色为棕黄色或棕褐色(图2a),主要表达于细胞质及细胞膜,以细胞质表达为主(图2b)。喉鳞状细胞癌组织中PD-L1、IL-10的阳性表达率分别为56.67%(17/30)、63.33%(19/30),显著高于PD-L1、IL-10在正常组织中的表达(P<0.05)。
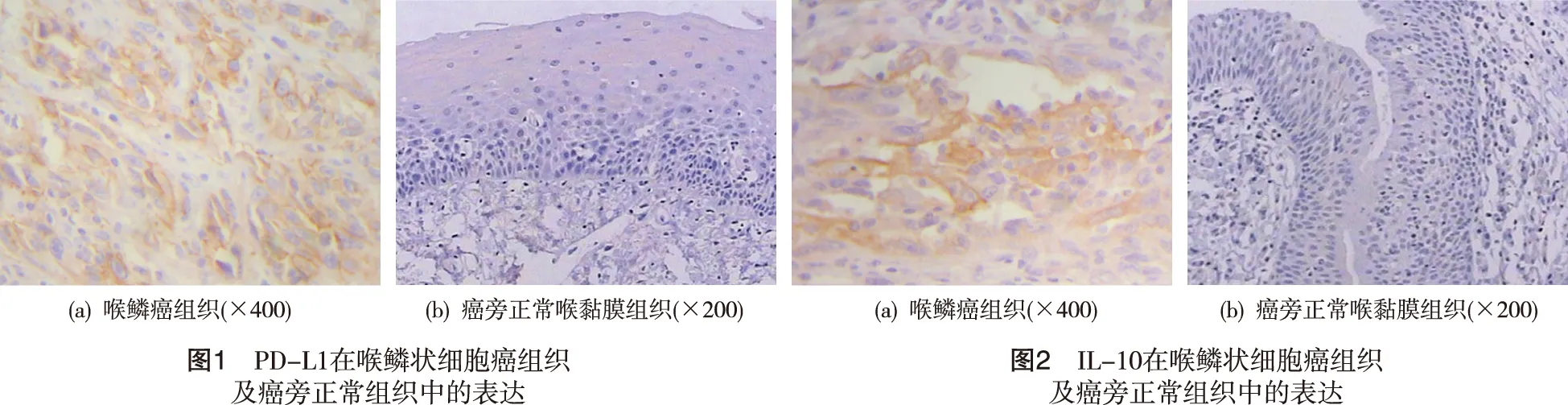
2.2 PD-L1和IL-10在喉鳞状细胞癌组织中的表达及其与临床病理特征的关系 喉鳞状细胞癌组织中PD-L1的阳性表达与病理分级、TNM分期、T分期、局部淋巴结转移有关(P<0.05),PD-L1在中低分化喉鳞癌组和Ⅲ、Ⅳ期患者组及T3、T4期患者组的阳性表达率显著高于临床分期早期患者组;局部淋巴结转移组PD-L1的阳性表达率87.50%明显高于无淋巴结转移组45.45%。喉鳞状细胞癌组织中IL-10阳性表达与TNM分期、T分期、局部淋巴结转移有关(P<0.05);IL-10在Ⅲ、Ⅳ期患者组、T3、T4期患者组、局部淋巴结转移组中的阳性表达率分别为75.00%、 73.68%、 100.00%,但与病理分级、肿瘤分区、患者年龄无明显相关性。
2.3 PD-L1和IL-10在喉鳞状细胞癌组织中表达的相关性分析 PD-L1与IL-10在喉鳞状细胞癌组织中的表达相关性检验采用Spearman秩相关分析,二者表达呈正相关,即随着PD-L1表达增加,IL-10高表达所占的比例升高(rs=0.522,P<0.05)。
3 讨 论
免疫卡控点的调控受到双向机制调节[4],在T细胞与APC(抗原呈递细胞)之间存在大量的配体受体结合的调控模式。这些细胞表面存在的受体和配体结合后,部分产生协调刺激信号,也有传递抑制信息。正常情况下,T细胞一旦出现活化,抑制信息往往会出现上调,避免对机体的过度攻击。负调控途径包括CTLA-4和CD80或CD60、PD-1和PDL-1、ICOS。其中程序性死亡受体-1,其最初是从凋亡的小鼠T细胞杂交瘤2B4.11克隆出来的[5]。PD-1可与其内源性配体PD-L1(B7-H1)或PD-L2(B7-DC)结合。研究[6-7]表明肿瘤微环境中呈现高度免疫抑制的状态,且已在乳腺癌、前列腺癌、卵巢癌、黑色素瘤等多种癌症的肿瘤浸润性淋巴细胞(TILs)中发现了PD-1的高表达,且PD-1的高表达与肿瘤的分级、大小、淋巴结转移、远处转移等有相关性,说明PD-1在肿瘤发生中具有重要作用,在多种肿瘤细胞中发现了PD-L1的高表达[8]。
本研究通过免疫组织化学染色显示PD-L1在喉鳞状细胞癌组织中主要表达于肿瘤细胞质中,PD-L1在喉鳞状细胞癌组织中的表达明显高于正常组织(P<0.05),我们推测在喉鳞状细胞癌微环境中,PD-L1分子与受体PD-1分子介导的信号通路是介导喉鳞状细胞癌免疫逃逸的重要信号分子。PD-L1在喉鳞状细胞癌组织中异常高表达,与病理分级、TNM分期、T分期、肿瘤局部淋巴结转移相关(P<0.05)。PD-L1在中低分化喉鳞癌中的阳性表达高于高分化癌组织,随着更晚期的肿瘤分期和淋巴结转移而增加,说明PD-L1在喉鳞癌细胞中的表达变化是构成喉鳞癌细胞微环境的非常重要的因素,伴随着喉鳞状细胞癌发病、恶性发展及转移的整个病程。
IL-10是肿瘤发生发展过程中一种重要的免疫抑制因子。肿瘤细胞自身也可分泌大量IL-10。IL-10主要通过以下几方面参与抑制机体抗肿瘤免疫反应:一方面,IL-10抑制Th1分化和细胞因子的合成。机体的抗肿瘤免疫主要通过Th1亚群介导的细胞免疫来完成,IL-10通过抑制抗原提呈细胞表面MHC-Ⅱ类分子和协同刺激分子CD80和CD86的表达,从而抑制抗原提呈给T细胞的过程,间接实现对Th1细胞的抑制;同时,IL-10抑制树突细胞产生Th1细胞分化所必需的细胞因子IL-12来抑制Th1的分化。另一方面,IL-10可以抑制CTL的增殖和细胞毒作用[9]。活化的CTL的主要作用是作为免疫效应分子诱导肿瘤细胞的凋亡,IL-10通过抑制Th1细胞和单核/巨噬细胞产生的细胞因子,从而抑制CTL的活化和分化;IL-10还可以抑制肿瘤细胞表面MHC-Ⅰ类抗原的表达,从而影响CTL对肿瘤抗原的识别,使肿瘤细胞逃避CTL的杀伤作用[10]。
本研究通过免疫组织化学方法检测到IL-10在喉鳞状细胞癌组织中的表达明显高于其在正常组织中的表达,且IL-10的阳性表达与TNM分期、T分期、肿瘤局部淋巴结转移有关(P<0.05),在更晚期肿瘤分期及有淋巴结浸润的喉鳞癌组织中更易检测到,这表明IL-10在喉鳞状细胞癌发生、发展及转移中起作用。Dulos等[11]发现PD-1能够抑制CD4+T细胞向Th1亚群分化,而促进其向Th2亚群分化。文献[12-13]发现,PD-L1能够增强Treg的功能,并且促进Treg产生IL-10。结合本研究结果,喉鳞状细胞癌组织中PD-L1与IL-10的表达呈正相关(P<0.05),两者可能共同参与喉鳞状细胞癌免疫逃避过程。
我们研究发现PD-L1与IL-10的高表达可能与喉鳞状细胞癌的发病相关,促进了肿瘤的恶性发展及颈部淋巴结转移。免疫卡控点的调控和免疫抑制因子与肿瘤的免疫逃逸密切相关,PD-L1与IL-10在喉鳞状细胞癌中的表达呈正相关,可能协同参与喉鳞状细胞癌的免疫逃逸,为喉癌的免疫治疗提供理论依据,调控喉鳞癌组织中的上述靶点,有望成为控制喉鳞状细胞癌恶性发展、淋巴结转移及复发的新途径。
[1] Hoffman H T,Karnell L H,Funk G F,et al.The National Cancer Data Base report on cancer of the head and neck[J].Archives of otolaryngology-head & neck surgery,1998,124(9):951-962.
[2] Spector G J,Sessions D G,Jason Lenox M S,et al.Management of stage IV glottic carcinoma:therapeutic outcomes[J].Laryngoscope,2004,114(8):1438-1446.
[3] Callahan MK,Postow MA,Wolchok JD.Immunomodulatory therapy for melanoma:ipilimumab and beyond[J].Clin Dermatol,2013,31:191-199.
[4] Zou W C,Inhibitory L.B7-family molecules in the tumour microenvironment[J].Nature Rev Immunol,2008,8:447-467.
[5] Ishida Y,Agata Y,Shibahara K,et al.Induced expression of PD-1,a novel member of the immunoglobulin gene superfamily,upon programmed cell death[J].The EMBO Journal,1992,11(11):3887-3895.
[6] Lauerova L,Dusek L,Simickova M I,et al.Malignant melanoma associates with Th1/Th2 imbalance that coincides with disease progression and immunotherapy response[J].Neoplasma,2002,49(3):159-166.
[7] Mirjana U,Joerg W,Beatrix M,et al.HLA-G protein up-regulation in primary cutaneous lymphomas is associated with interleukin-10 expression in large cell T-cell lymphomas and indolent B-cell lymphomas.[J].Blood,2002,2(3):179-197.
[8] Sheu B C,Lin R H,Lien H C,et al.Predominant Th2/Tc2 polarity of tumor-infiltrating lymphocytes in human cervical cancer.[J].Journal of Immunology,2001,167(5):2972-2978.
[9] Sharma S,Stolina M,Lin Y,et al.T cell-derived IL-10 promotes lung cancer growth by suppressing both T cell and APC function.[J].Journal of Immunology,1999,163(9):5020-5028.
[10] Petersson M,Charo J,Salazar-Onfray F,et al.Constitutive IL-10 production accounts for the high NK sensitivity,low MHC class I expression,and poor transporter associated with antigen processing (TAP)-1/2 function in the prototype NK target YAC-1[J].Journal of Immunology,1998,161(5):2099-2105.
[11] Dulos J,Carven G J,VanBoxtel S J,et al.PD-1 blockade augments Th1 and Th17 and suppresses Th2 responses in peripheral blood from patients with prostate and advanced melanoma cancer[J].Journal of Immunotherapy,2012,35(2):169-178.
[12] Qing D,Liming L,Xiaorong Z,et al.Human PD-L1-overexpressing porcine vascular endothelial cells induce functionally suppressive human CD4+CD25hiFoxp3+Treg cells[J].Journal of Leukocyte Biology,2011,90(1):77-86.
[13] Seung-Pil S,Hye-Hyun S,Jae-Hun S,et al.Adenovirus expressing both thymidine kinase and soluble PD1 enhances antitumor immunity by strengthening CD8 T-cell response[J].Molecular Therapy the Journal of the American Society of Gene Therapy,2013,21(3):688-695.
Expression and Role of Programmed death-1 ligand and Interleukin-10 in Laryngeal Squamous Cell Carcinomas
YeHuiping,LiangWenqing,LiQianqian,ZhangAnqi,WuZhedan,Yuguodong.
DepartmentofEar-Nose-Throat,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China.
Objective To identify the relationship between the expression of programmed death-1 ligand (PD-L1) and interleukin-10 (IL-10) and the tumorous division, clinical stage, pathological grade and lymph node metastasis of LSCC.Methods The expression of PD-L1 and IL-10 were detected by two-step immunohistochemistry in thirty cases of LSCC tissues (experiment group) and fifteen cases of para-carcinoma tissues (control group), the correlation between them and their correlations with the clinicopathological parameters were analyzed. Results The levels of PD-L1 positive expression in LSCC tissue (56.67%) were significantly higher than that of histologically normal tissue (13.33%). In the LSCC tissues, the expression of PD-L1 was significantly associated with the pathological grade, T stage, TNM stage of LSCC and lymph node metastasis (P<0.05), but no association was observed with tumor sites and age of patients. The levels of IL-10 expression in LSCC tissue (63.33%) were significantly higher than that of histologically normal tissue (20.00%). In the LSCC tissues, the expression of PD-L1 was significantly associated with the T stage, TNM stage of LSCC and lymph node metastasis (P<0.05), but no association was observed with pathological grade, tumor sites and age of patients. The expression of PD-L1 pro-correlated with IL-10 in the LSCC tissues (r=0.522,P<0.05). Conclusion The high expression of PD-L1 and IL-10 may be closely related to the occurrence, development and metastasis of LSCC. The expression of PD-L1 pro-correlated with IL-10 in the LSCC tissues, they may be interactive with each other in the immune escape of LSCC together. Inhibition of their expression in LSCC might be a new treatment to LSCC.
Programmed death-1 ligand; Interleukin-10; Laryngeal squamous cell carcinomas
贵州省科技厅联合基金项目资助(LG-2012-068);贵州医科大学附属医院博士启动基金资助
R739.65
A
1000-744X(2016)10-1019-03
2016-06-23)
