基于癌症基因组图谱筛查卵巢浆液性囊腺癌相关基因*
2017-01-03李典鹤黄昌男
李典鹤, 黄昌男, 李 奇
(1东北师范大学医院内科,吉林 长春 130024; 2首都医科大学附属北京天坛医院临床医学研究实验室,北京 100050)
·短篇论著·
基于癌症基因组图谱筛查卵巢浆液性囊腺癌相关基因*
李典鹤1, 黄昌男1, 李 奇2△
(1东北师范大学医院内科,吉林 长春 130024;2首都医科大学附属北京天坛医院临床医学研究实验室,北京 100050)
目的: 利用全基因组表达谱芯片筛查与卵巢浆液性囊腺癌发生相关的基因,对在卵巢浆液性囊腺癌发生过程中可能参与的基因间的信号转导通路进行分析。方法:选取癌症基因组图谱(TCGA)数据库中卵巢浆液性囊腺癌的Affymetrix GeneChip Human Exon 1.0 ST Array数据共16张,分别为卵巢浆液性囊腺癌组8张和正常组8张,筛选出差异表达基因,并进行基因本体(gene ontology, GO)分析和信号通路分析,构建卵巢浆液性囊腺癌相关基因间的信号转导通路,分析网络中具有重要作用的基因。结果:共筛选出1 144个在卵巢癌中差异表达的基因,其中表达上调的基因有747个,表达下调的基因有397个。GO分析得到上调差异基因的显著性功能分析结果362项,下调差异基因的显著性功能分析结果160项(P<0.05)。其中包括与肿瘤发生相关的基因功能有细胞周期、DNA复制、细胞增殖、细胞凋亡、细胞黏附等。信号通路分析得到45个显著上调信号通路和14个显著下调信号通路(P<0.05)。其中参与肿瘤发生相关的信号通路主要有细胞周期、P53信号通路、DNA复制、肿瘤中的信号通路、PI3K-Akt信号通路、ECM-receptor 信号通路、细胞黏附因子、细胞凋亡等。挑选显著性基因功能和信号通路分析的交集基因229个,构建显著性GO与信号通路基因间信号转导网络。分析发现CDK1、PLK1、MCM3和PGK1这4个基因在卵巢癌的基因调控网络中具有重要作用。结论:卵巢浆液性囊腺癌中有大量差异表达基因,差异表达的基因在多个与肿瘤发生密切相关的信号通路中发挥重要的调控作用。
卵巢浆液性囊腺癌; 基因芯片; 差异表达; 基因功能; 信号通路
卵巢癌的发病率仅次于子宫颈癌和子宫内膜癌,是女性生殖系统致死率最高的恶性肿瘤,占所有因癌症死亡女性患者的3%。卵巢癌的特点是起病隐匿,约85%患者首次诊断多为晚期,易播散转移,术后易复发和易产生化疗耐药等。随着手术和化疗水平的提高,卵巢癌患者的生存率虽然得到了改善,但总体预后仍然不好,在晚期患者中5年生存率还不足30%,而早期患者的5年生存率为90%左右,可见卵巢癌的早期诊断至关重要[1]。虽然大量的研究试图阐述和解释卵巢癌患者致病的具体原因,但卵巢癌发生、发展及转移的分子生物学机制目前仍不清楚。因此,深入研究卵巢癌的发病机制,阐明卵巢癌细胞侵袭和转移的分子机制,具有重要的临床应用价值[2-3]。
卵巢癌分为浆液性囊腺癌、黏液性囊腺癌和恶性宫内膜样癌3种类型。其中浆液性囊腺癌是最常见的卵巢恶性肿瘤,占卵巢癌的40%~60%。本研究采用基因芯片技术,筛查卵巢浆液性囊腺癌组织中差异表达的基因,为探寻新的有效的卵巢癌诊断、治疗和预后监测的分子标志物和治疗靶点,提供研究基础。
材 料 和 方 法
1 材料
癌症基因组图谱(The Cancer Genome Atlas,TCGA)计划数据库中卵巢浆液性囊腺癌的Affymetrix GeneChip Human Exon 1.0 ST Array芯片数据共16张,分别为卵巢浆液性囊腺癌组8张和正常卵巢组8张。该芯片可以检测20 000个基因,比较完整地覆盖了人全基因组表达谱。
2 主要方法
2.1 差异基因的筛选 将肿瘤组数据与正常组数据进行比较,每组8张表达谱芯片,筛选差异基因。采用适合小样本数据(小于30),利用随机方差模型(random variance model,RVM)修正的t检验,对卵巢浆液性囊腺癌和正常组表达谱芯片数据进行比较,计算基因间的显著性水平(Pvalue)和误判率(false dicovery rate, FDR)。按照:(1)P<0.05;(2)上调或下调倍数(fold change)≥2或≤0.5进行筛选,得到差异基因。
2.2 基因功能的显著性分析(GO analysis) 基因本体(gene ontology, GO)是基因功能国际标准分类体系。根据实验目的筛选差异基因后,研究差异基因在GO中的分布状况,将阐明实验中样本差异在基因功能上的体现。GO analysis对差异基因等按GO分类,并对分类结果进行基于离散分布的显著性分析、误判率分析、富集度分析,得出与实验目的有显著联系的、低误判率的、靶向性的基因功能分类,该分类即导致样本性状差异的最重要的功能差别。通过该分析有可能找到导致性状变化的重要功能,并且找到该功能所对应的基因。
2.3 信号通路的显著性分析(pathway analysis) 细胞信号通路是多个蛋白质间相互作用,共同调节细胞功能和代谢活动的过程。Pathway analysis是通过对差异基因按照信号通路的主要公共数据库KEGG和GenMap来进行分类,对信号通路中的基因进行基于离散分布的显著性分析,得到与实验目的有显著联系的信号通路分类。该分类即导致样本差异的最重要信号通路。
2.4 基因间的信号转导通路(Signal-Net) 利用数据库KEGG中的信号传递通路以及基因之间的作用关系,取差异基因,构建基因间的信号转导网络,通过信号转导网络得到基因间的一个相互作用关系,并从网络中筛选出网络的关键节点基因,正是这关键的节点基因的差异表达,导致其下游基因的差异表达,及信号传递的通路的改变,从而表现出相应的样本状态。
结 果
1 卵巢浆液性囊腺癌中差异表达基因的筛选
将肿瘤组与正常组芯片分析数据进行比较,筛选差异基因,共筛选出1 144个在卵巢浆液性囊腺癌中差异表达的基因,其中表达上调的基因有747个,表达下调的基因有397个。卵巢浆液性囊腺癌中表达上调10倍以上的基因,及表达下调10倍以上的基因如表1、2所示。
根据芯片数据分析的差异表达结果,分别对差异基因进行聚类分析,得到差异基因的聚类分析图(图1)。差异表达的基因以不同颜色划分,红色表示肿瘤组与正常组比较,基因表达上调,绿色表示基因表达下调。依据mRNA的表达情况,16例标本被分为2组,前8列为卵巢浆液性囊腺癌组,后8列为正常卵巢对照组,与卵巢浆液性囊腺癌组织和正常卵巢组织的分类一致,说明差异表达的mRNA具有肿瘤组织特异性。横行被分成2大类,根据每一基因分别在卵巢浆液性囊腺癌和正常卵巢组织的表达水平,表达差异显著的基因,被归为上调基因和下调基因。由聚类分析图可见红色和绿色形成显著的4大块,肿瘤组和正常组形成了明显的聚类群,层次聚类分析显示,组内数据关系接近,基因表达存在着明显不同的聚类。
表1 卵巢浆液性囊腺癌中表达上调大于10倍的基因
Table 1.The up-regulated genes (fold change>10) in ovarian serous cystadenocarcinoma

No.GenesymbolGenBank_IDFoldchange(C/N)1CXCL10NM_00609526.122MT1GNM_01494021.813PBKNM_00114246218.494DEPDC1NM_03340718.115CXCL11NM_19835316.806KIAA0101NM_00609114.707CCNB2NM_14517113.958CDK1NM_00116457913.789HIST1H3CNM_03364513.4110CTCFLNM_00627512.9211CHEK1NM_00512512.9112TOP2ANM_00116634712.6313TPX2NM_00278411.3914HIST1H3INM_03364511.1215HIST1H3BNM_15227710.9416DLGAP5NM_01498210.81
2 构建卵巢浆液性囊腺癌相关基因之间的信号转导网络
根据筛选出在卵巢浆液性囊腺癌差异表达的基因,构建相关基因之间的信号转导网络,网络构建的方法和步骤如图2所示。
首先,将卵巢浆液性囊腺癌和正常卵巢组之间的差异表达基因,基于GO数据库进行基因功能注释,分析差异基因所体现的显著性功能。按照显著性筛选的标准P<0.05,得到上调差异基因具有362个显著性功能,下调差异基因具有160个显著性功能。其中包括与肿瘤发生相关的基因功能有细胞周期、DNA复制、细胞增殖、细胞凋亡、细胞黏附等。
其次,基于KEGG数据库,对卵巢浆液性囊腺癌和正常卵巢组之间的差异基因参与的信号通路进行分析,按照P<0.05进行筛选,得到45个显著性的上调信号通路和14个显著性的下调信号通路。其中参与肿瘤发生相关的信号通路主要有:细胞周期、P53信号通路、DNA复制、肿瘤中的信号通路、PI3K-Akt信号通路、ECM-receptor 信号通路、细胞黏附因子、细胞凋亡等。
表2 卵巢浆液性囊腺癌中表达下调大于10倍的基因
Table 2.The down-regulated genes (fold change<0.1) in ova-rian serous cystadenocarcinoma

No.GenesymbolGenBank_IDFoldchange(C/N)1CRISP3NM_0060610.00722OVGP1NM_0025570.0263FAM216BNM_1825080.0314MS4A8BNM_0314570.0345MORN5NM_1984690.0496EFCAB1NM_0245930.0567PGRNM_0009260.0568C6NM_0000650.0579LRRC46NM_0334130.05710TPPP3NM_0161400.05711RSPH1NM_0808600.06212TEKT1NM_0532850.06413CDHR3NM_1527500.06514DNAH9NM_0013720.06515DYNLRB2NM_1308970.06516SPAG6NM_0124430.06517ENKURNM_1450100.06918STOML3NM_1452860.06919AKAP14NM_1788130.07120WDR16NM_1450540.07521KIAA1324NM_0207750.07522KCNRGNM_1994640.07623FAM81BNM_1525480.07824TUBA4BNM_0060000.07925SPATA18NM_1452630.08126ZNF295-AS1NM_0010984020.08127CCL21NM_0029890.08228TSPAN8NM_0046160.08429NDE1NM_0176680.08530ZCCHC12NM_1737980.08631CCL15NM_0329620.08732SERPINA6NM_0017560.09233CAPSLNM_1446470.09434NELL2NM_0011451080.096
然后,根据基因功能与基因信号通路分析结果,挑选显著性GO与信号通路分析中共有的基因取交集,得到基因功能和信号通路分析的交集基因229个。

Figure 1.The hierarchical clustering analysis of differentially expressed genes. Each column represents 16 samples: 8 ovarian serous cystadenocarcinoma (OV) and 8 normal ovary samples; each row represents one mRNA probe. The expression levels are represented as follows: red, high expression; green, low expression.
图1 差异基因的聚类分析图
最后,利用KEGG数据库中,信号通路的基因之间、基因产物之间的作用关系,通过数据库搜索分析,得到每个基因与其它基因的作用关系,可全面发现目标基因群之间的相互作用关系,定位上游蛋白和下游蛋白,而后构建显著性GO与信号通路基因间的信号转导网络,见图3。

Figure 2. Schematic overview of the work flow for construction of the intergenic signal transduction network.
图2 基因间信号转导网络的构建方法
3 卵巢浆液性囊腺癌相关基因信号转导网络中起重要作用的基因
本研究通过研究差异基因间的信号转导过程,得到网络中信号转导中枢。分析卵巢浆液性囊腺癌相关基因信号转导网络,用介数中心数(betweenness centrality)表示每个基因的中介能力,介数中心数是指:网络中进行传递信号,对某个基因的依赖性的大小,或是该基因与网络中的其它基因进行相互作用的控制能力。介数中心数越大,表明该基因参与更多的基因间的信号传递,说明其调控基因间相互作用的能力越大。某个基因与其他基因相互作用的多少以度(degree)来表示,degree的大小代表该基因与其他基因作用的多少。利用网络中基因的betweenness centrality和degree可以得到网络中起重要作用的关键基因,见表3。
由表3可以看出, 周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)和polo样激酶1(polo-like kinase 1,PLK1)基因的度最大,表示与其他基因相互作用的数目最多,分别为34和31。微型染色体保持复合体组分3(minichromosome maintenance complex component 3,MCM3)和磷酸甘油酸酯激酶1 (phosphoglycerate kinase 1,PGK1)基因的介数中心数最大,是中介能力比较强的基因,在整个基因相互作用网络中处于一个关键节点的位置。CDK1、PLK1、MCM3和PGK1基因是位于卵巢浆液性囊腺癌相关基因信号转导网络中具有重要作用的基因。
讨 论
本研究采用Affymetrix GeneChip Human Exon 1.0 ST Array基因芯片技术对卵巢癌基因表达谱进行分析,该基因芯片是最强大的全转录组研究工具。

Figure 3.Intergenic signal transduction network. The dot node: gene; red: up-regulated; purple: down-regulated. The dot area represents the betweenness centrality.
图3 基因间信号转导网络
表3 卵巢浆液性囊腺癌相关基因信号转导网络中的关键基因
Table 3.The key genes contained in the intergenic signal transduction network (betweenness centrality>0.0005)
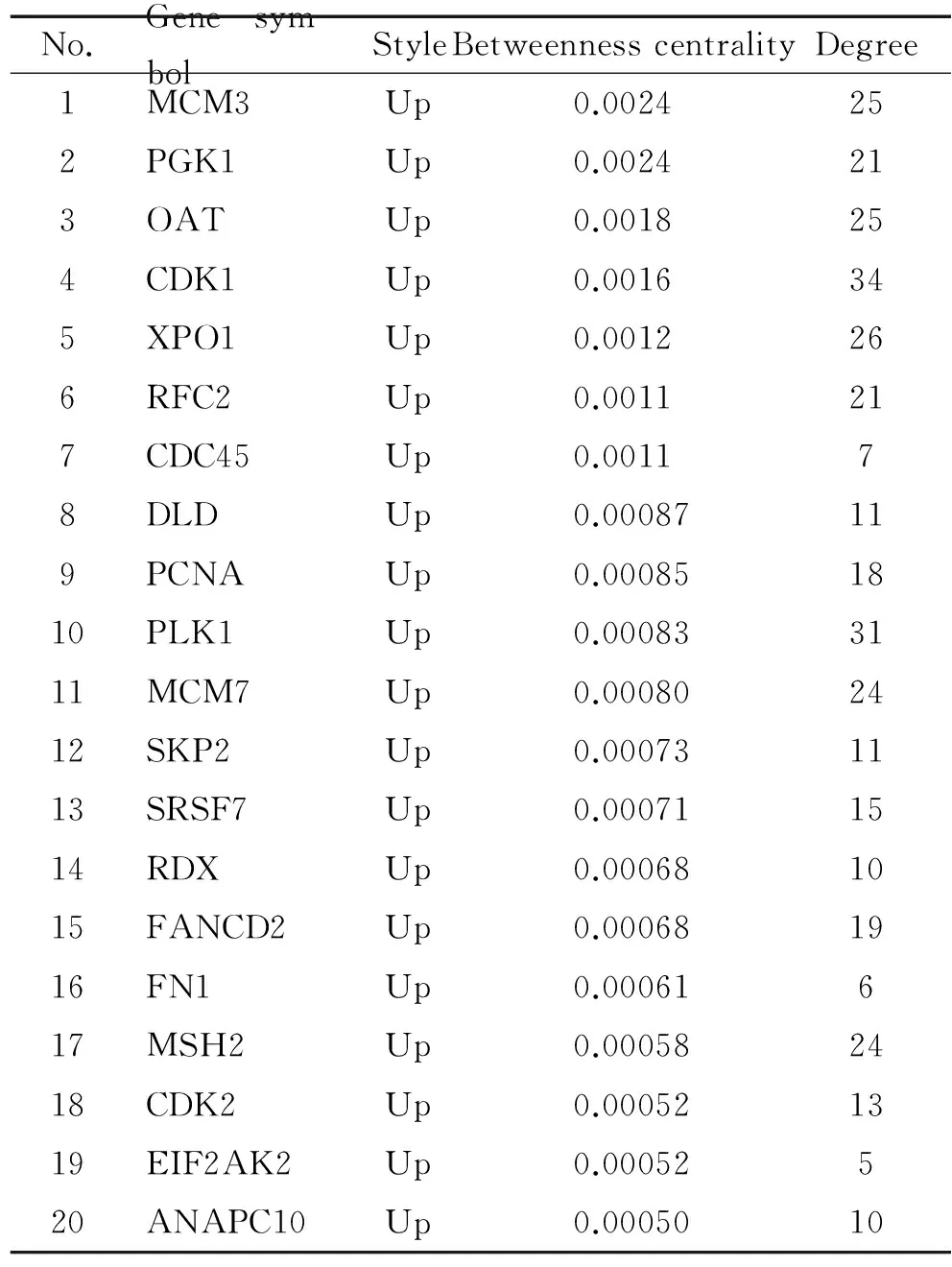
No.Genesym-bolStyleBetweennesscentralityDegree1MCM3Up0.0024252PGK1Up0.0024213OATUp0.0018254CDK1Up0.0016345XPO1Up0.0012266RFC2Up0.0011217CDC45Up0.001178DLDUp0.00087119PCNAUp0.000851810PLK1Up0.000833111MCM7Up0.000802412SKP2Up0.000731113SRSF7Up0.000711514RDXUp0.000681015FANCD2Up0.000681916FN1Up0.00061617MSH2Up0.000582418CDK2Up0.000521319EIF2AK2Up0.00052520ANAPC10Up0.0005010
该款芯片中覆盖了550万个探针,其中包括所有经典的转录本,并包含了能够预测出的所有可能基因转录形式。为此,利用GeneChip Human Exon 1.0 ST Array能够研究基因在所有状态下不同产物的真正性质和数量,从而为深入研究疾病形成机制、疾病诊断以及治疗靶点提供全面的转录水平检测。
TCGA 最初由美国国立癌症研究所和美国国立人类基因组研究所采用分阶段的策略来启动,它通过利用大量临床标本,进行大规模基因组测序和基因芯片检测,全面分析癌症的分子基础。该项目收录了20多种癌症全基因组和转录组表达谱,卵巢浆液性囊腺癌作为TCGA最早研究的3种肿瘤之一,收集了大量的样本和各种类型的数据,并对外开放部分数据(https://tcga-data.nci.nih.gov/tcga),TCGA是对卵巢癌研究的一个非常重要的数据库资源[4]。
本研究结果显示,在卵巢浆液性囊腺癌组织中发现1 144个差异表达基因,其中747个上调基因,397个下调基因。在表1中,趋化因子配体10 (chemokine ligand 10,CXCL10)的上调倍数为26.12倍,明显高于其它上调基因。已有研究发现,CXCL10基因在卵巢癌中高表达,可作为卵巢癌治疗和预后的生物标志物[5]。除表1和2中所列表达上调10倍以上的基因和表达下调10倍以上的基因以外,本研究还发现乳腺癌易感基因2(breast cancer suscepbility gene 2,BRCA2)在卵巢浆液性囊腺癌中表达量下调;垂体肿瘤转化基因1(pituitary tumor transforming gene 1,PTTG1)在卵巢浆液性囊腺癌中高表达。王莉等[6]报道,BRCA2 mRNA和蛋白在卵巢癌组织的表达量均低于正常卵巢组织,提示BRCA2基因在卵巢癌的发生发展中起一定的作用。刘洁等[7]报道,在卵巢癌细胞中,采用siRNA干扰PTTG1基因表达,抑制肿瘤细胞增殖,诱导细胞凋亡,提示PTTG1可作为卵巢癌基因治疗的候选靶点。本研究结果也提示CXCL10 、BRCA2和PTTG1基因在卵巢癌发生发展过程中可能起到关键作用。
根据构建的卵巢浆液性囊腺癌相关基因参与的信号转导网络,分析发现CDK1、PLK1、MCM3和PGK1这4个基因在卵巢浆液性囊腺癌的基因调控网络中具有重要作用。GO分析和信号通路分析结果表明:CDK1主要参与细胞周期调控、DNA复制、P53信号通路、细胞凋亡、细胞迁移等信号通路;PLK1主要参与细胞周期调控、细胞增殖、细胞分裂、细胞凋亡、蛋白磷酸化等信号通路;MCM3主要参与细胞周期、DNA复制等信号通路;PGK1主要参与代谢途径、氨基酸的生物合成、糖异生等信号通路。在本研究中,我们筛查到CDK1、PLK1、MCM3和PGK1基因在卵巢浆液性囊腺癌组织中高表达,为研究其在卵巢浆液性囊腺癌发生、发展过程中的作用及分子机制提供了实验基础。
已有研究表明,CDK1[8]与卵巢癌细胞增殖相关,可以作为预后标志物;PLK1[9]也是卵巢癌的一个预后标志物,MCM3是卵巢癌[10]和黑色素瘤[11]预后不良的标志物。而PGK1基因在卵巢癌中的功能尚未见报道。PGK1是糖酵解梅,催化糖酵解反应的重要步骤,可以将磷酸基团从1, 3-双磷酸甘油酸转移至ADP,生成ATP和3-磷酸甘油酸酯[12]。PGK1参与肿瘤生物学进程[13]、血管生成[14]、哺乳动物细胞核的DNA复制和修复[15-16]、肿瘤的转移[17]等。近期研究表明,PGK1与许多恶性肿瘤的发生、发展相关,包括胰腺癌[18]、肝癌[19]、胃癌[20-21]、乳腺癌[22]等。PGK1在卵巢浆液性囊腺癌组织中表达上调,在基因间信号转导网络中,具有重要的调控作用,推测其可能在卵巢浆液性囊腺癌发病、肿瘤转移和预后等生物学进程中发挥重要的作用。
本研究结果对于深入研究卵巢浆液性囊腺癌的分子机制,寻找新的诊断标志物和有效治疗靶点,提供了基础研究和实验基础。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015 [J]. CA Cancer J Clin, 2015, 65(1):5-29.
[2] Hanahan D, Weinberg A. Hallmarks of cancer: the next generation [J]. Cell, 2011, 144(5): 646-674.
[3] 谭树芬, 杨宏英, 李 凡, 等. 紫杉醇联合顺铂化疗对人卵巢浆液性囊腺癌组织occludin和ZO-1表达以及线粒体超微结构的影响[J]. 中国病理生理杂志,2013, 29 (8): 1437-1440.
[4] Zhang Q, Burdette JE, Wang JP. Integrative network analysis of TCGA data for ovarian cancer [J]. BMC Syst Biol, 2014, 8:1338.
[5] Bronger H, Singer J, Windmüller C, et al. CXCL9 and CXCL10 predict survival and are regulated by cyclooxygenase inhibition in advanced serous ovarian cancer [J]. Br J Cancer, 2016, 115(5): 553-563.
[6] 王 莉, 周 珂, 孙华清. BRCA2在卵巢癌中的表达及其与临床病理的相关性[J]. 实用医药杂志,2016,4:305-307.
[7] 刘 洁, 沈文静, 卢 瑶, 等. 小干扰RNA沉默hPTTG1基因对卵巢癌细胞增殖和凋亡的影响[J]. 中国病理生理杂志, 2011, 27(1):102-107.
[8] Xi Q, Huang M, Wang Y, et al. The expression of CDK1 is associated with proliferation and can be a prognostic factor in epithelial ovarian cancer[J]. Tumour Biol, 2015, 36(7): 4939-4948.
[9] Weichert W, Denkert C, Schmidt M, et al. Polo-like kinase isoform expression is a prognostic factor in ovarian carcinoma[J]. Br J Cancer, 2004, 90(4):815-821.
[10]Nodin B, Fridberg M, Jonsson L, et al. High MCM3 expression is an independent biomarker of poor prognosis and correlates with reduced RBM3 expression in a prospective cohort of malignant melanoma[J]. Diagn Pathol, 2012, 7: 82.
[11]Ehlén Å, Nodin B, Rexhepaj E, et al. RBM3-regulated genes promote DNA integrity and affect clinical outcome in epithelial ovarian cancer[J]. Transl Oncol, 2011, 4(4):212-221.
[12]Wang J, Wang J, Dai J, et al. A glycolytic mechanism regulating an angiogenic switch in prostate cancer[J]. Cancer Res, 2007, 67(1):149-159.
[13]Kabbage M, Chahed K, Hamrita B, et al. Protein alterations in infiltrating ductal carcinomas of the breast as detected by nonequilibrium pH gradient electrophoresis and mass spectrometry[J].J Biomed Biotechnol, 2008, 2008:564127.
[14]Lay AJ, Jiang XM, Kisker O, et al. Phosphoglycerate kinase acts in tumour angiogenesis as a disulphide reductase[J]. Nature, 2000, 408(6814):869-873.
[15]Vishwanatha JK, Jindal HK, Davis RG. The role of pri-mer recognition proteins in DNA replication: association with nuclear matrix in HeLa cells[J]. J Cell Sci, 1992, 101(Pt 1):25-34.
[16]Popanda O, Fox G, Thielmann HW. Modulation of DNA polymerases alpha, delta and epsilon by lactate dehydrogenase and 3-phosphoglycerate kinase[J]. Biochim Biophys Acta, 1998, 1397(1): 102-117.
[17]Zieker D, Königsrainer I, Weinreich J, et al. Phosphoglycerate kinase 1 promoting tumor progression and metastasis in gastric cancer: detected in a tumor mouse model using positron emission tomography/magnetic resonance imaging[J]. Cell Physiol Biochem, 2010, 26(2):147-154.
[18]Hwang TL, Liang Y, Chien KY, et al. Overexpression and elevated serum levels of phosphoglycerate kinase 1 in pancreatic ductal adenocarcinoma[J]. Proteomics, 2006, 6(7):2259-2272.
[19]Ai J, Huang H, Lv X, et al. FLNA and PGK1 are two potential markers for progression in hepatocellular carcinoma[J]. Cell Physiol Biochem, 2011, 27(3-4): 207-216.
[20]Zieker D, Königsrainer I, Traub F, et al. PGK1 a potential marker for peritoneal dissemination in gastric cancer[J]. Cell Physiol Biochem, 2008, 21(5-6):429-436.
[21]Zieker D, Königsrainer I, Tritschler I, et al. Phosphoglycerate kinase 1 a promoting enzyme for peritoneal dissemination in gastric cancer [J]. Int J Cancer, 2010, 126(6):1513-1520.
[22]Sun S, Liang X, Zhang X, et al. Phosphoglycerate kinase-1 is a predictor of poor survival and a novel prognostic biomarker of chemoresistance to paclitaxel treatment in breast cancer[J]. Br J Cancer, 2015, 112(8):1332-1339.
(责任编辑: 卢 萍, 罗 森)
Gene microarray analysis of ovarian serous cystadenocarcinoma-related genes based on TCGA
LI Dian-he1, HUANG Chang-nan1, LI Qi2
(1DepartmentofMedicine,HospitalAffiliatedtoNortheastNormalUniversity,Changchun130024,China;2CoreLaboratoryforClinicalMedicalResearch,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China.E-mail: 77liqi@sohu.com)
AIM: To detect the differentially expressed genes associated with ovarian serous cystadenocarcinoma (OV) by microarray and to analyze the participated signaling pathway. METHODS: We analyzed 16 datasets of Affymetrix GeneChip Human Exon 1.0 ST Arrays from The Cancer Genome Atlas (TCGA), including 8 OV and 8 normal ovary samples. The function of differential genes was determined by pathway and gene ontology (GO) analysis. The probable functions of the key genes were predicted according to intergenic signal transduction network. RESULTS: The 1 144 genes were identified as distinctively expressed in OV (P<0.05), 747 of which were up-regulated and 397 were down-regulated. The GO analysis results showed that the altered genes were involved in 362 up-regulated and 160 down-regulated significant functions (P<0.05) related to cell cycle, DNA replication, cell proliferation, cell apoptosis, cell adhesion, etc. The pathways of the different genes were involved in the 59 enrichment-related pathways (P<0.05), 45 of which were up-regulated and 14 were down-regulated. Among the 59 pathways, cell cycle, P53 signaling pathway, DNA replication, pathways in cancer, PI3K-Akt signaling pathway, ECM-receptor signaling pathway, cell adhesion molecules and cell apoptosis were related to tumor genesis, development and metastasis. As a result, 229 genes with significant functions and pathways in GO and pathway analysis were selected to construct signal transduction network (Signal-Net), 4 of which,CDK1,PLK1,MCM3 andPGK1, were found to play key roles in OV signal regulation network.CONCLUSION: The OV shows abundant differentially expressed genes that play key roles in cancer-related signal pathways.
Ovarian serous cystadenocarcinoma; Gene chip; Differential expression; Gene function; Signaling pathway
1000- 4718(2016)12- 2276- 07
2016- 06- 03
2016- 10- 08
国家自然科学基金资助项目(No. 81303268);北京市自然科学基金资助项目(No. 7152098)
R363
A
10.3969/j.issn.1000- 4718.2016.12.026
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 010-67098545; E-mail: 77liqi@sohu.com
