半枝莲黄酮抑制复合Aβ所致大鼠皮层细胞NFT沉积及其调节机制*
2017-01-03王树松程建军商亚珍
郭 可, 缪 红, 王树松, 程建军, 商亚珍△
(1河北省中医药抗痴呆重点研究室,河北省中药研究与开发重点实验室, 承德医学院中药研究所,河北 承德 067000;2河北省计划生育科学研究所,河北 石家庄 050071)
半枝莲黄酮抑制复合Aβ所致大鼠皮层细胞NFT沉积及其调节机制*
郭 可1, 缪 红1, 王树松2, 程建军1, 商亚珍1△
(1河北省中医药抗痴呆重点研究室,河北省中药研究与开发重点实验室, 承德医学院中药研究所,河北 承德 067000;2河北省计划生育科学研究所,河北 石家庄 050071)
目的:探讨半枝莲黄酮(SBF)对复合Aβ,即β淀粉样蛋白25-35(Aβ25-35)联合三氯化铝(AlCl3)和重组人类转化生长因子-β1(RHTGF-β1)所致大鼠脑内神经元纤维缠结(NFT)沉积,tau蛋白磷酸化的影响及糖原合成激酶(GSK)3β和蛋白磷酸酶(PP)2A的调节机制。方法:雄性SD大鼠,脑室注射复合Aβ建立拟阿尔茨海默病(AD)大鼠记忆障碍模型,Morris水迷宫进行记忆障碍模型筛选,模型成功大鼠灌胃35、70和140 mg/kg的SBF 和140 mg/kg的阳性对照药银杏叶黄酮(GLF),持续37 d。硝酸银法测定大鼠大脑皮层的NFT,Western blot法检测大鼠海马、皮层中总tau蛋白、Ser199和Ser214位点磷酸化的tau蛋白水平以及相关GSK3β和PP2A蛋白的表达水平。RT-PCR法检测海马、皮层中GSK3β和PP2A的mRNA水平。结果:大鼠脑室注射复合Aβ可以引起大鼠脑内NFT生成增加、Ser199和Ser214位点磷酸化tau蛋白、GSK3β蛋白和mRNA表达水平皆明显增加,PP2A的蛋白和mRNA表达水平明显降低。3种剂量的SBF灌胃37 d 不同程度地逆转复合Aβ所致大鼠脑内上述异常改变。GLF也表现出与SBF相似的结果。结论:SBF能够抑制复合Aβ所致大鼠脑内NFT沉积,该作用可能是通过抑制GSK3β活性、增加PP2A活性从而降低tau蛋白磷酸化而实现的。
半枝莲黄酮; β淀粉样蛋白25—35; 三氯化铝; 重组人类转化因子-β1; 神经纤维缠结; tau 蛋白; 糖原合成激酶3β; 蛋白磷酸酶2A
阿尔茨海默病(Alzheimer disease,AD)是一种多病因参与的神经退行性疾病,临床上表现为进行性记忆障碍和行为异常改变[1]。一系列资料显示,脑内老年斑(senile plaque,SP)的沉积和神经元纤维缠结(neurofibrillary tangle,NFT)形成被认为是AD最主要的病理特征。神经细胞内NFT形成是由过度磷酸化的tau蛋白相互缠结而成,而tau蛋白是神经系统特有的一种微管相关蛋白,具有促进微管形成和稳定微管结构的功能;当tau蛋白被过度磷酸化后就变成了对神经具有很强毒性的双螺旋丝(paired helical filament,PHF)和束状细丝(straight filament,SF)[2],PHF和SF再缠结沉积在神经细胞的胞体和树突从而形成了NFT,PHF、SF和NFT共同使神经元受损、变性,干扰神经信号传导,从而出现神经功能紊乱[3]。在AD的NFT中tau蛋白质有40个以上异常的磷酸化位点,而使这些位点磷酸化依赖于蛋白激酶糖原合成酶激酶3β(glycogen synthase kinase3β,GSK3β)、细胞周期素依赖性激酶-5(cyclin-dependent kinase -5,CDK5)和cAMP依赖的蛋白激酶(cyclin AMP-dependent protein kinase,PKA)等与蛋白磷酸酶(protein phosphatases,PP)1、PP2A和PP2B等之间的平衡[4],当某些因素引起蛋白激酶与磷酸酯酶活性失衡时,就会出现tau蛋白异常磷酸化[5]。另外,β-淀粉样蛋白(β-amyloid protein,Aβ)对神经系统也有较强的毒性,且脑内Aβ增加亦可增加tau蛋白过度磷酸化,二者互相交恶进一步加剧神经毒性,包括脑内NFT大量形成,进而引发AD[6-7]。因此,正向调节蛋白激酶与蛋白磷酸酶活性,抑制tau蛋白过度磷酸化、阻止NFT在神经细胞内形成可能会成为治疗AD的重要手段之一。研究发现,动物脑室投放Aβ肽段可以诱发动物神经病理学改变,如果结合铝和重组人类转化生长因子-β1(recombinant human transforming growth factor-β1,RHTGF-β1)建立多因素神经损害,更能接近模拟临床神经退行性病人的神经病理生理特征。
半枝莲黄酮(Scutellariabarbataflavonoids,SBF)是从半枝莲(ScutellariabarbataD. Don)地上部分分离的黄酮类化合物,其主要成分是野黄芩苷[8]。以往研究已经证明,SBF具有解热、抗炎和抗氧化等多种药理功效,对去势大鼠记忆障碍、神经内分泌及脑内自由基异常变化、对Aβ25-35损伤星形胶质细胞及复合Aβ诱导的神经线粒体凋亡通路异常都有明显的正向作用[9-14],但对Aβ25-35联合AlCl3和RHTGF-β1(复合Aβ)引起动物脑内NFT形成、tau蛋白磷酸化及相关酶的影响尚未见报道。本实验利用大鼠脑室注射复合Aβ建立神经损害模型,探讨SBF对复合Aβ所致大鼠脑内NFT形成的影响及机制。
材 料 和 方 法
1 动物和药品
清洁级健康Sprague-Dawley(SD)雄性大鼠(动物许可证号为150308,体重300~350 g)购于河北医科大学实验动物中心。RHTGF-β1购于Prospect Biosystems;Aβ25-35购于上海强耀生物科技有限公司;SBF由承德医学院中药研究所提供,纯度为83.29%;RIPA裂解液、BCA蛋白定量试剂盒购于碧云天生物技术公司;蛋白 Marker购于Thermo ;抗PP2A抗体购于北京博奥森生物技术有限公司;抗GSK3β抗体购于博士德生物技术公司;抗β-actin 抗体购于Bioword;抗tau、p-tau(Ser214)和p-tau(Ser199)的抗体购于Abcam;辣根过氧化物酶标记的Ⅱ抗购于中杉金桥生物技术有限公司;增强化学发光(enhanced chemiluminescence,ECL)试剂盒购于北京普利来基因技术有限公司;GSK3β、PP2A引物由宝生物工程(大连)有限公司合成,RNA PCR Kit(AMV)Ver.3.0亦购于宝生物工程(大连)有限公司;银杏叶黄酮(Ginkgobilobaleaves flavonoids, GLF)由扬子江药业提供。
2 方法
2.1 大鼠记忆障碍模型的建立和筛选 健康雄性SD大鼠,腹腔注射10%水合氯醛(300 mg/kg)麻醉后固定于大鼠脑立体定位仪上,头皮常规消毒后沿正中线纵向切开1.5 cm左右的切口,分离皮下组织及骨膜,标记前卤点位置。于前卤点后2.0 mm,矢状缝右侧旁开1.4 mm,深4.6 mm确认丘脑背侧核位置,微量注射器注入RHTGFβ1 1 μL。于前卤点后1.2 mm,失状缝左侧旁开2.0 mm,深4.0 mm确认侧脑室位置,用钻头在该点钻一直径为0.2 mm孔,埋置导管,并用磷酸锌水门汀固定导管,盖上导管帽。手术第2 天上午开始,每天注射Aβ25-354 μL,连续注射14 d,每天下午注射1% AlCl33 μL,连续注射5 d。假手术组大鼠做相同手术,但脑室注射等容积的生理盐水。
利用Morris大鼠水迷宫进行大鼠记忆障碍模型的动物筛选。所有大鼠在手术后第45 天进行水迷宫游泳训练,每天训练2次,以2次游泳成绩均值作为大鼠当天的训练成绩,连续训练4 天,以第4 天大鼠的训练成绩作为筛选模型成功的指标。水迷宫训练第4 天,注射复合Aβ的每只大鼠找到平台的潜伏期是A、假手术组大鼠找到平台的平均潜伏期是B,其筛选率(screening ratio,SR)= (A-B)/B,当注射复合Aβ的大鼠筛选率大于0.2时,即为造模成功大鼠。
2.2 实验动物分组及样品制备 造模成功大鼠30只随机分为模型组、3种剂量SBF药物组和阳性对照药GLF组,每组6只。药物组大鼠分别每天灌胃35、70和140 mg/kg SBF 或140 mg/kg GLF 1次,连续37 d;模型组和假手术组大鼠灌胃等体积生理盐水。动物于灌胃37 d后断头处死,一部分用滤纸吸干大脑表面血液,冰上选取大脑视交叉至大脑横裂冠状脑组织,将其置于4%甲醛中固定24 h后,常规石蜡包埋,用于硝酸银染色测定NFT。剩余大鼠亦断头处死,轻轻剥离软脑膜,在冰上分离海马、皮层,置于1.5 mL无RNA酶的EP管中,置液氮中冷冻后于-80 ℃冰箱保存备用,用于后续Western blot法的筛选和RT-PCR等指标的测定。
2.3 硝酸银染色法测定皮层NFT 将各组大鼠大脑石蜡包埋块用石蜡切片机连续切片,片厚5 μm,常规脱蜡至水;在20%硝酸银水溶液中避光浸染20 min;蒸馏水清洗;浸入银氨液作用15 min后移入稀氨水中浸泡;切片浸入显影工作液显色,见神经轴突呈黑色时即取出;稀氨水内浸洗1 min;流水冲洗1 min;5%的硫代硫酸钠处理2 min;流水冲洗5 min,二甲苯透明,封片。显微镜下观察神经细胞内NFT情况。镜下(×400)选取6个视野,对每个视野中NFT进行计数,以平均值作为NFT细胞数。
2.4 Western blot法检测海马、皮层中总tau蛋白、Ser199和Ser214位点磷酸化tau、GSK3β和PP2A的蛋白表达 将各组大鼠冻存的海马、皮层组织用匀浆器冰上匀浆,用RIPA裂解液提取相应组织总蛋白,BCA法测定样品蛋白浓度。在蛋白样品中加入5×上样缓冲液,100 ℃ 沸水变性3 min。在12% SDS-聚丙烯酰胺凝胶中用100 V恒压电泳分离蛋白,250 mA恒流湿转膜2 h,将蛋白转移至PVDF膜。5%牛血清蛋白封闭2 h,加入 I 抗4 ℃过夜,用TBST缓冲液漂洗5次,每次5 min ,加入 II 抗孵育2 h,TBST缓冲液漂洗5次,每次5 min。使用ECL化学发光剂进行曝光并显影。胶片扫描后采用Quantity One 4.6.2软件对显影条带进行分析,以目的蛋白与内参照β-actin蛋白的灰度比值作为目的蛋白的相对表达量。
2.5 RT-PCR检测海马、皮层中GSK3β和PP2A的mRNA表达 TRIzol法提取大鼠海马、皮层组织总RNA,逆转录为cDNA。根据大鼠GenBank的基因序列进行引物设计。GSK3β的上游引物序列为5’-TTCTCGGTACTACAGGGCACCA-3’,下游引物序列为5’-GTCCTAGCAACAATTCAGCCAACA-3’;PP2A的上游引物序列为为5’-ACTCGTCGTACCCCAGACTACTTC-3’,下游引物序列为5’-CCCGATTCCATTAGGTCAACA-3’;β-actin的上游引物序列为5’-GGAGATTACTGCCCTGGCTCCTA-3’,下游引物序列为5’-GACTCATCGTACTCCTGCTTGCTG-3’。按说明书在PCR仪中将引物加入cDNA 中进行序列扩增,反应条件为:94 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s, 72 ℃ 30 s,30个循环;72 ℃ 2 min。反应结束后取8 μL各扩增产物用2%琼脂糖凝胶电泳分离。电泳50 min后,取出凝胶,在紫外投射仪中确认PCR反应产物并拍摄图像。采用Quantity One 4.6.2软件进行定量分析,以目的条带GSK3β、PP2A与β-actin灰度的比值代表目的基因的相对表达量。
3 统计学处理
利用SPSS 19.0统计学软件进行统计学分析,所有数据用均数±标准差(mean±SD)表示。多样本均数间比较采用单因素方差分析(one-way ANOVA),均数间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 模型复制与筛选
图1显示,随着训练天数的延长,所有大鼠找到平台的潜伏期都逐渐降低,且假手术组大鼠找到平台的潜伏期明显低于脑室注射复合Aβ 大鼠找到平台的潜伏期。根据第4天假手术组大鼠和每只脑室注射复合Aβ 大鼠的SR大于0.2计算,本实验大鼠模型成功率为100%。有关大鼠学习记忆研究资料另文发表。

Figure 1.The successful model screening of the rats in memory impairment using Morris water maze.
图1 复合Aβ组和假手术组大鼠Morris水迷宫筛选
2 SBF对复合Aβ所致大鼠神经细胞NFT沉积的影响
与假手术组相比,模型组大鼠皮层中NFT细胞增加了4.82倍(P<0.01)。模型组大鼠皮层NFT沉积的细胞数显著增多,细胞内神经原纤维增粗、紊乱,或密集呈团块状、编织状,遍布全部细胞质并深入细胞突起,形成染色较深的拖尾状。与模型组大鼠相比,35、70和140 mg/kg剂量SBF及GLF明显减轻复合Aβ25-35所致神经细胞内NFT沉积(P<0.05),见图2。

Figure 2.SBF reduced composited Aβ-induced NFT aggregation in the brain (Silver staining, ×400). Mean±SD.n=6.##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group.
图2 SBF对复合Aβ所致大鼠神经细胞NFT沉积的影响
3 SBF对复合Aβ所致大鼠海马、皮层中总tau蛋白表达的影响
图3显示与假手术组比较,模型组大鼠海马、皮层总tau 蛋白的表达无显著性差异。与模型组相比,灌胃35、70、140 mg/kg SBF及140 mg/kg GLF 37 d后,海马、皮层总tau蛋白表达量无显著性差异。
4 SBF对复合Aβ所致大鼠海马、皮层tau蛋白Ser199位点磷酸化水平的影响
图4显示与假手术组比较,模型组大鼠海马、皮层中Ser199位点磷酸化tau 蛋白水平明显上升(P<0.01);灌胃35、70 mg/kg SBF 后,Ser199位点磷酸化tau 蛋白在海马、皮层中的表达量与模型组相比无显著性差异,而140 mg/kg SBF 使海马、皮层中Ser199位点磷酸化tau 蛋白水平显著降低(P<0.05)。阳性对照药GLF组与模型组相比无显著性差异。
5 SBF对复合Aβ所致大鼠海马、皮层tau蛋白Ser214位点磷酸化水平的影响
图5显示模型组大鼠海马、皮层中Ser214位点磷酸化tau 蛋白表达较假手术组明显升高(P<0.01)。给予SBF 37 d后,35 mg/kg SBF 组和模型组相比无显著性差异,70、140 mg/kg SBF显著降低了Ser214位点磷酸化tau 蛋白水平(P<0.05)。阳性对照药GLF显著降低大鼠海马、皮层中Ser214位点磷酸化tau 蛋白表达量(P<0.05)。
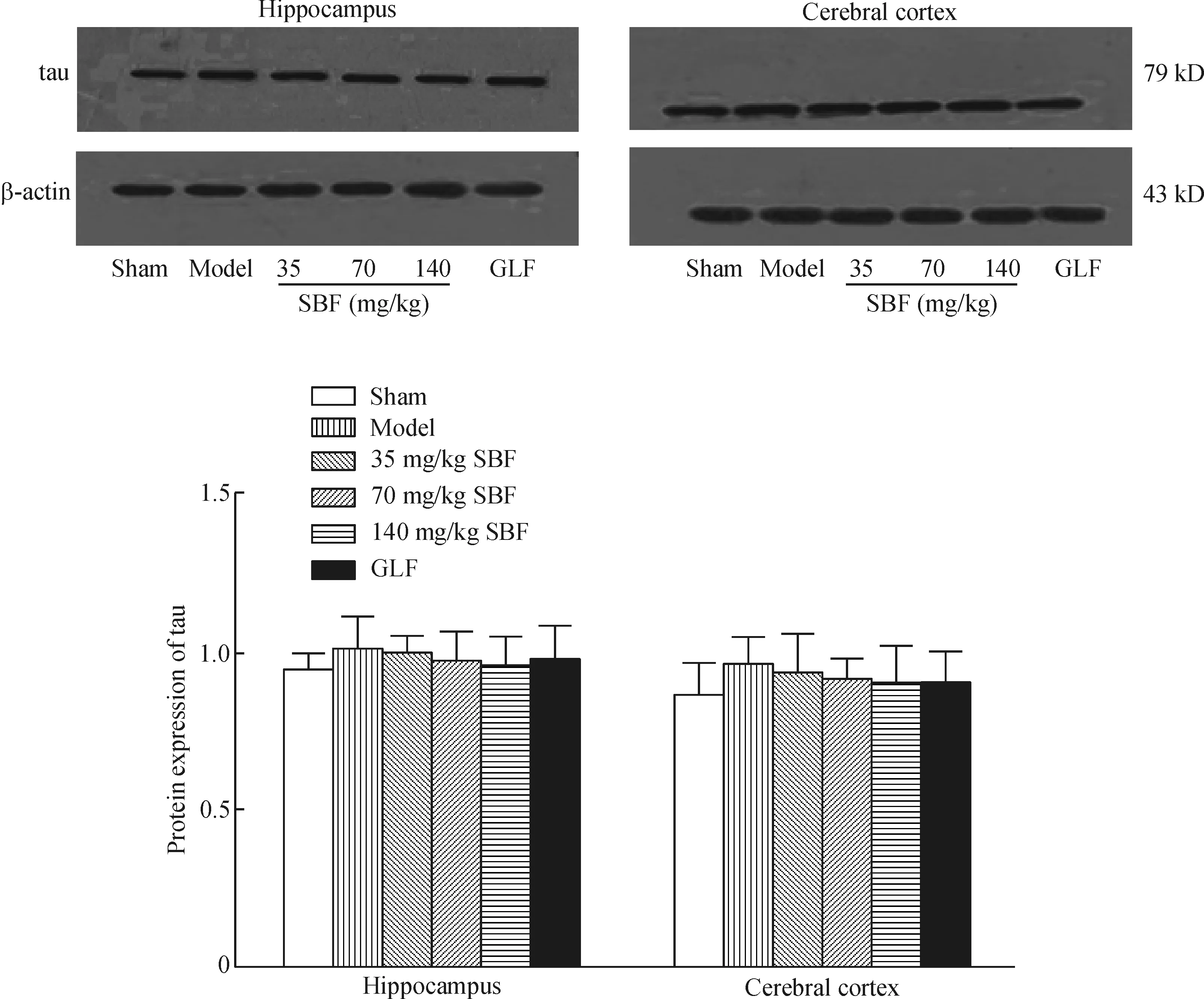
Figure 3.The effect of SBF on total tau protein expression in the hippocampus and cerebral cortex of the rats induced by composited Aβ. Mean±SD.n=6.
图3 SBF对复合Aβ所致大鼠海马、皮层中总tau蛋白表达的影响

Figure 4.The effect of SBF on p-tau (Ser199) protein level in hippocampus and cerebral cortex of the rats induced by composited Aβ. Mean±SD.n=6.##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group.
图4 SBF对复合Aβ所致大鼠海马、皮层中Ser199位点磷酸化tau蛋白水平的影响

Figure 5. The effect of SBF on p-tau (Ser214) protein level in hippocampus and cerebral cortex of the rats induced by composited Aβ. Mean±SD.n=6.##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group.
图5 SBF对复合Aβ所致大鼠海马、皮层中Ser214位点磷酸化tau蛋白水平的影响
6 SBF对复合Aβ所致大鼠海马、皮层GSK3β蛋白表达的影响
由图6可见模型组大鼠海马、皮层中GSK3β的蛋白表达量明显增加(P<0.01)。与模型组相比,35 mg/kg SBF组和模型组无显著性差异,而70、140 mg/kg SBF和阳性对照药140 mg/kg GLF显著降低了大鼠海马、皮层中GSK3β蛋白表达(P<0.05)。
7 SBF对复合Aβ所致大鼠海马、皮层PP2A蛋白表达的影响
与假手术组相相比,模型组大鼠海马、皮层中PP2A的表达水平明显降低(P<0.01)。而3剂量SBF均能显著升高海马、皮层中PP2A的表达(P<0.05)。阳性对照药GLF也使大鼠海马、皮层中PP2A蛋白表达显著增加(P<0.05),见图7。
8 SBF对复合Aβ所致大鼠海马、皮层中GSK3β mRNA表达的影响
与假手术组比较,模型组大鼠海马、皮层中GSK3β的mRNA表达量显著增加(P<0.01)。35 mg/kg SBF组与模型组相比无显著性差异,70、140 mg/kg SBF则使GSK3β的mRNA表达量显著降低(P<0.05)。阳性对照药GLF亦能显著降低大鼠海马、皮层中GSK3β的mRNA表达(P<0.05),见图8。
9 SBF对复合Aβ所致大鼠海马、皮层中PP2A mRNA表达的影响
与假手术组比较,模型组大鼠海马、皮层中PP2A的mRNA表达明显降低(P<0.01)。35 mg/kg SBF组与模型组相比无显著性差异,70、140 mg/kg SBF使PP2A的mRNA表达量显著升高(P<0.05)。阳性对照药GLF亦能显著升高大鼠海马、皮层中PP2A的mRNA表达(P<0.05),见图9。
讨 论
AD 是老年人群的最常见病和多发病,发病机制不甚明确。目前认为AD是由多病因参与的神经退行性疾病[1],对此提出了多种假说,包括胆碱能假说、Aβ毒性学说、tau蛋白过度磷酸化学说、神经炎症学说和氧化应激学说等。其中最受认可的是Aβ毒性学说和tau蛋白过度磷酸化学说[15],特别是Aβ

Figure 6.The effect of SBF on the protein expression of GSK3β in the hippocampus and cerebral cortex of the rats induced by composited Aβ. Mean±SD.n=6.##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group.
图6 SBF对复合Aβ所致大鼠海马、皮层中GSK3β蛋白表达的影响

Figure 7.The effect of SBF on the protein expression of PP2A in the hippocampus and cerebral cortex of the rats induced by composited Aβ. Mean±SD.n=6.##P<0.01vssham group;*P<0.05vsmodel group.
图7 SBF对复合Aβ所致大鼠海马、皮层中PP2A蛋白表达的影响

Figure 8. The effect of SBF on the mRNA expression of GSK3β in the hippocampus and cerebral cortex of the rats induced by composited Aβ. Mean±SD.n=6.##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group.
图8 SBF对复合Aβ所致大鼠海马、皮层中GSK3β mRNA表达的影响

Figure 9.The effect of SBF on the mRNA expression of PP2A in the hippocampus and cerebral cortex of the rats induced by composited Aβ. Mean±SD.n=6.##P<0.01vssham group;*P<0.05,**P<0.01vsmodel group.
图9 SBF对复合Aβ所致大鼠海马、皮层中PP2A mRNA表达的影响
毒性学说中涉及的Aβ在脑内沉积形成的SP和tau蛋白过度磷酸化形成的NFT被认为是AD发病的重要机制。然而,近年来有临床研究发现脑内Aβ水平与AD的严重程度并无明显相关性[16-17],而tau蛋白过度磷酸化形成NFT与AD患者临床痴呆程度呈正相关,提示tau蛋白异常磷酸化是造成痴呆的直接原因[18]。NFTs 是由神经细胞内tau蛋白异常磷酸化形成的PHF和SF组成。PHF和SF具有极强的神经毒性,它们主要沉积在轴突,也存在于神经元胞体,大量PHF和SF聚合而成的NFT诱导神经元受损、变性,干扰神经信号传导,进而导致神经结构与功能障碍,包括认知功能的障碍。
tau蛋白作为在神经系统中微管装配的微管相关蛋白,在正常的生理条件下,tau蛋白磷酸化水平非常低,且与微管蛋白结合形成微管核心,并促进其它微管蛋白在此核心上进一步延伸形成微管,同时tau蛋白与微管的结合也稳定了微管的结构与功能,参与调节神经细胞轴突的物质运输,包括神经营养物质供应、能量传递和信号传导等[19]。然而,在病理状态下,tau蛋白多个位点被磷酸化,过度磷酸化的tau蛋白从微管中分离出来,致使细胞骨架崩解,大量的过度磷酸化的tau蛋白聚积形成了PHF和SF,进而缠绕形成NFT,最终导致神经细胞发生退行性病变[20]。研究发现,在AD的脑内NTF中tau蛋白有多个丝氨酸(Ser)/苏氨酸(Thr)位点异常磷酸化,包括Ser199、Ser214、Thr231、Ser202、Ser404等。调节这些位点磷酸化的主要是蛋白激酶和蛋白磷酸酶。而在众多酶中,GSK3β和PP2A对调节tau蛋白磷酸化发挥更为重要的作用[21]。
GSK3β是一种丝氨酸苏氨酸磷酸激酶,在中枢神经系统的神经元极性建立和神经突触形成成熟轴突的过程中起重要作用[22]。GSK3β参与调节tau蛋白磷酸化,可使Ser199、Thr231、Ser396、Ser400、Ser413位点磷酸化[23],形成NFT,致使动物出现空间记忆障碍和神经损伤。
PP2A是丝氨酸/苏氨酸蛋白磷酸酶,存在于人脑的锥体神经元中,由结构亚基-A亚基和催化亚基-C亚基先形成核心酶,然后再与调节亚基-B亚基组成异三聚体复合物-PP2A全酶[24]。PP2A是参与tau蛋白磷酸化的关键酶之一[25],在tau蛋白去磷酸化中发挥着非常重要的作用。它能使难溶性PHF-tau蛋白上Ser214、Ser199、Ser202、Thr23、Ser404位点去磷酸化。一旦PP2A失去活性就不能发挥tau去磷酸化作用,最终导致NFT形成[26]。
NFT直接参与了AD的发生与发展,tau蛋白过度磷酸化是形成NFT的主要原因,而GSK3β、PP2A调节tau蛋白磷酸化。因此,任何能够抑制tau蛋白过度磷酸化、调节tau蛋白磷酸化的相关酶GSK3β与PP2A平衡,从而抑制NFT形成的方法都可能有利于AD的治疗。本实验利用大鼠脑室注射Aβ25-35联合AlCl3和RHTGF-β1建立多因素记忆障碍和神经损伤模型发现复合Aβ能够干扰蛋白激酶GSK3β和磷酸酯酶PP2A表达,促进tau蛋白Ser199、Ser214位点过度磷酸化,从而诱导神经细胞内NFT形成。然而,灌胃不同剂量的SBF 37 d后发现,3剂量SBF不同程度地逆转复合Aβ所致大鼠皮层细胞NFT沉积,在抑制Ser199、Ser214位点磷酸化tau蛋白水平和GSK3β的表达的同时升高PP2A表达。表明,SBF能够抑制复合Aβ所致大鼠脑内NFT的沉积,其抑制作用可能是通过抑制tau蛋白Ser199和Ser214位点的过度磷酸化、调节GSK3β和PP2A的活性来完成的。
tau蛋白过度磷酸化是AD患者神经异常改变的重要标志,研究发现,AD脑内总tau蛋白是由正常磷酸化的tau蛋白和过度磷酸化的tau蛋白组成,当过度磷酸化的tau蛋白表达增加时,正常磷酸化的tau蛋白表达则降低[27]。本研究发现,脑室注射复合Aβ使大鼠脑内Ser199和Ser214位点磷酸化tau蛋白表达明显增加,而总tau蛋白水平未发生明显改变,表明脑室注射复合Aβ不影响脑内总tau蛋白合成,只是促进过度磷酸化tau蛋白的表达,该结果与文献报道的D-半乳糖所致AD大鼠海马中总tau蛋白与正常对照组无显著差异相一致[28]。灌胃SBF后总tau蛋白表达较模型组没有明显变化,但使Ser199和Ser214位点磷酸化tau蛋白含量明显降低,表明SBF能够抑制tau蛋白过度磷酸化,其结果也与SBF能够调节GSK3β和PP2A的活性有关。
本研究证实了SBF抑制NFT在脑内的沉积机制可能与降低Ser199和Ser214位点磷酸化tau蛋白含量、抑制 GSK-3β和激活 PP2A活性有关。结合本研究室以往的研究,SBF对去势大鼠记忆障碍、神经内分泌及脑内自由基异常变化、对Aβ损伤星形胶质细胞及复合Aβ诱导的神经线粒体凋亡通路异常都有明显的正向作用[9-14],鉴于目前多个Aβ蛋白药物临床试用的失败,及tau蛋白药物研究中的成绩[29],SBF可能作为以tau蛋白为靶标的药物治疗如AD等神经退行性疾病。
[1] Khairallah MI, Kassem LA. Alzheimer’s disease: Current status of etiopathogenesis and therapeutic strategies[J]. J Biol Sci, 2011, 14(4): 257-272.
[2] Giacobini E, Gold G. Alzheimer disease therapy moving from amyloid-β to tau[J]. Nat Rev Neurol, 2013,9(12): 677-686.
[3] Polydoro M, Acker CM, Duff K, et al. Age-dependent impairment of cognitive and synaptic function in the htau mouse model of tau pathology[J]. J Neurosci, 2009, 29 (34):10741-10749.
[4] Wang JZ, Xia YY, Grundke-Iqbal I, et al. Abnormal hyperphosphorylation of tau: sites, regulation, and molecular mechanism of neurofibrillary degeneration [J]. Alzheimers Dis, 2013, 33(Suppl1): S123-S139.
[5] Nakamura K, Greenwood A, Binder L, et al. Proline isomer-specific antibodies reveal the early pathogenic Tau conformation in Alzheimer’s disease[J]. Cell, 2012, 149(1): 232-244.
[6] Dong S, Duan Y, Hu Y, et al. Advances in the pathogenesis of Alzheimer’s disease: a re-evaluation of amyloid cascade hypothesis[J]. Transl Neurodegener, 2012, 1(1): 1-18.
[7] Armstrong RA. The molecular biology of senile plaques and neurofibrillary tangles in Alzheimer’s disease[J]. Folia Neuropathol, 2009, 47(4):289-299.
[8] 郑永红, 韦晓瑜, 龙继红. 半枝莲的研究进展[J]. 中草药, 2010, 41(8): 1406-1408.
[9] 董永彩, 商亚珍. 半枝莲的药理学研究进展[J]. 承德医学院学报, 2009, 26(1): 98-100.
[10]郗玉玲, 刘敏华, 张晓峰, 等. 半枝莲黄酮对去卵巢大鼠记忆障碍的改善作用[J]. 中国老年学杂志, 2011, 31(2): 242-245.
[11]董永彩, 董雅洁, 龚玉芳, 等. 半枝莲黄酮对去卵巢大鼠血脂水平的影响[J]. 中国医院药学杂志. 2010, 30(15): 1260-1263.
[12]范 悦, 吴晓光, 赵泓翔, 等. 半枝莲黄酮对Aβ25-35引起的大鼠皮层星形胶质细胞NOS、HSP70及apoE异常表达的影响[J]. 中国病理生理杂志, 2014, 30(2): 359-363.
[13]赵泓翔, 郭 可, 崔亚迪, 等. 半枝莲黄酮对复合Aβ25 -35引起线粒体膜Bcl-2、Bax、Bcl-xL 及 Bak异常的干预作用[J]. 中国病理生理杂志, 2014, 30(12): 2262-2266.
[14]郭 可, 吴晓光, 崔亚迪, 等. 半枝莲黄酮对复合Aβ所致大鼠皮层细胞凋亡抑制作用及线粒体凋亡通路的调节机制[J]. 中国医院药学杂志, 2015, 35(20): 1994-1999.
[15]Wang JZ, Grundke-Iqball I, Iqbal K. Kinases and phosphatases and tau sites involved in Alzheimer neurofibrillary degeneration[J]. Eur J Neurosci, 2007, 25(1): 59-68.
[16]Imbimbo BP, Giardina GA. Gamma-secretase inhibitors and modulators for the treatment of Alzheimer’s disease: Disappointments and hopes[J]. Curr Top Med Chem, 2011, 11(12): 1555-1570.
[17]Ryan JM, Grundman M. Anti-amyloid-beta immunotherapy in Alzheimer’s disease: ACC-001 clinical trials are ongoing[J]. J Alzheimers Dis, 2009, 17(2): 243.
[18]王建枝. Tau蛋白在老年性痴呆症神经细胞退行性变性中的作用[J]. 神经损伤与功能重建,2006, 1 (1): 1-3.
[19]Kuznetsov IA, Kuznetsov AV. What tau distribution maximizes fast axonal transport toward the axonal synapse[J]. Math Biosci, 2014, 253: 19-24.
[20]Del Ser T, Steinwachs KC, Gertz HJ, et al. Treatment of Alzheimer’s disease with the GSK-3 inhibitor tideglusib: A pilot study[J]. J Alzheimers Dis, 2013, 33(1): 205-215.
[21]许 杰, 温世荣,于艳红, 等. Tau蛋白在阿尔茨海默病中的作用[J]. 现代生物医学进展, 2015, 15(3): 573-575.
[22]Forlenza OV, e-Paula VJ, Diniz BS. Neuroprotective effects of lithium: implications for the treatment of Alzheimer’s disease and related neurodegenerative disorders[J]. ACS Chem Neurosci, 2014, 5(6):443-450.
[23]Li DW, Liu ZQ, Chen W, et al. Association of glycogen synthase kinase-3β with Parkinson’s disease[J]. Mol Med Rep, 2014, 9(6):2043-2050.
[24]Van Eersel J, Ke YD, Liu X, et al. Sodium selenate mitigates tau pathology, neurodegeneration, and functional deficits in Alzheimer’s disease models[J]. Proc Natl Acad Sci U S A, 2010, 107(31):13888-13893.
[25]李雪莲, 杨翠翠, 张 兰. 蛋白磷酸酶2A活性调节机制及其在阿尔茨海默病中的作用[J]. 国际药学研究杂志, 2016, 43(1): 39-43.
[26]Liu R, Zhou XW, Tanila H, et al. Phosphorylated PP2A(tyro-sine 307)is associated with Alzheimer neurofibrillary pathology[J]. J Cell Mol Med, 2008, 12(1): 241-257.
[27]万 章, 王春梅. tau蛋白过度磷酸化在阿尔茨海默病发病机制中的作用[J]. 医学研究生学报, 2010, 23(5): 539-542.
[28]张智华, 王秀莲, 吕银娟, 等. 石菖蒲-远志药对不同组分对阿尔茨海默病模型大鼠海马Tau蛋白及其Ser396位点磷酸化的影响[J]. 医药导报, 2016, 35(5): 448-453.
[29]Duan Y, Dong S, Gu F, et al. Advances in the pathogenesis of Alzheimer’s disease: Focusing on Tau-mediated neurodegeneration[J]. Trans Neurodegener, 2012, 1(1): 24.
(责任编辑: 林白霜, 余小慧)
Scutellaria barbata flavonoids inhibits NFT aggregation and regulatory mechanism in rats induced by composited Aβ
GUO Ke1, MIAO Hong1, WANG Shu-song2, CHENG Jian-jun1, SHANG Ya-zhen1
(1HebeiProvinceKeyResearchOfficeofTraditionalChineseMedicineAgainstDementia,HebeiProvincialKeyLaboratoryofTraditionalChineseMedicineResearchandDevelopment,InstituteofTraditionalChineseMedicine,ChengdeMedicalCollege,Chengde067000,China;2HebeiResearchInstituteforFamilyPlanning,Shijiazhuang050071,China.E-mail:shangyz1018@sina.com)
AIM: To investigate the effects ofScutellariabarbataflavonoids (SBF) on neurofibrillary tangle (NFT) aggregation, tau protein phosphorylation and the regulated mechanism of glycogen synthase kinase (GSK) 3β and protein phosphatase (PP) 2A in the rats induced by amyloid β protein 25-35 (Aβ25-35) in combination with AlCl3and recombinant human transforming growth factor (RHTGF)-β1(composited Aβ). METHODS: The male SD rats were used to establish the simulated Alzheimer disease (AD) model by intracerebroventricular injection of composited Aβ. The Morris water maze was applied for screening the successful model rats with learning and memory deficits. The successful model rats were daily and orally administrated with SBF at doses of 35, 70 and 140 mg/kg or positive control drugGinkgobilobaleaves flavonoids (GLF) at 140 mg/kg for 37 d. The silver nitrate staining was used to determine the cortical NFT. The protein levels of total tau, phosphorylated protein of tau at Ser199 and Ser214 sites, GSK3β and PP2A in hippocampus and cortex were determined by Western blot. The mRNA expression of GSK3β and PP2A in the hippocampus and cortex was detected by RT-PCR. RESULTS: Compared with sham group, the cell number of positive NFT with silver nitrate staining in model rat cerebral cortex was significantly increased. The protein levels of phosphorylated tau protein at Ser199 and Ser214 sites, GSK3β in the hippocampus and cerebral cortex in the model rats dramatically elevated, and PP2A was marked decreased as compared with the sham group rats. Meanwhile, the mRNA expression of GSK-3β significantly increased but PP2A was decreased. However, these above abnormalities were differently attenuated by treating with SBF at different doses or GLF at 140 mg/kg for 37 d. CONCLUSION: SBF suppresses the NFT aggregation by inhibition of the regulatory functions of GSK-3β and PP2A, thus reducing the phosphorylation of tau protein.
Scutellaria barbata flavonoids; Amyloid β25-35; AlCl3; Recombinant human transforming growth factor-β1; Neurofibrillary tangle; tau protein; Glycogen synthase kinase 3β; Protein phosphatases 2A
1000- 4718(2016)12- 2147- 10
2016- 04- 07
2016- 09- 14
河北省自然科学基金资助项目(No. C2009001007; No. H2014406048);河北省中医药管理局资助项目(No. 05027); 河北省高校重点学科建设项目
R363; R749.1+6
A
10.3969/j.issn.1000- 4718.2016.12.005
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0314-2290616; E-mail: shangyz@sina.com
