Akt通路及细胞凋亡在瘦素介导的大鼠慢性吗啡镇痛耐受中的作用*
2017-01-03郭瑞鲜莫利求冯鉴强
胡 芬, 崔 宇, 郭瑞鲜, 莫利求, 冯鉴强△
(中山大学 1附属第一医院病理学教研室, 2中山医学院生理学教研室,广东 广州 510080; 3中山大学附属第一医院黄埔院区麻醉科,广东 广州 510700)
Akt通路及细胞凋亡在瘦素介导的大鼠慢性吗啡镇痛耐受中的作用*
胡 芬1, 崔 宇2, 郭瑞鲜2, 莫利求3, 冯鉴强2△
(中山大学1附属第一医院病理学教研室,2中山医学院生理学教研室,广东 广州 510080;3中山大学附属第一医院黄埔院区麻醉科,广东 广州 510700)
目的: 探讨Akt(又称蛋白激酶B)及活化的caspase-3在瘦素介导的大鼠慢性吗啡镇痛耐受中的作用。方法:在SD大鼠建立慢性吗啡镇痛耐受模型;采用Western blotting法测定脊髓Akt和cleaved caspase-3的水平;免疫组织化学染色法检测脊髓磷酸化Akt (p-Akt)及cleaved caspase-3阳性细胞;免疫双染检测p-Akt及cleaved caspase-3阳性细胞的定位。结果:鞘内慢性注射吗啡(15 μg)7 d可明显上调大鼠脊髓p-Akt及cleaved caspase-3的蛋白水平;在注射吗啡前30 min,鞘内注射瘦素拮抗剂(3 μg)7 d能显著地抑制慢性吗啡处理对p-Akt和cleaved caspase-3的上调作用;p-Akt只定位在脊髓神经元,而cleaved caspase-3仅定位在星形胶质细胞;瘦素拮抗剂、Akt抑制剂及caspase-3抑制剂均能抑制慢性吗啡镇痛耐受。结论:脊髓Akt通路及活化的caspase-3参与瘦素介导的大鼠慢性吗啡镇痛耐受。
瘦素; Akt; Caspase-3; 吗啡镇痛耐受
瘦素(leptin)是一种主要由脂肪组织分泌的分子量为16 kD的激素,随血循环到达全身各系统发挥重要的生理及病理生理作用。近年,有研究证实,瘦素与神经损伤引起的痛行为有关[1]。我们观察到,瘦素可通过激活信号转导子与转录激活子3 (signal transducer and activator of transcription 3,STAT3)通路和NMDA受体介导大鼠吗啡(morphine, Mor)镇痛耐受[2]。但是,瘦素在大鼠吗啡镇痛耐受中的作用机制是复杂的,可能还涉及其他的下游信号分子。
磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-Akt(也被称为蛋白激酶B)通路是瘦素介导的食物摄取快速作用的必需通路[3]。值得注意的是,吗啡受体与吗啡对Akt有明显的调节作用, 例如吗啡通过激活Akt引起体外培养的小胶质细胞增殖[4]。但是Akt是否参与瘦素介导的吗啡镇痛耐受尚未明了。
近年来,慢性吗啡处理的致神经元凋亡作用受到重视。有报道慢性吗啡处理能激活大鼠脊髓caspase-3(为反映细胞凋亡的指标),此作用与吗啡镇痛耐受有关[5-6]。但是,瘦素是否参与慢性吗啡耐受对caspase-3 的激活作用,国内外迄今未见报道。
为了探讨上述的研究内容,本研究拟在SD大鼠建立吗啡镇痛耐受模型,重点探讨Akt通路在瘦素介导的吗啡镇痛耐受和活化的caspase-3在瘦素介导的吗啡镇痛耐受中的作用。
材 料 和 方 法
1 动物和试剂
清洁级SD雄性大鼠36只,体重250~280 g,由国家级动物实验中心中山大学北校区动物中心提供。
盐酸吗啡购自青海制药有限公司;瘦素拮抗剂(leptin antagonist,LA)由ProSpec供应;兔抗大鼠瘦素多克隆抗体和羊抗大鼠瘦素受体多克隆抗体购自Santa Cruz;Akt抑制剂LY294002(LY)、兔抗大鼠p-Akt多克隆抗体及兔抗大鼠Akt多克隆抗体购自CST;caspase-3抑制剂Ac-DEVD-CHO (Ac)购自Sigma;兔抗大鼠cleaved caspase-3 抗体购自Bioworld;小鼠抗大鼠神经元特异性核蛋白(neuron-specific nuclear protein,Neu)单克隆抗体、小鼠抗大鼠小胶质细胞标志物OX-42单克隆抗体及小鼠抗大鼠GFAP单克隆抗体购自Chemicon。
2 方法
2.1 实验动物模型的建立、行为学测试及分组 大鼠于12 h光照-黑暗循环、安静环境下单笼饲养,自由饮水摄食。室温控制在(25±1) ℃。按照前文[2]介绍的方法,每只大鼠每天于上午9时接受1次鞘内吗啡注射(15 μg),连续注射7 d。在给予注射吗啡前及注射后30 min的第1、3、5、7天以热甩尾法测试甩尾阈值,注射前为基础阈值(basic latency,BL),注射后为镇痛阈值(total latency,TL),动物尾部在热水[(50.0±0.2) ℃]中停留最长时间为15 s(cut-off time), 使用最大镇痛百分比(percentage of maximal potential effect,%MPE)=(TL-BL)/(cut-off time-BL)×100%作为统计值来进行行为学测试。大鼠随机分为8组,每组6只:生理盐水(normal saline,NS)对照组、吗啡耐受组(NS+Mor组)、瘦素拮抗剂(LA)干预组(LA+Mor组)、瘦素拮抗剂对照组(LA+NS组)、Akt抑制剂(LY)干预组(LY+Mor组)、Akt抑制剂对照组(LY+NS组)、caspase-3抑制剂干预组(Ac+Mor组)和caspase-3抑制剂对照组(Ac+NS组)。干预组在给予吗啡注射前30 min给予药物干预。
2.2 Western blot法测定Akt及caspase-3的蛋白水平 行为学测定结束后,立即处死大鼠取得新鲜脊髓组织,将组织与裂解液以1∶10比例于4 ℃混合匀浆后,迅速以15 000 r/min离心30 min,4 ℃离心取上清组织蛋白,于-80 ℃储存。将组织蛋白与缓冲液以2∶1混合后加入SDS-PAGE凝胶中以恒压进行蛋白电泳,将组织蛋白以8 V、30 min转至PVDF膜,再将PVDF膜分别置于I抗液中(cleaved caspase-3,1∶2 000;p-Akt,1∶500)4 ℃孵育过夜,冲洗后置于 II 抗液中(1∶3 000)室温孵育1.5 h,使用ECL发光显影法于暗房中显影,使用图像分析软件进行各条带的灰度分析。
2.3 免疫荧光双染法检测p-Akt及cleaved caspase-3的细胞定位 行为学测定结束后,立即注射过量苯巴比妥钠(100 mg/kg)处死大鼠,采用4%多聚甲醛溶液灌注后取腰段脊髓进行脱水及切片。加3%正常羊血清封闭1 h;加入稀释后的混合 I 抗50 μL:兔抗大鼠p-Akt多克隆抗体(1∶200)或兔抗大鼠cleaved caspase-3 抗体(1∶200),分别与小鼠抗大鼠Neu单克隆抗体(1∶400)、小鼠抗大鼠OX-42(1∶400)或小鼠抗大鼠胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体(1∶400)置于I抗稀释液中混合,4 ℃孵育过夜;冲洗后再加入稀释后的混合 II 抗50 μL:Cy3标记的羊抗兔荧光II抗(1∶400)和FITC标记的羊抗小鼠荧光II抗(1∶400)。室温于暗盒中避光孵育2 h,甘油缓冲液封片置于暗玻片盒中。Olympus荧光显微镜下观察并照相。
3 统计学处理
采用SPSS 20.0统计分析软件进行统计学分析,所有实验结果数据以均数±标准误(mean±SEM)表示。组间均数比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 瘦素拮抗剂抑制慢性吗啡处理对大鼠脊髓p-Akt蛋白水平的上调作用
图1显示,在鞘内连续7 d注射吗啡(15 μg/d)可明显上调大鼠脊髓p-Akt的蛋白水平,与注射生理盐水组比较,差异具有统计学显著性(P<0.05);但是在吗啡注射前30 min,鞘内连续7 d注射3 μg LA显著抑制慢性吗啡处理对脊髓p-Akt蛋白水平的上调作用(P<0.05)。而单独鞘内注射LA 7 d对p-Akt的基础水平无明显影响。
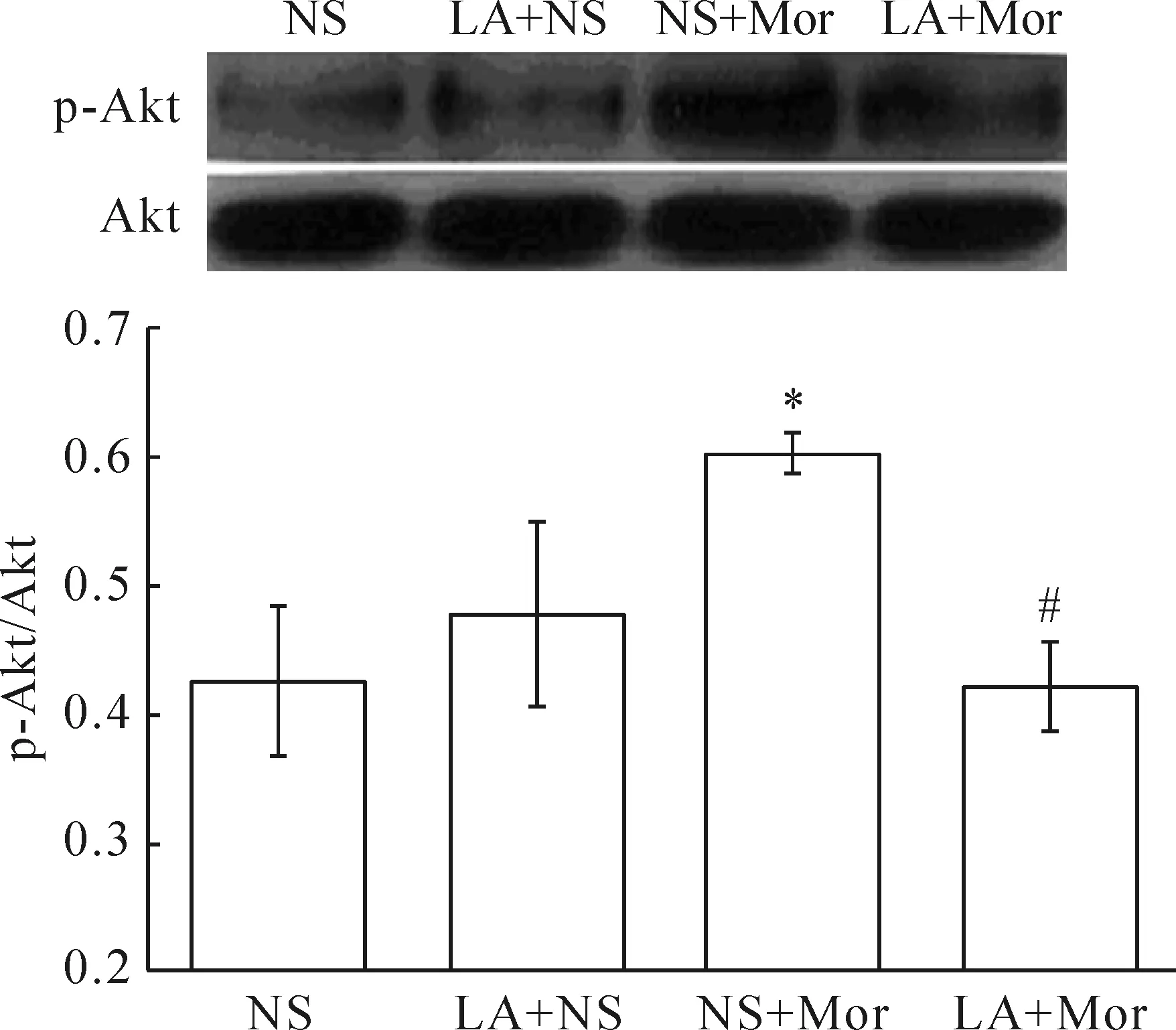
Figure 1.Leptin antagonist (LA) attenuated chronic morphine (Mor)-induced upregulation of spinal protein level of phosphorylated (p)-Akt in the rats. Mean±SEM.n=3.*P<0.05vsNS group;#P<0.05vsNS+Mor group.
图1 瘦素拮抗剂抑制慢性吗啡处理对大鼠脊髓磷酸化Akt表达的上调作用
2 慢性吗啡耐受大鼠脊髓p-Akt特异定位于神经元
免疫荧光双染法可确定p-Akt阳性的细胞类型。使用GFAP(绿色荧光)作为星形胶质细胞标志物,OX-42(绿色荧光)作为小胶质细胞的标志物,Neu(绿色荧光)作为神经元的标志物。免疫荧光双染结果显示,p-Akt(红色荧光)仅定位于脊髓神经元,在星形胶质细胞和小胶质细胞均未见p-Akt的荧光信号,见图2。
3 瘦素拮抗剂抑制慢性吗啡处理对脊髓cleaved caspase-3蛋白水平的上调作用
图3显示,鞘内连续7 d注射吗啡显著增加大鼠脊髓cleaved caspase-3(反映caspase-3被激活)的蛋白水平,与注射生理盐水组比较,差异有统计学显著性(P<0.05)。然而,在注射吗啡前30 min,鞘内连续7 d注射LA明显减弱了慢性吗啡处理对脊髓cleaved caspase-3蛋白水平的促进作用,与吗啡耐受组比较,差异具有统计学显著性(P<0.05)。而单独鞘内注射LA 7 d对脊髓cleaved caspase-3的基础水平无明显作用。

Figure 2.The p-Akt was exclusively observed in the spinal neurons in the chronic morphine-treated rats. GFAP as an astrocyte marker; OX-42 as a microglia marker; Neu as a neuron marker. The scale bar=50 μm.
图2 慢性吗啡耐受大鼠脊髓p-Akt仅表达于神经元

Figure 3.Leptin antagonist (LA) ameliorated chronic morphine (Mor)-induced an increase in spinal protein level of cleaved caspase-3 in the rats. Mean±SEM.n=3.*P<0.05vsNS group;#P<0.05vsNS+Mor group.
图3 瘦素拮抗剂减弱慢性吗啡处理对大鼠脊髓cleaved caspase-3蛋白水平上调的促进作用
4 Cleaved caspase-3特异定位于脊髓星形胶质细胞
图4结果显示,在慢性吗啡处理的大鼠,cleaved caspase-3(红色荧光)只定位于脊髓星形胶质细胞,在小胶质细胞及神经元未见cleaved caspase-3的荧光信号。

Figure 4.The cleaved caspase-3 was exclusively observed in the spinal astrocytes in the chronic morphine-treated rats. GFAP as an astrocyte marker; OX-42 as a microglia marker; Neu as a neuron marker. The scale bar=50 μm.
图4 慢性吗啡处理大鼠脊髓cleaved caspase-3仅定位于星形胶质细胞
5 瘦素拮抗剂、Akt抑制剂及caspase-3抑制剂减轻大鼠慢性吗啡镇痛耐受
疼痛行为学的检测结果显示,第1天给予大鼠鞘内注射吗啡可产生明显的镇痛作用[%MPE=(99.65±1.60)%],与注射生理盐水组比较,差异具有统计学显著性(P<0.05)。在连续鞘内注射吗啡期间,从第3天开始,吗啡镇痛作用明显减弱,%MPE降至(73.34±3.95)%,与第1天的作用比较,差异有统计学显著性(P<0.05),表明吗啡镇痛耐受开始形成。随着注射吗啡的时间延长,注射吗啡的第5天和第7天的镇痛作用进一步减弱,其中注射吗啡第7天的%MPE已降至(16.57±2.18)%,与注射吗啡第1、3和5天的镇痛作用分别比较,差异有统计学显著性(P<0.05)。上述结果表明,鞘内连续7天注射吗啡已导致大鼠产生吗啡镇痛耐受。

Figure 5.The inhibitory effects of intrathecal injection of leptin antagonist (LA), Akt inhibitor (LY) and caspase-3 inhibitor (Ac) on chronic morphine (Mor) antinociceptive tolerance in rats. Mean±SEM.n=6.*P<0.05vsNS+Mor group;#P<0.05vsNS group.
图5 鞘内注射瘦素拮抗剂、Akt抑制剂和caspase-3抑制剂对慢性吗啡镇痛耐受的抑制作用
重要的是,在注射吗啡前30 min,鞘内分别连续7 d注射瘦素拮抗剂(3 μg)或Akt抑制剂(5 mmol/L)或caspase-3抑制剂(5 μg)均能明显地减轻大鼠慢性吗啡镇痛耐受,其中注射的第5天,%MPE从(38.09±5.96)%分别增加至(66.27±3.90)%、(60.77±7.22)%和(66.46±8.20)%。注射的第7 d,%MPE从(16.57±2.18)%分别增加至(54.29±5.83)%、(49.53±6.43)%和(58.92±6.11)%。而单独鞘内分别注射LA、LY、Ac或生理盐水均不影响大鼠的基础痛阈。
讨 论
吗啡是一种临床上常被用于治疗急性和慢性疼痛的阿片类药物。然而,长期持续应用吗啡会产生吗啡镇痛耐受,表现为吗啡的镇痛作用逐渐减弱,甚至产生痛觉过敏,因此,限制了吗啡的临床应用。目前,深入探讨吗啡镇痛耐受机制已成为镇痛原理的一个重要课题。
越来越多的研究证实,引起吗啡镇痛耐受的分子机制和细胞机制是复杂的,涉及中枢神经系统的多个部位,如海马、脊髓等;涉及多种细胞,如神经元、胶质细胞等;涉及多种受体,如阿片受体、NMDA受体等;涉及多种信号通路。近年来我们已证实大鼠脊髓小胶质细胞的p38丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)通路[7]、NMDA-JNK通路[8]及瘦素-STAT3通路[2]参与吗啡镇痛耐受。瘦素是一种主要由脂肪组织分泌的多肽激素,随血循环到达全身多系统发挥其生理及病理生理作用[9]。我们最近证实,瘦素及其受体可在大鼠脊髓背角及背根节中表达,而且,慢性吗啡处理可促进它们的表达[2]。但是,一些受吗啡处理调控的信号分子,如Akt和cleaved caspase-3是否参与瘦素介导的吗啡镇痛耐受,迄今未见报道。Akt是瘦素靶通路PI3K通路的一个下游激酶,参与病理性神经痛的发生[10]。急性吗啡处理(只注射1次)可上调大鼠伏核p-Akt的水平[11]。基于这些研究基础,本研究推测,Akt可能参与瘦素介导的慢性吗啡镇痛耐受。研究结果表明,鞘内慢性吗啡注射可明显促进大鼠脊髓背角神经元p-Akt蛋白水平的上调;瘦素拮抗剂能抑制慢性吗啡处理对p-Akt的上调作用,提示Akt通路位于瘦素的下游。进一步的研究证实,Akt抑制剂能抑制慢性吗啡镇痛耐受,表明脊髓Akt通路参与慢性吗啡镇痛耐受的发生。上述结果表明,通过激活Akt通路可能是瘦素介导慢性吗啡镇痛耐受的作用机制之一。
另一方面,本研究探讨了脊髓凋亡信号分子cleaved caspase-3在瘦素介导吗啡镇痛耐受中的作用。有报道称慢性吗啡处理能激活大鼠脊髓的caspase-3,caspase-3的抑制剂能减轻吗啡镇痛耐受[5-6]。与他们的实验结果相一致,本研究证实,鞘内连续7 d注射吗啡可明显地促进cleaved caspase-3的蛋白水平的上调,而且,cleaved caspase-3仅定位于大鼠脊髓背角的星形胶质细胞。Caspase-3抑制剂(Ac)能明显地减轻大鼠慢性吗啡镇痛耐受。有意义的是,我们证实瘦素拮抗剂能显著地抑制慢性吗啡处理对cleaved caspase-3的上调作用,提示cleaved caspase-3是瘦素的一个下游靶分子,瘦素可通过激活caspase-3引起大鼠吗啡镇痛耐受。由于有研究指出,慢性吗啡处理可激活脊髓星形胶质细胞[12-14]。因此,今后进一步探讨在吗啡镇痛耐受中,活化的caspase-3与星形胶质细胞活动的相互关系将有助于深入阐明慢性吗啡镇痛耐受的病理生理机制。
综上所述,本研究清晰地证实脊髓的Akt通路及cleaved caspase-3参与瘦素介导的大鼠慢性吗啡镇痛耐受,有可能是吗啡镇痛耐受的一个新颖的病理生理机制。
[1] Maeda T, Kiguchi N, Kobayashi Y, et al. Leptin derived from adipocytes in injured peripheral nerves facilitates development of neuropathic pain via macrophage stimulation[J]. Proc Natl Acad Sci U S A, 2009, 106(31):13076-13081.
[2] Hu F, Cui Y, Guo RX, et al. Spinal leptin contributes to the development of morphine antinociceptive tolerance by activating the STAT3-NMDA receptor pathway in rats[J]. Mol Med Reports, 2014, 10(2):923-930.
[3] Niswender KD, Morton GJ, Stearns WH, et al. Intracellular signalling. Key enzyme in leptin-induced anorexia[J]. Nature, 2001, 413(6858):794-795.
[4] Horvath RJ, DeLeo JA. Morphine enhances microglial migration through modulation of P2X4 receptor signaling[J]. J Neurosci, 2009, 29(4):998-1005.
[5] Mao J, Sung B, Ji RR, et al. Neuronal apoptosis associated with morphine tolerance: evidence for an opioid-induced neurotoxic mechanism[J]. J Neurosci, 2002, 22(17): 7650-7661.
[6] Lim G, Wang S, Lim JA, et al. Activity of adenylyl cyclase and protein kinase A contributes to morphine-induced spinal apoptosis[J]. Neurosci Lett, 2005, 389(2): 104-108.
[7] Cui Y, Liao XX, Liu W, et al. A novel role of minocycline: Attenuating morphine antinociceptive tolerance by inhibition of p38 MAPK in the activated spinal microglia[J]. Brain Behavior Immun, 2008, 22(1):114-123.
[8] Guo RX, Zhang M, Liu W, et al. NMDA receptors are involved in upstream of the spinal JNK activation in morphine antinociceptive tolerance [J]. Neuroscience Letters, 2009, 467(2): 95-99.
[9] 李晓娟, 陆大祥. 瘦素(leptin)与肥胖[J]. 中国病理生理杂志, 2003, 19(7):992-995.
[10]Pereira PJ, Lazarotto LF, Leal PC, et al. Inhibition of phosphatidylinositol-3 kinase gamma reduces pruriceptive, inflammatory, and nociceptive responses induced by trypsin in mice[J]. Pain, 2011, 152(12):2861-2869.
[11]Muller DL, Unterwald EM.Invivoregulation of extracellular signal-regulated protein kinase (ERK) and protein kinase B (Akt) phosphorylation by acute and chronic morphine[J]. J Pharmacol Exp Ther, 2004, 310(2):774-782.
[12]Song P, Zhao ZQ. The involvement of glial cells in the development of morphine tolerance[J]. Neurosci Res, 2001, 39(3):281-286.
[13]Chen ML, Cao H, Chu YX, et al. Role of P2X7 receptor-mediated IL-18/IL-18R signaling in morphine tolerance: multiple glial-neuronal dialogues in the rat spinal cord [J]. J Pain, 2012, 13(10):945-958.
[14]刘 微, 郭瑞鲜, 崔 宇, 等. 脊髓星形胶质细胞的JNK介导吗啡耐受[J].中国药理学通报, 2010, 26(11):1435-1439.
(责任编辑: 陈妙玲, 罗 森)
Roles of Akt pathway and cell apoptosis in leptin-mediated chronic morphine antinociceptive tolerance
HU Fen1, CUI Yu2, GUO Rui-xian2, MO Li-qiu3, FENG Jian-qiang2
(1DepartmentofPathology,FirstAffiliatedHospital,2DepartmentofPhysiology,ZhongshanMedicalSchool,SunYat-senUniversity,Guangzhou510080,China;3DepartmentofAnesthesiology,HuangpuArea,FirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510700,China.E-mail:fengjq-sums@163.com)
AIM: To explore the roles of Akt (also called protein kinase B) and active caspase-3 in the leptin-mediated chronic morphine antinociceptive tolerance in rats. METHODS: A model of chronic morphine antinociceptive tolerance was established in the SD rats. The protein levels of spinal Akt and cleaved caspase-3 were tested by Western blotting. The technique of immunohistochemical staining was used to detect the immunoreactivity positive cells of phosphorylated (p)-Akt and cleaved caspase-3 in the spinal cord. Double staining of immunohistochemistry was used to examine the cellular location of the p-Akt and cleaved caspase-3 positive cells. RESULTS: The chronic intrathecal injection of morphine (15 μg) for 7 d markedly upregulated the spinal protein levels of p-Akt and cleaved caspase-3 in the rats. Thirty min before injection of morphine, intrathecal injection of leptin antagonist (3 μg) for 7 d significantly attenuated the upregulation of the protein levels of p-Akt and cleaved caspase-3 induced by chronic morphine treatment. The p-Akt was exclusively observed in the spinal neurons. The cleaved caspase-3 was only localized with the spinal astrocytes. Intrathecal injecting the inhibitors of leptin, Akt and caspase-3 ameliorated the chronic antinociceptive tolerance. CONCLUSION: The spinal Akt pathway and active caspase-3 are involved in the leptin-mediated chronic morphine antinociceptive tolerance in rats.
Leptin; Akt; Caspase-3; Morphine antinociceptive tolerance
1000- 4718(2016)12- 2163- 05
2016- 04- 29
2016- 08- 18
广东省医学科学技术研究基金资助项目(No.A2015415)
R363
A
10.3969/j.issn.1000- 4718.2016.12.007
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 13609738327; E-mail: fengjq-sums@163.com
