镍掺杂二氧化钛催化剂的制备及其光催化性能*
2016-12-29田小兵丁艳花房永征刘玉峰
田小兵,丁艳花,房永征,张 娜,刘玉峰,李 强
(1 武汉理工大学资源与环境工程学院,湖北武汉 430070;2 上海应用技术大学材料科学与工程学院,上海 201418;3 华东师范大学化学系,上海 200241)
镍掺杂二氧化钛催化剂的制备及其光催化性能*
田小兵1,丁艳花2,房永征2,张 娜2,刘玉峰2,李 强3
(1 武汉理工大学资源与环境工程学院,湖北武汉 430070;2 上海应用技术大学材料科学与工程学院,上海 201418;3 华东师范大学化学系,上海 200241)
采用溶胶-凝胶法制备了镍离子掺杂的二氧化钛光催化材料,利用靛蓝胭脂红染料溶液为目标污染物在可见光下将其光催化降解,研究了不同Ni掺杂TiO2催化剂的光催化活性。重点研究了不同镍掺杂浓度和煅烧温度,表面状态等对镍掺杂二氧化钛催化剂的影响,其中镍的掺杂浓度为1%,经过400℃煅烧的催化剂的效果最好,在可见光下40min就可以将10mg/L的靛蓝胭脂红溶液降解完。
镍掺杂二氧化钛,溶胶-凝胶法,光催化活性
二氧化钛光催化材料是目前被广泛研究的新型环保材料,通过其光催化氧化染料废水,农药、医药废水,含表面活性剂、氰化物等废水,均取得了较好的效果[1-2]。近年来,关于TiO2半导体光催化剂用于环境污染物降解的研究已受到广泛关注,并在一些基础研究与应用研究方面取得不少显著成果[3-4]。TiO2光催化剂本身一些缺陷,如禁带较宽、电子和空穴的复合等导致催化效率较低[5-7]。研究发现,金属离子掺杂是提高TiO2光催化活性的一种有效手段[8-10]。从化学角度考虑,掺杂金属离子有利于光生电子和空穴的分离,提高其量子效率。此外,掺杂金属离子后,TiO2吸收带也会发生红移,又可使其吸光范围向可见光区拓宽,这两种效应均可提高TiO2的光催化活性。
最近,利用不同的方法合成镍掺杂二氧化钛的文献相继被报道,制备出的光催化剂使用不同的方法测试其光催化性能。Akihiko KUDO等[11]以硝酸镍为镍源采用离子注入法,最后在空气中573K煅烧制备了NiO/TiO2催化剂,该催化剂可以将NaOH溶液中的水光解为H2和O2,但是不能分解纯水,但NaOH的作用还有待讨论。Thammanoon Sreethawong等[12]以表面活性剂为模板采用一步溶胶凝胶法合成了氧化镍和介孔二氧化钛的复合材料,同时作为对比还采用了初始湿法注入的方法制备了该催化剂,结果表明,一步溶胶凝胶法制备的样品光催化制氢的效果要优于IWI法,催化剂的活性与其制备方法有很大的关系。Dong Hyun Kim等[13]采用金属合金研磨的方法制备了镍掺杂的锐钛矿型和金红石型二氧化钛,研究了过渡金属在二氧化钛中的掺杂机理,以及晶型和催化作用之间的关系,结果表明镍掺杂的金红石型的二氧化钛具有最好的催化效果。S.H. Woo等[14]同样制备了镍掺杂的二氧化钛,催化剂呈规则的球形粒子,一次粒径约为50nm,二次粒径约为100nm~300nm,其中镍的含量为8%的样品在可见光下光催化氧化氯酚的性能最佳,可见镍的掺杂能够拓宽二氧化钛的光谱响应范围,吸收可见光。Dengwei Jing等[15]以介孔二氧化钛为基质成功掺杂了Ni2+,研究发现,Ni2+的掺杂能提高二氧化钛的热稳定性,控制介孔催化剂的形态,更重要的是镍离子的存在抑制了电子空穴对在介孔材料表面的复合,提高了催化剂的催化活性。
本研究采用传统的溶胶凝胶法,以钛酸丁酯为前驱体,以醋酸镍为镍源制备了镍掺杂的二氧化钛,利用在可见光下降解靛红染料废液,考察了镍的掺杂浓度以及煅烧温度对催化剂的光催化活性的影响。
1 实验部分
在室温下将30mL钛酸丁酯与20mL无水乙醇混合,搅拌40min,得到均匀透明的黄色溶液A;然后在室温下将不同质量的乙酸镍加入到10mL无水乙醇中,超声至完全溶解,形成绿色溶液B,并将绿色溶液B加入到黄色溶液A中,搅拌2h;将pH=3的乙酸溶液在搅拌条件下缓慢滴入上述混合液中,至形成凝胶,陈化12h,70℃旋转蒸发,再在烘箱中充分干燥,得到干凝胶,研磨成粉末,分别在400℃、500℃、600℃、700℃煅烧6h,得到镍掺杂的二氧化钛催化剂,其中镍的含量分别为二氧化钛质量的1%、3%、5%。
作为对比,按上述方法制备了不同煅烧温度下的纯二氧化钛。
本研究中,我们采用靛蓝胭脂红溶液模拟工业废水,考察催化剂在可见光下的光催化活性。光催化测定实验是在一个特制的双层反应容器中进行的,容器隔层通有循环水以保持室温并在容器底部加以磁力搅拌。使用500 W卤钨灯作为可见光光源,水平放置于反应体系上方约20cm处,在反应器上方2cm处放置KenKo L41 滤光镜屏蔽410nm以下的紫外光,从而控制照射到体系的光为可见光。靛蓝胭脂红溶液的最佳吸收波长为610nm。靛蓝胭脂红溶液脱色率的计算公式为:
式中:C表示脱色率(%),A0是靛蓝胭脂红溶液初始吸光度,A是光催化后靛蓝胭脂红溶液的吸光度。
2 结果与讨论
2.1 X射线衍射光谱(XRD)
图1是经过不同温度煅烧下的纯二氧化钛和镍掺杂的二氧化钛催化剂的XRD图。随着煅烧温度的升高,晶体的结晶度提高。经过400℃煅烧的纯TiO2以及Ni/TiO2都呈现出板钛矿相和锐钛矿相的混合相结构。Ni/TiO2在500℃、600℃煅烧下都是锐钛矿型的,没有金红石相出现。当700℃时,TiO2大部分转变为金红石型。说明掺杂后从锐钛矿到金红石的转变温度提高了,Ni的掺杂抑制了锐钛矿向金红石的转变。Ni掺杂TiO2复合材料从锐钛矿到金红石的转变主要是TiO62-八面体的重排[16-17],而掺杂离子延迟了八面体的重排,因此高温时锐钛矿仍具有一定的稳定性。当Ni掺杂元素从二氧化钛晶格中挤出时,锐钛矿将全部转变为金红石。

图1 不同温度煅烧后的掺镍TiO2的XRD图
2.2 催化剂的形貌分析
从图2中观察到,Ni/TiO2形貌近似球形,且大小均匀,样品的粒径约为5nm~8nm,很明显观察到TiO2的晶格条纹,根据晶格条纹的间距,计算得到是锐钛矿型TiO2的(101)晶面。

图2 400℃煅烧后1% Ni/TiO2 的TEM图
2.3 紫外-可见漫反射光谱(UV-Vis)
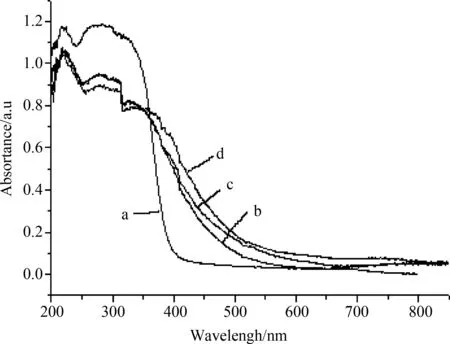
图3 400℃ 煅烧后纯TiO2和不同镍掺杂浓度的TiO2的紫外-可见吸收光谱:(a)纯TiO2;(b)5%;(c)3%;(d)1%
Fig.3 UV-Vis diffuse reflectance spectra of pure TiO2andNi-doped TiO2with different doping concentration calcined at 400℃:(a) pure TiO2;(b)5%;(c)3%;(d)1%
TiO2是一种能带隙较宽的半导体,其中锐钛矿相能带隙为3.2eV (387nm),金红石相能带隙为3.0eV (413nm)。为研究Ni/TiO2复合催化剂的光吸收性能,从图3可以看出,锐钛矿TiO2在200nm~380nm范围内产生吸收,这是由于在纯TiO2的能带结构中,导带是钛的空d轨道(t2g),价带主是O 2p轨道。Ni/TiO2的吸收光谱范围都有红移现象。这主要是由于镍原子d轨道比O 2p轨道的势能高,因此这些轨道与O 2p轨道形成新的杂化轨道[18]位于二氧化钛最初的价带和导带之间。由于中间能带的形成,减小了禁带宽度,使TiO2具有了可见光响应。同时,可能由于在TiO2粒子表面产生的氧空位[19],由于氧空位的能级介于TiO2的导带和价带之间,因此Ni/TiO2能够吸收可见光。他们认为能带隙变窄只有在较高的掺杂浓度条件下才能发生,并且此时TiO2的晶格将发生严重畸变。尽管随着掺杂浓度的增加,有可能产生更多的氧空位,但是能够使电子和空穴复合的晶体缺陷的数量也会增加。因此,掺杂浓度存在一个最佳值。如图所示3,镍的掺杂量为1%的TiO2在可见光区域表现了较强的吸收,根据直线外推法得出吸收带边界为580nm,由公式[Eg=1240/λ(nm)]计算出本征带隙能为2.1eV。当掺杂浓度增大时,样品的吸收光谱带边的红移程度相应减小,对可见光的有效利用率降低。因此,当镍的掺杂浓度为1%时,TiO2对可见光的响应范围宽,对太阳光的利用率高,有助于提高催化剂的光催化活性。
2.4 X射线电子能谱(XPS)
图4(a)中 Ti 2p的XPS图谱在464.25eV与458.48eV 出现了两个特征峰,分别对应着锐钛矿型TiO2中Ti4+2p1/2和Ti4+2p3/2的吸收峰,说明样品中的Ti元素以Ti4+形式存在,表明样品中的钛氧键是稳定的[21]。图4(b)是O的1s的XPS峰。由图可知O元素的XPS图是不对称的,呈现多个峰,说明粒子表面的氧物种不是由单一的晶格氧(529.5eV)组成。在能谱里,O 1s的峰是可由3~5种不同的氧。
图4(c)为Ni 2p的XPS峰,在光谱中呈现出多个杂峰。这是由于镍的相对含量低,信号较弱造成的。主要的峰位于855.38eV处,对应于Ni 2p3/2峰,结果表明在Ni/TiO2中已有部分Ti原子被Ni原子所取代。一般认为,Ni3+和Ni的XPS峰分别位于857.3eV、852.6eV~852.8eV,这就说明855.38eV处的峰是Ni2+的2p峰,证明了掺杂二氧化钛催化剂中的镍是以Ni2+形式存在的。将400℃和500℃样品中的镍元素的XPS峰比较,图4(c)所示,500℃样品中Ni 2p3/2峰位于855.92eV,结合能提高了0.4eV,这是由于随着温度的升高部分掺杂在TiO2晶格内部的Ni原子被挤出来,致使晶体表面氧空穴减少,结合能提高[22]。



图4 400℃ 和500℃ 1%-Ni/TiO2的XPS图:(a)Ti 2p;(b)O 1s;(c)Ni 2p
2.5 可见光催化活性的研究
选用了镍掺杂浓度为1%,煅烧温度为400℃的样品,进行相同实验条件的光催化。暗反应时间统一为1h,开灯光照,在卤钨灯的照射下,光降解的染料是10mg/L的靛红溶液。从图5(a)可以看出,1.0g/L的光催化效果好,在光照40min降解率为100%。因此,在反应时间与经济性的双重考虑下,催化剂浓度1.0g/L来进行光催化实验。
由图5(b)可知,随着镍掺杂量的增多,催化剂的催化活性先增大后降低,当镍的掺杂量为1%时,催化活性达到最佳。在光催化反应中,金属离子可能成为光生电子的捕获中心,而有效地抑制光生电子和空穴的复合,提高了光催化的活性。当掺入浓度较低时,增加杂质离子的浓度,载流子的俘获位会随之增多,使得载流子寿命延长,提高光生电子-空穴的分离效果,为载流子传递创造条件,因而活性提高。当金属离子的掺杂量达到最佳值时,光催化活性最大。但是,当掺杂量大于最佳值时,由于捕获载流子的捕获位之间距离变小,掺杂离子会演变为电子和空穴的复合中心,反而使催化剂的活性降低。对Ni来说,高的掺杂浓度有利于Ni2+向Ni+转变,使Ni+可能成为光生空穴的捕获阱,从而间接地使光生电子和空穴复合,催化活性下降。此外,过高的掺杂浓度也可能减小TiO2的有效表面积而降低其光催化活性。也可能是掺杂离子浓度过高时,大部分的形成NiO/TiO2的p-n结结构,降低了纯TiO2的催化氧化能力。



图5 (a)催化剂用量(a 0.5g/L;b 1g/L;c 2g/L;d 3g/L;e 5g/L;f 10g/L),(b)400℃煅烧后不同掺杂浓度(a 0.5%;b 1% c 3%;d 5%;e 纯TiO2;f 空白试验),(c) 400℃煅烧后1%-Ni/TiO2循环次数(1-1次,2-2次,3-3次,4-4次,5-5次)对光催化性能的影响
Fig.5 (a)The effect of catalyst dosage on the photocatalytic activity (a 0.5g/L;b 1g/L;c 2g/L;d 3g/L;e 5g/L;f 10g/L),(b) Variation of normalized C/C0of indigo carmine concentration for pure TiO2andNi-doped TiO2with different doping concentration calcined at 400℃(a 0.5%;b 1% c 3%;d 5%;e pure TiO2;f blank),(c) The effect of cycle number on the photocatalytic activity of 1.0% Ni-doped TiO2calcined at 400℃
催化剂的可重复使用性对于提高催化剂的使用效率,降低使用成本有很大意义。在相同的实验条件下,把光解实验后的催化剂离心分离,用乙醇和去离子水洗涤,80℃烘干重新用于光催化反应,如此重复操作进行5次光降解,其使用次数和光催化效果见图5(c),从图中可以看出,催化剂重复使用其吸附能力和光催化活性略有提高,使用3次时的催化效果最好,第4次以后催化活性略有降低,但在50min内仍能将靛红溶液完全降解。这可能由于催化剂经过多次离心洗涤后,催化剂比表面积增大,吸附能力增强,使得催化剂具有良好的寿命。然而,随着使用次数的增多,回收过程中催化剂逐渐损失,所以实际的催化剂不可能无限制地循环使用。
3 结论
采用溶胶凝胶法制备了Ni/TiO2光催化剂,400℃下煅烧的镍含量为1%的样品具有最好的光催化活性,在可见光下40min就把靛蓝胭脂红溶液全部降解,并且具有良好的回收利用价值。结果表明:煅烧温度和掺杂离子的浓度对催化剂的活性具有很大的影响。400℃下煅烧产生的板钛矿和锐钛矿的混晶效应能有效地促进锐钛矿晶体中的光生电子和光生空穴分离从而提高了光催化活性。金属Ni离子成为光生电子的捕获中心,而有效地抑制光生电子和空穴的复合,提高了光催化的活性,所以镍离子的掺杂要适量。
[1] Hoffmann M R,Martin S T,Choi W,et al. Environmental applications of semiconductor photocatalysis[J]. Chem. Rev.,1995,95(1):69-96.
[2] Hager S,Bauer R. Heterogeneous photocatalytic oxidation of organics for air purification by near UV irradiated titanium dioxide[J]. Chemosphere,1999,38(7):1549-1559.
[3] Cherian S,Wamser C C. Adsorption and Photoactivity of Tetra (4-carboxyphenyl) porphyrin (TCPP) on Nanoparticulate TiO2[J]. J. Phys. Chem. B,2000,104(15):3624-3629.
[4] Wold A. Photocatalytic properties of titanium dioxide (TiO2)[J]. Chem. Mater.,1993,5(3):280-283.
[5] Xu A W,Gao Y,Liu H Q. The preparation,characterization,and their photocatalytic activities of rare-earth-doped TiO2nanoparticles[J]. J. Catal.,2002,207(2):151-157.
[6] ZHU J,FU W,HE B,et al. Fe3+,Cr3+-doped TiO2Photocatalysts Preparedby the Sol-Gel and Hydrothermal Method[J]. Photographic Sci. Photoch.,2004,4:001.
[7] 梁金生,金宗哲,王静.稀土/纳米TiO2的表面电子结构[J].中国稀土学报,2002,20(1):74-76.
[8] Yang P,Lu C,Hua N,et al. Titanium dioxide nanoparticles co-doped with Fe3+and Eu3+ions for photocatalysis[J]. Mater. Lett.,2002,57(4):794-801.
[9] 李越湘,王添辉,彭绍琴,等. Eu3+,Si4+共掺杂TiO2光催化剂的协同效应[J]. 物理化学学报,2004,20(12):1434-1439.
[10] Xie Y,Yuan C,Li X. Photocatalytic degradation of X-3B dye by visible light using lanthanide ion modified titanium dioxide hydrosol system[J]. Colloids and Surfaces A,2005,252(1):87-94.
[11] Kudo A. Recent progress in the development of visible light-driven powdered photocatalysts for water splitting[J]. Int. J. Hydrogen Energy,2007,32(14):2673-2678.
[12] Sreethawong T,Suzuki Y,Yoshikawa S. Photocatalytic evolution of hydrogen over mesoporous TiO2supported NiO photocatalyst prepared by single-step sol-gel process with surfactant template[J]. Int. J. Hydrogen Energy,2005,30(10):1053-1062.
[13] Kim D H,Lee K S,Yoon J H,et al. Synthesis and electrochemical properties of Ni doped titanate nanotubes for lithium ion storage[J]. Appl. Surf. Sci.,2008,254(23):7718-7722.
[14] Woo S H,Kim W W,Kim S J,et al. Photocatalytic behaviors of transition metal ion doped TiO2powder synthesized by mechanical alloying[J]. Mat. Sci. Eng. A,2007,449:1151-1154.
[15] Jing D,Zhang Y,Guo L. Study on the synthesis of Ni doped mesoporous TiO2and its photocatalytic activity for hydrogen evolution in aqueous methanol solution[J]. Chem. Phys. Lett.,2005,415(1):74-78.
[16] Pillai S C,Periyat P,George R,et al. Synthesis of high-temperature stable anatase TiO2photocatalyst[J]. J. Phys. Chem. C,2007,111(4):1605-1611.
[17] Colon G,Hidalgo M C,Munuera G,et al. Structural and surface approach to the enhanced photocatalytic activity of sulfated TiO2photocatalyst[J]. Applied Catal. B:Environ.,2006,63(1):45-59.
[18] Xu Y,Schoonen M A A. The absolute energy positions of conduction and valence bands of selected semiconducting minerals[J]. Am. Mineral.,2000,85(3-4):543-556.
[19] Prokes S M,Gole J L,Chen X,et al. Defect-Related Optical Behavior in Surface Modified TiO2Nanostructures[J]. Adv. Funct. Mater.,2005,15(1):161-167.
[20] Kuznetsov V N,Serpone N. Visible light absorption by various titanium dioxide specimens[J]. J. Phys. Chem. B,2006,110(50):25203-25209.
[21] Li X Z,Li F B,Yang C L,et al. Photocatalytic activity of WOx-TiO2under visible light irradiation[J]. J. Photochem. Photobiol. A:Chem.,2001,141(2):209-217.
[22] Barborini E,Conti A M,Kholmanov I,et al. Nanostructured TiO2films with 2eV optical gap[J]. Adv. Mater.,2005,17(15):1842-1846.
Preparation of Ni-doped TiO2Nanocatalysts and Their Photocatalytic Performance
TIAN Xiao-bing1,DING Yan-hua2,FANG Yong-zheng2,ZHANG Na2,LIU Yu-feng2,LI Qiang3
(1 School of Resources and Environment Engineering,Wuhan University of Technology,Wuhan 430070,Hubei,China;2 School of Materials Science and Engineering,Shanghai Institute of Technology,Shanghai 201418,China;3 Department of Chemistry,East China Normal University,Shanghai 200241,China)
In this work,a series of Ni/TiO2catalysts were prepared by modified sol-gel method. And we make use of indigo carmine as the model reaction in aqueous solution under visible light to study the photocatalytic activities of Ni doped TiO2sample with different structure. The doping amounts,calcinations temperature,and surface state were investigated. The 1%-Ni-doped TiO2calcined at 400℃ has the best photocatalic ability. An indigo carmine solution of 10mg/L was completely photodegraded in 40min in the presence of such photocatalyst under visible light.
Ni-doped titanium dioxide,sol-gel method,photocatalytic activity
商洛学院科学与技术研究基金项目(13SKY006、14SKY-FWK08、SK-2014-2、14SKY011)
O 643
