趋化素上调丝裂原活化蛋白激酶的表达促进大鼠球囊损伤后颈动脉重塑
2016-12-21刘华东熊玮董少红吴美善李江华张键
刘华东 熊玮 董少红 吴美善 李江华 张键
·基础研究·
趋化素上调丝裂原活化蛋白激酶的表达促进大鼠球囊损伤后颈动脉重塑
刘华东 熊玮 董少红 吴美善 李江华 张键
目的 观察抑制趋化素基因对大鼠颈动脉球囊损伤后血管重塑的作用及机制。方法 构建大鼠颈动脉球囊损伤模型,模型组只进行球囊损伤术,不进行局部转染;慢病毒对照组球囊损伤术后于颈总动脉局部灌注对照慢病毒30min;慢病毒抑制组大鼠在球囊损伤术后于颈总动脉局部灌注趋化素基因缺陷慢病毒30min。在颈动脉局部转染趋化素基因缺陷性慢病毒,转染后第3天采用Real-timePCR检测颈动脉局部组织中趋化素的表达水平。观察抑制趋化素表达后颈动脉的内膜形态变化。采用5-溴-脱氧脲苷(BrdU)法检测颈动脉组织中血管平滑肌细胞的增殖情况,蛋白质免疫印迹法检测颈动脉组织中磷酸化的p38丝裂原活化蛋白激酶(p-p38MAPK)、磷酸化细胞外调节蛋白激酶(p-ERK1/2)、磷酸化c-jun氨基末端激酶(p-JNK)的水平。结果 在转染趋化素基因缺陷慢病毒后第3天,慢病毒抑制组趋化素mRNA水平显著低于模型组[(0.1633±0.02)比(1.005±0.02),P<0.001],差异有统计学意义。球囊损伤导致大鼠颈动脉内膜BrdU阳性颗粒明显增加,内膜显著增生,p-p38MAPK、p-ERK1/2、p-JNK的蛋白水平显著上升;抑制颈动脉中趋化素表达后,大鼠颈动脉内膜BrdU阳性颗粒减少,内膜增生程度减轻,p-p38MAPK、p-ERK1/2、p-JNK的蛋白表达水平也随之显著下降。结论 趋化素可以通过上调p38MAPK、ERK1/2及JNK的磷酸化水平,促进颈动脉损伤后内膜增生的发生。
趋化素; 血管平滑肌细胞; 血管重塑; 丝裂原活化蛋白激酶
血管损伤后的重塑过程是动脉粥样硬化和血管介入损伤后再狭窄的主要机制,其病理学基础主要是局部炎性细胞的浸润和中膜血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖和迁移[1]。趋化素(chemerin)最初被认为是一种脂肪因子,对其研究主要集中在内分泌和代谢领域[2-3]。近年来,研究发现趋化素还具有趋化因子和生长因子的作用,与肿瘤生长和心血管疾病的发生发展可能相关,但具体作用尚不清楚[4-7]。在前期研究中,本研究组发现沉默VSMC中的趋化素基因后,VSMC的增殖能力显著降低,磷酸化c-jun氨基末端激酶(c-Jun N-terminal kinase, p-JNK)的表达下降,表明趋化素具有促进VSMC增殖的作用[8-9]。本研究探讨趋化素与球囊损伤导致的血管重塑关系及其可能机制。
1 材料与方法
1.1 试剂和材料
大鼠趋化素基因缺陷性慢病毒和对照慢病毒由本实验室合成和鉴定,于-80℃保存。5-溴-脱氧脲苷(5-bromo-deoxyuridine,BrdU)抗体购自Santa Cruze公司,磷酸化p38丝裂原活化蛋白激酶(p-p38 mitogen activated protein kinase,p-p38 MAPK)、磷酸化细胞外调节蛋白激酶( extracellular regulated protein kinases1/2,p-ERK 1/2)、p-JNK抗体购自Abcam公司。
1.2 实验动物和分组
健康成年雄性SD大鼠(300±20)g,购自北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2012-0001,SPF级,动物合格证号为11400700115856。饲养环境:温度20℃~25℃,相对湿度40%~70%。大鼠在实验前于动物房环境中适应6 d。
83只SD大鼠随机分为4组:假手术组(n=15)、模型组(n=20)、慢病毒抑制组(n=24)和慢病毒对照组(n=24)。
1.3 实验方法
1.3.1 构建球囊损伤颈动脉内膜增生模型 按照本研究组前期研究采用的方法构建大鼠颈动脉球囊损伤模型[10]。其中假手术组只进行颈动脉结扎,不进行球囊损伤术;模型组只进行球囊损伤术,不进行局部转染;慢病毒对照组球囊损伤术后于颈总动脉局部灌注对照慢病毒30 min;慢病毒抑制组大鼠在球囊损伤术后于颈总动脉局部灌注趋化素基因缺陷慢病毒30 min。转染后第3天取颈总动脉组织,采用Real-time PCR检测颈动脉组织中趋化素mRNA的表达,验证转染效果。
1.3.2 血管平滑肌细胞增殖 转染后第7天各组随机处死5只大鼠,在大鼠处死前24 h经腹腔注射BrdU(100 mg/kg)。用4%多聚甲醛原位灌注固定后取颈总动脉,常规固定、脱水、石蜡包埋、切片,进行BrdU免疫组化染色。在光学显微镜下计数中膜和新生内膜BrdU阳性细胞核。BrdU指数=二氨基联苯胺(DAB)染色的阳性细胞核/苏木素染色的总细胞核。
1.3.3 颈动脉内膜形态学检测 转染后第14天各组随机取5只大鼠处死,取颈总动脉损伤处中段约2 cm血管组织,部分常规固定、脱水、石蜡包埋、切片,HE染色,在光学显微镜下观察内膜形态,在计算机图像分析系统中测量内膜、中膜面积,计算内膜/中膜面积比。
1.3.4 蛋白质免疫印迹(western blot) 转染后第14天各组随机取5只大鼠处死,取颈总动脉损伤处中段约2 cm血管组织,常规提取总蛋白。在10%的SDS-PAGE中每孔加入20 μL蛋白溶液,以80 V、30 min及120 V、1 h进行电泳分离;半干转液38 mA、90 min转入聚偏氟乙烯(PVDF)膜,5%牛奶封闭2 h。加入兔抗大鼠p-p38 MAPK一抗、p-JNK一抗(1∶200)、p-ERK 1/2一抗(1∶200)及GAPDH一抗(1∶1000),4 ℃孵育过夜。1‰ TBST洗3次,每次10 min,加入羊抗兔二抗(1∶6000)孵育1 h,再以1‰ TBST洗3次,每次10 min,加入ECL发光液100 μl在Image Quant RT ECL冷CCD成像系统进行显影,用Imagequant TL软件进行半定量分析。
1.4 统计学处理

2 结果
2.1 Real-time PCR检测转染效果
在转染趋化素基因缺陷慢病毒后第3天,采用Real-time PCR验证转染效果显示,模型组与慢病毒对照组趋化素mRNA比较[(1.005±0.02)比(0.950±0.03),P>0.05],差异无统计学意义(P>0.05),而慢病毒抑制组趋化素mRNA水平显著低于模型组[(0.1633±0.02)比(1.005±0.02),P<0.001],差异有统计学意义(图1)。
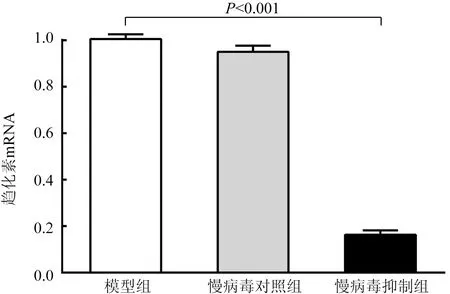
图1 Real-time PCR检测颈动脉组织的趋化素mRNA水平(n=5)
2.2 趋化素促进血管平滑肌细胞增殖
在转染慢病毒7 d后采用免疫组化法检测颈动脉组织中BrdU的表达,假手术组大鼠未见明显BrdU阳性颗粒;模型组和慢病毒对照组大鼠颈动脉组织可见大量棕褐色BrdU阳性颗粒,表明VSMC显著增殖;慢病毒抑制组大鼠颈动脉中棕褐色BrdU阳性颗粒显著减少,表明抑制趋化素表达后VSMC增殖减少(图2)。
2.3 趋化素促进颈动脉内膜增生
在转染趋化素基因缺陷性慢病毒14 d后检测颈动脉内膜形态,假手术组大鼠颈动脉内膜光滑,内弹力膜完整,中膜血管平滑肌细胞排列整齐,无新生内膜形成;模型组和慢病毒对照组大鼠颈动脉管壁中的血管平滑肌细胞由中膜向内膜增生,新生内膜形成,细胞排列紊乱,管腔狭窄,新生内膜较厚,并伴随泡沫细胞和纤维结缔组织形成;而慢病毒抑制组大鼠颈动脉内膜虽然存在增生,但增生程度明显减轻,泡沫细胞和纤维结缔组织较少,内皮较光滑(图3)。
2.4 趋化素上调p38MAPK磷酸化水平
在球囊损伤后14 d检测蛋白表达,与假手术组相比,模型组大鼠颈动脉组织的p-p38MAPK、p-JNK、p-ERK1/2表达上调;慢病毒抑制组中抑制趋化素基因表达后,球囊损伤诱导的p-p38MAPK、p-JNK、p-ERK1/2表达上调均被抑制(表1、图4),表明趋化素具有上调MAPK蛋白表达的作用。
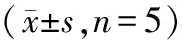
表1 各组蛋白质相对表达量比较情况
注:p-ERK1/2,酸化细胞外调节蛋白激酶;p-JNK,磷酸化c-jun氨基末端激酶;p-p38MAPK,磷酸化p38丝裂原活化蛋白激酶;a,与假手术组相比,P>0.05;b,慢病毒抑制组与模型组相比,P<0.01;c,慢病毒抑制组与模型组相比,P<0.05
3 讨论
趋化素是孤独G蛋白偶联受体趋化因子受体1(CMKLR1)的内源性配体,其主要产生部位是肝和白色脂肪组织,在成熟的脂肪细胞中趋化素和CMKLR1表达水平较高,因而最初认为趋化素是一种脂肪因子,促进脂肪细胞生长,参与脂肪组织生成[11]。有研究发现,趋化素通过CMKLR1活化p38MAPK通路,诱导白细胞介素-1β(IL-1β)、IL-6、肿瘤坏死因子-α(TNF-α)、基质金属蛋白酶等表达,促进巨噬细胞的活性,募集炎症细胞在损伤部位聚集和黏附,表明趋化素具有趋化因子的作用[12]。在胃癌细胞中,趋化素通过诱导血管内皮生长因子、基质金属蛋白酶-7的表达,促进p38MAPK和ERK1/2的磷酸化,促进胃癌细胞的生长和侵袭,表明趋化素具有生长因子的作用[4]。最近研究发现,在妊娠高血压病、冠心病、扩张型心肌病及类风湿关节炎合并心血管疾病的患者中,循环血趋化素水平明显升高[5-7,13]。体外研究发现,趋化素通过CMKLR1可以促进新生血管的生成[14],且可呈浓度依赖性促进胸主动脉的收缩舒张,调节血管功能[15]。这些研究均表明趋化素与心血管疾病发生具有相关性。

图2 免疫组化法检测颈动脉组织5-溴-脱氧脲苷表达(×100) A:假手术组;B:模型组;C:慢病毒对照组;D:慢病毒抑制组
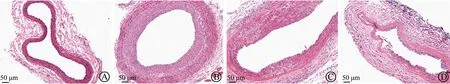
图3 颈动脉内膜形态学分析(×100) A:假手术组;B:模型组;C:慢病毒对照组;D:慢病毒抑制组
p-ERK1/2,酸化细胞外调节蛋白激酶;p-JNK,磷酸化c-jun氨基末端激酶;p-p38MAPK,磷酸化p38丝裂原活化蛋白激酶图4 趋化素上调颈动脉组织中的蛋白表达
VSMC是血管中膜的主要细胞,其表型转换、增殖和迁移是导致动脉粥样硬化、血管介入后发生再狭窄的主要病理机制[16]。本研究组在前期研究中发现,沉默VSMC中的趋化素基因后,VSMC的增殖能力显著降低,同时JNK磷酸化水平下降,表明趋化素具有促进VSMC增殖的作用[8-9]。在本研究中,利用慢病毒载体沉默颈动脉局部组织中的趋化素基因发现,在抑制颈动脉局部组织中的趋化素基因后,球囊损伤导致的内膜增生显著减轻,颈动脉组织VSMC的增殖也被显著抑制。与此同时,球囊损伤导致的p38MAPK、ERK 1/2、JNK磷酸化水平上调也在沉默趋化素基因后被显著抑制。
综上所述,本研究首次发现趋化素具有促进大鼠颈动脉损伤后血管重塑的作用,该作用与p38MAPK磷酸化水平上调有关,对其详细调控机制尚需进一步研究探索。
[1] Chistiakov DA, Orekhov AN, Bobryshev YV. Vascular smooth muscle cell inatherosclerosis. Acta Physiol (Oxf), 2015,214(1):33-50.
[2] Goralski KB, McCarthy TC,Hanniman EA, et al. Chemerin, a novel adipokine that regulates adipogenesis and adipocyte metabolism. J Biol Chem, 2007,282(38):28175-28188.
[3] Chakaroun R,Raschpichler M, Klöting N, et al.Effects of weight loss and exercise on chemerin serum concentrations and adipose tissue expression in human obesity. Metabolism, 2012,61(5):706-714.
[4] Wang C, Wu WK, Liu X, et al. Increased serum chemerin level promotes cellular in vasiveness in gastric cancer: a clinical and experimental study. Peptides, 2014,51:131-138.
[5] Stepan H, Philipp A, Roth I, et al. Serum levels ofthe adipokine chemerin are increasedIn preeclampsia during and 6 months after pregnancy. Regul Pept, 2011,168(1-3):69-72.
[6] Dong B, Ji W, Zhang Y. Elevated serum chemerin levels are associated with the presence of coronary artery disease in patients with metabolic syndrome. Intern Med, 2011,50(10):1093-1097.
[7] Zhang O, Ji Q, Lin Y, et al. Circulating chemerin levels elevated in dilated cardiomyopathy patients with overt heart failure. Clin Chim Acta, 2015,448:27-32.
[8] 熊玮,董少红,张键,等.Chn1基因缺陷性小鼠血管平滑肌细胞株的构建和鉴定.广东医学,2015,36(16):2495-2498.
[9] 熊玮,董少红,张键,等.趋化素通过上调磷酸化JNK促进小鼠血管平滑肌细胞的增殖.中国病理生理杂志,2015,31(12):2282-2286.
[10] Liu H, Dong S, Xiong W, et al. Effects of high mobility group box 1 and nuclear factor κB on neointimal hyperplasia after common carotid artery balloon injury. Int J Clin Exp Med, 2015, 8(8):13323-13328.
[11] Mattern A, Zellmann T, Beck-Sickinger AG. Processing, signaling, and physiological function of Chemerin. IUBMB Life, 2014,66(1):19-26.
[12] Herenius MM, Oliveira AS, Wijbrandts CA, et al. Anti-TNF therapy reduces serum levels of chemerin in rheumatoid arthritis: a new mechanism by which anti-TNF might reduce inflammation. PLoS One, 2013,8(2):e57802.
[13] Dessein PH, Tsang L, Woodiwiss AJ, et al. Circulating concentrations of the novel adipokine chemerin are associated with cardiovascular disease risk in rheumatoid arthritis. J Rheumatol, 2014,41(9):1746-1754.
[14] Kaur J,Adya R, Tan BK,et al. Identification of chemerin receptor (ChemR23) in human endothelial cells: chemerin-induced endothelial angiogenesis. Biochem Biophys Res Commun, 2010,391(4):1762-1768.
[15] Watts SW, Dorrance AM, Penfold ME, et al. Chemerin connects fat to arterial contraction. Arterioscler Thromb Vasc Biol, 2013,33(6):1320-1328.
[16] Davis-Dusenbery BN, Wu C, Hata A. Micromanaging vascular smooth muscle cell differentiation and phenotypic modulation. Arterioscler Thromb Vasc Biol, 2011,31(11): 2370-2377.
Chemerin stimulated rat carotid neointimal remodeling by activation of MAPK
LIUHua-dong,XIONGWei,DONGShao-hong,WUMei-shan,LIJiang-hua,ZHANGJian.DepartmentofCardiology,ShenzhenPeople′sHospital,theSecondClinicalMedicalCollegeofJinanUniversity,Shenzhen518020,China
Correspondingauthor:DONGShao-hong,Email:dsh266@medmail.com.cn
Objective To investigate the role and mechanism of chemerin in carotid artery remodeling after angioplasty. Methods Chemerin gene was knockdown by chemerin gene deficient lentivirus in carotid injured rats caused by angioplasty. Chemerin mRNA was tested by real time PCR. After chemerin was knockdown, the intimal morphology of carotid was surveyed and the proliferation of vascular smooth muscle cells (VSMCs) was explored by BrdU staining. The protein levels of phosphorylated-p38 MAPK, phosphorylated-ERK 1/2, phosphorylated-JNK were investigated by Western blot analysis. Results Local chemerin expression of carotid was significantly suppressed by chemerin deficient lentivirus (P<0.001). In carotid injured rats, significant intimal hyperplasia and VSMCs proliferation occurred. The protein levels of p-p38 MAPK, p-ERK 1/2, p-JNK were up-regulated. After chemerin was knockdown, the intimal hyperplasia of carotid and VSMCs proliferation were significantly attenuated and the protein levels of p-p38 MAPK, p-ERK 1/2, p-JNK were simultaneously down-regulated. Conclusions Chemerin may stimulate rat carotid neointimal remodeling by activation of MAPK.
Chemerin; Vascular smooth muscle cell; Vascular remodeling; Mitogen activated protein kinase
10.3969/j.issn.1004-8812.2016.11.013
深圳市科技创新计划项目(jcyj20150403101028192)
518020 广东深圳,深圳市人民医院心内科 暨南大学第二临床医学院(刘华东、熊玮、董少红、吴美善、李江华);广东深圳,中国科学院深圳先进技术研究院(张键)
董少红,Email:dsh266@medmail.com.cn
R543
2016-06-05)
