叉头框蛋白3过表达对胃癌细胞生物学行为的影响
2016-12-16马桂芬潘独伊曾昭冲陈世耀
马桂芬, 潘独伊, 何 健, 曾昭冲, 陈世耀*
1.复旦大学附属中山医院放疗科, 上海 200032 2.复旦大学附属中山医院消化内科, 上海 200032
·论 著·
叉头框蛋白3过表达对胃癌细胞生物学行为的影响
马桂芬1, 潘独伊2, 何 健1, 曾昭冲1, 陈世耀2*
1.复旦大学附属中山医院放疗科, 上海 200032 2.复旦大学附属中山医院消化内科, 上海 200032
目的: 探讨叉头框蛋白3(Forkhead box protein 3,FoxP3)过表达对胃癌细胞生物学行为的影响。方法: 用shRNA过表达质粒转染胃癌细胞,经药物筛选和单克隆挑选,建立稳定转染的细胞系。用四甲基偶氮唑盐(MTT)法检测转染FoxP3基因后胃癌细胞系生长增殖能力的改变;流式细胞术检测细胞周期;MTT法测定细胞转染FoxP3基因后对化疗药物敏感性的影响。结果: 成功建立稳定转染FoxP3基因的胃癌细胞。与空载体转染的对照组相比,上调FoxP3基因的胃癌细胞生长增殖能力减慢,迁移能力减弱[穿膜细胞数:(203±42)个/HPvs(891±100)个/HP,P<0.05],对化疗药物的敏感性增加(P<0.05)。结论: 过表达FoxP3基因可抑制胃癌细胞的增殖、迁移,提高化疗敏感性。
FoxP3; 胃癌; 基因功能; 生物学行为
2012年全球恶性肿瘤统计中,胃癌发病率排名第5位,在亚洲国家发病率更高达24.1 /10万,死亡率居第3位[1]。我国现有胃癌患者约300万,严重威胁人们的健康。目前对胃癌主要采用以手术为主,放疗、化疗为辅的综合治疗,虽然疗效较前有很大的改善,但中位生存期仅14.6个月,3年生存率仅27%[2]。分子靶向治疗能从根本上改变癌症的发生发展,纠正患者机体的促癌状态,有望成为有效的胃癌治疗新途径。
人类叉头框蛋白3(Forkhead box protein 3, FoxP3)基因突变会导致致死性疾病,如免疫功能紊乱(immune dysregulation)、多腺体病(polyendocrinopathy)、肠病(enteropathy)和X染色体连锁综合征(X-linked syndrome,IPEX综合征)[3]。近年来发现,FoxP3表达于肿瘤细胞中,可能是一种新的肿瘤调控因子。在肿瘤微环境中,肿瘤细胞可能通过表达FoxP3 抑制免疫活性,以此来模拟Treg细胞的功能[4]。FoxP3阳性的胰腺癌细胞系可抑制CD4+T细胞的扩增,可能与肿瘤细胞免疫逃逸有关[5]。目前大部分肿瘤中FoxP3表达增加,如小细胞肺癌[6]、肝癌[7]和胃癌[8]等。然而FoxP3基因对胃癌细胞生物学行为的影响目前尚不清楚。
1 材料与方法
1.1 重组质粒DNA转染胃癌细胞 AGS胃癌细胞株购于中国科学院上海生命科学院细胞库。用含10% 胎牛血清(FBS)及100 U/mL青霉素和0.1 mg/mL链霉素的DMEM完全培养基(美国Gibco公司)于37℃、5% CO2的培养箱中培养。取对数生长期的细胞,调整密度至2×105个/mL,接种至12孔培养板,培养至细胞融合度达70%~75%。将pEGFP/FoxP3和pEGFP/vector shRNA质粒(由上海吉凯基因化学技术有限公司构建)分别与Lipofectamine 2000 (美国Invitrogen公司) 混合后,用Opti-MEMI无血清培养基(美国Gibco公司)稀释至50 μL。将混合液加入培养板进行转染,6 h后换液,转染48 h后,收集细胞,按1∶10接种于培养皿中,使用含G418的选择培养基进行抗性筛选,每3 d更换培养基。3周后挑取细胞克隆,扩大培养。转染成功的阳性细胞克隆在荧光显微镜下可观察到绿色荧光,挑选出增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)表达最强的单个细胞克隆。进一步采用Western 印迹法选取FoxP3蛋白表达最强的克隆,扩大培养后用于后续实验。
1.2 流式细胞术检测细胞周期 细胞周期试剂盒购于南京凯基生物科技发展有限公司。取对数生长期细胞,倒去培养液,胰酶适度消化,用培养液吹打,250 ×g离心 15 min,去上清;PBS洗2次,加0.5 mL 磷酸缓冲盐溶液(PBS)混匀,务必吹散;用5 mL注射器将细胞吸起,用力打入5 mL 70%乙醇中,固定过夜;第2天收集固定的细胞,PBS洗2次;加RNase A约3 μL至终浓度约为50 μg/mL,37℃水浴消化30 min;加碘化丙啶(PI)约50 μL至终浓度约为65 μg/mL,在冰浴中避光染色30 min;用流式细胞仪(美国BD公司)检测细胞周期。
1.3 四甲基偶氮唑盐(MTT)法检测细胞增殖能力 MTT检测试剂盒购于南京凯基生物科技发展有限公司。分别取对数生长期的pEGFP/FoxP3及pEGFP/vector转染后的AGS细胞,调整细胞密度为104个/mL,接种至96孔板,每孔200 μL,每组设3~5个复孔;分别培养24、48、72、96 h后,每孔加入5 mg/mL浓度的MTT试剂 20 μL,继续培养4 h,弃培养液,加入150 μL DMSO,振荡后用酶标仪检测550 nm处光密度(D)值,以24 h为基准,计算以后每天的增长倍数。
1.4 细胞迁移实验 分别取对数生长期的AGS/FoxP3和AGS/vector细胞,调整其密度至5×105个/mL,接种至Transwell小室内(美国Corning公司),每孔200 μL;在下室加入0.5 mL含10%FBS的RPMI 1640完全培养基,放入培养箱培养;24 h后取出Transwell小室,用棉签拭去上室内细胞,置于预冷的无水乙醇中固定10 min;PBS洗涤3次后将Transwell小室浸入吉姆萨染色液中染色10 min,洗涤后用刀片小心割下膜,置于载玻片上,用中性树胶封片;在显微镜下,随机选取5个视野(100×),计数穿膜细胞个数。
1.5 化疗药物药敏试验 分别取对数生长期的AGS/FoxP3和AGS/vector细胞,计数,接种至96孔板,每孔5 000个细胞。每组设5个复孔。细胞贴壁8 h后,分别加入不同浓度的5-FU或伊立替康;48 h后用MTT法在550 nm波长处检测D值。
1.6 统计学处理 采用SPSS 17.0进行统计分析。满足正态性分布和方差齐性的两组间比较采用t检验,不满足者采用非参数Kruskal-Wallis检验。检验水准(α)为0.05。
2 结 果
2.1 单克隆挑选及过表达载体的鉴定 经Western 印迹验证,选取蛋白表达最强的5号克隆(图1)扩大培养用于后续试验。

图1 筛选FoxP3蛋白过表达最强克隆
2.2 流式细胞术鉴定细胞转染效率 经过 G418筛选和单克隆挑选扩增的稳定转染的AGS细胞(图2A),荧光显微镜下见细胞均带有绿色荧光(图2B),说明转染成功,流式细胞技术显示转染效率近100%(图2C)。
2.3 过表达FoxP3对胃癌细胞增殖能力的影响 细胞增殖实验均显示转染FoxP3质粒后,AGS细胞的增殖能力减低(图3),提示AGS/FoxP3具有抑制胃癌细胞增殖的作用(P<0.05)。

图2 FoxP3稳定转染细胞系的筛选
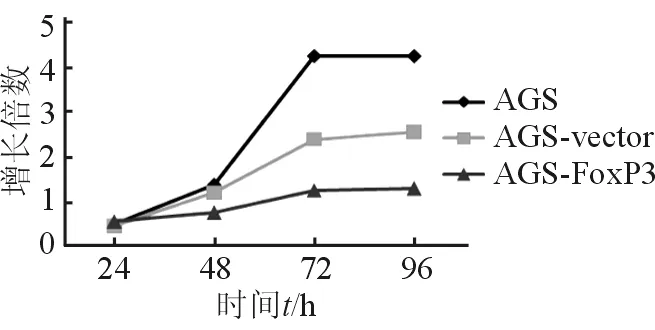
图3 MTT示AGS/FoxP3抑制AGS细胞生长
2.4 细胞周期的变化 流式细胞术分析结果(图4)表明:转染FoxP3后,细胞被阻滞在G1期,G1期细胞所占百分比明显多于未转染vector的对照组[G1期:(85.21±10.21)%vs(72.12±7.34)%,P<0.05]。

图4 流式细胞术提示细胞周期被阻滞在G1期
2.5 转染FoxP3对胃癌细胞迁移能力的影响 细胞迁移实验(图5)表明:与对照组相比,转染FoxP3的AGS细胞在高倍视野中平均穿膜细胞数明显减少[(203±42)个/HPvs(891±100)个/HP,P<0.05],说明转染FoxP3后胃癌细胞的迁移能力减弱。

图5 转染FoxP3胃癌细胞的迁移能力减弱
2.6 转染后FoxP3对胃癌细胞化疗敏感性的影响 在5-FU 100 μg/mL和500 μg/mL浓度下,转染FoxP3的AGS细胞生长抑制率明显高于对照组;在伊立替康25 μg/mL及50 μg/mL药物浓度下,转染FoxP3基因的AGS细胞的生长抑制率明显升高(P<0.05)。结果表明,FoxP3可以增加胃癌细胞对化疗药物的敏感性(图6)。
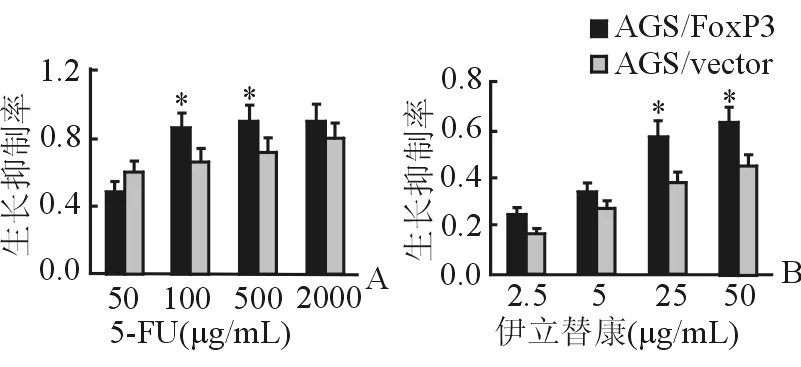
图6 化疗药物敏感性的增加
3 讨 论
FoxP3对Treg细胞的形成和功能起关键作用[9]。FoxP3阳性的T细胞大部分为Treg,它们是构成肿瘤免疫的重要因素。有研究[10]报道,胰腺癌新辅助放化疗后肿瘤微环境中Treg减少及相关的细胞毒作用减弱。放疗可使循环中的Treg明显下降,患者无瘤生存时间延长[11-12]。但是,有证据[13]发现,Treg比细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL) 更耐受离子照射,放疗后局部原位组织中Treg不减少是致放疗耐受的主要原因。在动物模型中也发现,Treg比其他淋巴细胞更耐受放疗,他们可能在放疗相关的组织损伤中有自稳态作用,导致放疗不敏感[14]。与FoxP3相互作用的蛋白质中有视黄酸受体孤儿受体样受体α(ROR-α),FoxP3可以抑制ROR-α介导的转录激活作用[15]。当缺乏配体时,ROR-α可以与转录共抑制因子结合;当与配体结合后,ROR-α发生形变与共活化因子相结合[16],从而调节其转录抑制或活化作用。
近来发现多种肿瘤细胞表达FoxP3,且FoxP3与淋巴结转移和预后有重要关系[17-19]。在亚洲胃癌患者中,肿瘤组织中浸润的CD3、CD8、CD45RO、FoxP3等免疫分子的表达与预后有关,说明免疫状态水平可影响患者预后[20]。既往研究多集中于Treg在肿瘤免疫中的作用,而忽视了肿瘤细胞表达FoxP3。肿瘤细胞表达的FoxP3可通过影响T淋巴细胞的分化而影响肿瘤免疫应答,如结肠癌细胞中,FoxP3与Treg发生相互作用,影响幼稚T淋巴细胞的分化,从而影响免疫效应[21];肝癌细胞可通过分泌转化生长因子β1(TGF-β1)诱导淋巴细胞中FoxP3的表达,从而抑制其抗肿瘤免疫反应[22]。我们的前期研究[23]也发现,将胃癌细胞与外周单个核淋巴细胞(PBMC)共培养后,FoxP3增多;而Treg也通过分泌抑制性细胞因子抑制胃癌细胞的生长。我们前期研究[24]发现,胃癌组织中胃癌细胞和淋巴细胞中均表达FoxP3,而且胃癌细胞FoxP3的表达与预后良好有关,而高密度浸润的Treg与预后差有关,风险模型分析提示Treg是影响预后的主要因素。然而,FoxP3基因对胃癌细胞具体生物学行为的影响目前还不清楚。
乳腺癌体内外实验[25-27]均表明,FoxP3能抑制乳腺癌的生长。乳腺癌细胞系过表达FoxP3基因后,细胞增殖、迁移和侵袭能力均降低[25]。FoxP3可通过抑制人表皮生长因子受体2(HER2)和S相激酶相关蛋白2(SKP2)的转录活性和诱导肿瘤抑制基因p21的活性抑制乳腺癌的生长[28-29]。前列腺癌细胞系增加FoxP3表达后生长明显抑制。另外敲除FoxP3会导致早发的前列腺增生和上皮内瘤变[30]。本实验发现过表达FoxP3的胃癌细胞增殖减慢、迁移能力减弱,胃癌细胞主要被阻滞在G1期。我们以往研究[31]还发现,FoxP3促进胃癌细胞的凋亡与Caspase相关的凋亡信号通路有关,因此推测FoxP3在胃癌中可能起抑癌作用。本研究发现,转染FoxP3的胃癌细胞对5-FU和伊立替康两种化疗药物的敏感性增加,这可能也是FoxP3影响患者预后的原因之一。Treg的免疫抑制作用是影响预后的重要因素,而胃癌细胞中FoxP3起抑癌作用,它们可能共同参与调节肿瘤微环境的状态,最终决定患者预后。
[ 1 ] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):e359-e386.
[ 2 ] Yoshikawa T, Sasako M, Yamamoto S, et al. Phase Ⅱ study of neoadjuvant chemotherapy and extended surgery for locally advanced gastric cancer[J]. Br J Surg,2009,96(9):1015-1022.
[ 3 ] Torgerson TR, Ochs HD. Immune dysregulation, polyendocrinopathy, enteropathy, X-linked: Forkhead box protein 3 mutations and lack of regulatory T cells[J]. J Allergy Clin Immunol,2007,120(4):744-750.
[ 4 ] 薛 剑,李美星,袁向亮,等. Foxp3在胃癌细胞中的表达[J]. 诊断学理论与实践,2009,8(2):160-164.
[ 5 ] Hinz S, Pagerols-Raluy L, Oberg HH, et al. Foxp3 expression in pancreatic carcinoma cells as a novel mechanism of immune evasion in cancer[J]. Cancer Res,2007,67(17):8344-8350.
[ 6 ] Dimitrakopoulos FI, Papadaki H, Antonacopoulou AG, et al. Association of FOXP3 expression with non-small cell lung cancer[J]. Anticancer Res,2011,31(5):1677-1683.
[ 7 ] Wang WH, Jiang CL, Yan W, et al. FOXP3 expression and clinical characteristics of hepatocellular carcinoma[J]. World J Gastroenterol,2010,16(43):5502-5509.
[ 8 ] 袁甲翔,张谢夫,赵春临,等. 核转录因子FOXP3在胃癌患者体内的表达及意义[J]. 世界华人消化杂志,2009,17(29):3052-3055.
[ 9 ] Brunkow ME, Jeffery EW, Hjerrild KA, et al. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse[J]. Nat Genet,2001,27(1):68-73.
[10] Tsuchikawa T, Hirano S, Tanaka E, et al. Novel aspects of preoperative chemoradiation therapy improving anti-tumor immunity in pancreatic cancer[J]. Cancer Sci,2013,104(5):531-535.
[11] Schmidt MA, Fortsch C, Schmidt M, et al. Circulating regulatory T cells of cancer patients receiving radiochemotherapy may be useful to individualize cancer treatment[J]. Radiother Oncol,2012,104(1):131-138.
[12] Tabachnyk M, Distel LV, Buttner M, et al. Radiochemotherapy induces a favourable tumour infiltrating inflammatory cell profile in head and neck cancer[J]. Oral Oncol,2012,48(7):594-601.
[13] Qinfeng S, Depu W, Xiaofeng Y, et al. In situ observation of the effects of local irradiation on cytotoxic and regulatory T lymphocytes in cervical cancer tissue[J]. Radiat Res,2013,179(5):584-589.
[14] Kachikwu EL, Iwamoto KS, Liao YP, et al. Radiation enhances regulatory T cell representation[J]. Int J Radiat Oncol Biol Phys,2011,81(4):1128-1135.
[15] Du J, Huang C, Zhou B, et al. Isoform-specific inhibition of ROR alpha-mediated transcriptional activation by human FOXP3[J]. J Immunol,2008,180(7):4785-4792.
[16] Atkins GB, Hu X, Guenther MG, et al. Coactivators for the orphan nuclear receptor RORalpha[J]. Mol Endocrinol,1999,13(9):1550-1557.
[17] Douglass S, Meeson AP, Overbeck-Zubrzycka D, et al. Breast cancer metastasis: demonstration that FOXP3 regulates CXCR4 expression and the response to CXCL12[J]. J Pathol,2014,234(1):74-85.
[18] Ganapathi SK, Beggs AD, Hodgson SV, et al. Expression and DNA methylation of TNF, IFNG and FOXP3 in colorectal cancer and their prognostic significance[J]. Br J Cancer,2014,111(8):1581-1589.
[19] Triulzi T, Tagliabue E, Balsari A, et al. FOXP3 expression in tumor cells and implications for cancer progression[J]. J Cell Physiol,2013,228(1):30-35.
[20] Lin SJ, Gagnon-Bartsch JA, Tan IB, et al. Signatures of tumour immunity distinguish Asian and non-Asian gastric adenocarcinomas[J]. Gut,2015,64(11): 1721-1731.
[21] Grimmig T, Kim M, Germer CT, et al. The role of FOXP3 in disease progression in colorectal cancer patients[J]. Oncoimmunology,2013,2(6):e24521.
[22] Wang Y, Deng B, Tang W, et al. TGF-beta1 secreted by hepatocellular carcinoma induces the expression of the Foxp3 gene and suppresses antitumor immunity in the tumor microenvironment[J]. Dig Dis Sci,2013,58(6):1644-1652.
[23] Ma GF, Miao Q, Zeng XQ, et al. Transforming growth factor-b1 and -b2 in gastric precancer and cancer and roles in tumor-cell interactions with peripheral blood mononuclear cells in vitro[J]. PLoS ONE,2013,8(1):e54249.
[24] Ma GF, Miao Q, Liu YM, et al. High FoxP3 expression in tumour cells predicts better survival in gastric cancer and its role in tumour microenvironment[J]. Br J Cancer,2014,110(6):1552-1560.
[25] Zhang HY, Sun H. Up-regulation of Foxp3 inhibits cell proliferation, migration and invasion in epithelial ovarian cancer[J]. Cancer Lett,2010,287(1):91-97.
[26] Liu Y, Wang Y, Li W, et al. Activating transcription factor 2 and c-Jun-mediated induction of FoxP3 for experimental therapy of mammary tumor in the mouse[J]. Cancer Res,2009,69(14):5954-5960.
[27] Li W, Wang L, Katoh H, et al. Identification of a tumor suppressor relay between the FOXP3 and the Hippo pathways in breast and prostate cancers[J]. Cancer Res,2011,71(6):2162-2171.
[28] Liu R, Wang L, Chen G, et al. FOXP3 up-regulates p21 expression by site-specific inhibition of histone deacetylase 2/histone deacetylase 4 association to the locus[J]. Cancer Res,2009,69(6):2252-2259.
[29] Zuo T, Wang LZ, Morrison C. FOXP3 is an X-linked breast cancer suppressor gene and an important repressor of the HER-2/ErbB2 oncogene[J]. Cell,2007,129(7):1275-1286.
[30] Wang L, Liu R, Li W, et al. Somatic single hits inactivate the X-linked tumor suppressor FOXP3 in the prostate[J]. Cancer Cell,2009,16(4):336-346.
[31] Ma GF, Chen SY, Sun ZR, et al. FoxP3 inhibits proliferation and induces apoptosis of gastric cancer cells by activating the apoptotic signaling pathway[J]. Biochem Biophys Res Commun,2013,430(2):804-809.
[本文编辑] 姬静芳
The role and mechanism of FoxP3 in biological behavior of gastric cancer cells
MA Gui-fen1, PAN Du-yi2, HE Jian1, ZENG Zhao-chong1, CHEN Shi-yao2*
1. Department of Radiotherapy, Zhongshan Hospital, Fudan University, Shanghai 200032, China 2. Department of Gastroenterology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective: To explore the role and mechanism of Forkhead box protein 3 (FoxP3) in biological behavior of gastric cancer (GC) cells.Methods:Invitro, the plasmid of FoxP3-shRNA was transfected into GC cells, and then the stably transfected cells were established by drug-screening and monoclone-selection. MTT assay was used to detect the growth and proliferation of GC cells. And cell cycle was detected by flow cytometry. MTT assay was used to measure the difference regarding sensitivity to chemotherapy drugs.Results: GC cell line which was stably transfected with FoxP3 gene, was established. GC cell line with up-regulation of FoxP3 gene, compared to the vector-transfected control, showed slower growth and proliferation rate, weaker ability of invasion (transmembrane cell counts: [203±42] cells/HPvs[891±100] cells/HP,P<0.05), and higher sensitivity to chemotherapy drugs(P<0.05).Conclusions: FoxP3 gene plays a role in inhibiting the growth of GC cells.
Forkhead box protein; gastric cancer; gene function; biological behavior
2015-12-22 [接受日期] 2016-05-19
国家自然科学基金青年科学基金项目(81502005),上海市自然科学基金(14ZR1406600). Supported by Youth Program of National Natural Science Foundation of China (8150200) and Natural Science Foundation of Shanghai (14ZR1406600).
马桂芬,硕士,住院医师. E-mail:ma.guifen@zs-hospital.sh.cn
*通信作者(Corresponding author). Tel: 021-64041990, E-mail: chen.shiyao@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2016.20160931
R 735.2
A
