人工重组Clara细胞蛋白16对放射性肺炎及肺纤维化防护机制研究
2016-12-15佟昌慈柳云恩张玉彪丛培芳史秀云刘学磊金红旭侯明晓
佟昌慈, 柳云恩, 刘 颖, 佟 周, 张玉彪, 施 琳, 丛培芳,史秀云, 刘学磊, 金红旭, 侯明晓
沈阳军区总医院 急诊医学部 全军重症(战)创伤救治中心实验室 辽宁省重症创伤和器官保护重点实验室,辽宁 沈阳 110016
·灾难医学·
人工重组Clara细胞蛋白16对放射性肺炎及肺纤维化防护机制研究
佟昌慈, 柳云恩, 刘 颖, 佟 周, 张玉彪, 施 琳, 丛培芳,史秀云, 刘学磊, 金红旭, 侯明晓
沈阳军区总医院 急诊医学部 全军重症(战)创伤救治中心实验室 辽宁省重症创伤和器官保护重点实验室,辽宁 沈阳 110016
目的 探讨人工重组Clara细胞蛋白16(rhCC16)对放射性肺炎及肺纤维化的防护机制。方法 将30只SD大鼠随机分成3组,对照组(n=10)、照射组(n=10)和rhCC16+照射组(n=10)。照射组和rhCC16+照射组均予单次全胸15 Gy剂量进行照射。3组均取SD大鼠肺组织进行HE、Masson染色;免疫组化、Western Blot及Real Time PCR检测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、转化生长因子β(TGF-β)、Bax以及Bcl-2的表达;ELASA检测血清中IL-6、TNF-α和TGF-β水平;Western Blot、Real Time PCR以及MTT验证rhCC16对大鼠肺泡上皮细胞的保护作用。结果 与对照组比较,照射组肺组织呈现明显的炎性细胞渗出,纤维病变明显,肺泡结构破坏,细胞凋亡增多,IL-6、TNF-α以及TGF-β表达水平增高;rhCC16干预处理后病变现象明显减轻,IL-6、TNF-α以及TGF-β的表达明显降低。结论 rhCC16可以抑制辐射诱导的炎症反应、细胞凋亡以及纤维病变,对放射性肺炎及肺纤维化具有防护作用。
rhCC16; 放射性肺炎; 肺纤维化
DOI∶10.16048/j.issn.2095-5561.2016.06.06
放射性肺炎及肺纤维化是指在放疗过程中胸部部分正常的肺组织由于受到一定剂量的放射线照射而引起的放射性损伤。放射治疗是广泛应用于肺部肿瘤的临床治疗方法。但是,其主要并发症放射性肺炎和放射性肺纤维化严重影响放射治疗的效果[1]。放射治疗导致放射性肺损伤的机制尚不明确。近年来,有研究表明,以炎症因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、转化生长因子β(TGF-β)为主的生物因子对于肺损伤的始动和维持具有重要作用。炎症反应在放射性肺炎及肺纤维化过程中起重要作用[2-3]。目前IL-6,TNF-α,TGF-β等细胞因子被认为是介导放射性肺炎和肺纤维化的重要介质,其表达水平反映了放射性肺炎和肺纤维化的程度[2-4]。
Clara细胞是一种非纤毛上皮细胞,具有分泌功能,位于肺的细支气管黏膜上,保护呼吸道,可以修复损伤的肺上皮细胞,清除呼吸道中的有害物质[4]。Clara细胞蛋白16(Clara cell protein16,CC16),作为Clara细胞主要分泌产物[5-6],是一种多见于支气管肺泡灌洗液(BALF)中的组织特异性蛋白[6]。CC16作为评估肺上皮细胞通透性和完整性的生物标志。当肺组织损伤时,CC16在BALF中的含量下降,而气血屏障的损坏则导致血浆CC16含量的增高[7-11]。CC16具有免疫抑制作用、抗炎作用等多种生物学功能,CC16基因缺失的大鼠肺组织更容易受到损害,炎症反应更强[12]。炎症反应的关键酶磷脂酶A2(PLA2)通过分解磷脂导致生物膜的损伤,CC16可抑制PLA2的活性,从而抑制炎症反应,达到保护生物膜的作用[13]。另外,CC16可直接抑制白细胞介素-1(IL-1)、TNF-α、γ干扰素(IFN-γ)等多种炎症因子的表达及其生物学活性[10-11,14]。有研究表明,CC16在慢性阻塞性肺病、哮喘等气道炎症中具有重要作用[15-16],亦在多种因素导致的急性肺损伤中起重要作用[14,17-18]。因此,本研究通过建立人工重组CC16(rhCC16)处理放射性肺炎及肺纤维化的SD大鼠模型,检测大鼠的病变程度,旨在验证rhCC16对放射性肺炎及肺纤维化的保护作用。
1 材料与方法
1.1 材料与试剂 人肺泡上皮细胞株HPAEpiC(美国ATCC公司);DMEM培养液、胎牛血清(美国Gibco公司);RNA提取试剂Trizol(美国Invitrogen公司);反转录及SYBR Premix Ex Taq试剂盒(TakaRa公司)。抗体:TGF-β(美国Cell signaling公司),IL-6(美国Cell signaling公司);Bax(美国Cell signaling公司),TNF-α(美国Santa Cruz公司);GAPDH(美国Gene script公司);Bcl-2(美国Invitrogen公司);二抗:HRP-山羊抗兔,山羊抗大鼠(中杉公司);引物由上海生工生物工程有限公司合成;MTT试剂盒(美国Gibco 公司产品)。rhCC16(上海星科生物科技有限公司),SD大鼠30只,由沈阳军区总医院动物实验中心提供,鼠龄26周,体质量(200±20)g,健康清洁级。动物自由饮食、饮水(饲料购自江苏省协同医药生物工程有限责任公司)。
1.2 研究方法
1.2.1 实验动物分组 将30只成年健康SD大鼠随机分为对照组、照射组和rhCC16+照射组,每组各10只。对照组给予尾静脉注射生理盐水;照射组通过直线加速器全胸X线照射,照射剂量为单次15 Gy,剂量率为2 Gy/min,照射距离为1.1 m,时间为1 min,同时给予生理盐水注射;rhCC16+照射组给予照射组相同剂量的X线,同时在照射前后7 d给予rhCC16(10 mg/kg)尾静脉静脉注射。各组大鼠正常饲养,每天进行动物称重,最后解剖取材。
1.2.2 病理染色分析 X线照射7 d后对动物进行解剖,将肺组织标本放入10%中性甲醛中固定约3 d,用二甲苯脱蜡梯度乙醇进行脱水,石蜡包埋切片,苏木精-伊红染色和Masson染色。通过病理影像系统在显微镜下摄像。免疫组化染色:石蜡切片置于60℃烘箱中,烘片4 h,脱蜡至水。3% H2O2室温孵育5~10 min消除内源性过氧化物酶的活性,于pH=6.0柠檬酸盐缓冲液中高压抗原修复,血清封闭后孵育一抗过夜。洗片后孵育生物素标记二抗工作液及辣根过氧化物酶标记的链霉卵白素工作液,DAB显色后自来水充分冲洗,复染、脱水以及封片。
1.2.3 细胞培养以及rhCC16处理 大鼠肺泡上皮细胞CCL-149在DMEM培养液(含10% 胎牛血清),5% CO2,37℃孵箱中培养。rhCC16处理前,35 mm细胞培养皿中铺入生长良好的HPAEpiC细胞,细胞覆盖率为70%~80%时,PBS清洗3次,用不含胎牛血清的DMEM培养液培养6 h后,再分别加入rhCC16(200 ng/ml)无抗生素的DMEM培养液中继续培养6 h。
1.2.4 RNA提取、反转录和引物设计 Trizol试剂提取细胞总RNA。提取的1 μg总RNA为转录模板,利用反转录酶合成cDNA,反转录反应条件为70℃ 5 min,42℃ 50 min,95℃ 5 min。根据GeneBank中的cDNA序列,分别设计IL-6、TNF-α以及TGF-β的引物。见表1。

表1 Real Time PCR引物设计
1.2.5 实时荧光定量 PCR及Western blot 采用SYBR荧光染料,Smart Cycler System分析软件分析。反应体系为cDNA 2 μl,ddH2O 6.4 μl,上下游引物各0.8 μl,SYBR Premix Ex TaqTMⅡ10 μl,共20 μl总反应体系。扩增条件:退火56℃30 min,延伸72℃ 30 s,45个循环。实验蛋白样品加入相应比例的SDS凝胶上样缓冲液(6×loading buffer),煮沸变性5 min,SDS-PAGE电泳,转膜,然后将膜移至5%的脱脂奶粉PBST缓冲液,室温封闭1 h,PBST洗膜3次。加入一抗,4℃孵育过夜。PBST洗膜3次,加辣根过氧化物酶标记的二抗,室温孵育1 h。洗膜3次,暗室显影。通过Western Blot及Real Time PCR检测大鼠肺组织中IL-6,TNF-α,TGF-β的表达水平。
1.2.6 MTT法 传代5×104个/100 μl细胞于96孔平底板,5%CO2,37℃培养过夜。每孔加入rhCC16(200 ng/ml)无抗生素的DMEM培养液100 μl继续培养,设3个副孔。每孔加入10 μl MTT溶液(5 mg/ml),继续培养4 h。每孔加入100 μl DMSO,置摇床上低速振荡10 min。在酶联免疫检测仪OD值490 nm处测量各孔的吸光值。
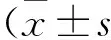
2 结果
2.1 3组大鼠肺组织结构及纤维化情况比较 受到单次大剂量照射后第8天取各组大鼠肺组织,进行HE及Masson染色。对照组肺组织结构清晰,肺泡壁未见增厚,未见纤维细胞;照射组可见明显渗出的炎症细胞,肺泡结构改变,大量增生纤维细胞,纤维组织栓塞,出现明显纤维化症状;rhCC16+照射组,具有较完整的肺泡结构,炎症细胞轻度浸润,肺泡壁轻度增厚。与对照组比较,照射组大鼠表现出明显的急性炎症反应及纤维变性,rhCC16干预减轻了其病变。见图1。
2.2 3组Bax及Bcl-2的蛋白及mRNA的表达水平比较 在照射24 h后,rhCC16有效地抑制了肺组织凋亡因子Bax的表达,促进了凋亡抑制因子Bcl-2的表达。与对照组比较,照射组大鼠组织中Bax表达水平明显增高,rhCC16+照射组大鼠Bax表达水平明显降低,接近正常对照组;而Bcl-2的表达情况则相反。见图2。
2.3 3组SD大鼠血清中IL-6、TNF-α以及TGF-β水平比较 ELASA检测血清中IL-6、TNF-α、TGF-β水平,与对照组比较,照射组大鼠血清中IL-6、TNF-α、TGF-β水平明显增高,而rhCC16+照射组大鼠血清中IL-6、TNF-α以及TGF-β水平明显降低,接近对照组。见表2。
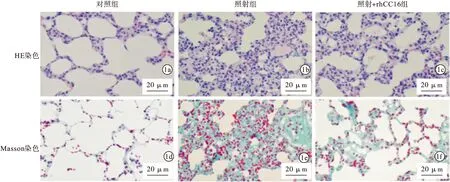
图1 3组大鼠肺组织受到单次大剂量照射后第8天取肺组织进行HE及Masson染色,rhCC16减轻了照射诱导的炎症细胞浸润和纤维变性
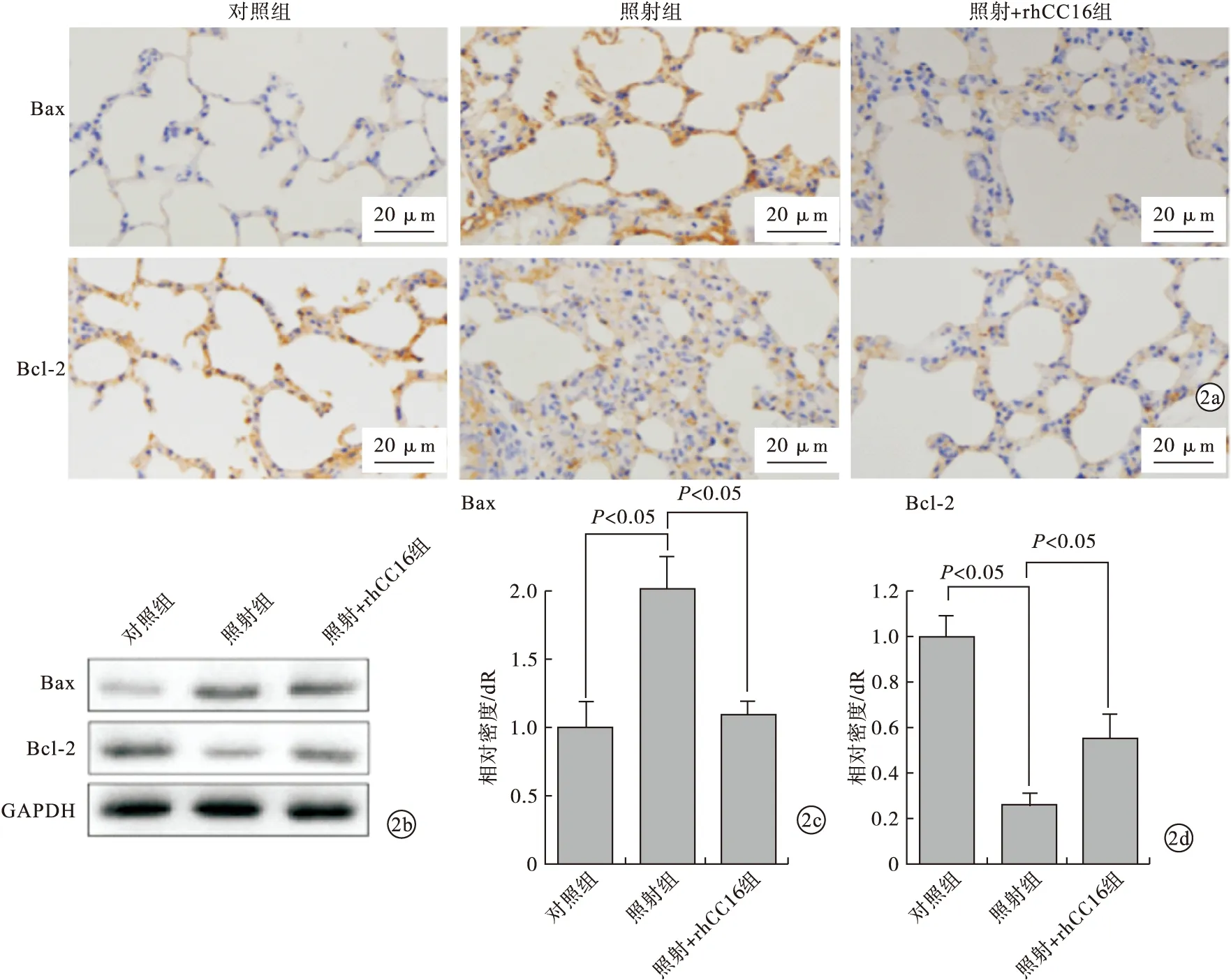
图2 rhCC16对凋亡相关因子的影响(a.Bax及Bcl-2大鼠肺组织免疫组织化学染色;b.Western Blot;c~d.Real Time PCR)
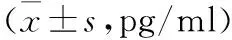
表2 3组大鼠血清中IL-6,TNF-α以及TGF-β
注:与对照组比较,①P<0.01;与照射组比较,②P<0.01
2.4 3组SD大鼠肺组织中IL-6、TNF-α以及TGF-β表达水平比较 与对照组比较,照射组大鼠肺组织中IL-6、TNF-α以及TGF-β表达水平明显增高,差异有统计学意义(P<0.01);rhCC16+照射组SD大鼠IL-6、TNF-α以及TGF-β表达水平明显降低,接近正常对照组。见图3。
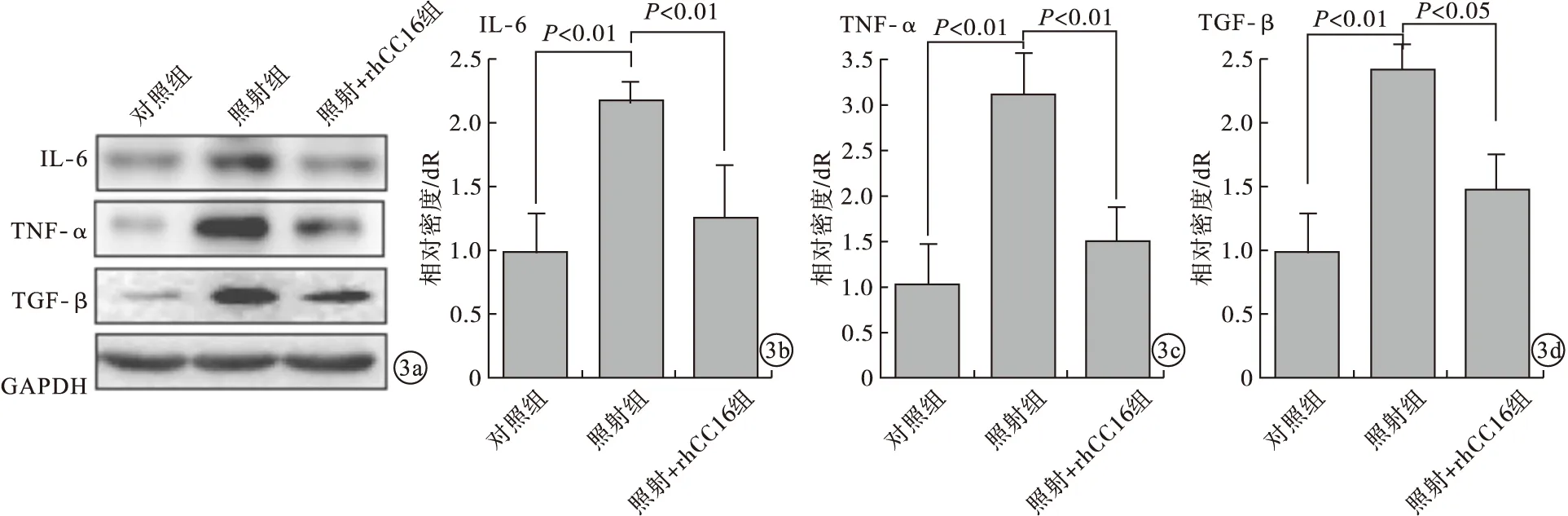
图3 大鼠肺组织中IL-6、TNF-α、TGF-β表达水平(a.Western Blot;b~d.Real Time PCR)
2.5 rhCC16对大鼠肺泡上皮细胞的保护作用 为了进一步验证rhCC16对肺泡细胞的在放射线照射条件下的保护作用,利用大鼠肺泡上皮细胞CCL-149进行验证。
与对照组比较,照射组中IL-6、TNF-α以及TGF-β表达水平明显增高,差异有统计学意义(P<0.01);rhCC16+照射组IL-6、TNF-α以及TGF-β水平明显降低,接近对照组。与对照组比较,照射组Bax表达水平明显增高;rhCC16+照射组Bax表达水平明显降低,接近正常对照组;而Bcl-2的表达情况则相反。MTT法检测细胞存活率,rhCC16+照射组细胞存活率明显高于照射组,差异有统计学意义(P<0.05)。见图4。
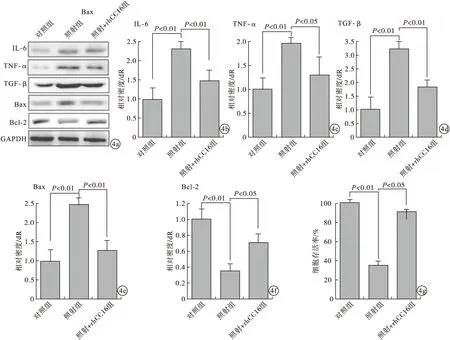
图4 3组大鼠肺泡上皮细胞中IL-6、TNF-α、TGF-β表达水平(a.Western Blot;b~f.Real Time PCR;g.MTT)
3 讨论
放射性肺炎及肺纤维化是局部放射治疗恶性胸部肿瘤后正常肺组织损伤的一种非特异性炎症反应,严重影响患者的生存质量,甚至危及患者的生命。目前,多采用大剂量的激素治疗,但疗效的不理想及相关的不良反应限制了其在临床中的应用[19]。放射治疗导致放射性肺损伤的机制目前仍未被完全认识。有研究表明,射线引起肺血管内皮细胞和肺组织上皮细胞凋亡是引起放射性肺炎和肺纤维化的的始动因素[20],同时,以TNF-α、IL-6以及TGF-β为主的生物介质对于造成肺组织损伤的始动和维持发挥着重要的作用,而伴随炎症损伤的修复机制则在肺纤维化的形成过程中发挥着关键的作用[2-3]。
CC16作为肺损伤的生物标记是肺泡上皮细胞衬液中含量最多的蛋白[3]。有研究表明,CC16表达的下降在哮喘等多种慢性肺部疾病的发病过程中起重要作用,可以抑制炎症反应[15-16]。因此,推测rhCC16在放射性肺炎及肺纤维化过程中可能起重要作用。建立放射性肺炎及肺纤维化大鼠模型并给予rhCC16处理,可以有效减轻辐射对大鼠的损害。通过HE及Masson染色对各组大鼠肺组织进行病理学分析,rhCC16可减缓照射引起的炎症细胞浸润和纤维变性。这表明rhCC16对放射性肺炎及肺纤维化具有防护作用。免疫组织化学、Western Blot及Real Time PCR检测结果表明,rhCC16可降低辐射诱导的凋亡因子Bax,促进凋亡抑制因子Bcl-2的表达,进一步说明rhCC16可以减少肺组织中的细胞凋亡。放射线对于正常肺组织的损伤激活通过核因子NF-κB为主的炎症信号通路,促进炎性免疫细胞分泌的IL-6、TNF-α大量释放,造成炎症级联反应的扩大。而TGF-β作为体内重要的炎症损伤修复因子,不仅反映了放射性肺损伤发生风险的高低,还促使放射性炎症向肺纤维化转化的重要因素[2-3,21-23]。因此,通过检测IL-6、TNFα以及TGF-β的表达反应rhCC16对放射性肺炎及肺纤维化的影响。ELASA、Western Blot及Real Time PCR分别检测血清及肺组织中IL-6、TNFα以及TGF-β的表达水平。结果显示,rhCC16可有效减轻辐射诱导的IL-6、TNF-α以及TGF-β的表达水平。这进一步证明rhCC16对放射性肺炎及肺纤维化具有防护作用。因此,笔者推测rhCC16对大鼠肺泡上皮细胞CCL-149具有同样的保护作用。利用放射线照射细胞并给予rhCC16处理,应用Western Blot及Real Time PCR方法检测,结果显示rhCC16可以在mRNA和蛋白水平上降低辐射诱导的IL-6、TNF-α、TGF-β的表达,抑制辐射诱导的炎症反应,而凋亡因子Bax表达的降低及凋亡抑制因子Bcl-2表达的升高,则证明rhCC16可以抑制辐射诱导的细胞凋亡。同时,MTT法检测细胞存活率结果显示,rhCC16可提高细胞在放射性照射下的存活率。这说明rhCC16可以保护大鼠肺泡上皮细胞CCL-149免遭放射线的破坏。
综上所述,rhCC16可以抑制炎症因子IL-6、TNF-α、TGF-β以及凋亡因子Bax的表达,诱导Bcl-2的表达,抑制放射线诱导的炎症反应、细胞凋亡,从而抑制放射性肺炎及肺纤维化的发生发展,保护肺组织免遭放射线的破坏。因此,rhCC16在放射性肺炎及肺纤维化中起重要的防护作用。
[1] Trott KR,Herrmann T,Kasper M.Target cells in radiation pneumopathy[J].Int J Radiat Oncol Biol Phys,2004,58(2):463-469.
[2] Hill RP,Zaidi A,Mahmood J,et al.Investigations into the role of inflammation in normal tissue response to irradiation[J].Radiother Oncol,2011,101(1):73-79.
[3] Rube CE,Rodemann HP,Rube C.The relevance of cytokines in the radiation-induced lung reaction.Experimental basis and clinical significanc[J].Strahlenther Onkol,2004,180(9):541.
[4] Broeckaert F,Bernard A.Clara cell secretory protein(CC16):characteristics and perspectives as lung peripheral biomarker[J].Clin Exp Allergy,2000,30(4):469-475.
[5] Broeckaert F,Bernard A.Clara cell secretory protein(CC16):characteristics and perspectives as lung peripheral biomarker[J].Clin Exp Allergy,2000,30(4):469-475.
[6] Hermans C,Petrek M,Kolek V,et al.Serum Clara cell protein(CC16),a marker of the integrity of the air-blood barrier in sarcoidosis[J].Eur Respir J,2001,18(3):507-514.
[7] Blomberg A,Mudway I,Svensson M,et al.Clara cell protein as a biomarker for ozone-induced lung injury in humans[J].Eur Respir J,2003,22(6):883-888.
[8] Janssen R,Sato H,Grutters JC,et al.Study of Clara cell 16,KL-6,and surfactant protein-D in serum as disease markers in pulmonary sarcoidosis[J].Chest,2003,124(6):2119-2125.
[9] Helleday R,Segerstedt B,Forsberg B,et al.Exploring the time dependence of serum clara cell protein as a biomarker of pulmonary injury in humans[J].Chest,2006,130(3):672-675.
[10] Determann RM,Millo JL,Waddy S,et al.Plasma CC16 levels are associated with development of ALI/ARDS in patients with ventilator-associated pneumonia:a retrospective observational study[J].BMC Pulm Med,2009,9:49.[11] Kropski JA,Fremont RD,Calfee CS,et al.Clara cell protein(CC16),a marker of lung epithelial injury,is decreased in plasma and pulmonary edema fluid from patients with acute lung injury[J].Chest,2009,135(6):1440-1447.
[12] Reynolds SD,Mango GW,Gelein R,et al.Normal function and lack of fibronectin accumulation in kidneys of Clara cell secretory protein/uteroglobin deficient mice[J].Am J Kidney Dis,1999,33(3):541-551.
[13] Michel O,Murdoch R,Bernard A.Inhaled LPS induces blood release of Clara cell specific protein(CC16)in human beings[J].J Allergy Clin Immunol,2005,115(6):1143-1147.
[14] Sarafidis K,Stathopoulou T,Agakidou E,et al.Comparable effect of conventional ventilation versus early high-frequency oscillation on serum CC16 and IL-6 levels in preterm neonates[J].J Perinatol,2011,31(2):104-111.
[15] Ku MS,Sun HL,Lu KH,et al.The CC16 A38G polymorphism is associated with the development of asthma in children with allergic rhinitis[J].Clin Exp Allergy,2011,41(6):794-800.
[16] Taniguchi N,Konno S,Hattori T,et al.The CC16 A38G polymorphism is associated with asymptomatic airway hyper-responsiveness and development of late-onset asthma[J].Ann Allergy Asthma Immunol,2013,111(5):376-381.
[17] Wutzler S,Lehnert T,Laurer H,et al.Circulating levels of Clara cell protein 16 but not surfactant protein D identify and quantify lung damage in patients with multiple injuries[J].J Trauma,2011,71(2):E31-E36.
[18] Min J,Luo FQ,Zhao WL.Regulation on the expression of Clara cell secretory protein in the lungs of the rats with acute lung injury by growth hormone[J].Chin Med J(Engl),2012,125(15):2728-2733.
[19] Min J,Luo FQ,Zhao WL.Regulation on the expression of Clara cell secretory protein in the lungs of the rats with acute lung injury by growth hormone[J].Chin Med J(Engl),2012,125(15):2728-2733.
[20] Kuwano K,Hagimoto N,Kawasaki M,et al.Essential roles of the Fas-Fas ligand pathway in the development of pulmonary fibrosis[J].J Clin Invest,1999,104(1):13-19.
[21] Rube CE,Uthe D,Schmid KW,et al.Dose-dependent induction of transforming growth factor beta(TGF-beta)in the lung tissue of fibrosis-prone mice after thoracic irradiation[J].Int J Radiat Oncol Biol Phys,2000,47(4):1033-1042.
[22] Tatler AL,Jenkins G.TGF-β activation and lung fibrosis[J].Proc Am Thorac Soc,2012,9(3):130-136.
[23] Novakova-Jiresova A,Van Gameren MM,Coppes RP,et al.Transforming growth factor-beta plasma dynamics and post-irradiation lung injury in lung cancer patients[J].Radiother Oncol,2004,71(2):183-189.
Protective mechanism of human recombinant clara cell protein 16 on radiation pneumonia and pulmonary fibrosis
TONG Chang-ci,LIU Yun-en,LIU Ying,TONG Zhou,ZHANG Yu-biao,SHI Lin,CONG Pei-fang,SHI Xiu-yun,LIU Xue-lei,JIN Hong-xu,HOU Ming-xiao
(Department of Emergency Medicine,Laboratory of PLA Wound and Trauma Center,The General Hospital of Shenyang Military Command,Shenyang 110016,China)
Objective To explore the protective mechanism of human recombinant clara cell protein 16(rhCC16) on radiation pneumonia and pulmonary fibrosis.Methods A total of SD rats were randomly divided into 3 groups:the normal control group(n=10),the irradiation group (n=10) and the rhCC16+irradiation group(n=10).Animals in the irradiation group and the rhCC16+irradiation group were irradiated with single dose of 15 Gy and rhCC16.Lung tissues were stained by HE and Masson staining;immunohistochemistry,Western blot and Real Time PCR were used to detect the expression levels of IL-6,TNF,TGF-β,Bax and Bcl-2;Serum was harvested for ELISA assay of IL-6,TNFαand TGF-β;Western blot,Real Time PCR and MTT were used to test protective effect of rhCC16 in rat alveolar epithelial cell.Results Compared with the normal control group,the lung tissue of irradiation group presented obvious inflammatory cell infiltration,fiber lesions significantly,alveolar structural damage,cell apoptosis increased and expression levels of IL-6,TNFα and TGF-β increased,which were significantly reduced after rhCC16 intervention treatment.RhCC16 could inhibit the expression of IL-6,TNFα and TGF-β,inhibit apoptosis,and protect rat alveolar epithelial cells from radiation damage.Conclusion RhCC16 can inhibit the radiation induced inflammatory reaction and fibrosis,and has protective effect on radiation pneumonia and pulmonary fibrosis.
RhCC16; Radiation pneumonia; Pulmonary fibrosis
2013年辽宁省科技攻关项目(2013225089);2013年全军十二五面上延续项目(CSY13J003);2014年总后卫生部重大新上项目(AWS14L008)
佟昌慈(1988-),女,辽宁抚顺人,技师,硕士
侯明晓,E-mail:houmingxiao188@163.com;金红旭,E-mail:hongxuj@126.com
2095-5561(2016)06-0341-07
R818
A
2016-10-21
