极寒环境对小鼠心肌组织凋亡蛋白表达影响
2016-12-15张玉彪柳云恩佟昌慈丛培芳史秀云刘学磊金红旭侯明晓
张玉彪, 柳云恩, 施 琳, 佟昌慈, 丛培芳, 史秀云, 刘学磊,刘 颖, 佟 周, 金红旭, 侯明晓
沈阳军区总医院 急诊医学部 全军重症(战)创伤救治中心实验室 辽宁省重症创伤和器官保护重点实验室,辽宁 沈阳 110016
·灾难医学·
极寒环境对小鼠心肌组织凋亡蛋白表达影响
张玉彪, 柳云恩, 施 琳, 佟昌慈, 丛培芳, 史秀云, 刘学磊,刘 颖, 佟 周, 金红旭, 侯明晓
沈阳军区总医院 急诊医学部 全军重症(战)创伤救治中心实验室 辽宁省重症创伤和器官保护重点实验室,辽宁 沈阳 110016
目的 研究极寒环境对小鼠心脏损伤的机制。方法 将30只小鼠分为正常室温组(15只)与-20℃实验组(15只)两组。将-20℃实验组小鼠放入-20℃温控箱内,每日4 h,持续1周,进行HE染色与MASSON染色观察心脏的病理学变化及纤维化,分别运用RT-PCR与Western-blot技术检测Bad、Bax、Col-3及Bcl-xl基因与蛋白水平表达量。结果 -20℃实验组小鼠在温控箱内呼吸急促,伴有颤抖,饮食饮水少于正常室温组,毛发无光泽,心脏有一定的损伤。RT-PCR与Western-blot结果显示,-20℃实验组Bad、Bax、Col-3与Bcl-xl基因与蛋白表达量均升高。结论 -20℃的极寒环境对小鼠心脏细胞凋亡具有一定的损伤作用。
极寒; 凋亡; 纤维化; 小鼠
DOI∶10.16048/j.issn.2095-5561.2016.06.07
温度对机体具有非常重要的作用,是决定生物多样性的一个因素。人体的正常温度在36.4℃~37.3℃;非外伤性低温症是指体温在32℃~35℃;如果受伤,人体的核心温度将降到35℃以下[1-2]。机体对温度的变化具有一定的调节能力,当外界温度变化时,会刺激神经发生一定的反应,中枢神经会根据相关变化调节机体的温度。温度降低到一定程度时,会导致机体发生一系列的反应,机体的能量存储和相关物质的代谢均会发生改变,对器官造成一定的损伤[3-4]。本研究旨在探讨-20℃低温暴露对小鼠心脏损伤的作用。现报道如下。
1 材料与方法
1.1 材料 昆明小鼠30只,6~8周龄,雄性,体质量为23~25 g,由沈阳军区总医院动物医学实验科提供。动物自由饮食、饮水(饲料购自江苏省协同医药生物工程有限责任公司)。MASSON染色试剂盒购于北京索莱宝公司,反转录试剂盒购于日本TAKARA公司,荧光定量试剂盒购于北京天根生化科技有限公司,Bcl-xl抗体、Bad抗体、Col-3抗体及Bax抗体购于美国Abcam公司,二抗山羊抗兔抗体购于美国Abcam公司。
1.2 方法 30只昆明小鼠随机分为两组:正常室温组(15只)与-20℃实验组(15只)。购买小鼠后,将小鼠置于室温下,12 h白昼交替,正常饮食饮水,适应饲养环境1周。正常室温组小鼠继续饲养1周;-20℃实验组小鼠每日置于-20℃温控箱内4 h,其余时间置于室温下,饲养1周。1周后对两组小鼠进行解剖,分别留取7只为病理标本、8只为冻存标本;病理标本放入4%多聚甲醛待HE与MASSON染色,冻存标本放入-80℃冰箱内待测基因及蛋白表达。
1.3 检测指标
1.3.1 生理学变化 观察两组小鼠被毛、饮食饮水、精神状态及体质量的变化。
1.3.2 病理学变化 心脏标本固定24 h后进行取材,梯度脱水17 h,然后包埋、切片,进行HE染色,封片。取一空白切片,按照MASSON试剂盒说明书进行染色。显微镜下观察心脏病理学变化及纤维化情况并拍片。
1.3.3 基因表达的检测 取心脏组织,在液氮下研磨,按照Trizol提取RNA步骤进行操作,对所提RNA进行定量,然后按反转录试剂盒说明书进行反转录,将RNA反转录成cDNA,行SYBR Green实时荧光定量PCR,以β-actin为内参,对β-actin、Bad、Col-3、Bax及Bcl-xl进行扩增并分析,计算实验组小鼠基因相对表达量。
1.3.4 蛋白表达的检测 Western-blot法检测蛋白表达。采用匀浆机将心脏组织制成匀浆,加入蛋白裂解液,以12 000 r/min的速度离心5 min,吸取上清液,运用酶标仪制作标准曲线。然后蛋白质定量,垂直电泳,胶体内的蓝色条带至分离胶底部时,完成电泳。湿转法转印,加入β-actin、Bad、Col-3、Bax及Bcl-xl一抗,置于4℃过夜,加入二抗室温孵育,显影定影,拍照。以β-actin为内参,进行灰度值分析,计算相对表达量。
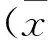
2 结果
2.1 生理学变化 正常室温组小鼠的饮食饮水等情况均正常,体质量增长正常;-20℃实验组小鼠在温控箱内呼吸急促,伴有颤抖,饮食饮水少于正常室温组,毛发无光泽,体质量增长缓慢,个别小鼠不增长。
2.2 HE与MASSON染色结果 HE染色结果显示,-20℃实验组小鼠与正常室温组小鼠比较,-20℃实验组小鼠心脏细胞具有明显的心肌细胞肥大、纤维化改变,并伴有炎症细胞产生(图1a、1b)。MASSON染色结果显示,正常室温组小鼠心脏细胞正常,无纤维化产生;-20℃实验组小鼠心脏组织具有明显的纤维化改变(图1c、1d)。
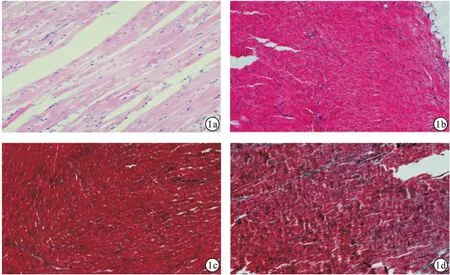
图1 心肌染色结果(a.实验组HE×200;b.对照组HE×200;c.实验组MASSON×200;d.对照组MASSON×200)
2.3 基因表达的结果 RT-PCR结果显示,与正常室温组小鼠比较,-20℃实验组小鼠心脏组织促进凋亡因子Bad、Bax及抑制凋亡因子Col-3、Bcl-xl表达均升高,差异有统计学意义(P<0.05),见表1。
表1 Bad、Bax、Col-3及Bcl-xl基因相对表达量
2.4 蛋白表达的结果 Western-blot结果显示,与正常室温组小鼠比较,-20℃实验组小鼠心脏组织促进凋亡因子Bad、Bax及抑制凋亡因子Col-3、Bcl-xl表达均升高,差异有统计学意义(P<0.05),见图2,表2。
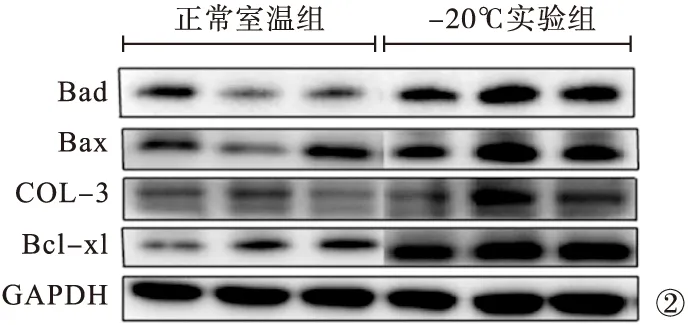
图2 Bad、Bax、Col-3、Bcl-xl蛋白相对表达量

组别BadBaxCol-3Bcl-xl正常室温组(n=8)1111-20℃实验组(n=8)3.95±0.353.46±0.283.25±0.225.62±0.45P值<0.05<0.05<0.05<0.05
3 讨论
很多关于寒冷环境的研究并不局限于病情的对症治疗,更重视诊治靶点的发现。Jain等[5]发现,寒冷刺激可提高成年大鼠心肌组织中GRP78、HIF-1α的蛋白表达。Su等[6]研究表明,寒冷条件下大鼠肝脏组织中TUG1高表达,TUG1可作为治疗极寒环境致肝脏损伤的新靶标。Farghaly等[7]研究发现,寒冷条件下大鼠血清中IL-6、TNF-α的表达显著降低,炎症反应被抑制。Joo等[8]发现,寒冷能加重小鼠急性肺损伤的炎症反应,IL-12、IL-17及干扰素诱导的单核因子的表达升高。循环系统在极寒环境中的早期改变有心率加快、心输出量增多、平均动脉压升高,随着体温的持续下降,心率减慢、心肌收缩力减弱、低血压等症状开始出现,严重时可出现心房颤动、心室颤动、心脏骤停[9-11]。此外,极寒还可以使心肌细胞凋亡率显著增加[12]。
寒冷环境不仅对身体造成了一定的损伤,对军事作战也有一定的影响。我国寒区地处国防战略重地,寒区恶劣的自然环境是我国寒区部队非战斗减员的最主要原因。在朝鲜战争中,寒冷引起的我军非战斗人员伤亡占我军伤亡总人数的20%。此后,我军对寒冷条件下机体的保护研究进行了多种有益探索,包括开展冻伤原因调查分析、救治技术改良、冻伤防治等多项寒区专项课题攻关等,这些研究对极寒地域部队预防并治疗寒冷致机体损伤起到了积极作用。
细胞凋亡时会导致一系列凋亡因子发生变化,凋亡发生会使线粒体外面形成多聚的Bax孔道,使线粒体内的色素、smac等从线粒体内流出,从而达到细胞凋亡的作用[13-15]。Bad蛋白作为Bcl-2家族的促进凋亡因子,能够在细胞受到凋亡刺激后从线粒体外侧进入线粒体内侧,促进细胞色素的产生及释放,从而达到促进凋亡的作用。Bcl-xl蛋白作为Bcl-2家族的抑制凋亡因子,当过氧化氢诱导H9C2凋亡时,能够从细胞浆内转移到线粒体膜上,从而发挥抑制凋亡作用。Bad蛋白能够在凋亡时转移到线粒体上,与Bcl-xl相互结合,形成促进凋亡的复合体,进而释放与Bcl-xl结合能够促进细胞凋亡的蛋白Bax,从而发挥促进凋亡作用[16-18]。
本研究中,-20℃实验组小鼠在温控箱内呼吸急促,伴有颤抖,饮食饮水少于正常组,毛发无光泽,体质量增长缓慢,个别小鼠不增长;HE染色结果中,-20℃实验组小鼠心脏细胞具有显著的心肌细胞肥大、纤维化改变,并伴有炎症细胞产生;MASSON染色结果中,-20℃实验组小鼠心脏组织具有明显的纤维化改变;RT-PCR、Western-blot结果中,与正常室温组小鼠比较,-20℃实验组小鼠心脏组织促进凋亡因子Bad、Bax及抑制凋亡因子Col-3、Bcl-xl基因与蛋白相对表达量均升高。实验结果表明,-20℃时,小鼠心脏细胞内的Bad、Bax表达量升高,导致细胞发生凋亡,由于机体在低温环境下会发挥一定的保护作用,因而Col-3、Bcl-xl表达量升高,在一定程度下对机体起到保护作用。
综上所述,-20℃的极寒环境对小鼠心脏细胞凋亡具有一定的损伤作用。极寒环境对心脏具体凋亡机制尚需进一步研究完善。
[1] Diestel A,Drescher C,Miera O,et al.Hypothermia protects H9c2 cardiomyocytes from H2O2induced apoptosis[J].Cryobiology,2011,62:53-61.
[2] Watanabe MA,Kucenas S,Bowman TA,et al.Angiotensin II and CRF receptors in the central nucleus of the amygdalamediate hemodynamic response variability to cocaine in conscious rats[J].Brain Res,2010,13(9):53-65.
[3] Sabir H,Scull BE,Liu X,et al.Immediate hypothermia is not neuroprotective after severe hypoxia-ischemia and is deleterious when delayed by 12 hours in neonatal rats[J].Stroke,2012,43:3364-3370.
[4] Kühlein HN,Tegeder I,Möser C,et al.Nerve injury evoked loss of latexin expression in spinalcord neurons contributes to the development of neuropathic pain[J].PLoS One,2011,6(4):e19270.
[5] Jain K,Suryakumar G,Prasad R,et al.Myocardial ER chaperone activation and protein degradation occurs due to synergistic,not individual,cold and hypoxic stress[J].Biochimie,2013,95(10):1897-1908.
[6] Su S,Liu J,He K,et al.Overexpression of the long non-coding RNA TUG1 protects against cold-induced injury of mouse livers by inhibiting apoptosis and inflammation[J].FEBS J,2016.
[7] Farghaly HS,Mahmoud AM,Abdel-Sater KA.Effect of dexmedetomidine and cold stress in a rat model of neuropathic pain:role of interleukin-6 and tumor necrosis factor-α[J].Eur J Pharmacol,2016,5(776):139-145.
[8] Joo SY,Park MJ,Kim KH,et al.Cold stress aggravates inflammatory responses in an LPS-induced mouse model of acute lung injury[J].Int J Biometeorol,2015.
[9] Mestre-Alfaro A,Ferrer MD,Banquells M,et al.Body temperature modulates the antioxidant and acute immune responses to exercise[J].Free Radic Res,2012,46:799-808.
[10] Søreide K.Clinical and translational aspects of hypothermia in major trauma patients:from pathophysiology to prevention,prognosis and potential preservation[J].Injury,2014,45(4):647-654.
[11] Sundar IK,Yao H,Huang Y,et al.Serotonin and corticosterone rhythms in mice exposed to cigarette smoke and in patients with COPD:implication for COPD-associated neuropathogenesis[J].PLoS One,2014,9:e87999.
[12] Perl T.Pathophysiology and epidemiology of accidental hypothermia[J].Biomed Tech,2012,57:1035.
[13] Klenerova V,Jurcovicova J,Kaminsky O,et al.Combined Restraint and cold stress in rats:effects on memory processing in passive avoidance task and on plasma levels of ACTH and corticosterone[J].Behav Brain Res,2003,142(1-2):143-149.
[14] Craig RP.Military cold injury during the war in the Falkland Islands 1982:an evaluation of possible risk factors[J].J R Army Med Corps,2007,153(Suppl 1):63-68.
[15] Armed Forces Health Surveillance Center.Update:cold weather injuries,U.S.Armed Forces,July 2006-June 2011[J].MSMR,2011,18(10):14-18.
[16] Williamson K,Izard R.Epidemic of non-freezing cold injury in the British Army[J].J R Army Med Corps,2007,153(2):143-146.
[17] Davis PR,Byers M.Accidental Hypothermia[J].J R Army Med Corps,2005,151(4):223-233.
[18] Jain K,Suryakumar G,Prasad R,et al.Myocardial ER chaperone activation and protein degradation occurs due to synergistic,not individual,cold and hypoxic stress[J].Biochimie,2013,95(10):1897-1908.
Effect of cold stress on the heart expression of apoptosis protein in mice
ZHANG Yu-biao,LIU Yun-en,SHI Lin,TONG Chang-ci,CONG Pei-fang,SHI Xiu-yun,LIU Xue-lei,LIU Ying,TONG Zhou,JIN Hong-xu,HOU Ming-xiao
(Department of Emergency Medicine,Laboratory of PLA Wound and Trauma Center,The General Hospital of Shenyang Military Command,Shenyang 110016,China)
Objective To explore the mechanism of cardiac injury in mice.Methods A total of 30 mice were divided into two groups the normal temperature room group(n=15) and the -20℃ experimental group(n=15),the experimental mice were placed in-20 ℃ temperature control box for 4 hours a day,Bad,Bax,Col-3 and Bcl-xl were detected by RT-PCR and Western-blot,respectively.The expression levels of Bad,Bax,Col-3 and Bcl-xl were detected by HE staining and MASSON staining in the pathological changes and fibrosis of the heart.Results In the experimental group,the heart of mice in experimental group had some damage,such as shortness of breath,shivering,drinking water less than normal group,dull hair,etc.Ruslts of RT-PCR and Western blot showed that Bad,Bax,Col-3 and Bcl-xl were increased the expression of genes and proteins.Conclusion Under the condition of -20℃,the cardiomyocyte apoptosis of mice is damaged.
Arctic; Apoptosis; Fibrosis; Mice
2014年总后卫生部重大新上(AWS14L008);2013年全军十二五面上延续项目(CSY13J003);全军十二五面上项目(CUS11J295)
张玉彪(1987-),男,黑龙江齐齐哈尔人,技师,博士
金红旭,E-mail:hongxuj@126.com; 侯明晓,E-mail:houmingxiao188@163.com
2095-5561(2016)06-0347-04
R541
A
2016-10-25
