爆震冲击波对大鼠脑组织炎症因子IL-1β、IL-6及IL-10表达影响
2016-12-15柳云恩史秀云刘学磊佟昌慈张玉彪丛培芳金红旭侯明晓
柳云恩, 刘 颖, 史秀云, 刘学磊, 佟 周, 佟昌慈, 张玉彪, 施 琳,丛培芳, 金红旭, 侯明晓
沈阳军区总医院 急诊医学部 全军重症(战)创伤救治中心实验室 辽宁省重症创伤和器官保护重点实验室,辽宁 沈阳 110016
·灾难医学·
爆震冲击波对大鼠脑组织炎症因子IL-1β、IL-6及IL-10表达影响
柳云恩, 刘 颖, 史秀云, 刘学磊, 佟 周, 佟昌慈, 张玉彪, 施 琳,丛培芳, 金红旭, 侯明晓
沈阳军区总医院 急诊医学部 全军重症(战)创伤救治中心实验室 辽宁省重症创伤和器官保护重点实验室,辽宁 沈阳 110016
目的 观察颅脑爆震伤后不同时间点大鼠炎症因子IL-1β、IL-6和IL-10的变化,探讨颅脑爆震伤后相关因子与时间的关系及损伤机制。方法 将健康雄性SD大鼠56只,随机分为模型组(n=8)和对照组(n=48)。采用Western-blot、ELISA和Real-time PCR方法,测定伤后3、6、12、24、48、72 h大鼠血清及脑组织中IL-1β、IL-6以及IL-10的含量和mRNA的表达变化。结果 与对照组比较,模型组血清及脑组织各个时间点炎症因子IL-1β、IL-6的含量以及mRNA的表达均明显增高,差异有统计学意义(P<0.05);抑炎因子IL-10含量以及mRNA的表达先明显降低后恢复正常,差异有统计学意义(P<0.05)。结论 IL-1β、IL-6以及IL-10等炎症因子的变化有助于判断和治疗颅脑爆震伤。
颅脑爆震伤; 白细胞介素-1β; 白细胞介素-6; 白细胞介素-10
DOI∶10.16048/j.issn.2095-5561.2016.06.05
随着强杀伤力爆炸性武器的广泛使用、恐怖袭击的增多和某些恶性事故频繁出现,爆震伤在现代社会中极其常见并引起国内外的广泛关注[1]。爆震产生的冲击波能够直接或间接作用于机体而引发各种组织器官损伤,其中颅脑爆震伤(blast-related traumatic brain injury,bTBI)居于首位[2]。目前,国内外对爆震伤已经进行了较为系统和深入的研究,但有关爆震伤中颅脑损伤的致伤特点及致伤机制报道则较少[3-4]。因此,本研究通过建立颅脑爆震伤大鼠实验动物模型,检测不同时间点大鼠脑组织中IL-1β、IL-6和IL-10的变化,探讨炎症因子在颅脑爆震伤中的作用,旨在为颅脑爆震伤的损伤特点及机制提供理论依据。现报道如下。
1 材料与方法
1.1 材料与试剂 健康成年雄性SD大鼠56只,体质量(200±10)g,由沈阳军区总医院动物医学实验科提供。动物自由饮食、饮水(饲料购自江苏省协同医药生物工程有限责任公司),清洁级动物房饲养,适应性喂养1周后开始实验。
鼠抗GAPDH单克隆抗体系武汉博士德生物工程有限公司产品,兔抗IL-1β多克隆抗体、兔抗IL-6多克隆抗体、兔抗IL-10多克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗小鼠IgG二抗及HRP标记羊抗兔IgG二抗均购自美国CST公司;Western Blot一抗稀释液购自中国碧云天生物技术研究所;IL-1β、IL-6和IL-10 ELISA 试剂盒购自法国Diaclone公司;IL-1β、IL-6、IL-10和β-actin引物由上海Sangon公司合成。
1.2 方法
1.2.1 实验动物分组 将56只SD大鼠随机分为对照组和模型组。模型组根据伤后时间又分为6个亚组,每亚组8只。伤后时间点分别为3、6、12、24、48、72 h。
1.2.2 动物模型的建立 模型组:采用爆震冲击装置建立颅脑损伤大鼠动物模型。大鼠称重麻醉后放置于爆震伤装置上,通过保护管保护大鼠胸腹部,头部外露。下方炮筒压力达到0.12 MPa时铝膜爆破,超压波显示压力为0.55 MPa,大鼠飞起高度为80~150 cm。对照组:不致伤,仅作为脑组织中IL-1β、IL-6和IL-10测定的对照。
1.2.3 Western-blot检测脑组织IL-1β、IL-6以及IL-10的含量 分别于颅脑爆震伤后3、6、12、24、48、72 h取大鼠脑组织。提取蛋白后,将蛋白样品经SDS-聚丙烯酰胺凝胶电泳并转移至PVDF膜上,于含3%牛血清白蛋白的TBST(0.05%Tween-20的TBS)中室温封闭1 h,分别用兔抗iNOS、IL-1β多克隆抗体以及鼠抗GAPDH单克隆抗体4℃孵育过夜。TBST漂洗3次,分别用HRP标记羊抗兔IgG二抗、HRP标记羊抗小鼠IgG二抗,室温孵育1 h。TBST漂洗3次,用ECL Western印迹试剂盒进行化学发光检测。
1.2.4 ELISA检测血清中IL-1β、IL-6以及IL-10的含量 分别于颅脑爆震伤后3、6、12、24、48、72 h取血液,分离血清后置入-80℃冰箱备用。实验时将血清在冰浴上融化,加入到抗原包被的96孔板中,孵育,甩干。加入Detection A溶液,孵育30 min,甩干洗板,再加入Detection B溶液,孵育30 min,甩干洗板,显色。检测每个孔的吸光度,根据标准曲线计算出每个血清中所含IL-1β、IL-6以及IL-10的浓度。
1.2.5 RT-PCR检测IL-1β、IL-6以及IL-10 mRNA的表达 利用Trizol试剂提取大鼠脑组织总RNA。取4.0 μg总RNA,65℃变性5 min,经AMV反转录酶42℃反转录30 min,合成cDNA。取cDNA产物5 μl,依次加入10×PCR缓冲液,上、下游引物各50.0 pmol、dNTP 0.2 mmol/L、MgCl 22.0 mmol/L以及TaqDNApoly-merase 1 U。以下列条件进行扩增:94℃ 3 min,94℃ 45 s,52℃45 s(IL-1β),50℃ 45 s(IL-6),51℃ 45 s(IL-10),55℃ 45 s(β-actin),72℃ 45 s。进行30次循环后进一步延伸,72℃ 5 min。根据GenBank中IL-1β、IL-6和IL-10的cDNA序列,用引物设计软件Primer 5设计特异性引物。见表1。
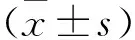
2 结果
2.1 Western-blot检测结果 与对照组比较,模型组大鼠脑组织中炎症因子IL-1β和IL-6表达增高,差异有统计学意义(P<0.05)。其中,IL-1β在6 h时达到高峰并持续至48 h,随后浓度稍有降低;IL-6在24 h时开始升高,48 h时达到最高;抑炎因子IL-10的表达降低,48 h时开始恢复。见图1。

表1 特异性引物设计
图1 不同时间点时大鼠脑组织中IL-1β、IL-6和IL-10表达水平(与对照组比较,①P<0.05)
2.2 ELISA试剂盒检测结果 与对照组比较,模型组大鼠血清中炎症因子IL-1β和IL-6表达增高。其中,IL-1β在6 h时达到高峰并持续至48 h,随后浓度稍有降低;IL-6则在3 h时开始升高,24 h达到最高;抑炎因子IL-10表达降低,24 h时开始恢复。见表2。
2.3 Real-time PCR检测结果 模型组大鼠脑组织中IL-1β、IL-6的mRNA表达明显高于对照组,差异有统计学意义(P<0.05)。其中,IL-1β在6 h时达到高峰并持续至48 h,随后浓度稍有降低;IL-6在3 h时开始升高,24 h达到最高;抑炎因子IL-10的mRNA表达则明显低于对照组,差异有统计学意义(P<0.05),24 h时开始恢复。见表3。
表2 不同时间点大鼠血清中IL-1β、IL-6以及IL-10的含量比较
注:与对照组比较,①P<0.05
表3 不同时间点大鼠脑组织中IL-1β、IL-6以及IL-10 的mRNA表达水平比较
注:与对照组比较,①P<0.05
3 讨论
颅脑爆震伤的发生逐年增多,其病因复杂,致死率高,除具有严重的原发性损伤外,继发性炎症损伤已成为颅脑爆震伤预后较差的重要原因之一[5]。IL-1β、IL-6和IL-10作为机体内重要的炎症因子和抑炎因子,常参与机体炎症和创伤反应的发生发展。尤其有关异常释放的炎性因子参与脑损伤的发生和修复的研究,目前已得到广泛的重视[6-7]。因此,本研究通过测定伤后不同时间点血清及脑组织中IL-1β、IL-6和IL-10的变化,进一步明确各因子在颅脑爆震伤中的作用。本研究结果表明,不同时间点模型组大鼠体内IL-1β和IL-6含量均明显升高,IL-10的含量明显降低后恢复。各细胞因子mRNA的变化趋势与蛋白水平一致,这进一步证明了颅脑爆震伤发生时相关炎症因子的变化。
促炎性细胞因子IL-1β主要由活化的单核巨噬细胞产生,是一种多效性的细胞因子,脑中触发炎症反应的重要介质之一,主要由血管内皮细胞、胶质细胞、神经元等活化表达[8]。在生理条件下,脑内IL-1β水平很低,脑损伤后IL-1β表达上调,除增强嗜中性粒细胞及单核细胞的粘附作用,导致了脑血管结构和血脑屏障的破坏,从而进一步加剧继发性脑损害的发生,IL-1β还可通过激活磷脂酶A2,使磷脂过度降解,从而导致细胞膜损伤[9]。IL-1β与细胞表面受体结合,激活炎症信号通路,最终激活核因子KB(NF-kB),在脑损伤的免疫应答和炎症反应中同样起到重要的作用[10]。急性颅脑损伤时,促炎细胞因子IL-1β激活后能够促使机体IL-6的释放,后者正反馈于单核巨噬细胞系统和多形粒细胞(PMN),进一步产生更多的各种炎症介质[11]。
IL-6是一种由184个氨基酸组成的糖蛋白,由单核细胞、B细胞、T细胞、成纤维细胞以及内皮细胞等多种有核细胞产生。作为颅脑爆震伤发生后早期出现的一种细胞炎症因子,IL-6的异常表达可出现在中枢神经系统创伤及感染性疾病中[12]。IL-6激活并介导多种细胞因子的相互作用,能够导致并加重继发性脑损害。机体损伤发生炎症反应产生IL-6,能够诱导多种细胞合成和分泌多种急性期蛋白,促进感染时中性粒细胞的产生、活化、促进细胞增殖、分化及产生免疫球蛋白[13]。损伤发生在早期神经系统及外周血中,IL-6含量明显升高,还会促使炎症细胞大量积聚在病变区域,导致血脑屏障通透性增加,造成脑实质的损伤[14]。此外,IL-6还可促进细胞钙离子内流,钙超载引起细胞一系列生化反应,最终导致细胞崩解。本研究中IL-6的表达升高,与相关脑损伤的研究结果一致[15]。
IL-10是一种重要的抗炎细胞因子,主要由单核细胞、巨噬细胞和辅助性T细胞分泌。其通过抗炎和抗凋亡能够发挥神经保护作用[16]。有研究表明,IL-10能够在分子和转录水平抑制细胞合成释放IL-1β、IL-6以及肿瘤坏死因子(TNF)等促炎因子[17]。此外,IL-10能通过下调单核细胞表面主要组织相容性抗原Ⅱ的表达,降低其抗原呈递作用,下调T淋巴细胞活性,抑制炎性细胞的激活、迁移和粘附[18]。本研究中,IL-10的表达降低后逐渐恢复正常,这说明颅脑爆震伤对抗炎介质产生了抑制作用。检测IL-10的表达有助于临床颅脑爆震伤的诊断。
综上所述,颅脑爆震伤后机体瞬间产生严重应激反应。IL-1β、IL-6以及IL-10等炎症因子参与颅脑爆震伤的发生和发展,且表达量与损伤时间具有相关性。因此,IL-1β、IL-6和IL-10对颅脑爆震伤的诊断、治疗及预后中有一定意义,较早抑制炎症反应的发生,干预IL-1β、IL-6以及IL-10等的表达可能成为爆震导致脑损伤的有效治疗方法之一。
[1] Wolf SJ,Bebarta VS,Bonnett CJ,et al.Blast injuries[J].Lancet,2009,374(9687):405-415.
[2] Mazzeo AT,Beat A,Singh A,et al.The role of mitochondrial transition pore,and its modulation,in traumatic brain injury and delayed neurodegeneration after TBI[J].Experimental neurology,2009,218(2):363-370.
[3] Ritenour AE,Baskin TW.Primary blast injury:update on diagnosis and treatment[J].Crit Care Med,2008,36(7 Supp l):S311-S317.
[4] Marti M,Parrón M,Baudraxler F,et al.Blast injuries from Madrid terrorist bombing attacks on March 11,2004[J].Emerg Radiol,2006,13(3):113-122.
[5] Finnie JW.Neuroinflammation:beneficial and detrimental effects after traumatic brain injury[J].Inflammopharmacology,2013,21(4):309-320.
[6] 彭 浩,陈 兵.白细胞介素1β在颅脑损伤中的作用[J].广东医学院学报,2008,26(5):550-552.
[7] 唐玉兰,秦 雪,盛文利,等.蛛网膜下腔出血患者外周血和脑脊液的IL-6水平研究[J].中国神经精神疾病杂志,2000,26(2):120-125.
[8] 朱 涛,杨树源,姚 智.白细胞介素-1与脑创伤[J].中华创伤杂志,1997,13(5):323-324.
[9] 杨树源,冯 健,姚 智,等.白细胞介素1受体拮抗剂对大鼠外伤性脑水肿的治疗作用[J].中华神经外科杂志,2003,19(4):297-299.
[10] 朱 刚,王正国,朱佩芳,等.脑内IL-1β和ICAM-1与继发性脑损伤关系[J].中国临床神经外科杂志,2002,7(4):230-232.
[11] 何百祥,张瑞娟,丁 丽,等.硫酸镁对重型颅脑损伤患者血清IL1β、TNFα浓度的影响[J].西安交通大学学报,2010,4(31):497-500.
[12] Woiciechowsky C,Schoning B,Cobanov J,et al.Early IL-6 plasma concentrations correlate with severity of brain injury and pneumonia in brain-injured patients[J].J Trauma,2002,52(2):339-345.
[13] 俞学斌,金国良,丁建仁.白介素6、8在急性颅脑损伤患者含量的变化及其临床意义[J].浙江创伤外科,2004,9(5):287-293.
[14] Winter CD,Pringle AK,Clough GF,et al.Raised parenchymal interleukin-6 levels correlate with improved outcome after traumatic brain injury[J].Brain,2004,127(Pt 2):315-320.
[15] Rhodes JK,Andrews PJ,Holmes MC,et al.Expression of interleukin-6 messenger RNA in a rat model of diffuse axonal injury[J].Neurosci Lett,2002,335(1):1-4.
[16] 赵宁伟,殷志敏.关于IL-10 抗炎机制的研究[J].生命科学研究,2007,4(11):14-18.
[17] Tryzmel J,Miskolci V,Castro-Alcaraz S,et al.Interleukin-10 inhibits proinflammatory chemokine release by neutrophils of the newborn without suppression of nuclear factor-kappa B[J].Pediatr Res,2003,54(3):382-386.
[18] Ward C,Murray J,Clugston A,et al.Interleukin-10 inhibits lipopolysaccharide-induced survival and extracellular signal-regulated kinase activation in human neutrophils[J].Eur J Immunol,2005,35(9):2728-2737.
Detonation shock wave in rat tissue inflammation factor influence on expression of IL-1β,IL-6 and IL-10
LIU Yun-en,LIU Ying,SHI Xiu-yun,LIU Xue-lei,TONG Zhou,TONG Chang-ci,ZHANG Yu-biao,SHI Lin,CONG Pei-fang,JIN Hong-xu,HOU Ming-xiao
(Department of Emergency Medicine,Laboratory of PLA Wound and Trauma Center,The General Hospital of Shenyang Military Command,Shenyang 110016,China)
Objective To explore the changes of IL-1β,IL-6 and IL-10 expression in rat brain at different time points after blast injury and explore the possible mechanism.Methods A total of 56 healthy male rats were randomly divided into the model group(n=8)and the normal control group(n=48).After 3 hours,6 hours,12 hours,24 hours,48 hours and 72 hours of the injury,Western-blot,ELISA and Real-time PCR methods were used for determination of IL-1β,IL-6 and IL-10 content and expression changes of mRNA in rat serum and brain.Results Compared with normal control group,the expression of inflammatory cytokines IL-1β and IL-6 and mRNA were significantly increased in serum and brain tissue of model group(P<0.05);the expression of anti-inflammatory factor IL-10 and mRNA was reduced before 24 hours(P<0.05),and then significantly reduced back to normal.Conclusion The change of inflammatory factors of IL-1β,IL-6 and IL-10 may help determine and carry out treatment of craniocerebral blast injury.
Traumatic brain blast injury; Interleukin-1β; Interleukin-6; Interleukin-10
2014年总后卫生部重大新上项目(AWS14L008);2013年全军十二五面上延续项目(CSY13J003);辽宁省自然科学基金(201602771)
柳云恩(1979-),男,辽宁葫芦岛人,主治医师,博士
侯明晓,E-mail:houmingxiao188@163.com;金红旭,E-mail:hongxuj@126.com
2095-5561(2016)06-0336-05
R651.1
A
2016-11-21
