低温处理对德尔100黄瓜品种生理生化指标的影响
2016-12-12张亚红王丽慧
方 媛,张亚红,叶 华,王丽慧,白 祥
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏回族自治区水产技术推广站,宁夏 银川 750021;3.宁夏林业研究院,宁夏 银川 750021)
低温处理对德尔100黄瓜品种生理生化指标的影响
方 媛1,张亚红1,叶 华1,王丽慧2,白 祥3
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏回族自治区水产技术推广站,宁夏 银川 750021;3.宁夏林业研究院,宁夏 银川 750021)
以宁夏日光温室栽培常用黄瓜品种德尔100为试材,通过智能人工气候箱模拟设施生产中的3个低温环境,依据丙二醛、脯氨酸、电导率和超氧化物歧化酶4个生理生化指标的变化阐述黄瓜在宁夏日光温室栽培受冷害的机制。结果表明:黄瓜幼苗在23℃/12℃环境下受影响较小,23℃/9℃环境次之,23℃/6℃环境对黄瓜幼苗的伤害最严重,其在23℃/12℃环境可耐受6 d,在23℃/9℃环境可耐受4 d,23℃/6℃环境可耐受2 d;黄瓜幼苗在低温胁迫后,经过23℃/17℃(CK)恢复不同时间,在23℃/12℃处理6 d、23℃/9℃处理4 d、23℃/6℃处理2 d后,植株恢复表现均不明显表明植株恢复状况取决于前期受低温胁迫程度和胁迫时间的影响。
黄瓜;低温;适应性;恢复性
近年来我国设施农业得到了突飞猛进的发展,其中日光温室占总设施面积的80%以上[1]。日光温室种植已成为农业种植业中效益最高的产业模式,解决了反季节蔬菜供应问题[2]。虽然目前我国的设施种植发展飞速,但不可否认我国与设施农业发达国家还有一定差距,一方面是种植以农民为主,文化水平不高以及对设施农业基础认识不足,缺乏专业技术人员的指导,限制了设施种植发挥最大的产能比[3],另一方面是我国设施较简陋,导致机械化和智能化程度较低,龙骨与覆盖膜及后墙材料受经济条件限制,抵御自然灾害能力较弱,影响了设施产业的整体发展。宁夏冬春季温度过低,是蔬菜冬春季大棚栽培所面临的主要问题。而黄瓜(Cucumis stivus L.)是一种世界性的重要蔬菜作物,种植范围较广,对低温敏感,其苗期种植温度一般低于15℃就会发生冷害[4]。黄瓜预冷害机制一是膜系统受到损伤,如细胞膜透性改变,导致细胞内外渗透压失衡,二是细胞代谢产物出现异常如脯氨酸(Pro)和丙二醛(MDA)含量上升,现关于自根苗的抗寒性已有许多报道[5-7]。低温胁迫3个彩叶草品种会使其电导率、脯氨酸含量、丙二醛含量、超氧化物歧化酶(SOD)活性上升[8]。叶静等[9]总结植物对冷害的机制表明,冷害会使蔬菜内MDA含量、SOD活性上升。黄希莲等[10]研究低温胁迫对6种绿篱植物生理生化的影响表明:低温胁迫的程度越深,时间越长,电导率、MDA、Pro含量呈上升趋势,SOD活性在2℃时呈下降趋势,其他处理温度呈上升趋势。近年来多以低温胁迫梯度、时间为因素研究植物生理生化指标的变化趋势,很少有研究不同低温胁迫程度下不同恢复天数对植物生理生化指标的影响。武辉等[11]报道指出,丙二醛、电导率在低温胁迫后都可得到一定程度的恢复,且恢复性与抗寒性呈正相关。
本试验针对宁夏设施栽培黄瓜品种,对其幼苗期进行低温处理和恢复处理,以宁夏春、冬季设施栽培常遇的低温处理黄瓜幼苗并进行每个阶段的多次恢复处理,研究低温胁迫下黄瓜幼苗MDA、Pro、电导率和SOD活性4个生理生化指标的变化趋势,探索黄瓜在各个低温胁迫阶段的抗低温能力,为宁夏地区设施黄瓜生产规避灾害性天气及茬口安排提供依据。
1 材料与方法
1.1 试验材料
供试材料为德尔100(抗寒系列)黄瓜品种,种子来源于天津德瑞特种业有限公司。
1.2 试验方法
试验于2013年5月在宁夏大学农科实训基地进行,温汤处理黄瓜种子后,采用72穴盘基质育苗。当黄瓜苗第2片真叶出现时移栽至营养钵内土培,进行正常的育苗管理,气温保持昼温15~28℃。待幼苗长至五叶一心时,选取长势一致的幼苗移入HP1500GS型智能人工气候箱内进行处理。
试验设3个低温处理:T1(23℃/12℃)、T2(23℃/9℃)、T3(23℃/6℃),以气温(23℃/17℃)为对照(CK),温度设置时长为昼8 h/夜16 h。低温处理2、4、6、8、10 d后,分别在CK(23℃/17℃)下恢复2、4、6 d,每个处理3次重复,相对湿度保持在60%~70%,设定光照强度为6 000 lx,光照时间为9:00~17:00(按冬季日光温室揭、放外覆保温被时间设置)。
1.3 测定项目及方法
相对电导率测定采用电解质外渗量法[12],丙二醛含量测定采用硫代巴比妥酸法[13],游离脯氨酸含量测定采用酸性茚三酮比色法[14],SOD活性测定采用氮蓝四唑比色法[15]。
采用Excel软件和DPS7.05统计软件进行数据分析。
2 结果与分析
2.1 低温处理对黄瓜幼苗生理指标的影响
2.1.1 低温处理对黄瓜幼苗相对电导率的影响 由图1可知,德尔100黄瓜幼苗的相对电导率随处理温度的下降而升高,且相对电导率表现为处理T3>T2>T1>CK。T1、T2、T3处理10 d的电导率较CK增加44%、78%和143%。低温处理2 d,T1、T2处理的黄瓜幼苗相对电导率变化不明显,处理4 d后,相对电导率开始显
著增加,说明黄瓜幼苗对9℃以下低温4 d细胞膜开始受伤害。本黄瓜品种幼苗在低温处理下,电导率随处理时间的延长而增大,其中T1处理下增幅较小,T2处理下电导率增加速率较T1明显增快,而T3处理下电导率持续增加且幅度大,说明低温处理导致细胞膜受损,且处理温度越低细胞膜受损越严重。
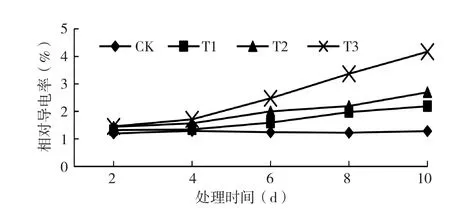
图1 低温处理对黄瓜幼苗相对电导率的影响
2.1.2 低温处理对黄瓜幼苗MDA含量的影响 由图2可知,德尔100黄瓜幼苗MDA含量随着处理温度的下降而升高,随着处理时间的延长呈上升趋势。不同温度处理MDA变化趋势为T3>T2>T1>CK。黄瓜幼苗在低温T1、T2、T3处理10 d MDA含量分别较CK增加8%、22%和58%。T1处理增幅较小,说明对细胞膜的伤害较小;随着处理时间的延长,T2和T3处理的MDA含量增加迅速,且都高于T1处理,说明T2、T3处理使黄瓜幼苗细胞膜脂过氧化程度加剧,大量有害物质的积累会影响生长,即MDA含量越高受低温伤害越严重。
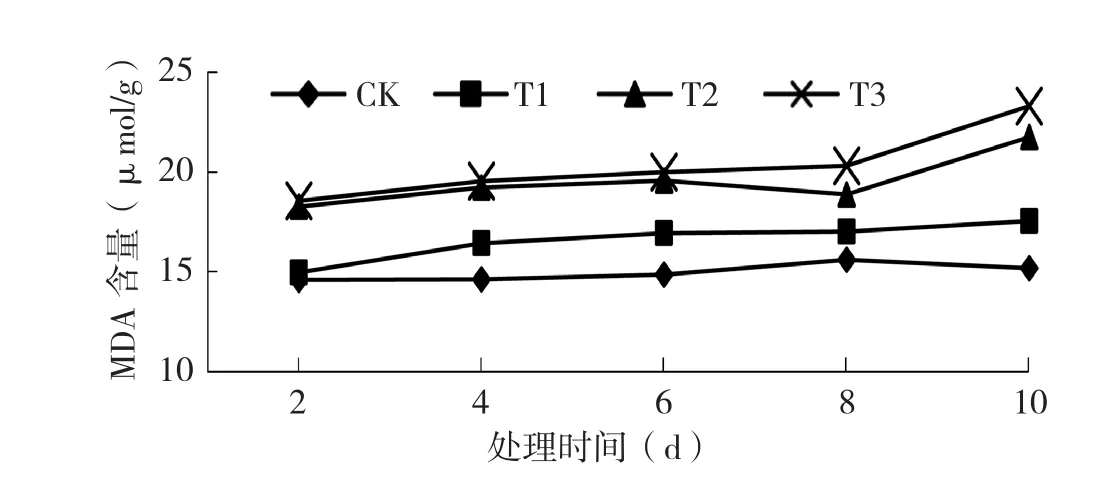
图2 低温处理对黄瓜幼苗丙二醛含量的影响
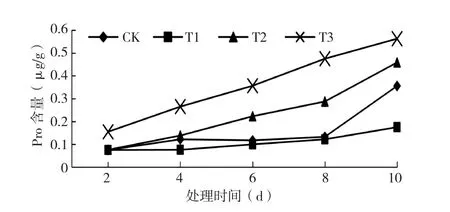
图3 低温处理对黄瓜幼苗脯氨酸含量的影响
2.1.3 低温处理对黄瓜幼苗Pro含量的影响 Pro是植物细胞中重要的渗透调节物质,对植物抗逆性起重要调节作用,植物通过增加细胞内Pro含量增强对外界低温环境的耐受性[16]。由图3可知,德尔100黄瓜幼苗Pro含量随着处理温度的降低而升高,不同温度处理的Pro含量变化趋势为T3>T2>T1>CK。T1、T2、T3处理10 dPro含量分别较CK增加2.10、3.23和5.13倍。结果表明,低温环境使黄瓜幼苗的Pro含量升高,并且随着低温程度和处理时间的延长,Pro含量持续增高。6℃低温处理2 d后Pro含量开始显著增加,9℃低温处理4 d后Pro含量开始显著增加,12℃低温处理8 d后Pro含量开始显著增加,说明黄瓜幼苗对6℃低温可耐受2 d以下,9℃低温处理4 d细胞膜开始受伤害,12℃处理低温8 d后幼苗开始出现胁迫。
2.1.4 低温处理对黄瓜幼苗SOD活性的影响 由图4可知,德尔100黄瓜幼苗SOD活性随着处理温度的下降而降低,T1处理SOD活性呈上升趋势,在低温处理6 dSOD活性上升幅度最大,随着处理时间的延长,SOD活性上升幅度逐渐减少,说明德尔100黄瓜在T1处理下能抵抗6 d低温;T2处理,SOD活性出现短暂上升后在低温处理6 d后出现显著下降,已失去保护酶活性;T3处理SOD活性相对CK呈现大幅减少,说明德尔100黄瓜在T3处理下已失去保护酶活性。
2.2 不同恢复时间对低温处理黄瓜幼苗生理指标的影响
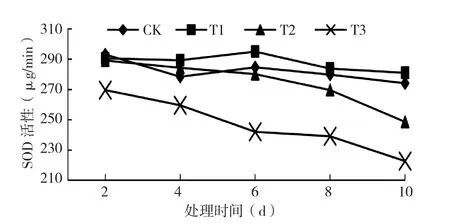
图4 低温处理对黄瓜幼苗SOD活性的影响
2.2.1 不同恢复时间对黄瓜幼苗相对电导率的影响 由图5可知,德尔100黄瓜幼苗在T1处理下的电导率随着恢复适温时间的延长呈下降趋势。T1处理10 d恢复适温6 d的电导率较T1处理降低32%,在T1处理10 d适温恢复6 d才恢复至CK水平,低温处理时间较长细胞恢复得越慢。T2处理8 d,电导率不随恢复时间的延长而降低,T2处理10 d恢复适温2、4、6 d,电导率均较CK分别升高了13%、15%、14%。T3处理4 d后,电导率不随恢复天数的增加而减小,T3处理10 d恢复2、4、6 d时较处理分别增加了14%、16%、14%。
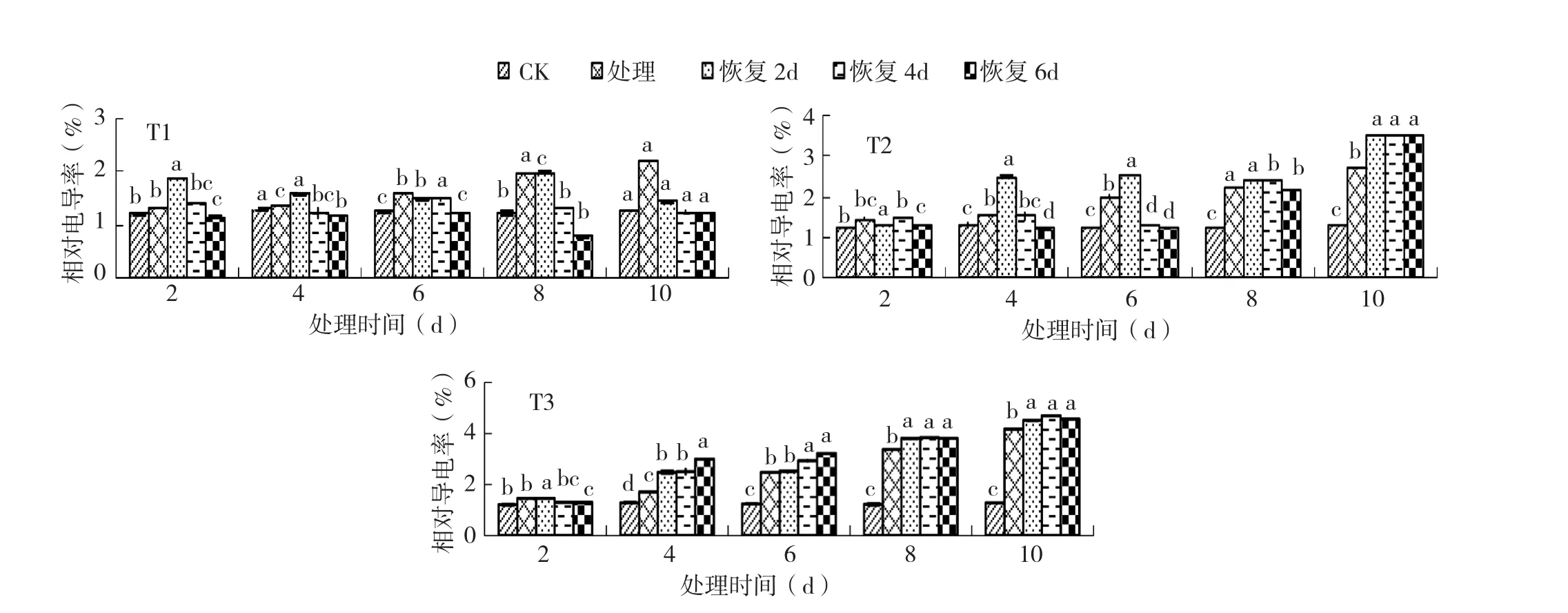
图5 3个低温处理后不同恢复时间对黄瓜幼苗相对电导率的影响
2.2.2 不同恢复时间对黄瓜幼苗MDA含量的影响 由图6可知,德尔100黄瓜幼苗在T1低温处理下的MDA含量随着恢复时间延长而下降。T1处理10 d,随着恢复天数的增加,恢复2、4、6 d各处理分别较CK增加了2%、-1%、-5%。T2处理10 d,随着恢复天数增加,恢复2、4、6 d各处理分别较CK增加了17%、14%、13%。在T1、T2处理2~8 d,恢复2 d就能恢复至CK水平,T2处理10 d时已无法恢复。T3处理10 d恢复2、4、6 d各处理分别较CK增加了22%、21%、27%。恢复性T3>T2>T1。
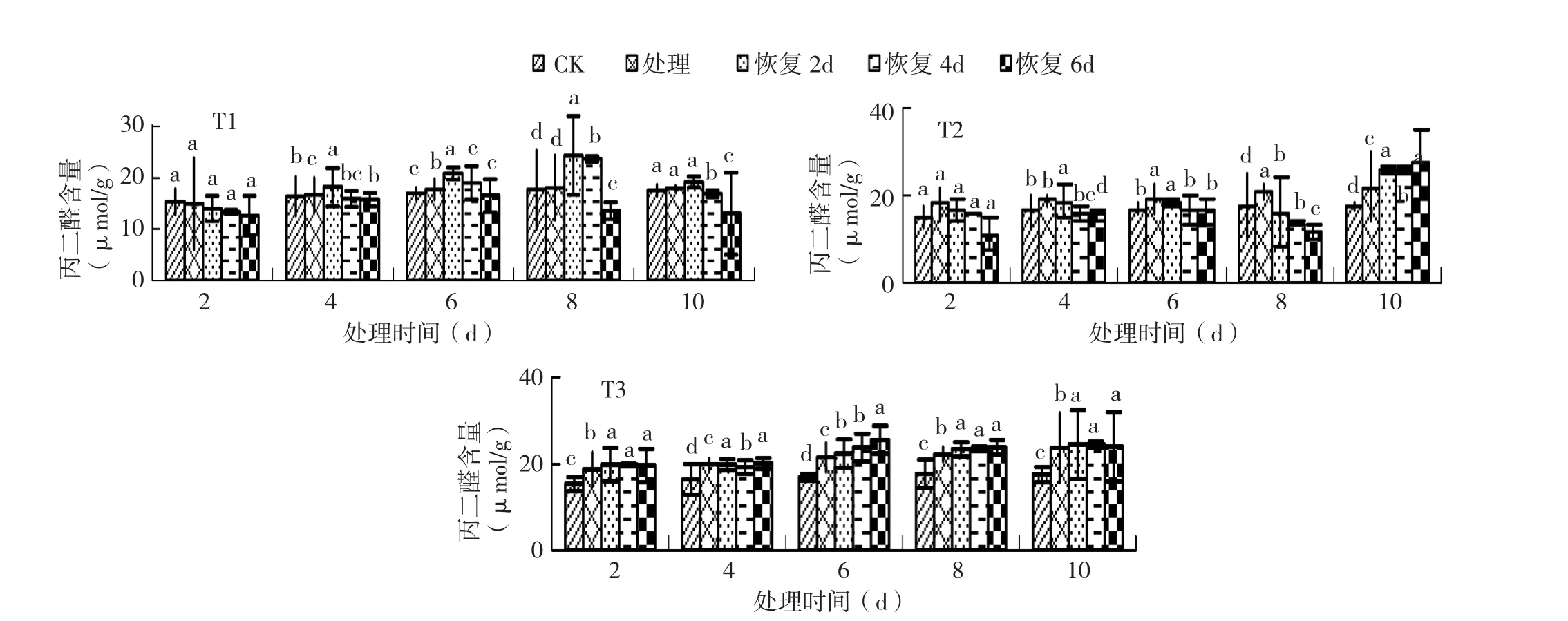
图6 3个低温处理后不同恢复时间对黄瓜幼苗丙二醛含量的影响
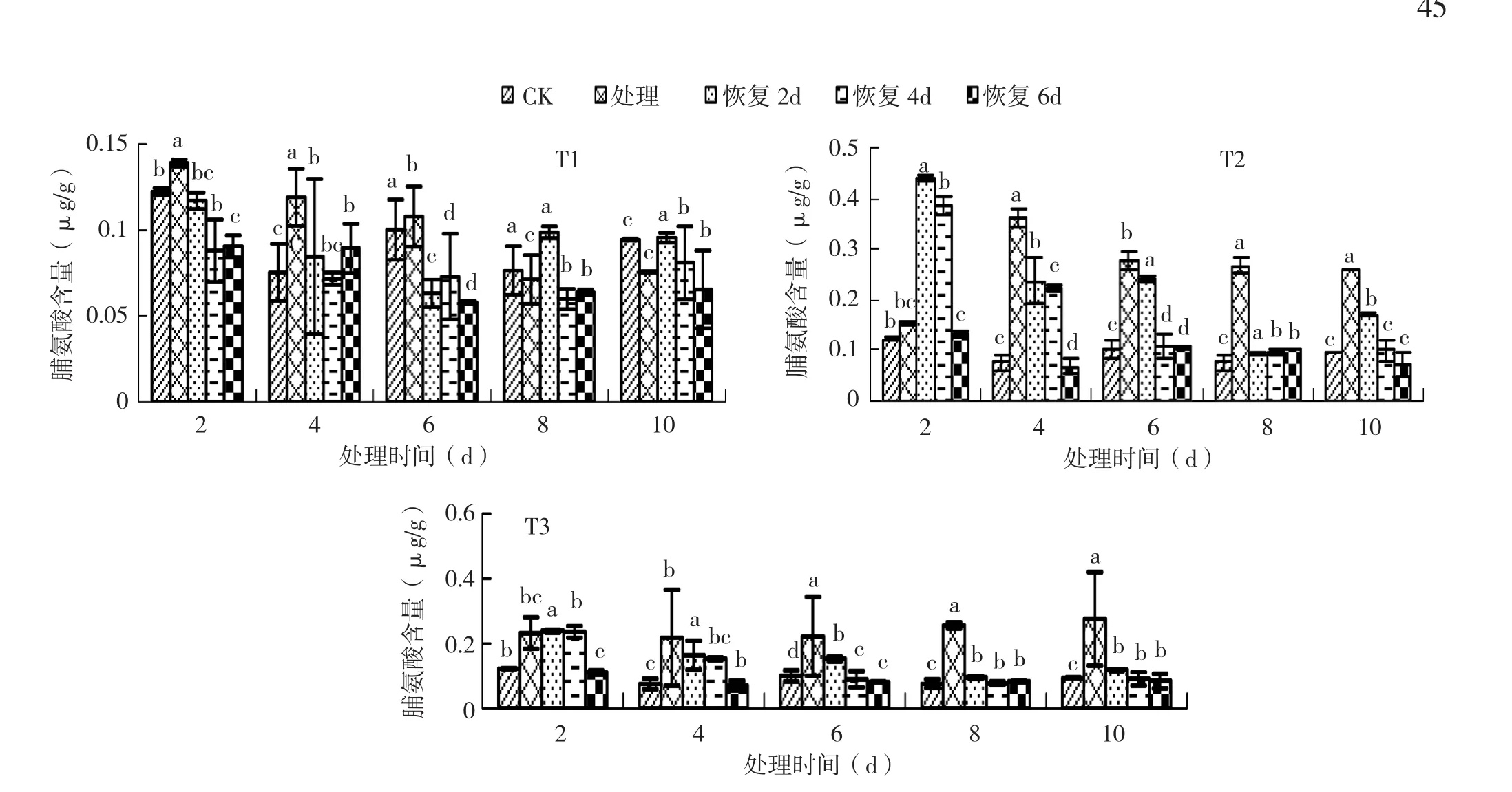
图7 3个低温处理后不同恢复时间对黄瓜幼苗Pro含量的影响
2.2.3 不同恢复时间对黄瓜幼苗Pro含量的影响 从图7可以看出,德尔100黄瓜幼苗在T1处理下的Pro含量随着恢复天数的增加而降低。T1处理6 d恢复6 dPro含量较CK减少25%,恢复幅度最大。T2处理下的Pro含量随着恢复天数的增加而降低,处理6 d恢复6 dPro含量较CK减少了17%,恢复幅度最大。T3处理4 d恢复6 d,Pro含量较T3处理减少56%,较CK较低12%,降幅最大。Pro是植物主动调节细胞渗透压的应激反应,Pro含量降低说明植物调节细胞渗透压的能力减弱。
2.2.4 不同恢复时间对黄瓜幼苗SOD活性的影响 从图8可以看出,德尔100黄瓜幼苗在T1处理下SOD活性随恢复时间的延长变化不显著,T1处理10 d恢复2、4、6 d,分别较CK降低1%、5%、9%,与CK无显著性差异。在T2处理SOD活性随恢复时间的延长变化不显著,低温处理10 d恢复2、4、6 d,分别较CK降低6%、10%、12%。T3处理SOD活性随恢复时间的延长变化不显著,该低温条件下处理10 d恢复2、4、6 d,较CK分别降低了7%、14%、21%。恢复性表现为T3>T2>T1。
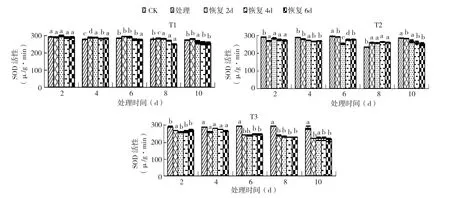
图8 3个低温处理不同恢复时间对黄瓜幼苗SOD活性的影响
3 结论与讨论
低温会使细胞膜内外的渗透性失去平衡,导致细胞液外渗,使细胞内的渗透压升高[17]。本试验结果表明,低温环境也会导致细胞膜受损,且处理温度越低细胞膜受损越严重,相对电导率越大。黄瓜幼苗在低温处理下,相对电导率随着处理时间的延长而增大,处理温度越低电导率增幅越大。在T3处理6 d后的恢复表现为直接下降,处理前4 d的恢复表现为先上升后下降。随着夜温的降低,此现象消失,但在处理10 d后都可以恢复。这与孙佳佳研究结果相似[18]。
MDA是细胞膜脂过氧化的产物,其含量高低反映了植物细胞膜脂过氧化的程度[19]。本试验中,黄瓜幼苗中MDA含量的变化量大小依次为T3>T2>T1,说明随着低温的下降黄瓜幼苗MDA含量呈增加趋势,MDA含量与处理时间呈正相关,这与李淑艳[20]的研究结果相似。在适温恢复生长后,则表现为温度越低的处理恢复性越不明显。
在正常的环境条件下,植物体内游离氨基酸的含量很低,由于低温对细胞膜的伤害,导致细胞内渗透压失衡,细胞会自我恢复,产生Pro缓解渗透压失衡[20]。本试验结果表明,低温环境也可使黄瓜幼苗中的Pro含量升高,并且随着温度的下降和处理时间的延长,Pro含量持续增高,说明低温环境在黄瓜幼苗生长发育过程造成了伤害。Pro含量随着低温胁迫程度的加强而增加,23℃/6℃(T3)处理的Pro含量显著高于23℃/9℃(T2)和23℃/12℃(T1)的处理,说明23℃/6℃处理对黄瓜幼苗的伤害最大,与田丹青等[21]、罗丹等[22]的研究结果相似。恢复性方面则表现相反趋势,证明低温处理程度越严重在恢复处理时Pro含量降幅越大。
SOD是植物细胞内清除活性氧的重要保护酶[23],其主要作用是在植物遇到逆境时消除超氧自由基,同时产生歧化物H2O2,减少超氧自由基对膜的伤害[24]。但酶活性也需要在适合的环境条件下才能保持正常的酶活性,如温度太低会影响其活性。本试验中,除T1处理外其余的低温处理的黄瓜幼苗SOD活性总体呈下降趋势,且夜温越低降幅越明显,说明本实验T2、T3处理保护酶系统已经失效。在23℃/6℃(T3)处理后,SOD活性下降,但在恢复处理2 d后仍然表现为下降,可能是由于低温对植株造成的伤害没有激活植株建恢复系统,所以酶活性表现为下降趋势。
通过本试验得出,在温室栽培黄瓜德尔99时,应注意夜间最低温度的控制,在23℃/12℃(T1)条件下可耐受10 d,在23℃/9℃(T2)条件下可耐受8 d,在23℃/6℃(T3)条件下可耐受 2 d。本试验中温度梯度设置较少,后续研究应更加细化温度梯度,以为指导黄瓜种植提供理论基础。
[1] 孙权,赵晖,张光弟,等. 宁夏南部山区设施园艺发展现状、问题与对策[J]. 农业科学研究,2011(2):77-81.
[2] 翟惠敏,马金平. 宁夏设施园艺发展现状及建议[J]. 现代农业科技,2010(10):233-234.
[3] 余朝阁,孙周平,须晖,等. 当前我国设施园艺发展中存在的问题及可持续发展途径[J]. 长江蔬菜,2012(24):107-108.
[4] Saltveotm E J,Morris L L. Overview on chilling injury of horticultural crops[A]. WangCY. Chilling injury of horticultural crops[C]. Florida:CRC Press,1990,3-15.
[5] 惠竹梅,王智真,胡勇,等. 24-表油菜素内酯对低温胁迫下葡萄幼苗抗氧化系统及渗透调节物质的影响[J]. 中国农业科学,2013(5):1005-1013.
[6] 邵怡若,许建新,薛立,等. 低温胁迫时间对4种幼苗生理生化及光合特性的影响[J]. 生态学报,2013(14):4237-4247.
[7] 倪郁,宋超,王小清. 低温胁迫下拟南芥表皮蜡质的响应机制[J]. 中国农业科学,2014(2):252-261.
[8] 王兆. 低温胁迫对彩叶草的生理效应及抗寒性研究[D]. 福州:福建农林大学,2014.
[9] 叶静,胡海涛,王长春,等. 植物脂肪酸去饱和酶与抗冷性研究进展[J]. 广东农业科学,
2011(12):131-134.
[10] 黄希莲,罗充,宋丽莎. 低温胁迫对贵阳市9种绿篱植物抗寒性生理生化指标的影响[J]. 广东农业科学,2012(2):47-50,59.
[11] 武辉,戴海芳,张巨松,等. 棉花幼苗叶片光合特性对低温胁迫及恢复处理的响应[J]. 植物生态学报,2014(10):1124-1134.
[12] 熊宁,李琦,刘利,等. 稻谷电导率测定方法的研究[J]. 粮油食品科技,2013(4):68-71.
[13] 窦坦祥. 10个油茶品种的耐寒性评价[D]. 武汉:华中农业大学,2013.
[14] 张蜜. 脯氨酸代谢在甘菊和切花菊抵御非生物胁迫中的作用机制[D]. 北京:北京林业大学,2014.
[15] 苏贝贝,刘佳,李琳琳,等. 外源脯氨酸对高温胁迫下半夏抗氧化酶活性及光合特性的影响[J]. 西南大学学报(自然科学版),2015(12):34-39.
[16] Lyons J M. Chilling injury in Plants[J]. Ann Rev Plant Physio,1973,20:423-451.
[17] 孙佳佳. 三张不同耐寒番茄品系的生理特性研究[J]. 安徽农业科学,2010(23):152-317.
[18] 王善广,张华云. 生物膜与果树抗寒性[J]. 天津农业科学,2006(6):37-40.
[19] 吴峻岩. 甘蓝叶片对低温的生理生化响应及分子生理学初探[D]. 重庆:西南农业大学,2004.
[20] 李淑艳. 低温对黄瓜保护酶体系及相关生理指标的影响[D]. 哈尔滨:东北农业大学,2002.
[21] 田丹青,葛亚英,潘刚敏,等. 低温胁迫对3个红掌品种叶片形态和生理特性的影响[J]. 园艺学报,2011(6):1173-1179.
[22] 罗丹,张喜春,田硕. 低温胁迫对番茄幼苗脯氨酸积累及其代谢关键酶活性的影响[J]. 中国农学通报,2013(16):90-95.
[23] Bowler C,Van Montahum,Inze D. Superoxide dismutase and stresstolerance[J]. Ann Rev Plant Physio,1990,41:187-223.
[24] 陈禹兴,付连双,王晓楠,等. 低温胁迫对冬小麦恢复生长后植株细胞膜透性和丙二醛含量的影响[J]. 东北农业大学学报,2010(10):10-16.
(责任编辑 白雪娜)
Experiment in low temperature adaptability of Del 100 cucumber variety
FANG Yuan1,ZHANG Ya-hong1,YE Hua1,WANG Li-hui2,BAI Xiang3
(1.Agricultural College,Ningxia University,Yinchuan 750021,China;2.Ningxia Autonomous Aquatic Product Technology Promotion Station,Yinchuan 750021,China;3. Ningxia Forestry Research Institute,Yinchuan 750021,China)
Using cucumber cultivated varieties Del 100 commonly as test material,which commonly used in Ningxia solar greenhouse cultivation;through the intelligent artificial climate chamber simulation facility in the production of three low-temperature environment,to measure the changes of four physiological and biochemical indexes--MDA,proline,electrical conductivity and superoxide dismutase under chilling injury situation. The results showed that:cucumber seedlings were less affected at 23 ℃ /12 ℃ environment,followed by 23 ℃ /9 ℃environment,and cucumber seedlings were seriously damaged under 23 ℃ /6 ℃ environment. Cucumber seedlings could tolerate for 6 days at 23 ℃ /12 ℃ environment,at 23℃ /9 ℃ environment they can withstand 4 days,and 2 days at 23 ℃ /6 ℃. Cucumber seedlings have different recovery time under 23 ℃ /17 ℃ (CK) after being treated by low temperature stress,the recovery of 6D was not obvious after being treated by 23℃ /12 ℃. 4D recovery process was not obvious at 23℃ /9 ℃. The recovery of 2D was not obvious after being treated by 23 ℃ /6 ℃. The recovery of plants depends on the early impact of the degree of low temperature stress and stress time.
cucumber;low temperature;adaptability;recovery
S626
A
1004-874X(2016)10-0041-07
2016-03-14
国家科技支撑计划项目(2014BAD05B02)
方媛(1990-),女,在读硕士生,E-mail:841359185@qq.com
张亚红(1965-),女,博士,教授,E-mail:zhyhcau@sina.com
方媛,张业红,叶华,等. 低温处理对德尔100黄瓜品种生理生化指标的影响 [J].广东农业科学,2016,43(10):41-47.
