一种枯草芽孢杆菌-刺五加多糖合生元的制备
2016-12-01龚建刚邵丽玮冯志华赵国先郝艳霜张一为
龚建刚,邵丽玮,冯志华,赵国先*,郝艳霜,张一为
(1.河北农业大学食品学院,河北保定071000;2.河北省畜牧兽医研究所,河北保定071000;3.河北农业大学动物科技学院,河北保定071000;4.天津市饲草饲料工作站,天津河西300210)
一种枯草芽孢杆菌-刺五加多糖合生元的制备
龚建刚1,邵丽玮2,冯志华3,赵国先3*,郝艳霜3,张一为4
(1.河北农业大学食品学院,河北保定071000;2.河北省畜牧兽医研究所,河北保定071000;3.河北农业大学动物科技学院,河北保定071000;4.天津市饲草饲料工作站,天津河西300210)
为优化枯草芽孢杆菌与刺五加多糖合生发酵的条件,本试验采用4×2因子试验设计,筛选适宜的温度(30、34、37、40℃)和转速(120 r/min和170 r/min);采用单因素试验设计筛选接种量(1%、2%、4%、6%、8%)、装液量(50、100 mL)和初始pH值(5.5、6、6.5、7、7.5、8、8.5);根据菌液的活菌数和芽胞产率确定刺五加多糖的添加量(0、0.4、0.8、1.6、2.4、3.6、4.8、6.4、8、10 mg/mL)及合生元的培养时间(24、36、48 h)。结果表明,种子液的培养时间为24 h,温度为37℃、转速为170 r/min,接种量为4%,250 mL锥形瓶中装液量为50 mL,培养基初始pH值为7.0,刺五加多糖的添加量为1.6 mg/mL,合生元培养时间为36 h,把培养好的菌液按1 L菌液∶0.5 kg麸皮的比例用干燥细麸皮吸附,在45℃烘箱中烘干即得枯草芽孢杆菌-刺五加多糖合生元。经检测,其活菌数为5×109cfu/g左右。
枯草芽孢杆菌;刺五加多糖;合生元;制备
合生元又称合生素或共生元,是“益生菌和益生元的混合制剂”(宋青龙,2007)。枯草芽孢杆菌合生元是枯草芽孢杆菌和与其具有协同作用的益生元的组合。枯草芽孢杆菌与益生元相辅相成,共同发挥作用,为胃肠道建立了一个良好的微生态环境,促进有益菌生长增殖,抑制有害菌生长,提高机体免疫力,增强保健功能,发挥预防治疗疾病的效果(潘宝海和孙东岩,2012;边连全等,2012)。枯草芽孢杆菌合生元既可发挥枯草芽孢杆菌的细菌生理活性,又可选择性增加这种菌的数量使益生作用更持久,并且具有高效性与无残留性等优点,现已被广泛应用于动物生产中。
本试验旨在研究刺五加多糖-枯草芽孢杆菌体外合生发酵的条件进而制备微生物饲料添加剂,为合生元饲料添加剂的开发提供基础。
1 材料和方法
1.1 试验时间和地点合生元的制备,于2013—2014年在河北农业大学动物科技学院和生命科学学院进行制备。
1.2 材料与设备枯草芽孢杆菌(ACCC11025,中国农业微生物菌种保藏管理中心);刺五加多糖(陕西慈缘生物有限公司,纯度50%);LB培养基(北京双旋微生物培养基制品厂;称取胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,加入1000 mL蒸馏水中加热溶解,调pH到7.0±0.1,分装,115℃高压灭菌20 min,备用)。
新型恒温振荡器(ZHWY-2112B,上海智城分析仪器有限公司);722型紫外可见分光光度计(上海光谱仪器有限公司制造);净化工作台(SWCJ系列,苏州安泰有限公司);电热恒温培养箱(DH6000AB型,天津市泰斯特仪器有限公司);250 mL锥形瓶。
1.3 试验方法
1.3.1 枯草芽孢杆菌生长曲线及种子液培养时间的确定用接种环将保存在试管斜面上的枯草芽孢杆菌挑取1环接种到含有50 mL LB培养基的250 mL锥形瓶中,在37℃、120 r/min的恒温振荡器中培养24 h,每隔2 h或者1 h取样1次,在600 nm分光光度计下测定其菌悬液的吸光度OD值,同时取无菌的LB培养液作对照,每组3个重复。以时间(h)为横坐标,OD值为纵坐标绘制生长曲线,确定种子液的培养时间。
1.3.2 培养温度、转速的确定采用4×2因子试验设计,将活化后的枯草芽孢杆菌种子液以容量比1%的接种量接种于50 mL LB培养基中,置于不同温度(30、34、37、40℃)和不同转速(120 r/min、170 r/min)的恒温振荡器中培养。于2、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、22、24 h各取样1次,测菌悬液的OD值,每组3个重复。以时间(h)为横坐标,OD值为纵坐标绘制生长曲线,筛选适宜的温度和转速。
1.3.3 接种量、装液量、初始pH值的确定采用单因素法筛选接种量、装液量和初始pH值,具体方法如下:
在无菌操作台中,分别按1%、2%、4%、6%和8%的接种量将活化后的枯草芽孢杆菌液接种于装50 mL LB培养基的250 mL锥形瓶中,每个接种量3个重复,置筛选好的温度、转速的恒温摇床中培养24 h,600 nm下测菌液的OD值(用无菌培养基调零),根据OD值的大小,确定接种量。
在无菌操作台中,按1%接菌量将活化后的种子液接种于250 mL锥形瓶,分别装有50 mL和100 mL的LB培养基,两种装液量各3个重复,同上培养、测定,根据24 h的OD值大小,确定装液量。
将培养基在灭菌前用1 mol/L的NaOH或HCl调节pH值分别为5.5、6、6.5、7、7.5、8、8.5,各培养基按50 mL的装液量分装入3个250 mL的锥形瓶中,115℃灭菌20 min。在无菌操作台中,按1%接菌量接种种子液,同上培养后根据24 h的OD值大小,确定初始pH值。
1.3.4 刺五加多糖最适添加量和合生元最适培养时间的确定在基础LB培养基中加入不同比例的刺五加多糖,使其浓度分别为:0、0.4、0.8、1.6、2.4、3.6、4.8、6.4、8、10 mg/mL。将每个浓度的培养基分装入250 mL锥形瓶中,115℃灭菌20 min后,备用。按上述筛选的培养条件接种后放进恒温振荡器中培养48 h,分别在24、36、48 h采样,用平板计数法测菌液的活菌数,显微镜下观察芽孢产率,每组数据设3个重复,根据菌液的活菌数和芽孢产率确定刺五加多糖的最适添加量及合生元最适培养时间。
1.3.5 刺五加多糖-枯草芽孢杆菌合生元产品的制备及活菌数的测定根据上述筛选的培养条件进行刺五加多糖-枯草芽孢杆菌发酵合生元的扩大培养。然后,将菌液用适量的麸皮吸附,45℃干燥成产品,用平板计数法测定产品的活菌数。
1.4 统计分析试验数据用Excel进行整理,作图;用SPSS 17.0进行数据分析,差异显著者进行Duncan’s多重比较。表中数值表示为“平均值±标准差”,P<0.05为差异显著。
2 结果与分析
2.1 枯草芽孢杆菌24 h的生长曲线及种子液培养时间的确定从图1可以看出,枯草芽孢杆菌生长到24 h时菌液OD值与前几个小时相比变化很小,即枯草芽孢杆菌处于生长的稳定期,此时菌液活菌数高,菌液浓度大,因此,24 h可以作为枯草芽孢杆菌种子液的培养时间。
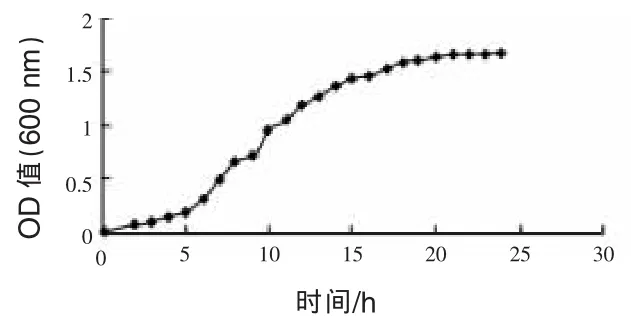
图1 枯草芽孢杆菌24 h的生长曲线
2.2 枯草芽孢杆菌培养温度、转速的筛选结果通过枯草芽孢杆菌在不同温度、转速条件下的24 h生长曲线(图2)可以看出,该菌在37℃、170 r/min条件下生长良好,优于在其他温度、转速组合下的生长情况,因此培养枯草芽孢杆菌的最佳温度、转速组合为37℃、170 r/min。
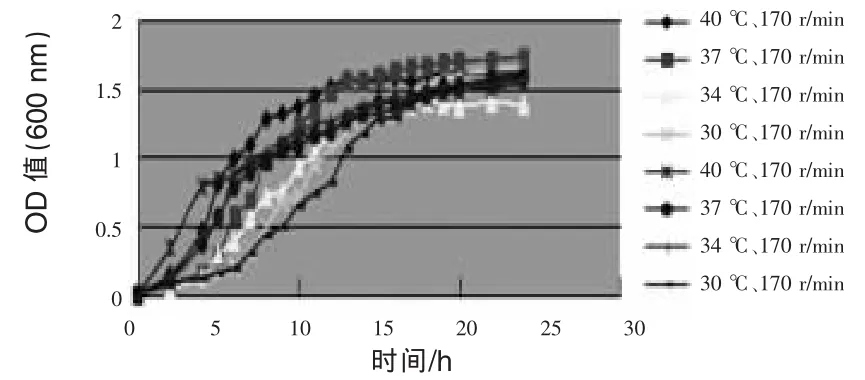
图2 枯草芽孢杆菌在不同温度、转速下的24 h生长曲线
2.3 接种量、装液量、初始pH值的确定由表1可知,随着接种量的提高,24 h菌液的OD值逐渐增大,接种量为4%的OD值显著高于2%(P<0.01),但与6%的OD值差异不显著(P<0.05),再从节省接种量方面考虑,确定4%为适宜的接种量。

表1 枯草芽孢杆菌在不同接种量下生长24 h的OD值
由表2可知,装液量为50mL时菌液的OD值明显高于100 mL时菌液的OD值,因此确定适宜的装液量为50 mL。

表2 枯草芽孢杆菌在不同装液量中生长24 h的OD值
由表3可知,枯草芽孢杆菌在培养基初始pH值为5.5~8.5时,随着pH值的增大24 h菌液的OD值逐渐增大,pH值在7.0以后随着pH值的增大,菌液的OD值反而降低。pH值为7.0时OD值极显著高于pH值为6.5时的OD值(P<0.01),与pH值为7.5的差异不显著(P<0.05),同时考虑节省酸碱用量,因此确定适宜的初始pH值为7.0。

表3 枯草芽孢杆菌在不同初始pH的培养基中生长24 h的OD值
2.4 刺五加多糖最适添加量和合生元最适培养时间的确定按1.3.4的试验条件及步骤培养枯草芽孢杆菌,分别在24、36、48 h采样,平板计数法测活菌数,结果见表4。
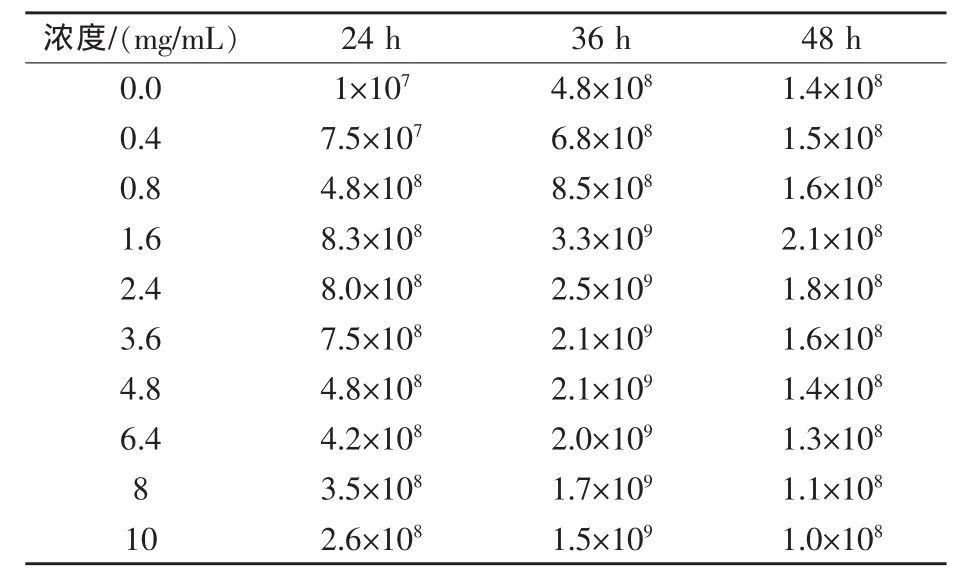
表4 枯草芽孢杆菌在不同刺五加多糖浓度和不同培养时间下的活菌数cfu/mL
由表4可知,低浓度刺五加多糖促进枯草芽孢杆菌生长,高浓度抑制其生长,刺五加多糖浓度为1.6 mg/mL时,生长36 h菌液中枯草芽孢杆菌的活菌数最高,为3.3×109cfu/mL。
由显微镜下结果可知,枯草芽孢杆菌在0 mg/mL的刺五加多糖培养基中培养36 h时几乎无芽孢,在1.6 mg/mL刺五加多糖培养基中培养36 h时芽孢率在90%以上。
2.5 枯草芽孢杆菌合生元产品的制备及其活菌数的检测把培养好的菌液按1 L菌液∶0.5 kg麸皮的比例用干燥细麸皮吸附,在45℃烘箱中烘干即得枯草芽孢杆菌-刺五加多糖合生元。利用平板计数法对枯草芽孢杆菌-刺五加多糖合生元活菌数进行检测,结果为5×109cfu/g左右。
3 讨论
3.1 本试验筛选益生菌和益生元的依据合生发酵技术即通过添加特定的一种或者多种益生元为底物对益生菌进行发酵,从而显著增强菌株活力,缩短菌株生长周期,提高菌体增殖速度;其中部分益生元被益生菌利用后转化为寡糖等物质,通过各自的代谢活动而有利于对方,从而更大化发挥合生元的潜力(潘宝海和孙东岩,2012)。合生元效果,首先取决于是否选了一个好菌种,再次取决于是否选对了与益生菌具有协同作用的益生元。为了确保本试验研制的合生元产品的质量效果,遵循菌种选择原则,选择了具有良好的益生功能,能在低pH和胆汁中存活并能植入肠黏膜,安全性好,耐高温、高压,易加工、贮存等优良特性(翟玲,2009;刘文波,2000),且具有调节肠道菌群平衡、增强动物免疫力、提高生产性能等诸多功能的枯草芽孢杆菌作为合生元的益生菌菌种。本课题组经过前期摸索,寻找到了一种与枯草芽孢杆菌具有协同作用的中草药提取物——刺五加多糖,最后通过合生发酵技术研制出枯草芽孢杆菌-刺五加多糖合生元。
3.2 本试验筛选发酵条件的依据合生元具有同时发挥益生菌与益生元的双重作用的功能特点,一方面通过直接增加肠道有益菌数量来改善宿主肠道微生态平衡,达到宿主机体保健或疾病预防的目的;另一方面通过益生元促进有益菌增殖、增强动物对肠内有害微生物的抑制作用及非特异性免疫功能来强化肠道固有有益菌的作用效果(王振国,2009)。本试验为了提高枯草芽孢杆菌数量及活性,对实验室条件下制约枯草芽孢杆菌生长的主要培养条件进行了筛选,通过绘制枯草芽孢杆菌24 h的生长曲线并比较24 h时菌液的OD值,确定了枯草芽孢杆菌适宜的培养温度为37℃,摇床转速为170 r/min,接种量为4%,250 mL锥形瓶的装液量为50 mL,培养基的初始pH值为7.0。筛选以上条件的依据如下:
首先,菌液的活菌数与菌液的OD值成一定的正相关关系。文宇婷(2012)研究表明,黄芪多糖-枯草芽孢杆菌合生元菌液中的活菌数与其OD值(425 nm)呈良好的线性相关,标准曲线为y=465.321x-81.61,R2=0.948,用600 nm波长与425 nm波长测出的不同浓度的菌液OD值变化趋势相同,但在600 nm波长下可以测更大浓度的菌液,因此我们通过比较600 nm下菌液的OD值来筛选枯草芽孢杆菌培养条件。
其次,温度可以通过改变酶反应速率来影响菌体的生长,温度过低抑制酶促反应速率及菌体代谢水平,温度过高又会引起酶类失活,菌体迅速衰老,导致活菌数大幅度降低;摇床转速不同对枯草芽孢杆菌的活菌数也有影响,转速可能与菌液与氧接触频率有关。摇床本身可以控制温度、转速两个影响因素,因此本试验设置30、34、37、40℃4个不同温度值,120、170 r/min 2个不同转速值,进行不同组合试验,最后发现在37℃和170 r/min的组合下,枯草芽孢杆菌生长最好。
再次,接种量、装液量和培养基初始pH值对枯草芽孢杆菌的生长都有一定的影响(张丽霞,2006)。接种量的多少与菌株生长周期的长短有关。接种量过低,延滞期变长,造成培养周期延长,耗费大量时间;接种量过高,细菌对营养成分的竞争力过大,造成菌体因营养供应不足而提前死亡,同样会抑制活菌数的增长,本试验从菌液活菌数和节约种子液综合考虑,选择4%的接种量。装液量的大小会影响摇瓶内溶氧量的变化,本试验在250 mL的锥形瓶中分别装50 mL和100 mL的培养基进行比较,发现装50 mL培养基的菌液浓度高,可能装100 mL培养基的锥形瓶中的溶氧量相比装50 mL培养基不能满足枯草芽孢杆菌生长的需要。pH值通过影响菌体细胞膜电荷、膜渗透性以及营养物质离子化的程度,而影响菌体对养分的吸收(张丽霞,2006)。由于摇瓶过程中的pH值难以控制,只能控制培养基的初始pH值。初始pH值的变化对于枯草芽孢杆菌生产发酵过程的影响非常显著(黄秀梨和夏立秋,2000)。本试验中枯草芽孢杆菌在培养基初始pH为5.5~8.5时,随着pH的增大菌液OD值先增大后降低,趋势与张媛媛等(2012)在复合益生菌芽孢杆菌发酵培养基及条件的优化试验中pH对复合益生菌芽孢杆菌生长影响一致。
最后,植物多糖对益生菌生长一般有低浓度促进、高浓度抑制的趋势,为了提高刺五加多糖对枯草芽孢杆菌的促生长作用及减少浪费,试验对刺五加多糖的添加量设置了10个不同浓度。结果表明,在0~10.0 mg/mL枯草芽孢杆菌活菌数随着刺五加多糖的浓度的提高先增加后降低,添加量为1.6 mg/mL时,枯草芽孢杆菌活菌数最高,这种活菌数随着植物多糖添加量变化的趋势与文宇婷(2012)和李树鹏(2007)的报道一致。但在确定刺五加多糖的适宜添加量及合生元培养时间的依据上考虑到在实际生产中菌体形式的枯草芽孢杆菌产品活菌数下降的很快,因此以枯草芽孢杆菌活菌数和芽胞产率作为筛选合生元最佳培养时间的条件。结果表明,36 h时活菌数最高,芽胞产率达到了90%以上。
根据研究的菌种生物学特性,有针对地采用加工技术生产合生元制剂,防止产品失活、变质并使生产成本最低化,是生产过程中应考虑的重要问题之一(刘洪明,2009)。鉴于枯草芽孢杆菌对营养条件要求不高、耐受低pH值、不容易失活的特性,本试验将发酵好的菌液以细麸皮作为载体进行吸附后在45℃烘干制成干燥的细粉状产品,并闻到类似乳酸菌发酵制品典型的味道,符合对益生菌制剂产品的性状检测方面的要求(张日俊,2010)。另外,我国正式批准生产的微生物制剂中,对芽孢杆菌含菌量的规定为:5×108cfu/g(张日俊,2007)。本试验枯草芽孢杆菌-刺五加多糖合生元的活菌数大约为5×109cfu/g,并且杂菌很少,完全达到了国家对微生物制剂含菌量的要求,可以说本产品加工工艺简单、科学,易于推广。
4 小结
在本试验条件下,研制出了一种枯草芽孢杆菌-刺五加多糖发酵合生元,其制备参数为:种子液的培养时间为24 h,温度为37℃、转速为170 r/min,接种量为4%,250 mL锥形瓶中装液量为50 mL,培养基初始pH值为7.0,刺五加多糖的添加量为1.6 mg/mL,合生元培养时间为36 h。枯草芽孢杆菌-刺五加多糖合生元产品活菌数为5×109cfu/g左右。
[1]边连全,杜欣,刘显军.枯草芽孢杆菌-菊糖合生元对断奶仔猪生长性能及体液免疫功能的影响[J].动物营养学报,2012,24(2):280~284.
[2]黄秀梨,夏立秋.微生物学实验指导[M].北京:高等教育出版社,2000.8.
[3]刘文波.微生态制剂及其在畜牧业中的应用前景[J].饲料研究,2000,9:14~16.
[4]李树鹏.黄芪多糖和2株益生菌体外抑菌作用研究[J].河南农业科学,2007,4:86~88.
[5]刘洪明.益生菌-黄芪多糖合生元的研制及其对腹泻犊牛肠道菌群结构影响的研究:[硕士学位论文][D].陕西杨凌:西北农林科技大学,2009,2.
[6]潘宝海,孙东岩.合生发酵枯草芽孢杆菌对断奶仔猪生产性能的影响[J].饲料研究,2012,9:45~46.
[7]宋青龙,潘宝海,孙冬岩,等.微生态调节剂在水产养殖中的应用研究进展[J].新饲料,2007,40:19~22.
[8]王振国.苦豆籽粕-双歧杆菌合生元的研究:[硕士学位论文][D].内蒙古呼和浩特:内蒙古农业大学,2009.
[9]文宇婷,边连全,杜欣,等.黄芪多糖枯草芽孢杆菌合生元菌液的研制[J].沈阳农业大学学报,2012,2,43(1):98~101.
[10]张丽霞.枯草芽孢杆菌B908发酵工艺优化研究:[硕士学位论文][D].内蒙古呼和浩特:内蒙古农业大学,2006.
[11]翟玲.枯草芽孢杆菌对肉鸡生产性能的影响及机理研究:[硕士学位论文][D].浙江杭州:浙江农业大学,2009.5.
[12]张媛媛,赵敏,张宁.复合益生菌芽孢杆菌发酵培养基及条件的优化[J].东北林业大学学报,2012,3,40(3):93~97.
[13]张日俊.微生物饲料添加剂的科学使用[J].饲料与畜牧,2007,6:5~8.
[14]张日俊.微生态制剂的质量鉴别与选择、检测指标和标准[J].饲料工业,2010,31(20):1~4.■ striped bass(M.chrysops female×M.saxatilis)[J].Aquacult.Nutr,1999,5:3~7.
[21]Li J,Liang X F,Tan Q S,et al.Effects of vitamin E on growth performance and antioxidant status in juvenile grass carp Ctenopharyngodon idellus [J].Aquaculture,2014,430:21~27.
[22]Lin Y H,Shiau S Y.Dietary vitamin E requirement for grouper,Epinephelus malabaricus,at two lipid levels,and their effects on immune responses[J].Aquaculture,2005,248,235~244.
[23]Mourente G,Diaz-Salvago E,Bell J G,et al.Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream(sparus aurata L.)fed dietary oxidized oil:attenuation by dietary vitamin E[J].Aquaculture,2002,214:343~361.
[24]Niki E.Role of vitamin E as a lipid-soluble peroxyl radical scavenger:in vitro and in vivo evidence[J].Free Radic Biol Med,2014;66:3~12.
[25]NRC(National Research Council).Nutrient requirements of fish and shrimp[M].Washington D C USA:National Academic Press,2011:189~198.
[26]Peng S,Chen L,Qin G J,et al.Effects of dietary vitamin E supplementation on growth performance,lipid peroxidation and tissue fatty acid composition of black sea bream(Acanthopagrus schlegeli)fed oxidized fish oil[J].Aquaculture Nutrition,2009,15:329~337.
[27]Sahoo D K,Roy A,Chainy G B N.Protective effects of vitamin E and curcumin on L-thyroxine induced rat testicular oxidative stress[J].Chemico-Biological interactions,2008,176:121~128
[28]Shiau S Y,Shiau L F.Reevaluation of the vitamin E requirements of juvenile tilapia,Oreochromis niloticus_O.aureus[J].Anim.Sci,2001,72,529~534.
[29]Takeuchi T,Watanabe K,Satoh S,et al.Requirement of grass carp fingerlings for α-tocopherol[J].Nippon Suisan Gakkaishi,1992,58:1743~1749.
[30]Wise D J,Tomasso J R,Gatlin D M,et al.Effects of dietary selenium and vitamin E on red blood cell peroxidation,glutathione peroxidase activity,and macrophage superoxide anion production in channel catfish[J].J Aquat Anim Health,1993,5(3):177~182.
[31]Zhou Q C,Wang L G,Wang H L,et al.Dietary vitamin E could improve growth performance,lipid peroxidation and non-specific immune responses for juvenile cobia(Rachycentron canadum)[J].Aquaculture Nutrition,2013,19(3):421–429.
[32]Zhu Y,Chen Y J,Liu Y J,et al.Effect of dietary selenium level on growth performance,body composition and hepatic glutathione peroxidase activities of largemouth bass Micropterus salmoide[J].Aquaculture Research,2012,43(11):1660~1668.
This experiment aimed to study the preparation of a kind of Bacillus subtilis-Acanthopanax polysaccharide synbiotics and optimize its preparation technology.A 4×2 factorial experiment design was used to selecte the appropriate temperature(30,34,37,40℃)and speed(120 r/min and 170 r/min);Inoculation amount(1%,2%,4%,6%,8%),fluid volume(50,100 mL)and the initial pH value(5.5,6,6.5,7,7.5,8,8.5)was optimized by single factor experiment.According tomicrobialnumberoflivingbacteriumandsporeproductionrate,theacanthopanaxpolysaccharidecontent(0,0.4,0.8,1.6,2.4,3.6,4.8,6.4,8,10 mg/mL)and synbiotics incubation time(24,48,36 h)was determined.The results showed that the incubation time of seeds of liquid was 24 h,suitable temperature and speed was 37℃and 170 r/min,inoculation amount was 4%,250 mL conical flask containing fluid amounted to 50 mL,medium initial pH value was 7.0.A-canthopanax polysaccharide content was 1.6 mg/mL,synbiotics incubation time was 36 h.After incubation,bacterial liquid was adsorpted with the fine bran according to the proportion(1 L bacteria liquid∶0.5 kg bran)bran and baked in the oven at 45℃,plate count method was used to test the product on the number of living bacterium.The number of living bacterium of Bacillus subtilis-Acanthopanax polysaccharide synbiotics product was about 5×109cfu/g.
Bacillus subtilis;Acanthopanax polysaccharide;synbiotics;preparation
10.15906/j.cnki.cn11-2975/s.20161707
S816.3
A
1004-3314(2016)17-0023-04
河北省蛋鸡体系(1004022)
*通讯作者
