金针菇耐高温新菌株的诱变选育*
2016-11-30罗润郭丽琼林俊芳韩飞李琼洁康林芝
罗润,郭丽琼**,林俊芳,韩飞,李琼洁,康林芝
(1.华南农业大学食品学院华南农业大学食品生物技术研究所,广东广州510640; 2.广东省微生态制剂工程技术研究中心,广东广州510640;3.广东汕头质量与计量监督检测研究所,广东汕头515000)
金针菇耐高温新菌株的诱变选育*
罗润1,2,郭丽琼1,2**,林俊芳1,2,韩飞3,李琼洁1,2,康林芝1
(1.华南农业大学食品学院华南农业大学食品生物技术研究所,广东广州510640; 2.广东省微生态制剂工程技术研究中心,广东广州510640;3.广东汕头质量与计量监督检测研究所,广东汕头515000)
以黄色金针菇(Flammulina velutipes)菌株FV7为材料,采用紫外线诱变、氯化锂诱变和甲基磺酸乙酯(EMS)诱变等多种诱变方法对金针菇的菌丝细胞进行诱变,诱变后的菌丝细胞经过菌丝体生长阶段33℃高温初筛和子实体发育阶段20℃中温复筛,并经过多轮筛选获得耐高温突变菌株FV7EMS。研究结果表明,采用甲基磺酸乙酯对金针菇菌丝细胞的诱变效果明显,突变菌株FV7EMS能在20℃温度出菇,且生长速度快、菌柄较长,生物学效率比亲本FV7提高了28.82%,与亲本间存在较大的遗传差异。金针菇耐高温新品种的培育,对于降低工厂化栽培能耗、多季节栽培金针菇有重要的科学研究价值。
金针菇;诱变育种;诱变剂;高温品种
金针菇(Flammulina velutipes)富含蛋白质、氨基酸、维生素以及矿物质,其中赖氨酸、精氨酸等人体必需氨基酸对促进儿童的生长发育有重要作用,在国外有“增智菇”的美誉[1],而金针菇菌体内多糖在抗炎、抗疲劳、耐缺氧及提高巨噬细胞吞噬功能方面作用显著[2]。目前广泛用于工厂化栽培的金针菇有黄色和白色两个品种,其中黄色金针菇比白色金针菇酚类物质等活性成份的含量更高[3]。
金针菇属低温结实性真菌,菌丝体在5℃~32℃范围内均能生长,最适温度为22℃~25℃,子实体生长期对温度要求较为严格,需在8℃~14℃的低温范围内才可正常生长[4-5]。已有研究表明,温度是金针菇子实体形成的关键因素之一,金针菇菌丝不经过低温刺激,在23℃条件下无法形成原基子实体[6]。因此,培育耐高温的金针菇新品种,对于降低工厂化反季节栽培的能耗、多季节栽培金针菇以及提高栽培的经济效益等方面有重要的研究和商业价值[7]。自然选育是获得优良菌株最基本的方法,但因其自发突变率低、耗时长等缺点,已经不能满足人们的需要。诱变育种能够在较短的时间内,通过改变遗传特性,快速获得理想菌株,弥补自然选育的不足,已经成为目前食用菌菌种培育的一个主要途径,常用的诱变方法根据诱变剂的不同可分为化学诱变、物理诱变和复合诱变[8-9]。本研究以黄色金针菇菌株FV7为实验材料,通过诱变剂诱变和不同的筛选方法相结合,培育出耐高温、生长快、具有更高生物学效率的金针菇新菌株。
1 材料与方法
1.1菌株和培养基
黄色金针菇(F.velutipes)菌株FV7,购自华中农业大学实验菌株中心。
棉籽壳培养料:棉籽壳78%、麸皮20%、蔗糖1%、碳酸钙1%,料水比为1∶1.6。
1.2试剂
0.01mol·L-1磷酸缓冲液:称取NaCl 7.9 g、KCl 0.2 g、KH2PO40.24 g和K2HPO41.8 g,溶于800 mL蒸馏水中,用HCl调节溶液的pH至7.0,最后加蒸馏水定容至1 L。
氯化锂(LiCl)诱变液:用0.01 mol·L-1磷酸缓冲液配制所需浓度(0.2%、0.4%、0.6%、0.8%、1%、1.5%、2%、2.5%),现配现用,过滤除菌。
甲基磺酸乙酯(EMS)诱变液:用0.01 mol·L-1磷酸缓冲液配置0.1 mol·L-1的甲基磺酸乙酯诱变液,现配现用,过滤除菌。
1.3FV7菌株对温度的敏感性检测
1.3.1菌株FV7菌丝体对温度的敏感性检测
菌株FV7经过PDA平板25℃活化培养后,接种于PDA平板上(直径90 mm),接种菌块大小一致(约2 mm3),接种后分别置于0、5℃、18℃、20℃、23℃、25℃、30℃和33℃下恒温培养,每个温度重复3次,8 d后测量菌落直径,计算菌丝生长速度,测定FV7菌丝的最高抑制温度值,以便确定突变株菌丝阶段筛选的温度。
1.3.2菌株FV7子实体形成对温度的敏感性检测
菌株FV7在PDA平板25℃培养7 d后,切取4 mm3~6 mm3的菌块接种于装有300 g棉籽壳培养基的17 cm×32 cm×0.005 cm聚丙烯塑料折角袋中,25℃培养至菌丝长满栽培袋后,分别置于16℃、18℃、20℃和22℃的恒温培养箱中培养,每个温度重复10袋,记录其生长趋势、原基数和生物学效率。通过出菇情况,统计得出菌株子实体形成的最高温度。
1.4诱变处理和突变株的筛选
1.4.1紫外线对金针菇菌丝的诱变试验
采用PDA平板培养金针菇菌丝,将金针菇菌丝体用内径为0.5 cm的无菌圆柱空心棒进行切割,转接于新的PDA平板上,每个板接约40个菌块。把转接好的平板置于15 W的紫外灯下30 cm处,用不同的时间(0、30 min、60 min、90 min、120 min、150 min、180 min、210 min、240 min、270 min、300 min、360 min、420 min、480 min、540 min)进行紫外线辐射处理,各处理重复3次。经紫外辐射处理后,用锡箔纸严密包裹平板,防止光线照射使菌丝复活,然后置于25℃培养箱黑暗培养,7 d后观察并计算菌丝致死率。在确定紫外线对金针菇菌丝细胞致死率的基础性上,选取致死率在80%左右的紫外辐射剂量对金针菇菌丝细胞进行诱变处理,每个板接种约40个菌块,平行重复5次。相对致死率(P)公式为:

式中:N1表示紫外处理后死亡菌块数;N2表示未处理死亡菌块数;N表示接种总数。
1.4.2氯化锂对金针菇菌丝的诱变试验
采用PDA平板预先培养金针菇菌丝体,将金针菇菌丝体用内径为0.5 cm的无菌圆柱空心棒进行切割,然后转接于不同浓度(0、0.2%、0.4%、0.6%、0.8%、1%、1.5%、2%、2.5%)的LiCl培养板中,各处理重复3次。每个LiCl培养皿中接种约40个菌块,25℃黑暗培养7 d后,观察计算菌丝致死率。在确定LiCl对金针菇菌丝细胞致死率的基础性上,选取致死率在80%左右的LiCl浓度对金针菇菌丝细胞进行诱变处理,每个板接种约40个菌块,平行重复5次。相对致死率(P1)公式为:

式中:N3表示氯化锂处理后死亡菌块数;N4表示未处理死亡菌块数;N表示接种总数。
1.4.3甲基磺酸乙酯(EMS)对金针菇菌丝的诱变试验
采用PDA平板25℃恒温活化培养金针菇菌丝体7 d,将金针菇菌丝体用内径为0.5 cm的无菌圆柱空心棒进行切割,放入0.1 mol·L-1EMS诱变液浸泡处理不同的时间(0、0.5 h、1 h、1.5 h、2 h、3 h、4 h和5 h),将处理后的菌丝分别转接于新的PDA平板中,每个平板中接种约40个菌块,25℃黑暗培养7 d后,观察计算菌丝致死率。选取致死率达80%的最短时间作为诱变处理时间,进行诱变处理,各处理重复3次。在确定EMS对金针菇菌丝细胞致死率的基础性上,选取致死率在80%左右的EMS处理时间对金针菇菌丝细胞进行进行诱变处理,每个板接种约40个菌块,平行重复5次。相对致死率(P)2公式为:
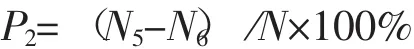
式中:N5表示EMS处理后死亡菌块数;N6表示未处理死亡菌块数;N表示接种总数。
1.4.4突变菌株菌丝阶段的筛选(初筛)
把经过诱变处理后存活的金针菇菌块转接于PDA平板上,先置于30℃暗培养24 h后再放置于33℃中继续暗培养15 d,挑选出能继续生长且具有正常菌落形态的突变株做进一步的子实体形成(出菇)筛选。
1.4.5突变菌株子实体形成阶段的筛选(复筛)
把菌丝阶段高温筛选得到的突变菌株,选择菌落形态正常、生长旺盛的菌株转接到PDA平板上培养7 d后,切取4 mm3~6 mm3的菌块接种于装有300 g培养料的栽培袋中,每个菌株接种15袋,同时接种原始菌株FV7为对照;接种后置于25℃培养至菌丝长满栽培袋后再置于20℃菇房培养,记录其出菇时间和原基数;出菇后80%~90%子实体菌柄长度在13 cm~15 cm成熟时,测量菌盖直径、菌盖厚度、菌柄长度、菌柄直径等性状,并测算菌株的生物学效率。各菌株试验数据均采用15袋的平均值,应用DSP数据处理系统对所测数据应用LSD法进行统计分析。生物学效率为子实体鲜重除以栽培料干重乘以100%(仅测算第1潮菇)。
1.5拮抗性测定和突变株的稳定性分析
突变株经过3次~5次传代培养活化后,从亲本和突变株PDA平板上,取大小相同的菌块接种于同一PDA培养板上,25℃培养8 d后,观察亲本FV7和突变株间的拮抗反应。为了验证突变株的性状稳定性,将经过3次传代培养后的亲本和突变株同时进行高温出菇实验,观察其出菇情况。
2 结果与分析
2.1温度筛选
金针菇原始菌株FV7在不同温度下的菌丝生长速度见图1。

图1 金针菇原始菌株FV7菌丝在不同温度下的生长速度Fig.1Growth rate of the original strain FV7 of F.velutipes at different temperatures
从图1可以看出,菌丝在18℃~30℃范围内,菌丝生长速度快,且呈不断上升的趋势,但30℃时生长速度达到顶峰后极速下降,在33℃时菌丝停止生长。所以,选择33℃作为诱变菌株菌丝阶段高温初筛的温度。菌株FV7在不同温度下子实体生长情况见表1。

表1 不同温度对金针菇菌株FV7子实体形成的影响Tab.1Effect of different temperatures on fruiting body formation of original strain FV7 of F.velutipes
从表1可知,在温度20℃条件下基本不形成原基,所以将20℃设定为子实体阶段中温复筛的温度。
2.2诱变处理致死曲线
不同诱变处理金针菇原始菌株FV7菌丝致死率曲线见图2。本研究选择致死率在80%左右的致死剂量作为诱变处理条件。

图2 诱变处理金针菇FV7菌丝的致死率曲线Fig.2Lethality curve of F.velutipes strain FV7 mycelia during mutagenesis
从图2A和图2C可知,随着紫外线辐射时间和1%EMS处理时间增加,菌丝致死率也相应提高,所以最终选择紫外辐射时间2 h(致死率96.25%),1% EMS处理2 h(致死率约为80%),作为最终的诱变处理时间。从图2B曲线图可以看出,随着LiCl浓度的增加,菌丝致死率相应提高,所以,选择1% LiCl(致死率87%)作为最终的诱变处理条件。
2.3突变菌株菌丝体培养阶段高温筛选结果
原始菌株FV7菌丝体经过多次紫外线辐射、LiCl诱变和EMS三种诱变处理之后,能在PDA培养基上继续生长的菌块为拟突变菌株。随机选择拟突变菌株各120株左右,先置于30℃暗培养24 h,后放置于33℃中继续暗培养15 d,能正常生长的菌丝即为耐高温的突变菌株。筛选结果表明,紫外线辐射和LiCl诱变的处理在33℃温度下均没有获得突变菌株,只有EMS诱变剂获得4个诱变个体,结果见图3(图未全附)。
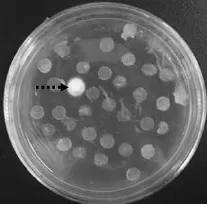
图3 EMS诱变的拟突变菌株在33℃下培养的平板图Fig.3Mutant strains cultured at 33℃temperature after the EMS mutagenesis
从图3可以看出,大部分诱变处理后的拟突变菌株在33℃高温下与对照一样不能生长(图1),只有约3%的拟突变株能够在33℃的温度下生长(图3箭头所示),说明这些突变菌株的基因组序列发生了改变,通过了高温的筛选。
2.4突变菌株子实体形成阶段中温筛选结果
为了获得能够在20℃形成子实体(出菇)的新菌株,将在菌丝阶段筛选得到的4株突变株和亲本一起在20℃恒温培养箱中培养,进行第2次筛选,试验结果表明,4株的突变菌株中只有FV7EMS能够形成正常的子实体,而且生物学效率最高(图4、表2)。
从图4可以看出,4株突变株在子实体形成阶段的原基数量均明显多于亲本,且突变株FV7EMS生长最为旺盛。从表2可以看出,突变株FV7EMS和原始菌株相比,具有生长势强、生育期短、原基数多、菌柄直立且较长等特点,生物学效率达35.38%,比亲本菌株的生物学效率提高5倍多,这表明突变菌株FV7EMS比亲本FV7具有更好的高温耐受性,能在20℃出菇,且具有更好的性状优势。
2.5突变菌株和亲本遗传变异分析
突变菌株FV7EMS和亲本FV7的拮抗性试验见图5。
从图5中可看出两者之间有很明显的拮抗线,
这说明突变菌株FV7EMS的基因组序列已经发生了变化,形成了新的菌株。因为当一个新菌株与亲本菌株在一起培养时,其菌丝体会产生自然屏障出现相互拮抗现象[10],即拮抗线。结果表明突变菌株FV7EMS和亲本FV7之间有较大的遗传差异。
2.6突变菌株FV7EMS的稳定性分析
突变菌株FV7EMS和亲本FV7在多次继代培养后,经过33℃菌丝培养作为菌种,接种棉籽壳培养基质上在20℃进行出菇培养实验,出菇情况见图6。

图4 亲本和4株突变菌株在20℃出菇情况Fig.4Fruiting experiment at 20℃of parent strain and 4 mutant strains

表2 突变菌株FV7EMS和亲本FV7出菇性状Tab.2Fruiting characters of mutant strain FV7EMS and parent strain FV7
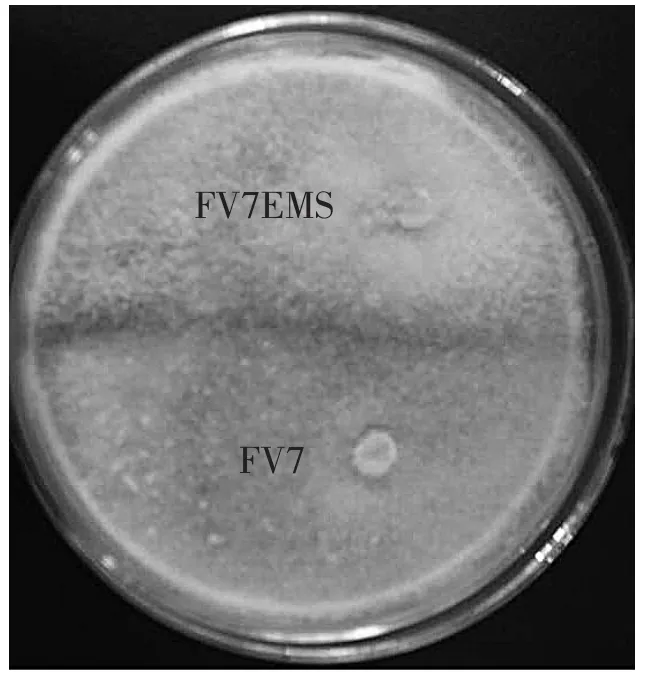
图5 突变菌株FV7EMS和亲本FV7菌株之间的拮抗性Fig.5Determination of antagonism between mutants strain FV7EMS and parent strain FV7

图6 突变株FV7EMS和FV7出菇情况Fig.6Fruiting experiment of mutant strain FV7EMS and FV7 descendant
从图6可以看出,突变菌株FV7EMS能正常出菇,子实体整齐,长势旺盛;而亲本FV7在20℃温度下虽然有少数原基形成,但基本上不能正常发育形成子实体,表明突变菌株能够稳定遗传。
3 讨论
金针菇的育种方法有自然育种、诱变育种、杂交育种和利用生物工程(细胞融合和基因重组)育种等。诱变育种是金针菇菌种选育的一个重要途径。金针菇紫外线诱变育种工作的研究已经取得了阶段性的进展[11],成亚利等[12]采用紫外照射诱变处理金针菇原生质体,获得生长快、长势好的优良菌株,张淑霞[13]利用紫外线照射诱变金针菇,获得耐碱性稳定、长势好、产量高的3个菌株。本研究采用了紫外线诱变、氯化锂诱变和EMS诱变三种诱变方法,但只有EMS诱变获得了耐高温出菇的新菌株FV7EMS,紫外线和氯化锂诱变处理在菌丝阶段获得了能够耐高温的突变菌株,但这些突变菌株均未能在20℃较高温条件下顺利形成原基,说明不同的诱变剂对金针菇基因组作用的突变位点不同。当突变位点不涉及子实体形成的基因位点时,可能就不会改变子实体的发育。本研究的结果表明,对于黄色金针菇而言,EMS诱变剂能够在控制金针菇子实体形成的基因位点上有效地发生突变,是一种较理想的诱变剂。同时,本研究所获得的突变菌株将为研究金针菇子实体形成机理提供优良的材料。本研究团队以白色金针菇品种FV1为出发菌株,采用紫外线、EMS诱变剂和紫外线、氯化锂、EMS三种诱变剂复合诱变均获得耐高温的金针菇目标突变菌株。其中复合诱变获得的菌株,其生物转化率最高[14]。研究表明了不同金针菇品种对诱变剂的敏感性不同,可能产生的突变位点也不同,对于不同诱变剂及诱变方法所产生的不同诱变效果的机理,有待进一步的研究。
在诱变育种工作中,除了诱变方法外,高效、准确的筛选方法同样是决定育种成败的关键。食用菌由于其生长分为营养生长阶段(菌丝生长)和子实体发育生长阶段的特殊性,决定了其育种筛选方法的特殊性,即一个性状良好的突变体菌丝可能不形成子实体或子实体性状不及亲本。因此,本团队经过大量的前期试验摸索,提出金针菇突变菌株的双阶段筛选方法,即菌丝阶段的33℃高温筛选和子实体阶段的20℃中温复筛,两步方法相结合。结果表明在菌丝阶段表现耐33℃高温的突变菌株,在子实体复筛阶段不能形成子实体或子实体产量与亲本相当,只有少数突变菌株能在复筛阶段表现出预期性状。本研究结果最终只成功获得一个突变株FV7EMS,突变成功率只有0.25%。突变株FV7EMS与亲本FV7相比,主要有原基数多、整齐度好、菌柄直立且较长、单丛菇朵数较多、生长势较强、株型较好、生育期短等特点,生物学效率达35.38%,比亲本FV7的生物学效率提高5倍多,两者的拮抗性试验表明突变体FV7EMS和亲本FV7之间有较大的遗传差异。
[1]袁仲.金针菇的保健功能与加工利用[J].农产品加工(学刊),2005(Z1):125-128.
[2]伍明,郑林用,许晓燕,等.金针菇活性物质及其作用研究进展[J].中国食用菌,2011(3):6-8.
[3]Zhang Z,Jin Q,Lv G,et al.Comparative study on antioxidant activity of four varieties of Flammulina velutipes with different colour[J].International Journal of Food Science&Technology, 2013,48(5):1057-1064.
[4]罗向东,蒋晓强,李玉林,等.金针菇生长发育条件及栽培技术[J].现代农业科技,2008(11):57.
[5]于荣利,秦旭升,宋凤菊.金针菇研究概况[J].食用菌学报,2004,11(4):63-68.
[6]Sakamoto Y,Tamai Y,Yajima T.Influence of light on the morphological changes that take place during the development of the Flammulina velutipes fruit body[J].Mycoscience,2004, 45(5):333-339.
[7]徐珍,尚晓冬,郭倩,等.早熟金针菇新品种G1的杂交选育[J].食用菌学报,2009,16(4):20-22.
[8]李荣杰.微生物诱变育种方法研究进展[J].河北农业科学,2009,13(10):73-76,78.
[9]马少丽,刘欣.常用诱变育种技术在我国真菌育种上的应用[J].青海畜牧兽医杂志,2014,44(1):42-44.
[10]周庆红,杨寅桂,范淑英,等.金针菇航天种菌丝诱变效应的研究[J].中国食用菌,2010,29(5):37-39.
[11]解生权,全艳玲,王菲.金针菇UV诱变育种研究[J].中国酿造,2011(3):143-144.
[12]成亚利,朱宝成,李亮亮,等.金针菇原生质体紫外诱变选育[J].食用菌学报,1995,2(3):61-64.
[13]张淑霞.金针菇诱变育种与生料栽培试验[J].食用菌,2003,25(3):14-15.
[14]Kang LZ,Han F,Lin JF,et al.Breeding of new high-temperature-tolerant strains of Flammulina velutipes[J].Scientia Horticulturae,2013,151(2):97-102.
A Novel High-temperature-tolerant Strain of Flammulina velutipes by Mutagenesis
LUO Run1,2,GUO Li-qiong1,2,LIN Jun-fang1,2,HAN Fei3,LI Qiong-jie1,2,KANG Lin-zhi1
(1.College of Food Science,Institute of Food Biotechnology,South China Agricultural University,Guangzhou 510640,China; 2.Microecologics Engineering Center of Guangdong Province,Guangzhou 510640,China; 3.Guangdong Shantou Supervision Testing Institute of Quality and Metrology,Shantou 515000,China)
The mycelial fragments of Flammulina velutipes(strain FV7,yellow)were treated with ultraviolet light(UV),ethylmethane sulfonate(EMS)and lithium chloride(LiCl).Then the mycelial cell treated with mutation was screened at 33°C during mycelial growth period and at 20°C during fruiting body development period,and heat resistant mutant strain FV7EMS was obtained.The results showed that EMS had significant mutagenic effects on hypha cells,the mutant strain was high-temperature resistant varieties with long stipe,and it grew fast,compared with original strain FV7,the biological efficiency was higher with 28.82%,which presented apparent genetic differences to the original strain.The breeding of F.velutipes with high-temperature resistance was of great importance in factory energy consumption and its multi-season cultivation.
Flammulina velutipes;mutation breeding;mutagen;high-temperature-resistant varieties
S646.1
A
1003-8310(2016)04-0018-06
10.13629/j.cnki.53-1054.2016.04.005
国家自然科学基金(31372116、31572178);广东省科技计划项目(2012A020100010、2013B010404041)。
罗润(1990-),女,在读硕士研究生,主要从事食品微生物研究。E-mail:670125876@qq.com
**通信作者:郭丽琼(1963-),女,博士,教授,主要从事食用菌天然产物研究。E-mail:guolq@scau.edu.cn
2016-05-20
