ER阳性乳腺癌中Efp和Plk3蛋白表达相关性探讨
2016-11-17段佳君邹天宁刘德权
段佳君,邹天宁,张 季,刘德权
云南省肿瘤医院/昆明医科大学第三附属医院乳腺外一科,云南 昆明 650118
ER阳性乳腺癌中Efp和Plk3蛋白表达相关性探讨
段佳君,邹天宁,张 季,刘德权
云南省肿瘤医院/昆明医科大学第三附属医院乳腺外一科,云南 昆明 650118
背景与目的:长期以来,雌激素受体(estrogen receptor,ER)阳性乳腺癌患者对内分泌治疗耐药是临床上棘手的难题。目前研究表明,雌激素效应环指蛋白(estrogen-responsive finger protein,Efp)和polo样激酶3(polo-like kinase 3,Plk3)的表达与乳腺癌发展具有密切关系。该研究旨在探讨ER阳性乳腺癌中Efp和Plk3蛋白表达相关性,了解Efp和Plk3表达变化在耐药中的作用。方法:应用免疫组织化学SP法检测74例ER阳性乳腺癌组织中Efp和Plk3蛋白表达情况,结合临床资料进行分析。并采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)及蛋白[质]印迹法(Western blot)检测ER阳性乳腺癌MCF-7细胞中Efp和Plk3的基因和蛋白表达变化。结果:74例ER阳性乳腺癌组织中Efp和Plk3蛋白表达与患者的临床病理特征未见任何关系(P>0.05),其中有51例(68.9%)患者Efp表达阳性和23例(31.1%)患者Plk3表达阳性,χ2检验分析结果显示,ER阳性乳腺癌组织中Efp和Plk3具有显著的负相关关系(χ2=8.837,P<0.05)。RTFQ-PCR检测结果显示,MCF-7细胞经雌激素刺激后Efp mRNA的表达显著增加,而Plk3 mRNA的表达无明显变化。Western blot检测结果显示,MCF-7细胞经雌激素和MG132刺激后,Efp的蛋白表达较MG132组显著增加,而Plk3蛋白表达明显下降。结论:在ER阳性乳腺癌患者中Efp和Plk3的蛋白表达呈负相关,Efp高表达可促进Plk3的蛋白降解,对内分泌耐药过程的形成可能产生一定影响。
乳腺癌;雌激素受体;雌激素效应环指蛋白;Polo样激酶3;耐药
近年来,随着对乳腺癌发病机制和治疗研究的不断深入,人们发现大部分对内分泌治疗耐药的乳腺癌患者中雌激素受体(estrogen receptor,ER)呈阳性,其生长具有雌激素依赖性[1-2]。雌激素效应环指蛋白(estrogenresponsive finger protein,Efp)基因作为ERα的靶基因,在依赖雌激素的乳腺癌细胞增殖和功能的调节中发挥重要作用,有研究证实,当雌激素与ER结合时可诱导Efp高表达,后者可通过泛素途径降解细胞内多种与乳腺癌增殖相关的蛋白,导致疾病进一步恶化,甚至使机体产生耐药[3-4]。Polo样激酶3(polo-like kinase 3,Plk3)是Plk家族成员之一,最新研究显示,其过表达能抑制ER阳性乳腺癌细胞的增殖[5]。基于此,本文拟探讨ER阳性乳腺癌中Efp和Plk3蛋白表达相关性,旨在了解Efp和Plk3表达的变化在ER阳性乳腺癌内分泌治疗耐药中的作用,为临床治疗乳腺癌提供新的思路。
1 材料和方法
1.1 临床资料
选取2010年3月—2010年9月于云南省肿瘤医院/昆明医科大学第三附属医院乳腺外一科行乳腺癌切除术并且ER阳性的乳腺癌患者74例,均为女性,中位年龄为51(33~71)岁。患者术前未行放疗、化疗和内分泌治疗,术中在乳腺癌组织离体后立即切取约0.2 g标本及癌旁正常组织,并迅速置于液氮中保存备用。上述组织标本均经过病理诊断为ER阳性乳腺癌。所有患者均签署了知情同意书,实验过程严格按照国家伦理学审查机构和协议进行。
1.2 主要试剂
RPMI-1640培养基购自美国HyClone公司,胎牛血清购自美国Gibco公司,PBS干粉购自美国Sigma公司,胰蛋白酶-EDTA购自武汉博士德生物工程有限公司,TransScript®Two-Step实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQPCR)SuperMix试剂盒购自北京全式金生物技术有限公司,免疫组化鼠抗人Efp单抗、鼠抗人Plk3单抗购自英国Abcam公司,蛋白酶体抑制剂MG-132、雌二醇E2购自美国Gene Operation公司,ER阳性MCF-7细胞株由云南省肿瘤医院病理科提供,鼠抗人Efp单抗、鼠抗人的Plk3单抗和兔抗人的β-actin单抗均美国SantaCruz公司,37 ℃恒温培养箱购自美国Thermo公司,倒置光学显微镜(奥林巴斯CKX-41)购自日本奥林巴斯株式会社。
1.3 免疫组织化学SP法
采用免疫组织化学SP法检测ER阳性乳腺癌组织中Efp和Plk3蛋白表达。方法如下:取患者的乳腺癌组织标本,经10%中性甲醛固定,常规石蜡包埋,制成厚4 μm的连续病理切片,抗原修复采用EDTA(pH=9.0)抗原修复液高压锅热修复。鼠抗人Efp单克隆抗体和鼠抗人Plk3单克隆抗体的工作浓度分别为1∶200和1∶200,置于4 ℃冰箱温育过夜。PBS冲洗2次,滴加二抗后室温温育30 min,DAB显色,苏木精复染,脱水、透明、封固。
1.4 阳性结果判断
Efp、Plk3阳性表达判定:以细胞质呈现棕黄色及棕褐色颗粒者为阳性细胞,测定时采用双盲法,由两名经验丰富的病理科医师在200倍光镜下随机选择5个视野进行半定量计数[6]。根据染色强度,无色积分为0分,浅黄色积分为1分,棕黄色积分为2分,棕褐色积分为3分;根据阳性细胞数<25%为阴性(-),25%~50%为低水平表达(+),50%~75%为中等水平表达(++),>75%为较高水平表达(+++)。本研究以(-)~(+)为阴性组,以(++)~(+++)为阳性组。
1.5 ER阳性MCF-7细胞培养
加入1640培养液(含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素)重悬ER阳性MCF-7细胞后,调整细胞密度为1×104个/mL,接种于25 cm2培养瓶中,置37 ℃、CO2体积分数为5%的恒温培养箱中培养。细胞用0.05%胰蛋白酶进行消化传代。
1.6 RTFQ-PCR实验
取细胞培养收集的ER阳性MCF-7细胞,将细胞密度调整为2×106个/mL,按每孔100 μL接种于96孔板中,分为溶剂对照组(无水乙醇)和E2组(E2浓度为1×10-7mol/L)。每组设4个复孔,置于37 ℃、CO2体积分数为5%的培养箱中培养48 h,收集细胞,参照试剂盒说明书分别提取各组细胞总RNA,并反转录为cDNA,以β-actin为内对照进行PCR扩增。目的基因和内参的引物设计是根据GenBank提供Efp、Plk3和β-actin的mRNA序列(表1)。

表 1 目的基因的引物设计Tab. 1 Primer designing of target gene
1.7 蛋白[质]印迹法(Western blot)实验
取收集的ER阳性MCF-7细胞,将细胞密度调整为2×106个/mL,按每孔100 μL接种于96孔板中,分为溶剂对照组(无水乙醇)、E2组(E2浓度为1×10-7mol/L)、MG-132组(MG-132浓度为5×10-6mol/L)和E2+MG-132组(E2浓度为1× 10-7mol/L,MG-132浓度为5×10-6mol/L)。每组设4个复孔,置于37℃、CO2体积分数为5%的培养箱中培养48 h,收集细胞用PBS洗涤2次,加入1×SDS上样缓冲液300 μL,冰上放置30 min,超声裂解细胞,4 ℃,12 000×g条件下离心10 min,收集上清液为细胞裂解液。用BCA法进行蛋白定量,10%SDA-PAGE垂直电泳分离,上样量为30 μg/孔,转移蛋白质到聚乙烯二氟膜上,5%脱脂奶粉4 ℃封闭过夜,1∶1 000倍稀释的鼠抗人Efp单抗、1∶1 000倍稀释的鼠抗人Plk3单抗和1∶4 000倍稀释的兔抗人β-actin单抗室温温育1 h,膜洗3次,加入1∶3 000倍稀释的辣根过氧化物酶标记的抗鼠或抗兔的二抗室温温育1 h,膜洗3次,用ECL发光系统进行显影,对条带进行定性分析,以β-actin作为内参照。
1.8 统计学处理
采用SPSS 13.0统计软件进行数据处理。计数资料采用χ2检验。Efp和Plk3的表达相关性研究采用χ2检验或连续校正的χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组织化学法检测ER阳性乳腺癌组织中Efp和Plk3的蛋白表达
免疫组织化学法检测结果显示,Efp和Plk3主要表达于浆细胞的细胞质中,细胞质染色多且呈棕黄色颗粒或团块状(图1、2)。
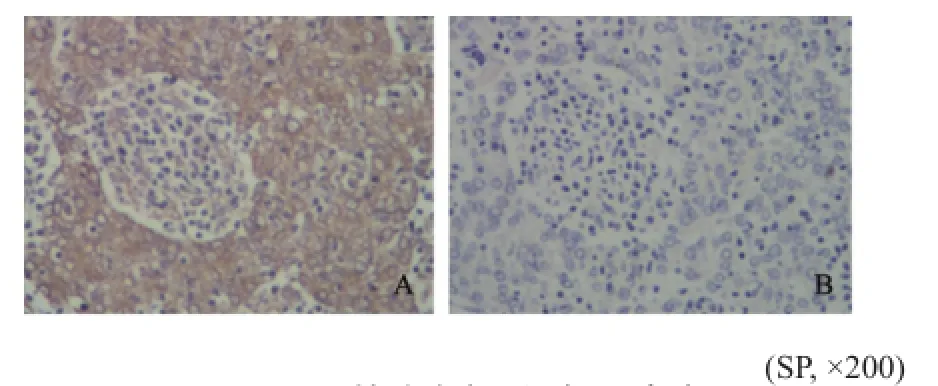
图 1 ER阳性乳腺癌组织中Efp表达Fig. 1 The expression of Efp in ER positive breast cancer
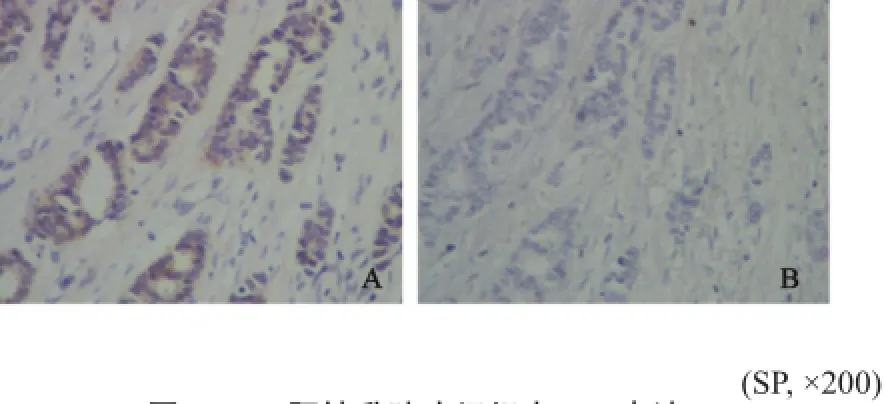
图 2 ER阳性乳腺癌组织中Plk3表达Fig. 2 The expression of Plk3 in ER positive breast cancer
2.2 ER阳性乳腺癌患者Efp和Plk3蛋白表达与患者临床的关系
74例ER阳性乳腺癌患者组织中,Efp和Plk3蛋白表达与临床病理特征无明显的相关性(P>0.05,表2)。
2.3 ER阳性乳腺癌组织中Efp和Plk3蛋白表达的相关性分析
在74例ER阳性乳腺癌患者中,有51例患者Efp表达阳性,阳性率为68.9%;有23例患者Plk3表达阳性,阳性率为31.1%。在51例Efp表达阳性患者中,有11例Plk3表达阳性,23例Efp表达阴性患者中有13例Plk3表达阳性。经χ2检验分析发现,ER阳性乳腺癌组织中Efp和Plk3具有显著的负相关关系(χ2=8.837,P=0.003)。
2.4 雌激素对ER阳性乳腺癌MCF-7细胞的Efp mRNA和Plk3 mRNA基因表达的影响
采用RTFQ-PCR检测ER阳性乳腺癌MCF-7细胞的Efp mRNA和Plk3 mRNA基因表达情况,结果显示,与对照组相比,E2组中MCF-7细胞经雌激素刺激后Efp mRNA的表达显著增加,而Plk3 mRNA的表达则无明显变化(图3)。
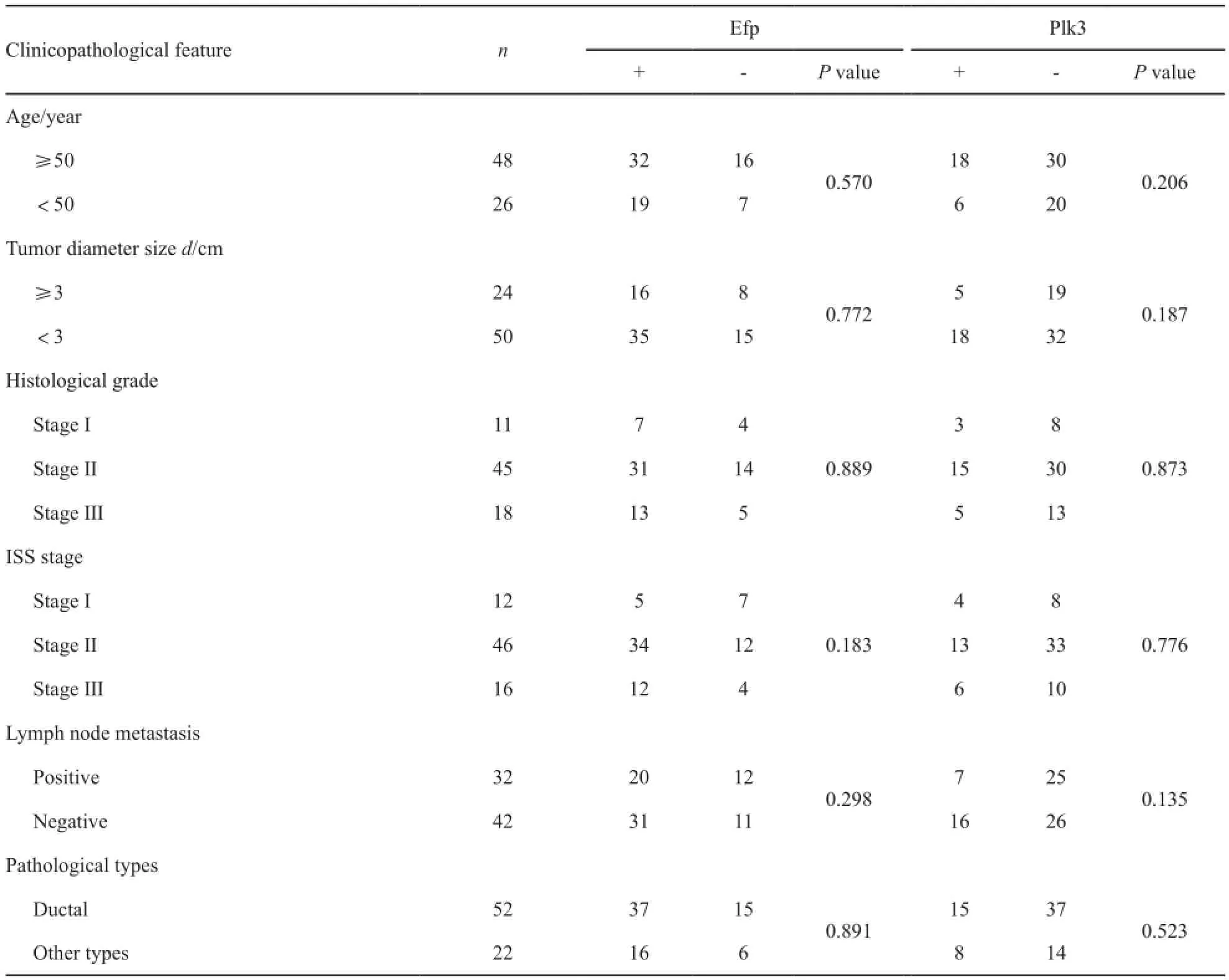
表 2 Efp、Plk3蛋白表达在ER阳性乳腺癌组织中的表达与临床病理特征关系Tab. 2 The Relationship between expressions of Efp and Plk3 and clinical characteristics in ER positive breast cancer
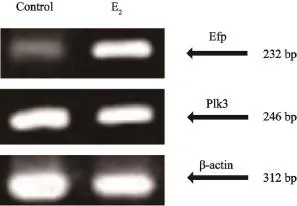
图 3 雌激素对ER阳性乳腺癌MCF-7细胞的Efp和Plk3基因表达的影响Fig. 3 Expression of Efp mRNA and Plk3 mRNA in ER positive MCF-7 cells induced by estrogen
2.5 雌激素和蛋白酶体抑制剂对ER阳性乳腺癌MCF-7细胞的Efp和Plk3蛋白表达的影响
采用Western blot检测ER阳性乳腺癌MCF-7细胞的Efp和Plk3蛋白表达情况。结果显示:E2组细胞经雌激素刺激后Efp的蛋白表达较对照组显著增加而Plk3蛋白明显下降;MG132组细胞经蛋白酶体抑制剂刺激后Plk3蛋白较对照组显著增加;E2+MG132组细胞经雌激素和MG132刺激后,Efp的蛋白表达较MG132组显著增加,而Plk3蛋白表达明显下降(图4)。
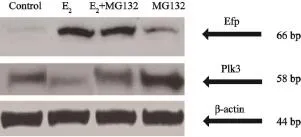
图 4 雌激素和蛋白酶体抑制剂对ER阳性乳腺癌MCF-7细胞的Efp和Plk3蛋白表达的影响Fig. 4 Expression of Efp and Plk3 protein in ER positive MCF-7 cells induced by estrogen and MG132
3 讨 论
ER阳性乳腺癌患者对内分泌治疗耐药一直是临床上的难题。近年来研究发现,长期雌激素刺激能引起ER下游靶基因上的雌激素反应元件调控基因表达能力增强,它是导致乳腺癌耐药过程形成的重要因素[7-8]。Efp主要表达于雌激素靶向性的组织和细胞中,如乳腺和子宫等上皮细胞。既往研究证实,Efp高表达可导致雌激素依赖性癌细胞的增殖和恶化,Zhao等[9]研究发现,雌激素诱导ER阳性乳腺癌细胞中Efp高表达,导致抑癌因子KLF5降解。Efp在ER阳性乳腺癌中也存在高表达现象,Ueyama等[10]通过沉默MCF-7乳腺癌细胞中Efp的表达,导致MCF-7的体外增殖受到显著抑制。因此,Efp可能是参与乳腺癌耐药过程的一个重要指标。高表达的Efp作为一种泛素连接酶,可通过泛素途径降解细胞内多种与乳腺癌增殖相关的蛋白,如Plk3蛋白。Plk3作为Plk家族的成员之一,是有丝分裂、胞质分裂和DNA损伤反应的关键调节剂。Naik等[11]发现抑制乳腺癌细胞中Plk3的活性,可导致乳腺癌细胞异常增殖。Yan等[12]的调查显示,大部分乳腺癌患者的癌组织中Plk3蛋白表达减少。因此,推测Efp和Plk3可能参与了ER阳性乳腺癌患者的内分泌治疗耐药过程。
本研究探讨ER阳性乳腺癌中Efp和Plk3蛋白表达相关性,在74例ER阳性乳腺癌组织中Efp和Plk3蛋白表达与患者的临床病理特征未见明显关联(P>0.05),而χ2检验分析结果显示,ER阳性乳腺癌组织中Efp和Plk3具有显著的负相关关系(χ2=8.837,P<0.05);此外,免疫组织化学检测显示,在同一个乳腺癌患者的乳腺癌组织标本中,Efp的高表达往往同时存在Plk3的低表达,提示Efp高表达可促进Plk3的蛋白降解。进一步观察外源性雌激素和蛋白酶抑制剂MG132反应性指蛋白Efp对Plk3表达的影响,结果显示,MCF-7细胞经雌激素刺激后Efp mRNA的表达显著增加,而Plk3 mRNA的表达无明显变化,说明雌激素能显著促进Efp高表达,而对Plk3的表达不产生影响。随后我们通过Western blot检测不同刺激对MCF-7细胞Efp和Plk3蛋白的影响,结果显示,MCF-7细胞经雌激素刺激后,Efp的蛋白表达较对照组显著增加,而Plk3蛋白明显下降。Plk3在细胞中可被蛋白酶抑制剂MG132稳定[13],当MCF-7细胞经MG132刺激后,Plk3蛋白较对照组显著增加。MCF-7细胞经雌激素和MG132同时刺激后,Efp的蛋白表达较MG132组显著增加,而Plk3蛋白表达明显下降。上述结果进一步验证了Efp高表达可促进Plk3的蛋白降解。
综上所述,在ER阳性乳腺癌中,雌激素能促进Efp高表达,加速Plk3的蛋白降解,从而更有利于具有雌激素依赖性的ER阳性乳腺癌细胞的增殖。因此,Efp和Plk3表达的变化可能对内分泌耐药过程的形成产生一定影响。
[1] DENG H, ZHANG X T, WANG M L, et al. ER-α36-mediated rapid estrogen signaling positively regulates ER-positive breast cancer stem/progenitor cells.[J]. PloS One,2014, 9(2): e88034-e88034.
[2] YING S, WANG Y, CONG F, et al. Estrogen promotes stemness and invasiveness of ER-positive breast cancer cells through Gli1 activation[J]. Mol Cancer, 2014, 13(1): 1-16.
[3] DONG X Y, FU X, FAN S, et al. Estrogen causes ATBF1 protein degradation through the estrogen-responsive E3 ubiquitin ligase EFP[J]. Biochem J, 2012, 444(3): 581-590.
[4] HORIE K, URANO T, IKEDA K, et al. Estrogen-responsive RING finger protein controls breast cancer growth[J]. J Steroid Biochem Mol Biol, 2003, 85(s2-5): 101-104.
[5] CUORVO L V, VERDERIO P, CINISELLI C M, et al. PI3KCA mutation status is of limited prognostic relevance in ER-positive breast cancer patients treated with hormone therapy[J]. Virchows Arch, 2014, 464(1): 1-9.
[6] 王 岩, 聂明豪, 卢艳红, 等. FAP在大肠癌中表达的临床病理意义[J]. 现代肿瘤医学, 2015, 23(20): 2979-2981.
[7] SWEENEY E E, FAN P, JORDAN V C. Mechanisms underlying differential response to estrogen-induced apoptosis in long-term estrogen-deprived breast cancer cells [J]. Int J Oncol, 2014, 44(5): 1529-1538.
[8] Y O K O O, T A K A S H I T, Y U T A K A Y, e t a l. Immunohistochemical analysis in ethinylestradiol-treated breast cancers after prior long-term estrogen-deprivation therapy[J]. Springerplus, 2015, 4(1): 1-9.
[9] ZHAO K W, SIKRIWAL D, DONG X Y, et al. Estrogen causes degradation of KLF5 by inducing the E3 ubiquitin ligase EFP in ER-positive breast cancer cells[J]. Biochem J, 2011,437(2): 323-333.
[10] UEYAMA K, IKEDA K W, NAKASATO N, et al. Knockdown of Efp by DNA-modified small interfering RNA inhibits breast cancer cell proliferation and in vivo tumor growth[J]. Cancer Gene Ther, 2010, 17(9): 624-632.
[11] NAIK M U, PHAM N T, BEEBE K, et al. Calcium-dependent inhibition of polo-like kinase 3 activity by CIB1 in breast cancer cells[J]. Int J Cancer, 2011, 128(3): 587-596.
[12] YAN Y D, REMLINGER K, GRESHOCK J, et al. Biomarker analyses of PLK isoforms in breast cancer[J]. Cancer Research, 2006, 66(1): 459-459.
[13] SANG M, ANDO K, OKOSHI R, et al. Plk3 inhibits proapoptotic activity of p73 through physical interaction and phosphorylation[J]. Genes Cells, 2009, 14(7): 775-788.
Expression correlation between Efp and Plk3 in estrogen receptor-positive breast cancer
DUAN Jiajun, ZOU Tianyu, ZHANG Ji, LIU Dequan
(Department of Mammary Surgery, Yunnan Cancer Hospital,Third Affiliated Hospital of Kunming Medical University, Kunming 650118, Yunnan Province, China)
Correspondence to: DUAN Jiajun E-mail: zhuomiansohuji@163.com
Background and purpose: Estrogen receptor (ER)-positive breast cancer always presents a dilemma for resistance to endocrine therapy in a long time. The recent studies showed that the expression of estrogenresponsive finger protein (Efp) and polo-like kinase 3 (Plk3) had a close relationship with breast cancer development. This study was to explore the expression correlation between Efp and Plk3 in ER-positive breast cancer in order to understand the influence of Efp and Plk3 on the drug resistance. Methods: The expression of Efp and Plk3 in 74 cases of ER-positive breast cancer was detected by SP immunohistochemistry. The clinical significance was then analyzed. Real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) and Western blot were used to detect the expression of Efp and Plk3 in ER-positive MCF-7 cells. Results: No significant relationship was found between Efp and Plk3 expression and the clinicopathological features of 74 cases of ER-positive breast cancer (P>0.05). The number of cases whose Efp showed positive expression was 51 (68.9%), while the number of cases whose Plk3 showed positive expression was 23 (31.1%). Chi-square test analysis showed the expression of Efp and Plk3 was negatively correlated in 74 cases of ER-positive breast cancer (χ2=8.837, P<0.05). The result of RTFQ-PCR showed that the expression of Efp mRNA in MCF-7 cells was up-regulated by estrogen stimulation, whereas Plk3 mRNA was not changed. The result of Western blot showed that the expression of Efp protein in MCF-7 cells was increased by estrogen and MG132 stimulation, whereas Plk3 protein was decreased. Conclusion: The expression of the Efp protein is negatively correlatedwith Plk3 protein in ER-positive breast cancer. High expression of Efp may be involved in the resistance to endocrine therapy.
Breast cancer; Estrogen receptor; Estrogen-responsive finger protein; Polo-like kinase 3; Drug resistance
10.19401/j.cnki.1007-3639.2016.10.007
R737.9
A
1007-3639(2016)10-0848-06
段佳君 E-mail:zhuomiansohuji@163.com
(2015-11-10
2016-02-10)
