miR-26a靶向MMP16参与调控胃癌细胞侵袭作用研究
2016-11-17陈治宇王辰辰赵晓莹李文桦朱晓东
陈治宇,王辰辰,胡 健,赵晓莹,李文桦,朱晓东
1.复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032;
2.中国人民解放军第四五五医院消化内科,上海 200052
miR-26a靶向MMP16参与调控胃癌细胞侵袭作用研究
陈治宇1,王辰辰1,胡 健2,赵晓莹1,李文桦1,朱晓东1
1.复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032;
2.中国人民解放军第四五五医院消化内科,上海 200052
背景与目的:胃癌发生侵袭转移是导致患者预后不良的重要因素。本研究旨在明确miR-26a在调控胃癌细胞运动侵袭中的作用及其可能机制。方法:通过实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测胃癌组织细胞中miR-26a表达情况,体外通过CCK-8法、平板克隆形成实验和Matrigel-Transwell实验评价miR-26a对人胃癌细胞增殖、运动和侵袭能力的影响。荧光素酶报告基因系统评估miR-26a对下游靶基因的调控作用。结果:胃癌组织中miR-26a表达较癌旁组织明显下降。miR-26a体外对胃癌细胞增殖无明显影响,但可显著抑制胃癌细胞的运动和侵袭。相反,抑制miR-26a表达可促进胃癌细胞的侵袭能力。生物信息学分析提示,基质金属蛋白酶16(matrix metalloproteinase 16,MMP16)为miR-26直接调控靶基因,miR-26a可抑制胃癌细胞MMP16 miRNA和蛋白的表达。荧光素酶报告基因检测提示,miR-26a可与MMP16 mRNA 3’UTR结合诱导其转录后抑制。进一步研究提示,MMP16 siRNA对胃癌细胞侵袭具有模拟miR-26a作用,而过表达MMP16可拮抗miR-26a对胃癌细胞侵袭的影响。结论:miR-26a可通过靶向MMP16来抑制胃癌细胞运动侵袭,miR-26a可作为抑制胃癌细胞侵袭的重要干预靶点。
miR-26a;胃癌;基质金属蛋白酶16;侵袭
胃癌是消化系统常见恶性肿瘤,其发病率在世界范围内居第4位,死亡率居恶性肿瘤死因的第2位[1]。我国是胃癌高发国家,目前已成为第2位常见癌症和第3位癌症死因[2]。因此,探寻胃癌侵袭转移机制,寻找干预靶点具有重要临床价值。miRNA在恶性肿瘤发生、发展中的作用在近年来受到广泛关注和深入研究[3]。已有研究提示,miRNA在调控胃癌细胞增殖、运动和侵袭等恶性表型方面发挥重要作用[4]。因此,本研究将深入探讨miR-26a在调控胃癌细胞侵袭中的作用及其可能机制。
1 材料和方法
1.1 细胞系
人胃癌细胞系MGC-803、HGC-27及人肾上皮细胞293T均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。其中MGC-803和HGC-27用含有10%胎牛血清、丙酮酸钠和HEPES的RPMI1640来培养;293T用含有10%小牛血清、4 mmol/L谷氨酰胺的培养液。所有的细胞均在37 ℃、CO2体积分数为5%的温箱中培养,每2~3 d更换1次培养液。
1.2 WST法细胞体外增殖测定
将处于对数期的细胞按5 000个/孔(100 μL/孔)的浓度接种至96孔板,每孔设3个对照,于24、48、72、96和120 h后加入CCK-8溶液10 μL,37 ℃温育3 h,测量在450 nm处的吸光度(D)值并绘制生长曲线。
1.3 体外运动、侵袭实验
按1∶3的比例混合Matrigel和RPMI1640培养基制备成人工基底膜;将Transwell置于24孔培养板中,于上室各加入50 μL的混合液,37 ℃温育2 h以使其凝固;按1×106/mL的浓度将处于对数期的细胞用无血清RPMI1640培养基制成细胞悬液,于上室中加入100 μL的细胞悬液(1×105个细胞),下室加入600 μL含10%胎牛血清的RPMI1640培养基,每室设3个对照;于37 ℃、CO2体积分数为5%的条件下分别培养24 h。在24孔板上取下Transwell,用棉签蘸去小室上面的细胞后进行H&E染色,显微镜下进行侵袭细胞计数。
1.4 RNA的提取
参照GENERAY公司总RNA抽提试剂盒(Trizol-离心柱型)使用说明进行RNA抽提后,经紫外分光光度计检测其D260及D280并计算其RNA浓度(C=D260×40×稀释倍数×10-3,单位: µg/µL);用DEPC水调整RNA浓度至1 µg/µL,置-70 ℃冰箱保存。
1.5 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测
参照Fermentas “RevertAidTM”First Strand cDNA Synthesis Kit”进行反转录合成cDNA(RT),-20 ℃保存。采用SYBR GREEN法RTFQ-PCR,PCR反应体系总体积25 μL,PCR反应条件:95 ℃热启动15 min,94 ℃变性30 s,53 ℃退火1 min,72 ℃延伸1 min,共40个循环,至4 ℃结束。miR-26a特异性扩增引物为:5’-TGTCAACGATACGCTACCTAACGGCA TGACAGTGTCAGCCTA-3’。U6 特异性引物为5’-GAACGCTTCACGAATTTGC-3’。基质金属蛋白酶16(matrix metalloproteinase 16,MMP16)扩增引物序列为:上游5’-AGCACGTTGTTTCC CTTCC-3’,下游5’-CCCGAGCTGTTTATCCA TCA-3’。GAPDH 扩增引物序列为:上游5’-GGGAGCCAAAAGGGTCATCATCTC-3’,下游5’-CCATGCCAGTGAGCTTCCCGTTC -3’。
1.6 蛋白抽提及蛋白[质]印迹法(Western blot)检测
细胞长至瓶底的80%~90%时,弃去培养液,以预冷的PBS洗涤2次后,向培养瓶中加入相应体积的蛋白裂解液,于冰上振摇30 min,然后用刮棒刮下细胞,收集到预冷的1.5 mL离心管中,以4 ℃、12 000×g离心15 min,将上清液按需分装,保存于-70 ℃。拟行Western blot检测时,按《分子克隆》第2版相关章节配制SDS-聚丙烯酰胺凝胶,然后从不同样品中取出等量蛋白(100 µg)与1×SDS蛋白上样缓冲液混合,并于100 ℃变性10 min后,以4 ℃、12 000×g离心5 min;用离心所得的上清液上样进行电泳,转膜,将转膜后的硝酸纤维素膜浸泡至含5%牛奶的PBS溶液中进行封闭,然后加入一抗(浓度1∶500),于4 ℃下,与膜共同温育过夜,然后用PBS洗涤;将二抗按1∶2 000的比例稀释,与膜于室温下温育1 h后用PBS洗涤,最后根据ECL试剂盒说明,于暗室中进行显影。本研究所用抗体MMP16和GAPDH均为兔抗人多抗,购自英国Abcam公司。
1.7 荧光素酶活性检测
用胰蛋白酶消化293T细胞,离心后重悬于含有10%胎牛血清的细胞培养基中并按4×104个细胞/孔的密度接种于48孔板上,培养24 h后(此时细胞密度为40%~50%),用磷酸钙转染法把相应的miRNA表达载体(20 nmol/L)、3’UTR报告载体(80 ng)和pRL-TK(表达海肾荧光素酶蛋白作为实验的内参,40 ng)共转到293T细胞。转染48 h后,用Dual-Luciferase Reporter Assay裂解细胞并用多功能酶标仪测定荧光素酶活性。
1.8 RNA转染
取6孔板,每孔5×105个细胞,2 mL无抗生素完全培养液;将6 μL miRNA mimics或inhibitors加入250 Opti-MEM中(每孔20 µmol/ L);6 μL LipofectamineTM2000加入250 Opti-MEM中(每孔20 µmol/L);室温温育5 min;两者混合,室温温育20 min;500 μL混合液加入6孔板中,轻轻混匀,RNA终浓度为50 nmol/L;37 ℃培养6 h后,去除转染液,更换完全培养液;培养24 h后继续后续实验。miR-26a mimics和inhibitors均购自上海吉玛制药技术有限公司。miR-26a mimics序列为:正义5’-UUCAAGUAAUCCAGGAUAGGCU-3’,反义5’-CCUAUCCUGGAUUACUUGAAUU-3’。miR-26a inhibitor序列为:5’-UUGUUCAUAU AGAUCUCGUCAUU-3’。MMP16 siRNA序列为:5’-AUAAUCUCCAAUAUCCUC UUAAA-3’。
1.9 统计学处理
本研究相关统计分析由SPSS 15.0软件完成,主要方法为χ2检验和方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-26a在胃癌细胞中表达下调
选择10对人胃癌组织及癌旁正常组织,通过RTFQ-PCR检测miR-26a表达情况,结果显示,相对于癌旁正常组织,miR-26a在胃癌组织细胞中的表达水平明显下调(P<0.001,图1)。
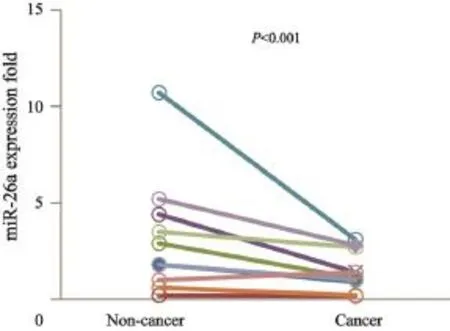
图 1 miR-26a在人胃癌组织与癌旁正常组织表达差异Fig. 1 A comparison of miR-26a expression levels in 10 paired gastric cancer and adjacent non-cancer tissues
2.2 miR-26a体外对胃癌细胞增殖无明显影响
体外通过miR-26a mimics转染人胃癌细胞,然后通过CCK-8法和平板克隆形成实验评估miR-26a体外对人胃癌细胞增殖克隆的影响。结果显示,miR-26a过表达并没有影响胃癌细胞体外增殖能力,差异均无统计学意义(P均>0.05,图2)。
2.3 miR-26a抑制胃癌细胞运动、侵袭
体外通过Transwell实验及Matrigel评估miR-26a对人胃癌细胞运动、侵袭能力的影响。结果显示,转染miR-26a mimics进行过表达可在体外显著抑制胃癌细胞的运动和侵袭。相反,转染miR-26a抑制剂anti-miR-26a inhibitors可促进人胃癌细胞的运动和侵袭能力(图3)。
2.4 MMP16为miR-26a直接调控靶基因
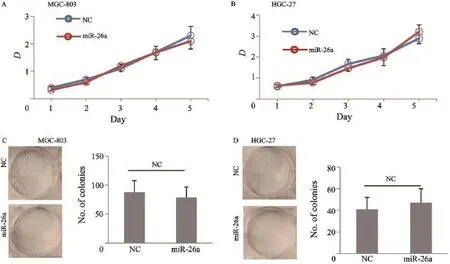
图 2 miR-26a体外对人胃癌细胞增殖的影响Fig. 2 miR-26a has no effect on gastric cell growth in vitro
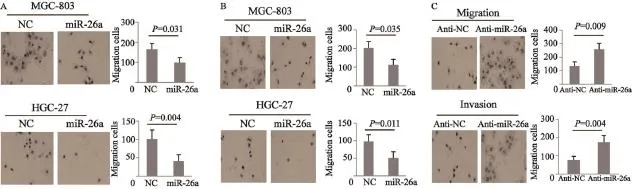
图 3 miR-26a对人胃癌细胞运动、侵袭的影响Fig. 3 miR-26a suppresses gastric cancer cell migration and invasion in vitro
为明确miR-26a直接调控靶基因,我们通过Targetscan软件预测发现,MMP16 mRNA 3’UTR存在miR-26a的结合位点,将含有MMP16 mRNA 3’UTR序列克隆到报告载体pGL-MCS-control中,得到野生型的3’UTR报告载体,同时也构建含有突变靶位点的突变型3’UTR报告载体,然后利用双荧光素酶报告系统检测发现,miR-26a可抑制野生型3’UTR报告载体荧光素酶活性,而对突变型3’UTR报告载体荧光素酶活性并没有明显的抑制作用。进一步研究发现,过表达miR-26a可明显抑制胃癌细胞MMP16 mRNA和蛋白的表达,而抑制miR-26a表达可促进MMP16 mRNA和蛋白的表达(图4)。
2.5 MMP16介导了miR-26a抑制胃癌细胞运动侵袭作用
为进一步评估MMP16是否为miR-26a功能性靶基因,我们通过siRNA进行MMP16表达沉默后发现人胃癌细胞体外侵袭能力下降,与miR-26a作用相一致;然后构建表达MMP16的表达载体进行挽救实验,由于靶基因的表达载体只克隆了其对应基因的蛋白编码区域而不包含其3’UTR序列,因此靶基因表达不受miR-26a抑制,可实现靶基因与miR-26a共表达,结果发现,MMP16的过表达可抑制miR-26a效应(图5)。
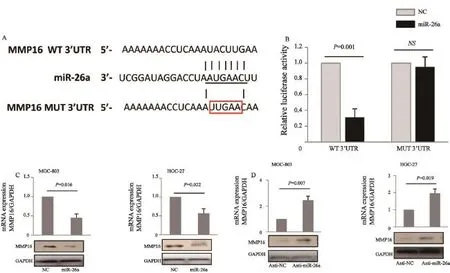
图 4 MMP16为miR-26a直接调控靶基因Fig. 4 miR-26a down-regulates MMP16 expression by directly targeting its 3’-UTR
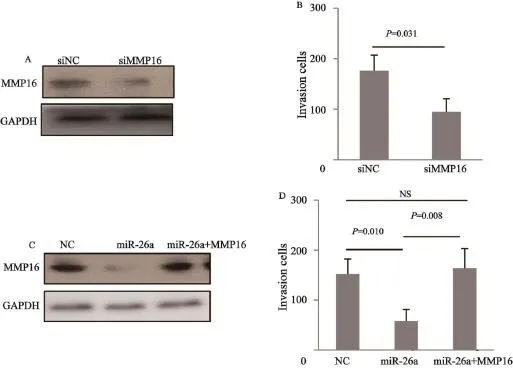
图 5 MMP16介导miR-26a抑制胃癌细胞侵袭作用Fig. 5 MMP16 mediates the invasion-suppressive function of miR-26a
3 讨 论
miRNA是一类长18~25 nt的非编码RNA,可靶向于特异性mRNA的3’UTR区,通过抑制miRNA的翻译或直接引起其降解来沉默对应的靶基因,从而调节其生物学过程[5]。miRNA在恶性肿瘤发生、发展中的作用在近年来受到广泛关注[6]。目前认为,miRNA主要通过2种方式发挥作用[7]:① 作为抑癌因子抑制原癌基因的激活;② 通过下调肿瘤抑制因子水平或下调抑癌基因表达从而产生致癌作用并促进肿瘤的生长。已有研究提示,miRNA在调控胃癌细胞增殖、运动、侵袭、转移及治疗敏感性方面发挥重要作用[4]。同时基于miRNA表达指纹谱用于胃癌早期诊断[8]、化疗疗效[9]和预后预测[10]等方面具有重要价值。
既往研究提示,miR-26a在调控肿瘤细胞恶性表型方面具有重要作用。如miR-26a在许多恶性肿瘤中发挥抑制癌细胞增殖、运动及侵袭的作用,其机制除靶向传统的肿瘤癌基因诱导其转录后抑制外,还包括参与调控肿瘤相关炎性反应、肿瘤干细胞干性维持等。另外,外周血miR-26a表达检测可用于肿瘤治疗疗效及预后预测等[11]。但到目前为止,miR-26a在人胃癌细胞中的表达情况及其对胃癌细胞运动、侵袭能力的作用研究尚未见报道。因此,本研究首次深入系统地研究了miR-26a对人胃癌细胞的作用,结果发现,miR-26a可在体外明显抑制人胃癌细胞的运动、侵袭能力,但本研究也发现,miR-26a对胃癌细胞的增殖能力并没有显著影响,提示其作用的发挥主要体现在对胃癌细胞的运动侵袭作用上,且其功能的发挥具有细胞特异性。
本研究还提示,MMP16为miR-26a直接调控靶基因。MMP家族是一类活性依赖于锌离子和钙离子的蛋白水解酶,主要的生理作用是降解细胞外基质,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用,在肿瘤浸润、转移中的作用日益受到重视,被认为是该过程中主要的蛋白水解酶[12-13]。本研究发现,MMP16介导了miR-26a抑制胃癌细胞侵袭转移作用。已有文献报道,MMP16参与多种肿瘤的运动、侵袭及转移,包括肺癌、胰腺癌和恶性黑素瘤等[14-16]。而本研究再次提示,MMP16在诱导胃癌细胞运动、侵袭方面发挥了重要作用。
胃癌早期症状无特异性,大多数患者就诊时已到晚期,预后很差,多因广泛的侵袭转移而死亡。因此研究胃癌侵袭转移相关机制,有可能为胃癌侵袭转移的早期诊断和靶向治疗提供帮助和依据。本研究提示,miR-26a可能作为人胃癌侵袭转移的重要干预靶点。而在目前,miRNA在临床上除用于早期诊断、疗效预测和预后判断外,直接用于临床治疗已进入临床试验阶段,如Mirna Therapeutics开发的MRX34是一种miR-34脂质体,补充miR-34治疗肿瘤的临床试验已经开展[17]。因此,miR-26a未来可能作为胃癌侵袭转移新的干预靶点。
综上所述,miR-26a在人胃癌组织中表达下调,miR-26a可抑制人胃癌细胞运动、侵袭能力,MMP16为miR-26a直接调控靶基因,其介导了miR-26a对人胃癌细胞运动侵袭的影响,miR-26有可能作为胃癌预后新的分子标志物及重要的临床干预靶点。
[1] KARIMI P, ISLAMI F, ANANDASABAPATHY S, et al. Gastric cancer: descriptive epidemiology, risk factors,screening, and prevention[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(5): 700-713.
[2] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[3] ESQUELA-KERSCHER A, SLACK F J. Oncomirs - miRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4): 259-269.
[4] JIANG C, CHEN X, ALATTAR M, et al. MicroRNAs in tumorigenesis, metastasis, diagnosis and prognosis of gastric cancer[J]. Cancer Gene Ther, 2015, 22(6): 291-301.
[5] KIM V N, HAN J, SIOMI M C. Biogenesis of small RNAs in animals[J]. Nat Rev Mol Cell Biol, 2009, 10(2): 126-139.
[6] ESQUELA-KERSCHER A, SLACK F J. Oncomirs-miRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4): 259-269.
[7] IORIO M V, CROCE C M. MiRNAs in cancer: small molecules with a huge impact[J]. J Clin Oncol, 2009, 27(34): 5848-5856.
[8] LI X, ZHANG Y, ZHANG Y, et al. Survival prediction of gastric cancer by a seven-miRNA signature[J]. Gut, 2010,59(5): 579-585.
[9] WANG P, ZHUANG L, ZHANG J, et al. The serum miR-21 level serves as a predictor for the chemosensitivity of advanced pancreatic cancer, and miR-21 expression confers chemoresistance by targeting FasL[J]. Mol Oncol, 2013,7(3): 334-345.
[10] MATUSZCAK C, HAIER J, HUMMEL R, et al. MiRNAs: promising chemoresistance biomarkers in gastric cancer with diagnostic and therapeutic potential[J]. World J Gastroenterol, 2014, 20(38): 13658-13666.
[11] QIU X, ZHANG J, SHI W, et al. Circulating miRNA-26a in plasma and its potential diagnostic value in gastric cancer[J]. PLoS One, 2016, 11(3): e151345.
[12] NEMETH J A, YOUSIF R, HERZOG M, et al. Matrix metalloproteinase activity, bone matrix turnover, and tumor cell proliferation in prostate cancer bone metastasis[J]. J Natl Cancer Inst, 2002, 94(1): 17-25.
[13] LOKESHWAR B L. MMP inhibition in prostate cancer[J]. Ann N Y Acad Sci, 1999, 878: 271-289.
[14] TATTI O, GUCCIARDO E, PEKKONEN P, et al. MMP16 mediates a proteolytic switch to promote cell-cell adhesion,collagen alignment, and lymphatic invasion in melanoma[J]. Cancer Res, 2015, 75(10): 2083-2094.
[15] LIN F, WANG X, JIE Z, et al. Inhibitory effects of miR-146b-5p on cell migration and invasion of pancreatic cancer by targeting MMP16[J]. J Huazhong Univ Sci Technolog Med Sci, 2011, 31(4): 509-514.
[16] WANG P, CHEN L, ZHANG J, et al. Methylation-mediated silencing of the miR-124 genes facilitates pancreatic cancer progression and metastasis by targeting Rac1[J]. Oncogene,2014, 33(4): 514-524.
[17] BOUCHIE A. First miRNA mimic enters clinic[J]. Nat Biotechnol, 2013, 31(7): 577.
miR-26a suppresses gastric cancer cell invasion by targeting MMP16
CHEN Zhiyu1, WANG Chenchen1, HU Jian2, ZHAO Xiaoying1, LI Wenhua1, ZHU Xiaodong1
(1.Department of Medical Oncology,Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2.Department of Gastroenterology, the 455th Hospital of Chinese People's Liberation Army, Shanghai 200052, China)
Correspondence to: CHEN Zhiyu E-mail: zychan75@163.com
Background and purpose: Invasion and metastasis lead to poor prognosis in gastric cancer. In this study, we investigated the potential function of miR-26a in gastric cancer. Methods: Real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) was used to detect the expression of miR-26a in gastric cancer cells. In vitro CCK-8 assay, cloning formation assay and Matrigel-Transwell assay were used to evaluate the proliferation, migration and invasion of gastric cancer cells. A luciferase reporter assay was also conducted to confirm that matrix metalloproteinase-16 (MMP16) is a direct target of miR-26a. Results: miR-26a was down-regulated in gastric cancer tissues compared with that in non-cancerous tissues. Functional studies showed that miR-26a inhibited cell proliferation, colony formation, cell motility and invasion. However, miR-26a had no effect on cell proliferation. We also characterized MMP16 as a direct target of miR-26a. We showed that knocking down MMP16 in gastric cancer cells significantly decreased MMP16 expression and inhibited cell invasion, whereas ectopic MMP16 expression significantly abrogated the suppressed cell invasion induced by miR-26a. Conclusion: miR-26a suppresses gastric cancer cell invasion by targeting MMP16. miR-26a could represent a potential therapeutic target for gastric cancer.
miR-26a; Gastric cancer; Matrix metalloproteinase-16; Invasion
10.19401/j.cnki.1007-3639.2016.10.002
R735.2
A
1007-3639(2016)10-0813-07
上海市自然科学基金(16ZR1406800)。
陈治宇 E-mail: zychan75@163.com
(2016-07-14
2016-09-05)
