VX2移植性兔直肠癌淋巴结转移动物模型的建立及其生物学特性
2016-11-17孙轶群钟芳芳顾雅佳
孙轶群,童 彤,毛 健,钟芳芳,顾雅佳
VX2移植性兔直肠癌淋巴结转移动物模型的建立及其生物学特性
孙轶群1,童 彤1,毛 健1,钟芳芳2,顾雅佳1
1.复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:直肠癌淋巴结转移模型是研究肿瘤发生、发展、转移及抗肿瘤治疗的工具,但较大型动物模型鲜见报道。该研究旨在建立可行性强、重复率高的VX2移植性兔直肠癌淋巴结转移模型。方法:采用原位移植方法,将切好的小瘤块置入穿刺针内,并使用穿刺针将小瘤块推入到新西兰大白兔的直肠壁内。共制作模型20只。每周使用MR扫描2只实验兔,MR上观察肿瘤生长情况及肠周淋巴结个数,使用MR后处理软件测量实验兔的直肠壁肿瘤体积,扫描完成后进行详细解剖,切除直肠壁上肿瘤及肠周淋巴结,进行标本固定及HE染色,并探讨肿瘤体积与生长时间及转移淋巴结个数的关系。结果:成功制作模型13只,成功率为65%。于第4周开始在MR上可观察到局限于直肠壁肿块。随着时间增长,肿瘤体积不断增大,且不同时期(生长周数)肿瘤体积差异有统计学意义(F=52.865,P<0.05);进一步分析得出,肿瘤的平均体积与生长周数呈正线性相关(r=0.910),差异有统计学意义(P<0.05)。当肿瘤体积大于9 cm3时,实验兔开始出现转移性淋巴结,第9周开始转移淋巴结个数明显增多。统计分析得出肿瘤体积越大,转移性淋巴结个数就越多(F=92.531,P<0.05),且两者呈线性相关(r=0.945),差异有统计学意义 (P<0.05)。结论:本实验将组织学完整的VX2移植瘤组织块原位种植到新西兰大白兔直肠内,成功建立了VX2移植性兔直肠癌的淋巴结转移模型。本模型对于研究直肠癌的局部生长、浸润机制、淋巴结转移灶及生物学特性均有一定价值。
模型;直肠癌;转移性淋巴结
我国直肠癌发病率以每年2%的速度上升,在消化系统肿瘤中位于第3位。直肠癌术前分期对于患者治疗方法的选择有很大的关系,即使接受根治性手术的患者中仍有40%~50%死于术后肿瘤复发与转移[1],其中淋巴结转移是常见的转移方式,且淋巴结转移又可以进一步成为血行转移的桥头堡[2]。由于缺乏原位直肠癌淋巴结转移模型,故对影像学转移淋巴结的检出及研究难以深入进行。迄今为止,关于直肠癌动物模型以裸鼠皮下移植瘤及原位种植瘤较多见[3-4],但相关研究多采用较小的实验动物模型,而且成模后的进一步影像评估和治疗干预也存在困难。目前鲜见国内有关于较大型原位直肠癌淋巴结转移模型制作的报道,所以本实验旨在为直肠癌淋巴结转移的检出、治疗的研究提供可行性强、重复率高的较大型实验动物模型。
1 材料和方法
1.1 材料
1.1.1VX2荷瘤种兔
由上海斯莱克实验动物有限责任公司提供,体质量3~4 kg,后腿肌肉内见局部隆起的软组织肿块,肿块质韧,大小约2.5 cm× 2.5 cm×2.5 cm。
1.1.2实验动物
清洁级健康新西兰大白兔20只,由复旦大学实验动物部提供,体质量2.5~3.0 kg,雌雄各半,4~6个月龄。
1.2 方法
1.2.1模型制作前准备及传代
剥去VX2荷瘤兔后腿肌肉内的瘤块,取瘤块边缘生长旺盛的鱼肉样组织,剔除筋膜和坏死组织,使用眼科剪将选取好的组织剪切成体积约为2 mm×2 mm×2 mm的瘤块,浸入0.9%NaCl溶液备用,使用20号骨穿针将切好的小瘤块移植于健康兔后腿外侧肌肉内,4周左右进行1次保种传代。
1.2.2模型制作
实验兔前1 d禁食,随机选取。磁共振扫描前5 min对新西兰大白兔采用氯胺酮与地西泮混合液(2 mL氯胺酮和 2 mL地西泮)进行肌内注射麻醉,用量为 0.20~0.25 mL/kg。待实验动物麻醉后仰卧位四肢固定,并消毒兔子肛门周围。将切好的小瘤块置入穿刺针内待用。助手利用卵圆钳将实验兔肛缘提起以张开肛门及直肠下段,然后将载有瘤块的穿刺针沿直肠壁进针2~3 cm深度,借助无影灯观察针尖是否穿入肠壁,若针尖停留位置在直肠壁内,借助注射器针头将小瘤块推入到直肠壁内,沿肠壁轻轻退出穿刺针,并用生物OB胶(医用粘连剂,购自广州白云医用胶有限公司)封闭进针口,术毕。若针尖穿透直肠,则换位置继续进针。实验兔一般1 h内苏醒,苏醒后即可恢复其正常饮食。
1.2.3MR监测肿瘤生长状况
从第1周开始,每周对其中2只实验兔进行MR扫描,观察移植肿瘤生长情况。并利用MR后处理系统3D-MIP中的Segment功能测量肿瘤体积大小,使用其中的quick paint工具,在横断位T2WI图上对肿瘤信号区域感兴趣区(region of interest,ROI)进行勾画,将每个层面的肿瘤信号画入,最后点击measure volume即可计算出勾画的肿瘤体积VROI。由于横断位T2WI扫描为有间隔的扫描,间隔为1 mm,使用quick paint未能将间隔画入ROI,间隔区体积的测量使用粗略算法:用上下两层ROI面积的平均值乘以间隔厚度,即V间隔=1×(An+An+1)/2(n≥1)(V=volume;A=area)。V总=VROI+V间隔。
1.2.4MR检查
所有实验兔检查前不需要肠道准备,未服用肠道解痉药物。检查时受检实验兔取仰卧位。采用3.0 T(Signa Horizon,GE Medical Systems)MR扫描仪,使用柔软体线圈发射并接收信号。扫描参数:冠状位T1WI: TR=620 ms,TE=7 100 ms,Matrix=352×192,层厚=3 mm,层间距=0.5 mm,FOV=200 mm。冠状位T2WI: TR=2 500 ms,TE=106 ms,Matrix=320×224,层厚=3 mm,层间距=1 mm,FOV=200 mm。矢状位T2WI:TR=3 220 ms,TE=103 ms,Matrix=320×224,层厚=3 mm,层间距=0.5 mm,FOV=200 mm。横断位T2WI: TR=3 900 ms,TE=93 ms,Matrix=256×256,层厚=4 mm,层间距=1 mm,FOV=120 mm。
1.2.5MR判断转移淋巴结的标准
判断转移性淋巴结的标准:淋巴结短经大于3 mm,或在T2WI图像上显示混杂信号并且边缘不规整的淋巴结视为转移。
1.2.6观察直肠周围淋巴结生长情况
每周扫描2只实验兔。MR扫描完成后,观察肠周淋巴结生长情况,并立即处死已完成扫描的2只实验兔,对直肠及周围邻近器官进行详细的解剖学检查。肉眼观察移植瘤生长部位、质地、活动度及移植瘤周围的淋巴结位置、个数;并将移植瘤及淋巴结完整切除。移植肿瘤及淋巴结使用4%甲醛溶液固定,石蜡包埋,切片,经苏木精-伊红染色,在光镜下观察。
1.3 统计学处理
采用SPSS 13.0统计软件分析。统计方法采用方差分析与直线回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 移植瘤生长情况
成功制作VX2移植性兔直肠癌模型13只,成功率65%(13/20,表1,图1~6)。造模后前3周MR上未见明显异常肿块。在第4周,MR上观察到局限于直肠壁的肿块,其边界清楚,T2WI信号均匀,未见明显坏死灶。解剖见肿瘤在直肠壁内呈圆形,肿瘤结节呈灰白色,鱼肉样,质硬,其内见丰富的供瘤血管。第5周行MR扫描及解剖,肿瘤情况均如第4周所见。第6、7周时MR上肿瘤边界不清,T2WI信号不均匀,肿瘤内部出现少许坏死灶。解剖后见肠壁内肿块,内部中央见少许液化坏死区,实性区仍见丰富的供瘤血管。第8~10周,MR上见肿瘤体积增大明显,并与盆腔壁黏连,T2WI信号更不均匀,肿瘤下端突出肛门向外生长,另有肠膨胀表现。解剖时肿瘤与盆壁不易分离,肿瘤内部坏死范围愈加明显。其中1只实验兔,于第9周时死于衰竭。利用MR后处理软件测得不同时期肿瘤体积,由表1可见:4~10周内,随着时间增长,肿瘤体积不断增大,且不同时期(生长周数)肿瘤体积差异有统计学意义(F=52.865,P<0.05)。进一步分析得出,肿瘤平均体积与生长周数呈正线性相关(r=0.910),差异有统计学意义(P<0.05,表2,图7)。
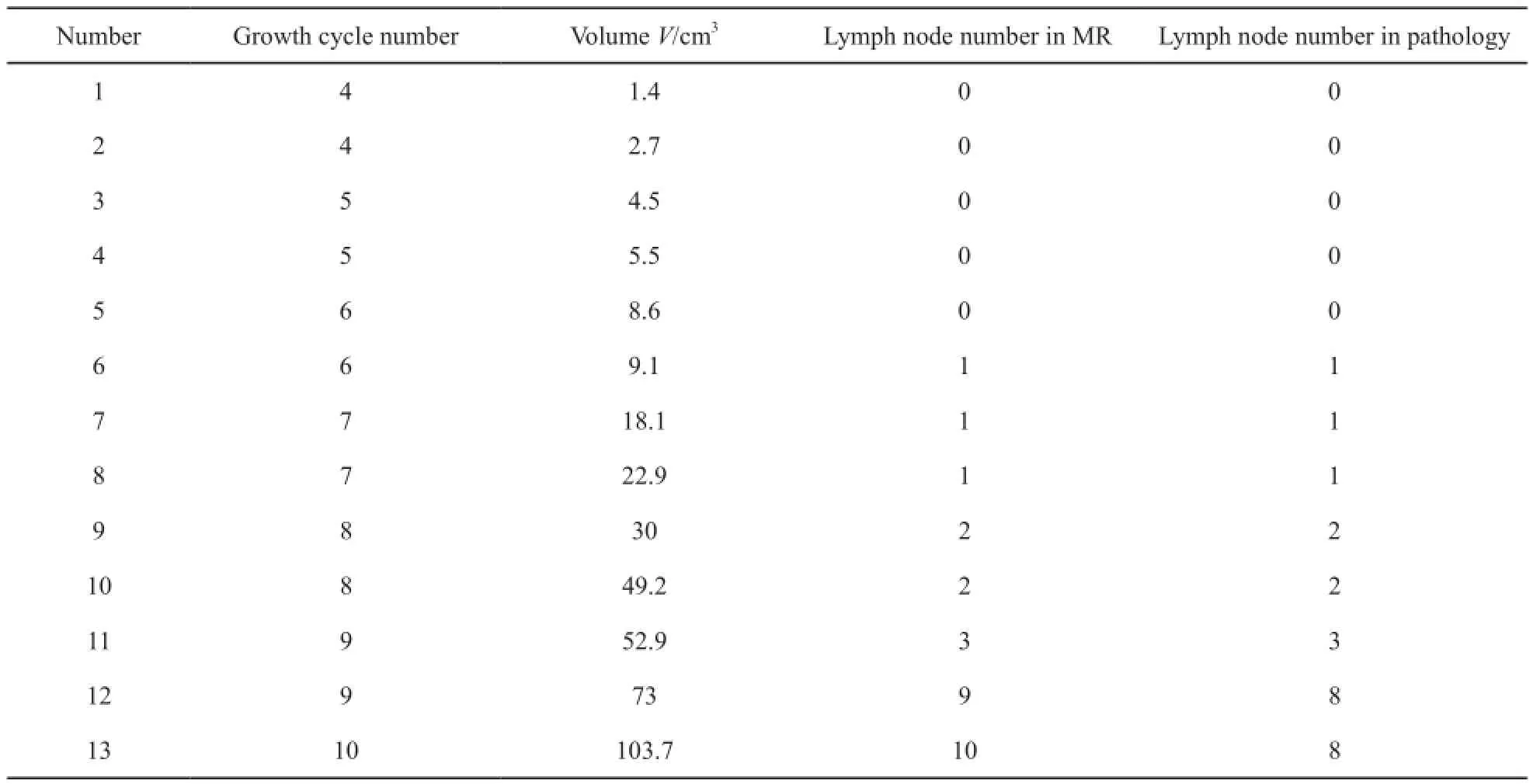
表 1 实验兔生长情况Tab. 1 General introduction of the experimental rabbits
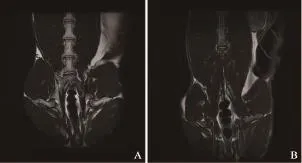
图 1 移植瘤接种后第3周MR图像Fig. 1 MR images 3 weeks after building model
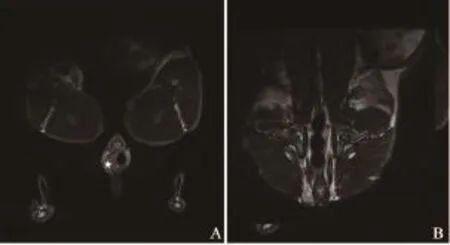
图 2 移植瘤接种后第4周MR图像Fig. 2 MR images 4 weeks after building model
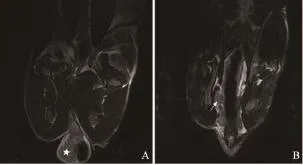
图 3 移植瘤接种后第7周MR图像Fig. 3 MR images 7 weeks after building model
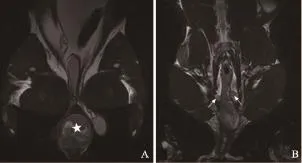
图 4 移植瘤接种后第8周MR图像Fig. 4 MR images 8 weeks after building model
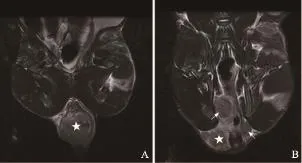
图 5 移植瘤接种后第9周MR图像Fig. 5 MR images 9 weeks after building model
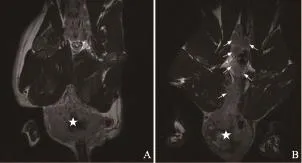
图 6 移植瘤接种后第10周MR图Fig.6 MR images 10 weeks after building model
2.2 肠周淋巴结生长情况
MR图像上观察肠周淋巴结(表1,图1~6)。实验兔前5周(图1~2)肠周未见明显肿大淋巴结,解剖后对直肠及盆腔进行详细检查,也未见明显肿大淋巴结。第6周时,MR扫描见1只实验兔肠周出现1枚类圆形的肿大淋巴结,边缘较清晰,解剖后摘除此枚淋巴结后病理证实为转移性淋巴结。第7周MR扫描(图3),2只实验兔分别可见1枚明显肿大淋巴结,术后病理均证实为转移性淋巴结。第8周MR扫描(图4),2只实验兔分别见2枚肿大淋巴结,形态欠规则,T2WI信号不均匀,摘除后病理证实均为转移性淋巴结。第9周MR扫描2只实验兔,其中肿瘤体积较小的1只实验兔肠周见3枚肿大淋巴结(图5),T2WI信号不均匀,有坏死部分,病理证实3枚均为转移性淋巴结;另1只肿瘤体积较大的实验兔肠系膜周见9枚异常强化淋巴结,沿肠系膜呈串珠样分布,部分相互融合,T2信号不均匀,病理证实为8枚转移性淋巴结及1枚癌结节。其中1只实验兔于第9周的第3天衰竭而死亡,第10周MR扫描时仅剩1只实验兔,MR上见10枚呈串样分布的异常肿大淋巴结(图6),T2WI信号亦不均匀,病理证实为8枚转移性淋巴结及2枚癌结节。第9周开始,实验兔肠周转移淋巴结个数开始明显增多。
2.3 淋巴结个数与肿瘤体积的关系
当肿瘤体积小于等于9 cm3时,5只实验兔均未出现转移性淋巴结,肿瘤体积超过9 cm3但不足30 cm3时,3只实验兔出现1枚转移性淋巴结,肿瘤体积大于等于30 cm3但不足53 cm3时,3只实验兔有2或3枚转移性淋巴结。当肿瘤体积大于等于70 cm3时,转移性淋巴结个数明显增多,多达8枚(表1)。经统计,肿瘤体积越大,转移性淋巴结个数越多(F=92.531,P<0.05),且两者呈线性相关(r=0.945,P<0.05,表3,图8)。
2.4 直肠癌模型组织学特征
肿瘤组织活检并行HE染色(图9)。低倍镜下可见浸润性癌巢,无明显边界,间质分界不清,结缔组织较少,癌巢边缘分布着被浸润的肠壁结构。肿瘤细胞弥散排列,可见纤维间隔,新生毛细血管丰富。高倍镜下见瘤细胞体积大,形态不规则,呈不规则排列;细胞质丰富,淡红染色;核肥大,其大小及形态各异,染色深浅不均,核分裂象多见。
2.5 转移性淋巴结组织学特征
肠周淋巴结组织活检并行HE染色(图10)。低倍镜下见正常淋巴结结构被破坏,出现转移性肿瘤组织,高倍镜下见肿瘤组织成巢状结构排列。肿瘤细胞体积增大,边界欠清,核浆比增大,细胞质丰富粉染,细胞核增大深染,可见病理性核分裂象。
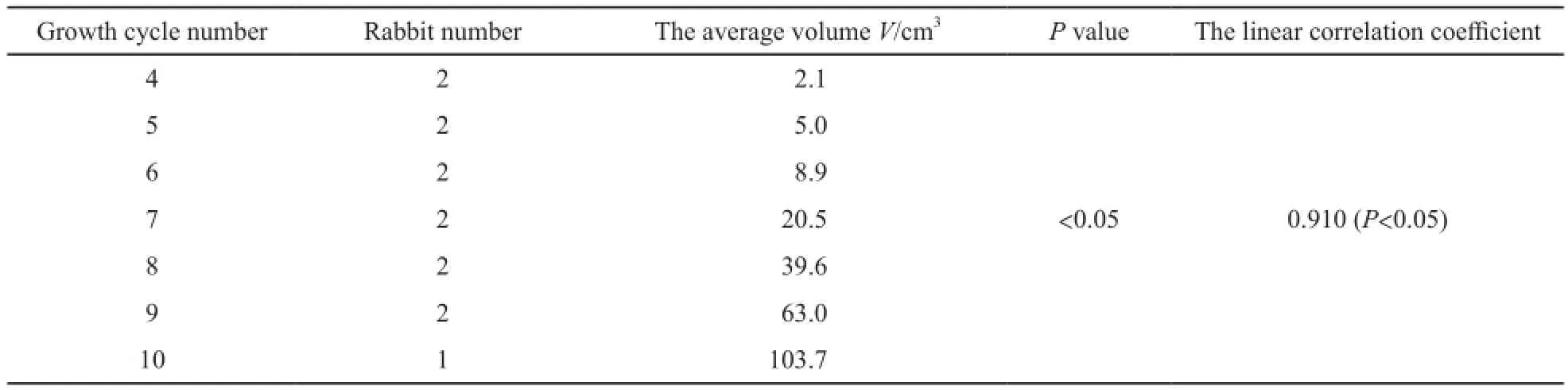
表 2 肿瘤体积与生长周数关系Tab. 2 The relationship between tumor volume and growing number of weeks
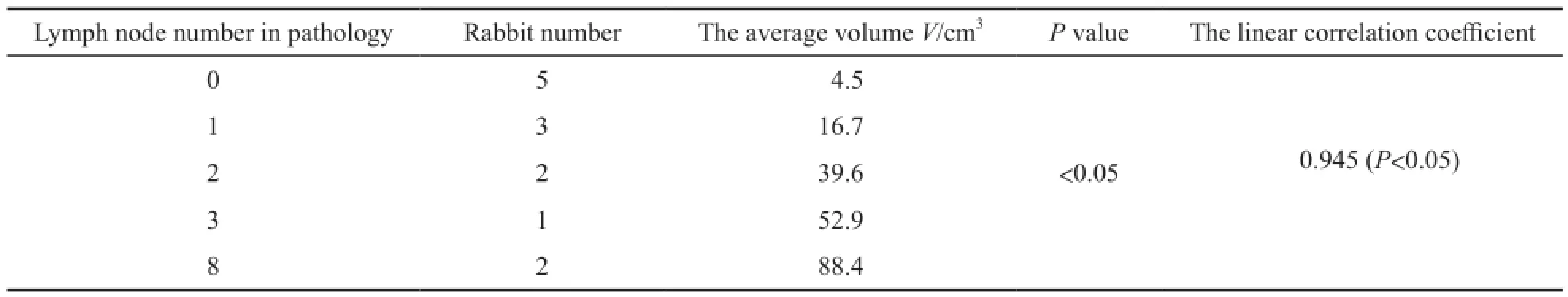
表 3 淋巴结个数与肿瘤体积关系Tab. 3 The relationship between the tumor volume and lymph node number
2.6 癌结节组织学特征
肠周癌结节组织活检并行HE染色(图11)。低倍镜下肿瘤组织边界不清,肿瘤细胞成实性片状分布,部分区呈乳头状分布。高倍镜下肿瘤细胞呈圆形或椭圆形,细胞较一致,核仁明显,染色质粗颗粒状,分布不均,淡红染色;核肥大,见病理性核分裂象。
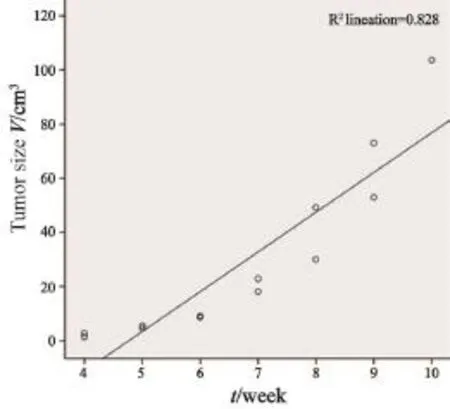
图 7 生长周数与肿瘤体积关系Fig. 7 The relationship between growing number of weeks and volume of tumor
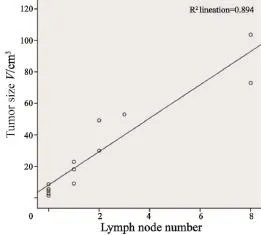
图 8 淋巴结个数与肿瘤体积关系Fig. 8 The relationship between number of lymph nodes and volume of tumor
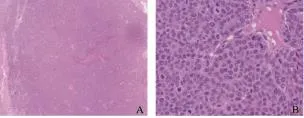
图 9 移植瘤病理HE染色Fig. 9 Tissue section with HE staining of VX2 tumor
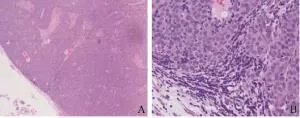
图 10 转移性淋巴结病理HE染色Fig. 10 Tissue section with HE staining of metastatic lymphnodes
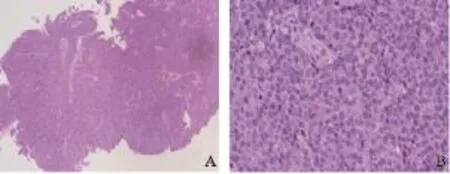
图 11 癌结节病理HE染色Fig. 11 Tissue section with HE staining of extranodal tumordeposits
3 讨 论
肿瘤已成为人类死亡的主要原因之一[5-6],其中结直肠癌是常见的恶性肿瘤之一[7],直肠癌淋巴结转移模型是研究肿瘤发生、发展、转移及抗肿瘤治疗的工具[8-10]。据文献报道,主要有以下几种方式。化学诱发模型,即使用化学致癌物通过灌肠和口服等使实验动物发生结直肠癌,但致癌物质诱癌过程需时较长[11-12],肿瘤发生的潜伏期个体变异大,不易同时获得肿瘤大小较均一的动物模型[13]。转基因动物肿瘤模型,是利用分子生物学手段,对实验动物基因进行改造或修饰,从而培育出相应肿瘤的动物模型[14]。但目前对于癌基因及抑癌基因还有待深入研究,所以这种建模方法目前并不实用,只能作为一种研究方向。还有一种就是移植性肿瘤模型,是目前应用最多的动物实验模型。它是将外源性肿瘤的瘤块或细胞移植到实验动物体内生长,从而形成肿瘤,此方法因其成瘤率高而被广泛使用。按照移植部位不同,又可分为原位移植、皮下移植[15],这两种移植方式也最为多见。为了尽可能模拟直肠癌自然生长、局部浸润及转移的过程,从而产生与人直肠癌类似的生物学特征,因此此次造模选择了原位移植的方式。
原位移植根据移植方法的不同又可以分为细胞移植和组织块移植。细胞移植是将一定浓度的体外培养的细胞悬液注射在动物相应部位,不少学者已使用此方法成功制作出直肠癌模型[16-17]。在前期的预实验中,笔者也尝试此种方法,亦成功制作出直肠癌模型,并出现淋巴结转移,但是,由于使用针筒注射时往往因阻力不均及术者用力不均或手法不娴熟,出现细胞悬液外漏的情况或注射入实验兔肠壁的细胞悬液差异较大,在相同的生长时间内,肿瘤体积差异较大。
组织块移植是以将瘤组织小块接种的方法将肿瘤原位植入动物体内,通过原位移植的肿瘤组织细胞完整,且细胞间的协同性好,模型的生物学行为较为稳定。文献最常报道的是裸鼠的原位移植,众所周知,裸鼠体积小,麻醉及手术对裸鼠造成的创伤大,术后可能发生肠梗阻[18],进行肿瘤原位移植时需要娴熟而精准的外科操作,对手术器械的选择要求也高,手术时间不宜过长,因此对于无外科基础及初学者来讲相对困难。此次笔者尝试选用了体积较大、易进行操作的新西兰大白兔。
本实验选用的移植瘤为VX2肿瘤,VX2肿瘤细胞株起源于shope病毒诱发的兔乳头状瘤的鳞癌,经过72次移植传代后正式建立株,命名为VX2,由于兔缺乏针对该肿瘤的抗体,因此可作为稳定可移植的肿瘤细胞株,具有生长迅速、侵袭力强、血供丰富及早期即可发生转移的优势;但此肿瘤为鳞癌,因此与人类直肠腺癌相比更易发生坏死。目前有移植到兔的肾脏、肝脏等部位制成的原位肿瘤动物模型的报道。
本组成模率为65%,VX2肿瘤原位移植术后,我们通过观察MR扫描后图像判断是否成瘤,CT扫描也可用于观察,但是CT软组织分辨率不高,肿瘤较小时观察会有局限性;兔子肛门较小,超声探头难以进入,故超声也不作为观察工具,目前尚无在接种后短期内判断是否成瘤的方式,如何尽早判断成瘤,也是本课题组之后研究的重点。但是通过本实验小组的观察,若第4、5周行MR检查未在实验兔直肠上观察到肿瘤,则说明造模失败。此次造模部分未能成功,分析原因可能为:① 瘤块自身活性低,移植后不易生长;② 兔直肠壁薄,未能将瘤块移植入实验兔肠壁;③ 将瘤块植入直肠壁后,OB胶封闭不严。因此在以后的造模过程中,我们通过以下方式进行改善:① 尽可能选取肿瘤边缘生长旺盛的部位,取其最质韧部分;② 尽可能多地训练移植术,增加成功概率;③ 使用OB胶封闭穿刺口0.5 h后,进行第2次涂抹,以防封闭不严。
在VX2肿瘤原位移植术后,无实验兔因手术创伤而死亡。恶性肿瘤的生长速度快慢取决于细胞周期的长短、增殖比例及其他因素等综合作用,大多数恶性肿瘤的生长速度不是恒定不变的,而是交错出现迅速生长和相对的稳定的状态。本次建模过程中VX2移植瘤生长速度较快,在相同的生长周期内,不同实验兔个体间肿瘤体积虽然存在差异,但总体上看来肿瘤体积随着时间推移而不断增大且呈正相关。移植瘤较易观察,实验兔一般状况尚可。第6周后肿瘤中心开始坏死,后期肿瘤浸润盆腔组织,出现相应的并发症,部分实验兔衰竭死亡。
此次建模最终目的是观察VX2移植性兔直肠癌是否能发生肠周淋巴结转移,在成功接种移植瘤的前5周内未出现转移性淋巴结,自第6周开始出现转移性淋巴结,直至第10周,出现8枚以上转移性淋巴结。转移性淋巴结个数也与肿瘤体积呈正相关。第9周之前,MR上诊断为转移性淋巴结的结节经病理证实均为转移性淋巴结。病理证实第9、10周亦出现癌结节,但在MR观察时,此结节在T2WI上表现为不均匀高信号,形态饱满,边缘毛糙,误认为是转移性淋巴结,出现假阳性,但在MR上两者较难鉴别。
本实验将组织学完整的VX2移植瘤组织块原位种植到新西兰大白兔直肠内,成功地建立了VX2移植性兔直肠癌的淋巴结转移模型。在移植后第4~7周,肿瘤生长迅速,以肿瘤本身生长为主,且质地均匀,若仅仅是以研究直肠肿瘤本身而言,此时期为最佳研究时期。在移植后第6周直肠肿瘤周围开始出现转移性淋巴结,因此对研究直肠癌淋巴结转移这一内容而言,移植第6周后为最佳研究时期。直肠癌周围转移性淋巴结,自移植后第7周开始T2信号不均匀。综上所述,此模型对于研究直肠癌的局部生长、浸润机制、淋巴结转移灶及生物学特性均有一定价值。学者们可以根据不同的实验要求(观察肿瘤本身还是转移性淋巴结),选择移植后不同生长时期的实验兔进行研究。
理想的直肠癌淋巴结转移模型应具备以下几个特点:① 尽可能模拟人类直肠癌生长、浸润及转移过程;② 造模成功率高,动物模型一般情况好且存活时间较长;③ 模型的建立不仅可行而且具有可重复性的特点。虽然,此次模型模拟了直肠癌淋巴结转移,但也不能满足上述标准。各种建立模型的方法都有优缺点,应该根据自己的需要选择适合的动物模型。
[1] SPILIOTIS J, DATSIS A. The surgical approach to locally recurrent rectal cancer. [J]. Tech Coloproctol, 2004,8(Suppl 1): s33-s35.
[2] SLEEMAN J P. The lymph node as a bridgehead in the metastatic dissemination of tumors [J]. Recent Results Cancer Res, 2000, 157: 55-81.
[3] MINICOZZI A M, CONTI G, MERIGO G, et al. A new model of rectal cancer with regional lymph node metastasis allowing in vivo evaluation by imaging biomarkers[J]. Biomed Pharmacother, 2011, 65(6): 401-406.
[4] FIDLER I J. Critical factors in the biology of human cancer metastasis: twenty-eighth G. H. A. Clowes memorial award lecture[J]. Cancer Res, 1990, 50(19): 6130-6138.
[5] 鲍 晓, 程竞仪, 章英剑. 分子影像学肿瘤疗效评价标准及应用[J]. 肿瘤影像学, 2014, 23(3): 165-171.
[6] 王荣福. 多模态影像技术在肿瘤诊治中的应用进展[J].肿瘤影像学, 2013, 22(4): 292-295.
[7] 南宇乐, 鹿 彤, 张 林, 等. 18F-FDG符合线路显像在结直肠癌诊断中的临床价值[J]. 肿瘤影像学, 2013, 22(3): 211-213.
[8] TSUTSUMI S, KUWANO H, MORINAGA N, et al. Animal model of para-aortic lymph node metastasis[J]. Cancer Lett, 2001, 169(1): 77-85.
[9] FLATMARK K, MAELANDSMO G M, MARTINSEN M, et al. Twelve colorectal cancer cell lines exhibit highly variable growth and metastatic capacities in an orthotopic model in nude mice[J]. Eur J Cancer, 2004, 40(10): 1593-1598.
[10] SASAKI H, MIURA K, HORII A, et al. Orthotopic implantation mouse model and cDNA microarray analysis indicates several genes potentially involved in lymph node metastasis of colorectal cancer[J]. Cancer, 2008, 99(4): 711-719.
[11] 李宇华, 刘 莉, 冯 娟, 等. 一种结肠炎相关的结肠癌模型的复制[J]. 世界华人消化杂志, 2007, 15(3): 234-239.
[12] 唐伟军, 吴志勇, 喻德洪. 结直肠癌的实验模型[J]. 中华实验外科杂志, 2000, 17(4): 380-383.
[13] BERGER M. Is there a relevance for anticancer drug development: Relevance of tumour models for anticancer drug development, contributions to oncology [M]. HH fiebig: BA burger, Basel, karger, 1999: 15-27.
[14] YU Y, SUN P, SUN L C. Downregulation of MDM2 expression by RNAi inhibits LoVo human colorectal adenocarcinoma cells growth and the treatment of LoVo cells with mdm2siRNA3 enhances the sensitivity to cisplatin[J]. Biophys Res Commun, 2006, 339(1): 71-78.
[15] HOFFMAN R M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic[J]. Invest New Drugs, 1999, 17(4): 343-359.
[16] 李 霞, 张西臣, 李建华, 等. 小鼠结肠癌皮下转移模型的建立[J]. 中国兽医学报, 2008, 28(9): 1074-1076.
[17] 周 琪, 梁后杰, 阎晓初, 等. 人结肠癌裸鼠原位移植瘤模型的建立[J]. 重庆医学, 2007, 36(19): 1929-1931.
[18] 叶尔买克, 唐沙哈尔, 汪 洋, 等. 人结直肠癌裸鼠原位移植模型的建立及生物学特性的研究[J]. 国际外科学杂志, 2015, 42(2): 90-92.
Lymph node metastatic models of VX2 tumor in New Zealand white rabbits and their biological
characteristics
SUN Yiqun1, TONG Tong1, MAO Jian1, ZHONG Fangfang2, GU Yajia1
(1.Department of Radiology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College,Fudan University, Shanghai 200032, China; 2.Department of Pathology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
Correspondence to: GU Yajia E-mail: cjr.guyajia@vip.163.com
Background and purpose: The lymph node metastatic model of rectal tumor is a useful tool for the research on tumor occurrence, development, metastasis and antineoplastic therapy. There are few reports about establishment of larger animal model. This study aimed to establish feasible and reproducible lymph node metastatic models of VX2 tumor in rabbits. Methods: The VX2 tumor tissue was put into the puncture needle. The VX2 tumor tissue in the needle was orthotopically transplanted into the rectal wall of the New Zealand white rabbits successfully. Twenty New Zealand white rabbits were transplanted. Two experimental rabbits were scanned by MR weekly. Tumor growth curve and lymph node numbers were observed on MR. Experimental rabbit tumor volumes were measured by MR post-processing software. The rectal tumor and surrounding lymph nodes were resected, and the specimens were fixed. The sections were stained with HE. We explored the relationship between tumor volume and growth time,the number of metastatic lymph nodes and tumor volume, respectively. Results: Thirteen models were successfully established with a rate of 65%. Tumors limited in the rectal wall were observed on the fourth week. Tumor sizeincreased over time. There was significant difference in the tumor volume between different periods (growth cycle number) (F=52.865, P<0.05). There was a significantly positive correlation between tumor volume and the growth cycle number (r=0.910, P<0.05). The metastatic lymph nodes could be observed when VT>9 cm3. The number of metastatic lymph node increased obviously from the ninth week. The more tumor volume, the greater the number of metastatic lymph nodes was observed (F=92.531, P<0.05). There was a significantly positive correlation between the number of metastatic lymph nodes and the tumor volume (r=0.945, P<0.05). Conclusion: Metastatic lymph node models of VX2 tumor in New Zealand white rabbits were established successfully. This model has some value in the research on local growth, invasion mechanism, lymph node metastasis and biological characteristics of rectal cancer.
Model; Rectal cancer; Metastatic lymph node
10.19401/j.cnki.1007-3639.2016.10.006
R735.3
A
1007-3639(2016)10-0840-08
顾雅佳 E-mail: cjr.guyajia@vip.163.com
(2015-07-14
2015-11-19)
