肝细胞性肝癌中磷酸化PED/PEA-15和P-p27T187的表达及临床意义
2016-11-11吴益峰朱柯磊陈磊王静文蒋存兵李定耀陈明良
吴益峰,朱柯磊,陈磊,王静文,蒋存兵,李定耀,陈明良
肝细胞性肝癌中磷酸化PED/PEA-15和P-p27T187的表达及临床意义
吴益峰,朱柯磊,陈磊,王静文,蒋存兵,李定耀,陈明良
目的探讨磷酸化蛋白PED/PEA-15(s-116)和P-p27T187在肝细胞性肝癌中的表达,揭示两者在肝细胞肝癌发生发展及转移中的可能作用机制。方法应用免疫组织化学和Western印迹检测40份(40例患者)肝细胞性肝癌和相应癌旁组织(距离肿瘤边缘2 cm以外)及12份(12例患者)正常肝组织中PED/ PEA-15(s-116)和P-p27T187的表达,分析其与临床病理特征的关系,并采用Spearman秩相关法分析两者之间的相关性。结果肝细胞性肝癌组织中PED/PEA-15(s-116)和P-p27T187蛋白的表达均明显高于癌旁组织和正常肝组(均P<0.05)。PED/PEA-15(s-116)、P-p27T187的表达与病理分级、临床分期及有无门静脉癌栓均有关(均P<0.05);而与发病年龄、性别、肿瘤大小、肿瘤数目及甲胎蛋白(AFP)水平等均无关(均P>0.05)。PED/PEA-15(s-116)和P-p27T187蛋白在肝细胞性肝癌中的表达呈正相关(r=0.056,P<0.05)。结论PED/PEA-15(s-116)和P-p27T187在肝细胞肝癌中呈高表达,与肝癌的发生、发展及转移相关并有可能成为肝细胞性肝癌基因治疗的新靶点。
肿瘤;肝细胞性癌;PED/PEA-15(s-116);P-p27T187
[Modern Practical Medicine,2016,28(9):1134-1138]
肝细胞性肝癌(HCC)是恶性程度极高、预后极差的恶性肿瘤之一[1-2],目前对其发生、发展、转移和复发的精确分子机制尚不完全清楚。PED/PEA-15是一种广谱抗凋亡蛋白质,在肿瘤的形成过程中发挥着重要的作用,其通过调控凋亡关键因子[如天冬氨酸特异性半胱氨酸蛋白酶(caspases)]介导的信号传导通路而阻断凋亡途径,从而抑制细胞凋亡,促进细胞增殖。p27蛋白属于细胞周期蛋白依赖性激酶抑制因子(CDKI)家族成员,参与调节细胞增殖、凋亡及分化等,p27的磷酸化可导致细胞内p27蛋白水平下降,引发细胞周期调控紊乱并促进细胞异常增殖,抑制细胞的凋亡[3]。本研究采用免疫组织化学及Western免疫印迹研究磷酸化PED/PEA-15和P-p27T187在肝细胞性肝癌的表达情况,对比研究两者的相关性,分析揭示其肝细胞肝癌发生、发展、转移和复发中的可能作用机制。现将结果报道如下。
1 资料与方法
1.1一般资料收集宁波大学医学院附属鄞州医院2012年10月至2015年12月手术切除的40份(40例患者)HCC组织及相应的癌旁组织(距肿瘤边缘2 cm以外,切缘经病理证实未见癌细胞),其中男25例,女15例;年龄30~71岁,平均(47.6±10.0)岁。按照Edmondson分级标准:Ⅰ级10例,Ⅱ级12例,Ⅲ级15例,Ⅳ级3例;高中分化21例,低分化19例。所有病例均经术后病理学证实,术前未接受放疗、化疗等干预措施。另收集同期肝血管瘤旁和肝外伤正常肝组织12份(12例患者)作为正常对照组。标本采集后立即将组织块用0.9%氯化钠注射液进行反复清洗,以去除血液,并尽可能剪去多余的其他组织,置于-80℃冰箱保存。标本采集均通过伦理委员会讨论同意。
1.2主要试剂及材料兔抗人多克隆抗体PED/ PEA-15(s-116)和P-p27T187购于美国santaCrus公司,兔抗人多克隆抗体actin购于美国santaCrus公司,山羊抗兔二抗购于美国santaCrus公司。免疫印迹化学发光试剂(ECL)购于上海碧云天生物技术有限公司。蛋白质电泳与电转移装置(美国Bio-Rad公司)。
1.3方法
1.3.1免疫组织化学定位和半定量检测PED/ PEA-15(s-116)和P-p27T187的表达标本经4%中性甲醛固定,常规石蜡包埋,切片厚0.4m,常规HE染色,光镜下行细胞形态学观察,确定病理诊断、分组及细胞定位。免疫组化染色采用Elivison二步法检测PED/PEA-15(s-116)和P-p27T187表达情况,按试剂盒说明操作。以PBS代替一抗、二抗做阴性对照。
1.3.2Western免疫印迹定量检测PED/PEA-15(s-116)和P-p27T187的表达取约50mg组织液氮研磨后,加入1 ml预冷组织裂解液(10 mmol/L Tris-HCl,1%Triton X-100,1 mmol/L EDTA,1 mmol/L EGTA,1 mmol/L PMSF,65 mmol/L DTT,30 mol/L焦磷酸钠,50 mmol/L NaF,1 mmol/L Na3VO4,2% CocKtail),冰上静置1h,4℃低温12000转离心30min,取上清液,考马斯亮兰法测定蛋白浓度。取10g蛋白样品加入1/4样品体积的5×上样缓冲液,100℃煮5min变性后,结合临床资料按因素进行实验分组并分别进行实验,严格控制实验误差在有效范围内。行12%聚丙烯酰胺凝胶(SD-PAGE)电泳分离蛋白质,电转移法将蛋白质转移到NC膜,用含5%脱脂牛奶的TBS封闭2h,加入一抗(P-p27T187以1∶300稀释),4℃冰箱中过夜,TBST液洗膜15 min×3次,加入二抗中(1∶5 000稀释),反应1 h,TBST洗膜15min×3次后作ECL化学发光,X片(Kodak)曝光显影,利用凝胶成像仪灰度分析软件QuantityOne进行光密度值分析测定目的显影条带和内参照Actin的光密度OD值,结果以比值(样本光密度OD值/内参光密度OD值)表示。
1.4免疫组化结果判定PED/PEA-15(s-116)和P-p27T187在免疫组化中的阳性表达体现为细胞内棕黄色颗粒样物质的沉积,根据显色强度判断其阳性程度:标本无色为0分;淡黄色为1分,棕黄色为2分,棕黑色、棕褐色为3分。根据阳性细胞数在观察细胞中所占的比例分为:无阳性细胞为0分;阳性细胞数≤10%为1分;11%~50%为2分;51%~75%为3分;>75%为4分。染色强度与阳性细胞百分比的乘积>3分为阳性[4]。
1.5统计方法采用SPSS17.0统计分析软件进行数据分析和统计学处理,率的比较采用2检验;计量资料以均数±标准差表示,两组比较用t检验,指标之间用Spearman秩相关法进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1HCC/癌旁组织及正常肝组织中PED/PEA-15(s-116)、P-p27T187表达PED/PEA-15(s-116)、P-p27T187蛋白阳性表达均定位于细胞质内,为粗细不一的棕黄色颗粒样物质(封三彩图1~2)。40份HCC组织中PED/PEA-15(s-116)(29份,72.5%)和P-p27T187(31份77.5%)的阳性表达率均明显高于癌旁组织和正常肝组织(2≥11.95,均P<0.05);蛋白定量分析结果提示肝细胞性肝癌中PED/PEA-15(s-116)、P-p27T187蛋白的表达明显高于癌旁组织和正常肝组织(t≥15.64,均P<0.05)。见表1。
2.2PED/PEA-15(s-116)、P-p27T187表达与HCC临床病理特征的关系PED/PEA-15(s-116)、P-p27T187的表达与病理分级、临床分期及有无门静脉癌栓均有关(均P<0.05);而与发病年龄、性别、肿瘤大小、肿瘤数目及甲胎蛋白(AFP)水平等均无关(均P>0.05)。表2。
2.3肝细胞性肝癌中PED/PEA-15(s-116)、P-p27T187表达的相关性分析PED/PEA-15(s-116)和P-p27T187蛋白的表达呈正相关(r=0.056,P<0.05)。
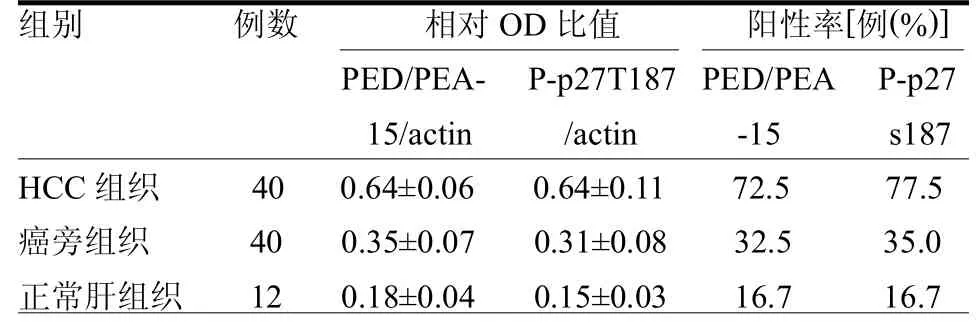
表1 PED/PEA15(s-116)、P-p27T187在HCC、癌旁及正常肝组织的表达
3 讨论

表2 PED/PEA15(s-116)、P-p27T187的表达与HCC临床病理特征关系
细胞凋亡是一种程序性细胞死亡,不仅对细胞生长、分化和维持机体稳态有很重要的作用,而且还可以通过清除变异的细胞和改变基因表达来阻止细胞发生转化,而细胞凋亡信号传导通路的调控往往发生在基因转录后阶段,通过蛋白质修饰来发挥其生物学效应,蛋白质的磷酸化和去磷酸化过程调节着细胞生长、细胞分化、细胞信号转导及细胞凋亡等几乎所有的生命活动。如果凋亡被抑制,发生基因突变的细胞就会得以继续生存,从而导致肿瘤的发生、发展和转移。因此,细胞凋亡调控的紊乱与细胞的恶性转变具有十分密切的关系。近年来,随着细胞凋亡信号传导通路研究的不断深入,凋亡相关因子的作用及其特异性调控机制已成为肿瘤发生、发展、转移及治疗研究的靶点[5],其中转录后阶段的蛋白质磷酸化修饰扮演着重要的作用[6]。因此,深入探讨磷酸化蛋白PED/PEA-15(s-116)、P-p27T187在凋亡信号传导通路中的作用,对肿瘤的发生、发展及转移机制的研究具有重要意义。
PED/PEA-15是从II型糖尿病患者的组织中克隆得到,属于IAPs家族成员[7],是一种具有广谱抗凋亡功能的小分子蛋白质(分子量15kD),由131个氨基酸组成,其前80个氨基酸形成规范的“死亡效应区(DED)”;后51个氨基酸形成结构不规则的C末端尾(含有磷酸化位点)。PED/PEA-15主要参与细胞增殖、分化、细胞信号转导、细胞周期和凋亡的调控以及葡萄糖转运过程,与肿瘤的发生、发展和转移密切相关,在多种肿瘤中表达上调[8-10]。研究表明[8-12],磷酸化PED/PEA-15(s-116)可通过其DED区域与其他含有该区域的蛋白相结合,从而抑制死亡诱导复合体(DISC)形成,使caspase-8、caspase-10等信号传导分子失活,阻止caspase系统的级联激活,从而阻断凋亡过程,抑制肿瘤细胞的凋亡,促进肿瘤的发生、发展和转移;磷酸化PED/PEA-15也可通过结合细胞外信号调节酶(ERK),通过ERK-MAP信号传导通路调节细胞增殖,最终抑制caspase的级联激活,阻断细胞凋亡过程,发挥其抑制凋亡的生物学效应。
p27蛋白属于CDKI家族成员,由198个氨基酸组成,是一种高度保守的蛋白质分子,其进入细胞核后,通过其N末端的CDK结合区,结合cyclin和CDK,能够抑制Cyclin-CDK复合物的激酶活性,阻碍细胞周期由G1期进入S期,使细胞周期停滞,抑制细胞的增殖,对细胞的生长起负向调控作用,从而促进细胞凋亡[13]。研究表明,p27蛋白水平和功能的障碍可严重损害细胞周期的“制动”机制,导致正常细胞的恶性转化,多种肿瘤中均存在p27蛋白的表达下调或功能障碍[14-16],然而,p27蛋白在基因水平极少发生缺失或突变,在细胞周期中保持稳定,因此,其在蛋白水平的表达修饰及其在亚细胞中的分布改变可能与肿瘤的发生发展相关,本研究发现在P-p27T187定位于HCC细胞的细胞质中,并在HCC细胞中呈高表达(P<0.05),其可能作用机制为在HCC的发生过程中,p27蛋白发生磷酸化后由胞核转移到胞质,改变了亚细胞定位,启动了Skp2分子介导的泛素/蛋白酶体降解途径,促进p27的多聚泛素化及随后的蛋白酶体降解,从而引发细胞周期调控紊乱,抑制细胞凋亡,促进细胞异常增殖,加快肿瘤细胞的播散与侵袭,因此p27基因转录后阶段的磷酸化修饰有着重要的作用,P27-T187可降低p27蛋白的表达水平及干扰细胞周期稳定,通过AKT/ ERK-MAP信号传导通路,调节细胞增殖,最终抑制caspase的级联激活,阻断细胞凋亡过程,发挥其促进肿瘤细胞增殖及转移的生物学效应。
本研究中免疫组织化学及Western免疫印迹结果显示,磷酸化蛋白PED/PEA-15(s-116)和P-p27T187在肝细胞性肝癌组织中的表达强度均明显高于癌旁组织和正常组织,提示PED/PEA-15(s-116)和P-p27T187在HCC的发生、发展中发挥了重要作用,其机制可能在HCC的发生进展过程中,PED/ PEA-15(s-116)、p27T187的过表达参与了细胞凋亡过程,通过相关的细胞信号传导通路,参与调节细胞的凋亡,发挥其抗凋亡作用,导致基因突变的积聚,促进细胞的异常增殖及恶性转化。这表明基因转录后阶段的磷酸化修饰是细胞凋亡信号传导通路的重要组成部分,其可调控、干扰甚至阻断信号传导通路,抑制细胞的正常凋亡及分化,促进其增殖,与肿瘤的发生发展有着密切的关系。本研究还发现PED/ PEA-15(s-116)和P-p27T187蛋白的表达与HCC患者的发病年龄、性别、肿瘤大小、肿瘤数目、AFP水平大小无关;而与HCC的Edmondson病理分级、临床分期及转移相关,肿瘤分化程度越低、临床晚期及有门静脉癌栓的HCC组织中表达强度逐渐增强。提示PED/PEA-15(s-116)和P-p27T187对HCC的发生发展及转移可能具有促进作用,此外,HCC组织中PED/PEA-15(s-116)和P-p27T187蛋白的表达呈正相关,提示两者在抗凋亡作用中发挥着协同作用。
总之,磷酸化蛋白PED/PEA-15(s-116)和P-p27T187与HCC的发生发展密切相关,二者可能通过细胞信号传导通路共同参与了细胞的凋亡过程,并协同抑制HCC细胞的凋亡,本研究结果为今后进一步深入研究二者在HCC发生、发展及转移中的相互作用机制奠定了有利基础。磷酸化蛋白PED/ PEA-15(s-116)和P-p27T187可能成为肝细胞肝癌临床治疗和药物研发的新靶点。
[1]ParkinDM,BrayF,FerlayJ,et al.Globalcancerstatistics[J].CACancer J Clin,2002,55:74-108.
[2]Llove JM,Burroughs A,Bruix J.Hepatocellular carcinoma[J].Lancet,2003,362:1907-1917.
[3]Lee JG,Kay EP.Two populations of p27 use differential kinetucs tophosphorylate Ser-10andThr-187viaphosphatidylinositol 3-Kinase in response to fibroblast growth factor-2 stimulation[J].J Biol Chem,2007,282:6444-6454.
[4]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志.1996,6(4):229-231.
[5]Wang KW,Lin BL.Inhibitor of apoptosis proteins(IAPs)as regulatory factors of hepatic apoptosis[J].Cellular signalling(Cell Signal),2013,25(10):1970-1980.
[6]Caino MC,Altieri DC.Molecular path-ays:mitochondrial reprogramming in tumor progression and therapy[J].Clinical cancer research:an official journal of the American Association for Cancer Research,2016,22(3):540-545.
[7]Condorelli G,Vigliotta G,IavaroneC,et al.PED/PEA-15genecon trolsslucosetransport andisoverexpressedintype2diabetesmellitus[J].EMBO J,1998,17:3858-3866.
[8]Verena F,Lehmann-Koch J,Bickeboller M,et al.The PEA-15/PED protein regulates cellular survival and invasiveness in colorectal carcinomas[J].Cancer Lett,2013,335:431-440.
[9]BartholomeuszC,Gonzalez-Angulo AM,KazanskyA,et al.PEA-15 inhibitstumorigenesisinanMDA-MB-468triple-negativebreastcancer xenograft model through increased cytoplasmic localization of activated extracellular signal-regulated kinase[J].Clin Cancer Res,2010, 16(6):1802-1811.
[10]Bartholomeusz,C Gonzalez-AnguloAM,LiuP,etal.HighERKprotein expression levels correlate with shorter survival in triple-negative breast cancer patients[J].Oncologist,2012,17:766-774.
[11]Mace1 PD,Wallez Y,Egger MF,et al.Structure of ERK2 bound to PEA-15 reveals a mechanism for rapid release of activated MAPK[J].Nature Communications,2013,4(2):1681-1681.
[12]Lee S,Warthaka M,Yan CL,et al.Examining Docking Interactions on ERK2 with Modular Peptide Substrates[J].Biochemistry,2011,50(44):9500-9510.
[13]Chu IM,Hengst L,SlingerlandJM.TheCdkinhibitor P27inhuman cancer:prognostic potential and relevance to anticancer therapy[J]. Nat Rev Cancer,2008,8:253-267.
[14]Luo LL,ZhaoL,Wang YX,et al.Insulin-like growth factor binding protein-3isanewpredictor of radiosensitivityon esophageal squamous cell carcinoma[J].Scientific reports,2015,5:17336.
[15]Liu DZ,Zhang HY,Long XL,et al.MIR-150 promotes prostate cancer stem cell development via suppressing p27Kip1[J].European reviewformedicalandpharmacologicalsciences,2015,19(22):4344-4352.
[16]Yasunobu M.Molecular mechanism underlying the functional loss of cyclindependent kinase inhibitors p16 and p27 in hepatocellular carcinoma[J].World J Gastroenterol,2008,14(11):1734-1740.
(本文编辑:姜晓庆)
Express and clinical significance of phosphoryprotein PED/PEA-15 and P-p27T187 in hepatocellular carcinoma
WUYifeng,ZHUKelei,CHENLei,WANGJingwen,LIDingyao,CHENMingliang.(Yinzhou HospitalAffiliated to Ningbo university,Ningbo 315040,Zhejiang,China)
Corresponding author:CHEN Mingliang,Email:wyf5495@163.com
ObjectiveTo investigate the expression of phosphoryprotein PED/PEA-15(s-116)and P-p27T187 in hepatocellular carcinoma(HCC),and to reveal the possible action mechanism of carcinogenesis and cancerometastasis in HCC.MethodsThe protein expressions of PED/PEA-15(s-116)and P-p27T187 were detected by immunohistochemistry and Western blot in resected liver tumor tissues and corresponding adjacent noncancerous tissues from 40 HCC patients and normal liver tissues from 12 patients with benign lesions,their relationship with HCCwas analyzed by Spearman rank correlation.ResultsThe protein expressions of PED/PEA-15(s-116)and P-p27T187 were significantly higher than those in adjacent tissues and normal tissues(all P<0.05),and they were significantly associatedwiththepathologicalgrade,clinicalstageandmetastasizeofHCC(allP<0.05).Howevertherewasnosignificant correlation with age,gender,size oftumor,numbers oftumorand alpha fetoprotein(AFP)level(allP>0.05).Spearman rank correlation analysis showed that PED/PEA-15(s-116)was correlated with P-p27T187 in HCC tissues(r=0.056,P<0.05).ConclusionsPED/PEA-15(s-116)and P-p27T187 are highly expressed in HCC,which are associated with the occurrence,development and metastasis of HCCand may become a newtarget for gene therapy of HCC.
Hepatocellular carcinoma;PED/PEA-15(s-116);P-p27T187
10.3969/j.issn.1671-0800.2016.09.005
R735.7
A
1671-0800(2016)09-1134-05
宁波市科技计划(201401C5010016)
315040宁波,宁波大学医学院附属鄞州医院(吴益峰、朱柯磊、陈磊、蒋存兵、李定耀、陈明良);大连医科大学(王静文)
陈明良,Email:wyf5495@163.com
2016-03-11
