吞噬细胞运动蛋白1在IL-8诱导的乳腺癌细胞的侵袭和转移中发挥重要作用
2016-11-08张长杰徐新伟李洪利刘雨清尹崇高
张长杰,徐新伟,李洪利,刘雨清,尹崇高
(潍坊医学院1.病理学教研室、2.医学研究实验中心、3.护理学院,山东 潍坊 261053)
吞噬细胞运动蛋白1在IL-8诱导的乳腺癌细胞的侵袭和转移中发挥重要作用
张长杰1,徐新伟1,李洪利2,刘雨清1,尹崇高3
(潍坊医学院1.病理学教研室、2.医学研究实验中心、3.护理学院,山东 潍坊261053)
目的探讨吞噬细胞运动蛋白1(engulfment and cell motility 1, ELMO1)在IL-8诱导的乳腺癌细胞侵袭和转移过程中的作用。方法采用趋化运动实验检测不同浓度IL-8刺激下乳腺癌细胞的趋化运动能力;采用Western blot检测乳腺癌细胞中ELMO1的表达情况;利用小RNA干扰技术,瞬时转染乳腺癌细胞MDA-MB-231,用过表达质粒上调乳腺癌细胞MCF-7中ELMO1的表达;应用趋化运动实验和Transwell侵袭实验检测各组转染细胞的趋化和侵袭能力。结果趋化运动实验结果显示,在IL-8刺激下,乳腺癌细胞MDA-MB-231和MCF-7的运动能力明显增强,具有剂量依赖性;Western blot结果显示ELMO1在siELMO1/MDA-MB-231细胞中的表达明显降低,而在MCF-7/ELMO1细胞中的表达明显增高;趋化运动实验结果显示在IL-8刺激下,SiELMO1/MDA-MB-231细胞组的趋化运动能力明显降低,MCF-7/ELMO1细胞组的趋化运动能力明显增强;Transwell侵袭实验结果显示在IL-8刺激下,敲除ELMO1明显降低MDA-MB-231细胞的侵袭能力,过表达 ELMO1明显增强MCF-7细胞的侵袭能力。结论IL-8能促进MDA-MB-231和MCF-7细胞的趋化运动和侵袭能力,而ELMO1在IL-8诱导的乳腺癌细胞趋化和侵袭作用中发挥重要作用。
乳腺癌;IL-8;ELMO1;侵袭;转移;趋化运动
乳腺癌(breast cancer,BC)是世界范围内严重危害女性健康的恶性肿瘤,具有高转移率和高复发率,肿瘤细胞从原发病灶脱落,浸润周围组织及发生远处转移是乳腺癌难以治愈的关键[1]。白细胞介素8(interleukin-8,IL-8)主要由单核细胞和内皮细胞分泌,能激活细胞表面趋化因子受体的多个细胞内下游信号通路,其分泌在正常细胞中受到严格控制[2],Zuccari等[3]利用免疫组织化学技术检测72例乳腺癌标本,结果发现IL-8在乳腺癌中的表达高于正常乳腺组织。IL-8表达增多具有促进血管生成和肿瘤形成的功能,参与肿瘤的发生、发展和转移过程。吞噬细胞运动蛋白1(engulfment and cell motility 1, ELMO1)是进化上非常保守的一种蛋白质,主要介导细胞的吞噬、移动和形态改变,ELMO蛋白在肌动蛋白细胞骨架和微管网络中发挥重要作用,调节细胞运动能力[4]。在乳腺癌细胞水平上,利用基因沉默技术降低ELMO1蛋白的表达能够抑制乳腺癌细胞迁移、趋化运动和侵袭能力[5]。众多研究表明IL-8和ELMO1均与乳腺癌细胞的侵袭和转移密切相关,而目前对于ELMO1在IL-8诱导的乳腺癌侵袭和转移中的作用尚未见报道。因此,本实验利用小RNA干扰技术和过表达质粒分别下调和上调乳腺癌细胞中ELMO1蛋白的表达,通过体外侵袭实验和趋化运动实验检测转染后MDA-MB-231细胞和MCF-7细胞在IL-8诱导下的侵袭和运动能力的变化,从而探讨IL-8及ELMO1在乳腺癌侵袭和转移中的作用及可能的分子机制。
1 材料与方法
1.1材料
1.1.1主要试剂β-actin购自北京中杉金桥生物技术有限公司;兔抗ELMO1单抗购自武汉三鹰生物技术有限公司;RPMI 1640培养基购自上海拜力生物科技有限公司;胎牛血清购自赛默飞世尔生物化学制品(北京)有限公司;胰蛋白酶购自北京索莱宝公司;彩色预染蛋白P0068购自上海碧云天公司;无内毒素质粒中量提取试剂盒购自康为世纪;Lipofectamine 2000脂质体转染试剂购自Invitrogen公司,侵袭试验所用小室购自康宁公司,基质胶(Matrigel)购自碧迪医疗器械(上海)有限公司。
1.2方法
1.2.1细胞培养乳腺癌细胞MDA-MB-231和MCF-7在含10% FBS的RPMI 1640培养基,37℃,5% CO2培养箱培养。细胞传代3次以上,在对数生长期进行实验。
1.2.2细胞转染将细胞悬液均匀铺于6孔板中培养过夜,细胞长到约70%,按照Lipofectamine 2000的使用说明书进行操作。用于转染的ELMO1特异性小RNA干扰质粒及过表达质粒由上海吉凯基因化学技术有限公司构建。
1.2.3Western blot将培养的细胞裂解提取蛋白,制备SDS-PAGE凝胶,用移液器加入等量所提各组蛋白,电泳、转膜、封闭,加入一抗ELMO1(1 ∶500)、β-actin(1 ∶1 000)孵育过夜,洗膜,二抗(1 ∶5 000)孵育后显影,曝光。
1.2.4趋化运动实验将对照细胞和经过处理的细胞分别重悬于RPMI 1640培养液中,细胞计数(5×108·L-1)。在趋化小室下层中加入趋化因子IL-8,含10% FBS的RPMI 1640培养基500 μL,将细胞悬液200 μL加入上层中,然后将趋化小室放入37℃,5% CO2培养箱,培养24 h后,将滤膜上层细胞用棉签擦去,下室固定、洗涤并染色。高倍镜(400×)下观察,随机计数3个高倍镜视野下穿过人工基膜的细胞数,每个实验重复3次,取平均数作为实验结果。
1.2.5Transwell细胞侵袭实验按文献操作[6],应用8 μm滤膜transwell小室,铺一层人工基质胶(matrigel)室温下干燥。将胰酶消化后重悬的各组细胞悬液(5×108·L-1)200 μL分别加入小室上室中。下室加入500 μL含10% FBS的RPMI 1640培养基,加入或不加入100 μg·L-1IL-8。37℃,5% CO2培养24 h。弃去培养基,用棉签擦尽上室面的人工基质胶和细胞,下室面固定染色。每孔随机取5个高倍镜(400×)视野,计数下室面的细胞数即为穿透人工基底膜的细胞数,每个实验重复3次,取平均数作为实验结果。
2 结果
2.1IL-8刺激影响乳腺癌细胞MDA-MB-231和MCF-7的趋化运动能力用1、10、50、100 μg·L-14种不同剂量的IL-8刺激乳腺癌细胞MDA-MB-231和MCF-7 24 h,结果显示:在未用IL-8干预的情况下,乳腺癌细胞MDA-MB-231和MCF-7趋化运动能力较弱,IL-8刺激后,2种不同细胞的趋化运动能力明显增加,具有剂量依赖性(Fig 1)。

Fig 1 Comparison of IL-8 induced chemotaxis of different breast cancer cell lines
IL-8 induced the robust chemotaxis of different breast cancer cell lines(MDA-MB-231 and MCF-7). Columns mean of triplicate measurements;bars,standard deviation
2.2人乳腺癌细胞MDA-MB-231、MCF-7和正常乳腺上皮细胞MCF-10A中ELMO1蛋白的表达用Western blot检测人正常乳腺上皮细胞MCF-10A和人乳腺癌细胞MDA-MB-231和MCF-7中ELMO1的表达,结果显示:ELMO1蛋白在人乳腺癌细胞MDA-MB-231中高表达,在正常乳腺上皮细胞MCF-10A和人乳腺癌细胞MCF-7中低表达(Fig 2)。
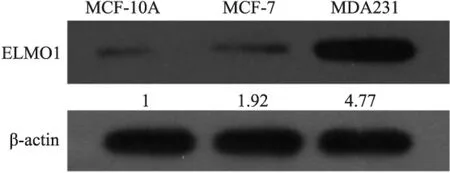
Fig 2 Expression of ELMO1 in MCF-10A cells, MDA-MB-231 cells and MCF-7 cells(Values represent gray value)
2.3转染后各组细胞中ELMO1蛋白的表达瞬时转染干扰质粒72 h后,Western blot结果显示在siELMO1/MDA-MB-231细胞中ELMO1的表达明显低于Scr/MDA-MB-231细胞和MDA-MB-231细胞中的表达。转染过表达质粒72 h后,Western blot结果显示在MCF-7/ELMO1细胞中ELMO1的表达明显高于Scr/MCF-7细胞中的表达(Fig 3)。
2.4ELMO1对IL-8诱导的乳腺癌细胞MDA-MB-231和MCF-7趋化运动能力的影响为了检测ELMO1表达改变对IL-8诱导的乳腺癌细胞迁移能力的影响,我们进行了细胞趋化运动实验,结果显示:在IL-8(100 μg·L-1)刺激下,siELMO1/MDA-MB-231细胞趋化运动能力与MDA-MB-231细胞和Scr/MDA-MB-231细胞相比明显降低(P<0.01),差异有统计学意义。MCF-7/ELMO1细胞的趋化运动能力与MCF-7细胞和Scr/MCF-7细胞相比明显增强(P<0.01),差异有统计学意义(Fig 4)。

Fig 3 Expression of ELMO1 in transfected cells by Western blot(Values represent gray value)
A:Expression of ELMO1 protein in MDA-MB-231, Scr/MDA-MB-231 and siELMO1/MDA-MB-231 cells; B: Expression of ELMO1 protein in MCF-7, MCF-7/Con and MCF-7/ELMO1 cells
2.5ELMO1对IL-8诱导的乳腺癌细胞MDA-MB-231和MCF-7侵袭能力的影响肿瘤细胞向细胞外基质的侵袭与细胞的迁移能力密切相关,肿瘤细胞迁移能力的降低通常会导致细胞的侵袭能力的降低,以上研究证明,IL-8和ELMO1可以调节乳腺癌细胞的趋化运动能力,因此,我们通过基质胶(matrigel)模拟体内细胞外基质,用Transwell小室来检测乳腺癌细胞的侵袭能力,用100 μg·L-1的IL-8作为趋化因子吸引乳腺癌细胞穿透基质胶和滤膜。结果显示:在IL-8(100 μg·L-1)刺激下,siELMO1/MDA-MB-231组穿过人工基底膜进入下室的细胞数量比Scr/MDA-MB-231组明显减少(P<0.05),差异有统计学意义(Fig 5)。MCF-7/ELMO1组穿过人工基底膜进入下室的细胞数量比Scr/MCF-7组明显增多(P<0.05),差异有统计学意义(Fig 5)。

Fig 4 The chemotaxis ability of each group transfected MDA-MB-231 cells and MCF-7 cells(Giemsa×400)
A:Comparison of chemotacitc responses with IL-8 stimulation in MDA-MB-231, Scr/MDA-MB-231 and SiELMO1/MDA-MB-231 cells. The chemotaxis index in SiELMO1/MDA-MB-231 decreased compared with Scr/MDA-MB-231.**P<0.01; B: Comparison of chemotacitc responses with IL-8 stimulation in MCF-7, MCF-7/Con and MCF-7/ELMO1 cells. The chemotaxis index in MCF-7/ELMO1 increased compared with MCF-7/Con.**P<0.01;C:Scr/MDA-MB-231 cell, 24 h; D: SiELMO1/MDA-MB-231 cells, 24 h; E: Scr/MDA-MB-231 cell, 48 h; F: SiELMO1/MDA-MB-231 cells,48 h; G: MCF-7/Con cell, 24 h; H: MCF-7/ELMO1 cells, 24 h; I: MCF-7/Con cell,48 h; J: MCF-7/ELMO1 cells,48 h

Fig 5 Invasion ability of each group transfected MDA-MB-231 cells and MCF-7 cells
A:Quantification IL-8 induced penetrated cells was performed in Scr/MDA-MB-231 and SiELMO1/MDA-MB-231 cells by transwell invasion assay. The number of invasive cells in SiELMO1/MDA-MB-231 decreased compared with Scr/MDA-MB-231.*P<0.05(two-way ANOVA); B: Quantification IL-8 induced penetrated cells was performed in MCF-7/Con and MCF-7/ELMO1 cells by transwell invasion assay. The number of invasive cells in MCF-7/ELMO1 increased compared with MCF-7/Con.*P<0.05(two-way ANOVA)
3 讨论
尽管乳腺癌的治疗已经取得重大进展,但转移仍是乳腺癌患者死亡的主要原因[7],因此抑制肿瘤细胞侵袭转移,研究其转移机制,设计靶向阻断药物对乳腺癌的进一步治疗至关重要。
IL-8具有促进肿瘤发生和血管生成的功能,在许多人类癌症中表达增高,对肿瘤的发生、发展和转移起重要作用[8]。Deng等[9]构建含IL-8基因的重组腺病毒载体,观察对乳腺癌细胞BT549增殖、细胞周期和迁移的影响。过表达IL-8促进BT549细胞迁移,抑制细胞周期在S期的DNA复制,而对BT549细胞的增殖没有明显影响。Kim等[10]发现,用IL-8处理后,三阴性乳腺癌(雌激素受体ER、孕激素受体PR、原癌基因Her-2均为阴性的乳腺癌)细胞的侵袭性明显增强。本研究通过趋化运动实验检测IL-8对乳腺癌细胞运动能力的影响,结果显示:在IL-8刺激下,乳腺癌细胞MDA-MB-231和MCF-7的运动能力增强,具有剂量依赖性。结果提示IL-8与乳腺癌的侵袭转移相关。
已有研究表明,ELMO1可以促进乳腺癌细胞迁移、趋化运动和侵袭的能力,基质细胞衍生因子-1诱导的乳腺癌细胞肌动蛋白聚合和侵袭转移需要ELMO1的参与[5]。ELMO1蛋白可以和胞质分裂作用因子180(dedicator of cytokinesis 180,DOCK180)形成复合体,从而以鸟嘌呤核苷酸交换因子的角色发挥作用,通过G蛋白偶联受体介导的通路来调控Rac蛋白从而促进肌动蛋白的聚合,调控细胞迁移、趋化运动、侵袭和转移能力[11-13]。本实验Western blot检测结果显示,ELMO1蛋白在乳腺癌细胞MDA-MB-231中的表达明显高于乳腺癌细胞MCF-7和人正常乳腺上皮细胞MCF-10A中的表达,侵袭性强的MDA-MB-231细胞中ELMO1蛋白表达高于侵袭性低的MCF-7细胞中表达;降低ELMO1的表达,抑制了MDA-MB-231细胞的运动和侵袭能力,上调ELMO1的表达增强了MCF-7细胞的运动和侵袭能力。结果提示ELMO1能够促进乳腺癌细胞的侵袭和转移。
IL-8依次激活PI3K、Akt和NF-κB通路,增强非嗜荷尔蒙乳腺癌细胞的侵袭能力[8]。NF-κB通路参与了PKC信号诱导的乳腺癌中IL-8表达,促进了乳腺癌细胞的迁移[14]。本课题组前期研究发现IL-8激活ELMO1-NF-κB-Snail信号通路促进胶质瘤细胞的侵袭转移,降低ELMO1的表达,抑制了IL-8诱导的胶质瘤细胞迁移[15]。但IL-8和ELMO1在乳腺癌侵袭转移中的关系尚不清楚,我们因此提出假设,IL-8通过ELMO1促进乳腺癌细胞的侵袭和转移,本实验为研究IL-8和ELMO1在乳腺癌侵袭和转移中的相互关系,采用小RNA干扰技术沉默乳腺癌细胞MDA-MB-231中内源性ELMO1基因,用过表达质粒上调乳腺癌细胞MCF-7中的内源性ELMO1基因,Western blot检测SiELMO1/MDA-MB-231细胞组ELMO1蛋白的表达降低,MCF-7/ELMO1细胞组ELMO1蛋白的表达增高。趋化运动和Transwell检测结果显示,降低ELMO1的表达抑制了IL-8诱导的MDA-MB-231细胞的运动和侵袭能力,上调ELMO1的表达增强了IL-8诱导的MCF-7细胞的运动和侵袭能力。以上结果提示,IL-8促进乳腺癌侵袭和转移是通过ELMO1实现的。
综上所述,本实验研究证实ELMO1在乳腺癌细胞MDA-MB-231中高表达,IL-8通过ELMO1促进乳腺癌细胞的侵袭和转移。因此,通过减少ELMO1的表达降低IL-8对乳腺癌的影响,可以成为抑制乳腺癌侵袭转移的新的治疗方向。
[1]田红艳,陈萍萍,李笑,等. Gab2通过 PI3K/Akt/ARK5/MMP途径影响乳腺癌的侵袭和转移[J].中国药理学通报,2015,31(7):1014-8.
[1]Tian H Y, Chen P P, Li X, et al. Gab2 effects the invasion and metastasis of breast carcinoma through PI3K/Akt/ARK5/MMPsignal pathway[J].ChinPharmacolBull, 2015,31(7):1014-8.
[2]Snoussi K, Mahfoudh W, Bouaouina N, et al. Combined effects of IL-8 and CXCR2 gene polymorphisms on breast cancer susceptibility and aggressiveness[J].BMCCancer,2010,10:283.
[3]Zuccari D A, Leonel C, Castro R,et al. An immunohistochemical study of interleukin-8(IL-8) in breast cancer[J].ActaHistochem, 2012, 114(6):571-6.
[4]Margaron Y, Fradet N, Cote J F. ELMO recruits actin cross-linking family 7(ACF7) at the cell membrane for microtubule capture and stabilization of cellular protrusions[J].JBiolChem,2013,288(2):1184-99.
[5]Li H,Yang L,Fu H, et al. Association between Gɑi2 and ELMO1/Dock180 connects chemokine signalling with Rac activation and metastasis[J].NatCommun,2013,4:1706.
[6]Song J, Wang X, Zhu J, et al. Rapamycin causes growth arrest and inhibition of invasion in human chondrosarcoma cells[J].JBUON, 2016, 21(1):244-51.
[7]Bill R, Christofori G. The relevance of EMT in breast cancer metastasis: Correlation or causality?[J].FEBSLett,2015, 589(14):1577-87.
[8]Shao N, Lu Z, Zhang Y, et al.Interleukin-8 upregulates intergrin β3 expression and promotes estrogen receptor-negative breast cancer cell invasion by activaing the PI3K/Akt/NF-κB?pathway[J].CancerLett,2015, 364(2):165-72.
[9]Deng F, Wang J, Fan M, et al. Overexpression of IL-8 promotes migration of BT549 breast cancer cells[J].XiBaoYuFenZiMianYiXueZaZhi,2016,32(5):585-9.
[10]Kim S, Lee J, Jeon M, et al. MEK-dependent IL-8 induction regulates the invasiveness of triple-negative breast cancer cells[J].TumourBiol,2016,37(4):4991-9.
[11]Patel M, Pelletier A, Cote J F. Opening up on ELMO regulation: New insights into the control of Rac signaling by the DOCK180/ELMO complex[J].SmallGTPases, 2011, 2(5):268-75.
[12]Sevajol M, Reiser J B, Chouquet A, et al. The C-terminal polyproline-containing region of ELMO contributes to an increase in the life-time of the ELMO-DOCK complex[J].Biochimie, 2012, 94(3):823-8.
[13]Patel M, Chiang T C, Tran V, et al. The Arf family GTPase Arl4A complexes with ELMO proteins to promote actin cytoskeleton remodeling and reveals a versatile Ras-binding domain in the ELMO proteins family[J].JBiolChem, 2011, 286(45):38969-79.
[14]Chou W Y, Chuang K H, Sun D, et al. Inhibition of PKC-induced COX-2 and IL-8 expression in human breast cancer cells by glucosamine[J].JCellPhysiol,2015,230(9):2240-51.
[15]Zhang B, Shi L, Lu S,et al. Autocrine IL-8 promotes F-actin polymerization and mediate mesenchymal transition via ELMO1-NF-κB-Snail signaling in glioma[J].CancerBiolTher,2015,16(6):898-911.
Important role of ELMO1 in invasion and migration of breast cancer cells induced by IL-8
ZHANG Chang-jie1,XU Xin-wei1,LI Hong-li2,LIU Yu-qing1,YIN Chong-gao3
(1.DeptofPathology, 2.MedicineResearchCenter,3.CollogeofNursing,WeifangMedicalUniversity,WeifangShandong261053,China)
AimTo explore the relationship between IL-8 and ELMO1 in breast carcinoma and the mechanisms of IL-8 induced invasion and metastasis.MethodsUnder the IL-8 stimulation, chemotaxis assay was examined to detect the chemotaxis ability of breast cancer cell line MDA-MB-231 and MCF-7. ELMO1 protein levels in breast cancer cell lines were detected using Western blot. MDA-MB-231 cells were transfected with small RNA interference plasmids in order to downregulate ELMO1 expression, and overexpression plasmids were used to upregulate the expression of ELMO1 in MCF-7 cells. Matrigel invasion assay and chemotaxis assay were used to detect theinvitroinvasion and chemotaxis ability of breast cancer cells with IL-8 stimulation.ResultsIL-8 induced chemotaxis of the different breast cancer cell lines in a dose-dependent manner. After transient transfection, Western blot results showed that ELMO1 protein levels observably decreased in SiELMO1/MDA-MB-231 cells compared with Scr/MDA-MB-231 cells, while the expression of ELMO1 protein levels significantly increased in MCF-7/ELMO1 cells compared with the MCF-7/Con cells; with IL-8 stimulation, SiELMO1/MDA-MB-231 cells showed significantly decreased chemotaxis ability compared with Scr/MDA-MB-231 cells. MCF-7/ELMO1 cells showed significantly increased chemotaxis ability compared with MCF-7/Con cells; the invasion assay showed under the stimulation of IL-8, and the invasion ability was significantly reduced in SiELMO1/MDA-MB-231 cells compared with Scr/MDA-MB-231 cells(P<0.05). The invasion ability was significantly enhanced in MCF-7/ELMO1 cells compared with MCF-7 cells(P<0.05).ConclusionIL-8 promotes the invasion and migration of breast cancer cells MDA-MB-231 and MCF-7, and ELMO1 plays an important role in IL-8 induced chemotaxis and invasion.
breast cancer; interleukin-8; engulfment and cell motility protein 1 (ELMO1); migration; metastasis; chemotactic movement
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.046.html
2016-06-27,
2016-08-20
国家自然科学基金青年基金项目(No 81402389);山东省自然科学基金(No ZR2014HL077,ZR 2015HL065);山东省高等学校科技计划(No J12LK03,J13LK03)
张长杰(1991-),男,硕士,研究方向:肿瘤病理学,E-mail: 13695363890@163.com;
刘雨清(1962-),女,硕士,教授,研究方向:肿瘤病理学,通讯作者,E-mail:yuqingliu89@hotmail.com;
10.3969/j.issn.1001-1978.2016.10.023
A
1001-1978(2016)10-1452-06
R341;R392.12;R73-37;R737.9
尹崇高(1979-),男,硕士,副教授,研究方向:乳腺肿瘤,通讯作者,E-mail:ycglihongli@163.com
