虾原肌球蛋白及其IgE单克隆抗体建立I型过敏反应体内外模型
2016-11-08费巧玲蔡润兰
方 蕾,侯 睿,费巧玲,高 源,刘 芬,蔡润兰,齐 云
(1 中国医学科学院药用植物研究所,北京 100193;2 扬州大学医学院,江苏 扬州 225009)
虾原肌球蛋白及其IgE单克隆抗体建立I型过敏反应体内外模型
方蕾1,2,侯睿1,费巧玲1,高源1,刘芬1,蔡润兰1,齐云1
(1 中国医学科学院药用植物研究所,北京100193;2 扬州大学医学院,江苏 扬州225009)
目的利用虾原肌球蛋白及其IgE单克隆抗体建立I型过敏反应体内外模型。方法采用等电点沉淀法制备刀额新对虾原肌球蛋白,利用杂交瘤技术制备抗虾原肌球蛋白IgE单克隆抗体。建立虾原肌球蛋白攻击IgE单抗致敏的RBL-2H3细胞模型,测定β-氨基己糖苷酶释放量。利用虾原肌球蛋白及其IgE单抗建立被动全身过敏反应小鼠模型,监测抗原攻击后30 min内肛温的变化。结果IgE单抗致敏的RBL-2H3细胞在虾原肌球蛋白攻击后发生脱颗粒,β-氨基己糖苷酶释放量明显增加。虾原肌球蛋白及其IgE单抗诱导了小鼠被动全身过敏反应,抗原攻击后小鼠肛温平均下降约1.44℃。结论虾原肌球蛋白及其IgE单克隆抗体成功建立了I型过敏反应体内外模型。
Ⅰ型过敏反应;原肌球蛋白;刀额新对虾;单克隆抗体;免疫球蛋白E;RBL-2H3细胞
目前,在抗I型过敏反应药物筛选中,国内常采用卵清蛋白(ovalbumin,OVA)及抗OVA的动物血清建立的被动皮肤过敏试验(passive cutaneous anaphylaxis,PCA)[1]。然而,OVA对啮齿类动物IgE的诱导并不理想,尤其在没有佐剂的情况下致敏性更差,已有研究认为这与小鼠在饲养过程中接触(鸡蛋)蛋白粉导致出现的免疫耐受有关[2]。我们的初步研究显示虾原肌球蛋白(shrimp tropomyosin,ST)是一种致敏性更强的大分子抗原[3],提示其极有可能成为经典致敏原OVA的一个更好的替代品。因此,本文在前期研究基础上,制备ST IgE单克隆抗体(monoclonal tropomyosin-specific murine IgE antibody,anti-ST-IgE mAb),并进一步建立虾原肌球蛋白及其IgE单抗诱导的RBL-2H3细胞模型和被动全身过敏反应小鼠模型,以此丰富现有I型过敏反应模型,为研究者提供更多的选择和参考。
1 材料
1.1实验动物和细胞Balb/c小鼠(6~8周龄),16 g~18 g,购自北京维通利华实验动物技术有限公司(许可证编号:SCXK (京)2012-0001)。于中国医学科学院药用植物研究所SPF级动物房常规饲养。小鼠骨髓瘤细胞Sp2/0购自中国医学科学院基础医学研究所细胞资源中心。大鼠的嗜碱性粒细胞株RBL-2H3购自中国科学院上海生科院细胞资源中心。
1.2主要试剂50×HAT(美国Sigma公司,H0262),聚乙二醇-4000(polyethylene glycol,PEG,美国Sigma公司,95904-250G-F),弗式不完全佐剂(美国Sigma公司,F5506),小鼠IgE ELISA试剂盒(美国Biolegend公司,432401),MEM培养基(美国Gibco,41500-034);胎牛血清(fetal bovine serum,FBS,中国Excell Bio公司,140425);4-甲基伞形酮-β-D-乙酰氨基葡萄糖苷(美国Sigma公司,69585);色甘酸钠(中国药品生物制品检定所,100245-201002)。
1.3主要设备荧光化学发光分析仪(美国Thermo Electron公司);RM6240C型生理实验系统和CTP100型温度传感器(中国成都仪器厂)。
2 方法
2.1铝佐剂的配制取Al2(SO4)31.0 g,溶于20 mL无菌三蒸水中,即5%;NaOH 0.4 g,溶于8 mL无菌三蒸水中,即5%;在强烈搅拌下,将5% NaOH加入5% Al2(SO4)3中,4 000 r·min-1离心15 min,无菌生理盐水重悬2次,最终以生理盐水定容至20 mL,-20℃分装保存。
2.2ST的提取和鉴定新鲜的刀额新对虾(metapenaeusensis),购自北京回龙观海鲜市场;去头去壳,得虾肉91 g,研钵研碎后匀浆(PBS为匀浆介质),所得的匀浆液加入等体积的预冷丙酮,混合,4℃下搅拌20 min,3 500 r·min-1离心15 min,弃上清,沉淀以相同体积的丙酮混合,搅拌,离心,以上步骤重复3次,最后1次获得的沉淀在滤纸上平铺,于通风橱中风干过夜,即得虾丙酮粉。
参照文献以等电点沉淀的方法[4]提取ST:虾丙酮粉先以150 mL提取缓冲液(1 mol·L-1KCl,0.5 mmol·L-1DTT,pH 7.0)提取过夜。离心取上清,置于4℃,调pH至4.6,搅拌30 min,离心,沉淀以150 mL提取缓冲液溶解,室温搅拌20 min,离心,取上清。以上等电沉淀步骤再重复2次。最终的沉淀溶于0.5 mmol·L-1DTT(pH 7.0)溶液中,PBS透析24 h。经硫酸铵盐析、透析、冻干,最终得167.65 mg ST,得率为0.184%。采用SDS-PAGE对所得的ST进行分子量鉴定。
2.3anti-ST-IgE mAb的制备和鉴定参照我们实验室常规的杂交瘤技术制备单克隆抗体的经验[5]和相关文献[6]:小鼠腹腔注射20 μg ST,每周1次。6周末将小鼠脱颈处死,无菌取其脾脏,在质量分数为50% PEG存在条件下将脾细胞与骨髓瘤Sp2/0细胞进行融合,采用HAT培养基进行选择培养。融合后d10~14,采用ELISA法对存活细胞的上清进行IgE测定,筛选阳性细胞,进行单克隆及扩增培养。♀ Balb/c小鼠腹腔注射弗式不完全佐剂,7 d后将杂交瘤细胞腹腔接种至小鼠腹腔,2周后取其腹水,即得单克隆抗体,腹水经硫酸铵纯化后,分别采用SDS-PAGE和Western blot法进行分子量和特异性鉴定。
2.4测定胞外β-氨基己糖苷酶的含量RBL-2H3细胞以EMEM完全培养基(含体积分数为0.15的FBS,100 kU·L-1青霉素,100 mg·L-1链霉素和2 mmol·L-1L-谷氨酰胺)常规培养,待至对数生长期,胰酶消化后按每孔105个细胞接种于48孔细胞板。贴壁6 h后,除正常对照孔外,其余孔则分别加入终浓度6 mg·L-1anti-ST-IgE mAb,孵育过夜。次日弃上清,用预温的Hank′s液(含5.6 mmol·L-1葡萄糖,1 g·L-1BSA)洗细胞1次,加入终浓度20 μg·L-1ST,37℃孵育1.5 h,阳性药物30 μmol·L-1色甘酸钠则于抗原攻击前与细胞孵育30 min。取上清30 μL加入96孔黑板,加0.57 g·L-1底物4-甲基伞型酮-β-D-乙酰氨基葡萄糖苷(溶于133 mmol·L-1枸橼酸钠,133 mmol·L-1NaCl,pH 4.3)50 μL,25℃孵育2 h,加200 μL终止液(50 mmol·L-1甘氨酸,5 mmol·L-1EDTA-Na2,pH 10.5),在荧光化学发光分析仪Ex:355 nm,Em:460 nm处测定荧光值。
2.5小鼠被动全身过敏反应(passive systemic anaphylaxis,PSA)模型的建立♂ Balb/c小鼠尾静脉注射anti-ST-IgE mAb。24 h后,将温度传感器插入动物肛门内3 cm,小鼠安置于固定器内,室温维持在23℃~25℃。生理实验系统实时监测小鼠肛温,待小鼠肛温平稳后,尾静脉注射ST,连续记录小鼠肛温30 min,计算温差△T(℃)。
预实验时,首先初步拟定anti-ST-IgE mAb的剂量为每只20 μg,ST的起始剂量为每只4 μg,监测小鼠肛温。若注射抗原后5 min内小鼠肛温恢复至起始值,则说明抗原剂量偏低,立即追加等量的ST,如肛温下降明显,则下只动物则单次给予该累加剂量重复实验,若肛温下降不明显则继续追加抗原或考虑提高下次实验的抗体剂量,直至寻找到能使小鼠肛温明显下降的抗原和抗体剂量。最终,我们确定了抗体的剂量为每只40 μg,抗原的剂量为每只20 μg,进行重复实验。
待模型条件确立后,动物分为3组:阴性对照组、模型组和色甘酸钠组。阴性对照组动物给予生理盐水;模型组动物同上述anti-ST-IgE mAb致敏和ST攻击;色甘酸钠组动物于抗原攻击前30 min腹腔注射剂量为100 mg·kg-1色甘酸钠,其余同模型组。观察动物经ST攻击后肛温的下降程度,计算温差△T(℃)。
3 结果
3.1ST的鉴定刀额新对虾是华南地区常见的食用海产经济虾类,市面常见,形态极好辨认;它属于对虾科属,分布广泛,且国内外文献也普遍采用对虾科属的虾品种进行致敏原研究,所以我们选择这种价廉易得且共识度较高的的虾品种提取抗原。如Fig 1所示,提取的ST主要为36 ku的蛋白,与文献报道的结果相一致[7]。
3.2anti-ST-IgE mAb的鉴定Fig 2A中,该抗体经硫酸铵初步纯化后,重链和轻链的分子质量分别为70 ku和25 ku左右,与IgE分子质量(190 ku)吻合。进一步通过Western blot实验验证,采用ST进行电泳,与anti-ST-IgE mAb进行孵育后,经HRP标记的抗IgE二抗进行杂交,结果显示该抗体是结合分子质量36 ku ST的IgE(Fig 2B)。
3.3ST攻击anti-ST-IgE mAb致敏的RBL-2H3细胞致脱颗粒如Fig 3所示,IgE单抗致敏的RBL-2H3细胞在受到抗原攻击后,细胞发生脱颗粒,与对照组比较,释放至胞外的β-氨基己糖苷酶明显升高(P<0.01)。且阳性药物色甘酸钠可以明显的抑制抗原攻击后致敏细胞的脱颗粒(P<0.01)。

Fig 1 Analysis of ST by SDS-PAGE
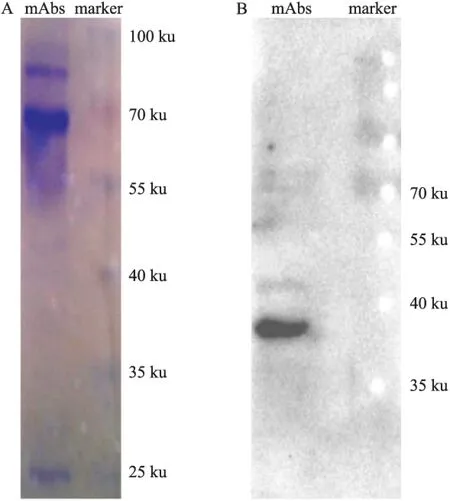
Fig 2 Identification for anti-ST-IgE mAb
A: SDS-PAGE; B: Western blot analysis
3.4PSA小鼠模型我们测定了抗原攻击IgE单抗致敏小鼠肛温的下降(Fig 4A/B),与攻击前比较,攻击后30 min内的最大降幅约1.44℃(P<0.01,Fig 4C),采用色甘酸钠干预后可有效缓解肛温下降的趋势。
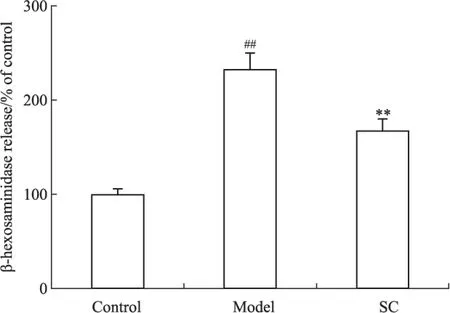
Fig 3 Degranulation in RBL-2H3 induced by anti-ST-IgE mAb and ST
##P<0.01vscontrol;**P<0.01vsmodel,SC:Sodium cromoglycate
4 讨论
由于免疫耐受的原因,啮齿类动物对于目前常用的大分子致敏原OVA响应性较差。研究显示,Balb/c小鼠对OVA的敏感性并不如多数杂志报道的敏感。IgE的诱导比较困难,国内也有报道,并认为与小鼠在饲养过程中接触(鸡蛋)蛋白粉有关[2],采用特殊饲料(无相关蛋白)喂养Balb/c(♀)小鼠对蛋白则有很好的响应性[8]。另有报道称与小分子偶联的OVA(如DNP-OVA)更易致敏动物[9],可能的原因是小分子与蛋白共价偶联,使蛋白构型改变,暴露出更易致敏的部位有关。从这些研究报道,以及我们的验证,普通的Balb/c小鼠对OVA的反应并不敏感[3]。
甲壳类是目前世界公认的八大类引发食物过敏的食物之一,虾类是甲壳类生物的主要代表,同时虾也是引起海产品过敏的一个最常见的病因[10]。我们的前期研究发现:无论是否使用佐剂,采用虾蛋白粗提成分(电泳显示以分子量36 ku和16 ku的蛋白为主)免疫Balb/c小鼠后,致敏动物血清中的总IgE水平均明显高于OVA联合佐剂组[3]。这一结果提示虾蛋白中所含成分的致敏性要高于OVA,能够在小鼠体内诱导出I型过敏反应。目前,关于虾的主要有效致敏组分的研究已越来越明确,研究表明绝大多数虾过敏患者血清均与相对分子量为36 ku的ST反应[7],现已证实ST为虾的主要过敏原,有研究初步显示ST能够诱导小鼠食物过敏反应[4]。基于此,我们制备了ST及其IgE单克隆抗体,并建立Ⅰ型过敏反应体内外模型。

A: The rectal temperature measurement; B: Temperature(T); C: Temperature change(△T),##P<0.01vsT or △T at 0 min; D: Effect of sodium cromoglycate(SC) on PSA in mice,##P<0.01vscontrol.
体外模型中细胞系仍是首选。大鼠嗜碱性粒细胞系RBL-2H3细胞表面存在高亲和力的FcεRI,目前广泛应用于IgE介导的脱颗粒模型[11]。脱颗粒释放的介质,如组胺、β-氨基己糖苷酶、蛋白水解酶(类胰蛋白酶等),是引起过敏反应速发阶段主要症状的活性物质。但是我们在实际检测时发现,组胺本身易降解,类胰蛋白酶比色法[12]在此模型的灵敏度不高,故通常在细胞模型中,测定与组胺平行释放的β-氨基己糖苷酶的量是较为常用的用来评价脱颗粒程度的指标。本实验中,我们制备的anti-ST-IgE mAb致敏的RBL-2H3细胞在受到抗原攻击后,细胞发生脱颗粒,与对照组比较,释放至胞外的β-氨基己糖苷酶含量明显增加,阳性药物色甘酸钠对细胞脱颗粒有明显抑制作用。
PCA法是经典的I型过敏实验研究方法,利用抗OVA动物血清皮内注射致敏同种或异种动物的局部皮肤,以伊文思蓝为指示剂,测定抗原激发后局部皮肤蓝斑直径和伊文思蓝吸光度,来判断过敏反应的程度[1]。由于动物局部皮肤的过敏反应无法代表整个机体的过敏效应,如果建立一种体现全身效应的被动过敏反应模型,将是对现有模型的重要补充。I型过敏反应速发阶段可引起血管通透性增加,心血管和胃肠道等平滑肌收缩致血压降低,而后体温下降。基于此,有研究通过监测直肠温度变化来评价全身性过敏反应程度[13-14]。因此,在获得anti-ST-IgE mAb的基础上,我们建立了一种全新的被动全身过敏反应模型。实验过程中从ST及其IgE单抗的剂量、动物基线体温、室温控制、肛温下降幅度标准的确定(不造成小鼠全身性过敏反应死亡)等多方面进行造模条件的优化。结果显示,致敏小鼠在ST攻击后体温明显下降,30 min内平均最大降幅为1.44℃。色甘酸钠对体温的降低有缓解趋势。该模型的特点在于:模型具有被动过敏实验的优势,与主动模型相比,模型效应完全由IgE介导(主动致敏模型产生的IgG类抗体也参与介导效应[15]),且以单抗被动致敏替代数周的抗原主动诱导,提高了实验效率;与被动皮肤过敏试验相比,以致敏机体全身效应——体温降低的动态变化替代局部反应来展现过敏反应程度,应用于抗过敏药物的评价将更加客观、准确的体现量效关系和作用特点。
综上,ST是一种优于OVA的潜在替代抗原分子,有望成为模拟人类I型过敏反应的体内外模型的大分子致敏原。采用ST及其IgE单抗建立的RBL-2H3细胞脱颗粒模型和被动全身过敏反应小鼠模型,将丰富现有Ⅰ型过敏反应模型,为国内研究者进行抗I型过敏反应药物筛选提供更多的参考和选择。(致谢:本实验在中国医学科学院药用植物研究所完成,感谢侯睿、费巧玲、高源、刘芬和蔡润兰对文章相关工作的支持。)
[1]谢强敏,卞如濂.抗变态反应实验法//徐叔云,卞如濂,陈修,主编. 药理实验方法学[M]. 第3版.北京:人民卫生出版社,2002:1407-18.
[1]Xie Q M, Bian R L. Anti allergic experiment methods//Xu S Y, Bian R L, Chen X.Methodologyofpharmacologicalexperiment[M]. 3rd edition. Beijing: People’s Medical Publishing House, 2002: 1407-18.
[2]郑珊珊,刘火媛,周藉良,等.小鼠IgE抗体生成的免疫调节-Ⅳ抗卵清蛋白IgE抗体应答的研究[J].中国医学科学院学报,1987,9(5):329-33.
[2]Zheng S S, Liu H Y, Zhou J L, et al. The immunoregulation of IgE antibody production in mice Ⅳ. anti-ovalbumin IgE antibody response[J].ActaAcadMedSin, 1987, 9(5): 329-33.
[3]方蕾.采用虾原肌球蛋白及其抗体建立I型过敏反应模型及双黄连在模型中的作用研究[D].北京:北京协和医学院,2015:13-22.
[3]Fang L. Development of murine models of type I allergy to shrimp tropomyosin and evaluation of the anti-allergic effect of Shuang-Huang-Lian injection[D]. Beijing: Peking Union Medical College, 2015: 13-22.
[4]Capobianco F, Butteroni C, Barletta B, et al. Oral sensitization with shrimp tropomyosin induces in mice allergen-specific IgE, T cell response and systemic anaphylactic reactions[J].IntImmunol, 2008, 20(8): 1077-86.
[5]Gao Y, Hou R, Liu F, et al. Highly specific and sensitive immunoassay for the measurement of prostaglandin E2 in biological fluids[J].Bioanalysis, 2015, 7(19):2597-607.
[6]Tung A S. Production, purification, and characterization of antigen-specific murine monoclonal antibodies of IgE class[J].MethodsEnzymol, 1983, 92: 47-66.
[7]陈伟,张华,刘群英,等.刀额新对虾主要变应原的纯化与初步应用[J].中国海洋药物杂志,2009,28(2):32-5.
[7]Chen W, Zhang H, Liu Q Y, et al. Purification and application of major allergens of Metapenaeusensis[J].ChinJMarDrugs, 2009,28(2): 32-5.
[8]毛露甜,向军俭,张在军,等.牛乳清蛋白Balb/c小鼠过敏模型的建立及优化[J].暨南大学学报(医学版),2006,27(2):214-8.
[8]Mao L T, Xiang J J, Zhang Z J, et al. The experiment study of allergic models with BALB/c mice for whey protein[J].JJinanUniversity(MedicineEdition), 2006, 27(2): 214-8.
[9]郑珊珊,王旭东,吴安然.小鼠IgE抗体生成的免疫调节-对半抗原-载体蛋白质IgE抗体应答的研究[J].中国免疫学杂志,1987,3(4):198-201.
[9]Zheng S S, Wang X D, Wu A R. Establishment of the mouse B cell mitogenic-and co-mitogenic monoclonal antibodies[J].ChinJImmunol, 1987, 3(4): 198-201.
[10]Sicherer S H, Sampson H A. Food allergy: Epidemiology, pathogenesis, diagnosis, and treatment[J].JAllergyClinImmunol, 2014, 133(2): 291-307.
[11]王南南,刘中成,张艳芬,等.hFcεRIα/RBL-2H3细胞株的构建与评价[J].中国药理学通报,2015,31(8):1174-9.
[11]Wang N N,Liu Z C,Zhang Y F, et al. Construction and identification of recombinant RBL-2H3 cells transfected with hFcεRIα[J].ChinPharmacolBull, 2015, 31(8): 1174-9.
[12]Lavens S E, Proud D, Warner J A. A sensitive colorimetric assay for the release of tryptase from human lung mast cellsinvitro[J].JImmunolMethods, 1993, 166(1): 93-102.
[13]Liu Y, Sun Y, Chang L J, et al. Blockade of peanut allergy with a novel Ara h 2-Fcy fusion protein in mice[J].JAllergyClinImmunol, 2013, 131(1):213-21.
[14]Noval Rivas M, Burton O T, Wise P, et al. Regulatory T Cell Reprogramming toward a Th2-cell-like lineage impairs oral tolerance and promotes food allergy[J].Immunity, 2015, 42(3):512-23.
[15]Karasuyama H, Tsujimura Y, Obata K, Mukai K. Role for basophils in systemic anaphylaxis[J].ChemImmunolAllergy, 2010, 95: 85-97.
Theinvitroandinvivomodels induced by shrimp tropomyosin and monoclonal tropomyosin-specific murine IgE antibody
FANG Lei1, 2, HOU Rui1, FEI Qiao-ling1, GAO Yuan1, LIU Fen1, CAI Run-lan1, QI Yun1
(1.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100193,China; 2.CollegeofMedicine,YangzhouUniversity,YangzhouJiangsu225009,China)
AimTo develop theinvitroandinvivomodels induced by shrimp tropomyosin(ST) and monoclonal tropomyosin-specific murine IgE antibody(anti-ST-IgE mAb).MethodsST was purified from Metap-enaeusensis by an isoelectric precipitation method. The anti-ST-IgE mAb was obtained from hybridomas. After RBL-2H3 cells were sensitized with anti-ST-IgE mAb and challenged with ST, β-hexosaminidase release was determined. Passive systemic anaphylaxis(PSA) was induced in mice and the rectal temperature was recorded after ST challenge within 30 min by a thermal probe.ResultsA significant increase of β-hexosaminidase was observed in sensitized cells after ST challenge. The average temperature drop after ST challenge was 1.44℃ in PSA mice within 30 min.ConclusionTheinvitroandinvivomodels induced by ST and anti-ST-IgE mAb are established as an improvement of present models of type Ⅰ allergy.
type Ⅰ allergy; tropomyosin; Metapenaeusensis; monoclonal antibody; IgE; RBL-2H3 cells
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.036.html
2016-06-25,修回稿日期:2016-07-21
国家科技部“重大新药创制”科技重大专项(No 2014ZX 09201022-006);北京市自然科学基金项目(No 7142112)
方蕾(1983-),女,博士,讲师,研究方向:抗过敏中药药理学,E-mail:fanglei@yzu.edu.cn,0514-87978877;
齐云(1964-),男,博士,研究员,博士生导师,研究方向:抗炎免疫药理学,通讯作者,E-mail:yqi@implad.ac.cn
10.3969/j.issn.1001-1978.2016.10.018
A
1001-1978(2016)10-1422-06
R-332;R341;R392.11;R593.1;R977.6
