雷公藤甲素对人结肠癌HCT116细胞增殖、自噬和凋亡的影响
2016-11-08章平贵谢大泽周南进
赵 林,吴 鹏,章平贵,谢大泽,高 典,周南进
(江西省医学科学院 1.实验中心,2.分子医学研究所,江西 南昌 330006;3.南昌大学基础医学院,江西 南昌 330006)
雷公藤甲素对人结肠癌HCT116细胞增殖、自噬和凋亡的影响
赵林1,吴鹏2,章平贵2,谢大泽2,高典3,周南进2
(江西省医学科学院 1.实验中心,2.分子医学研究所,江西 南昌330006;3.南昌大学基础医学院,江西 南昌330006)
目的探究雷公藤甲素(TP)对人结肠癌HCT116细胞增殖的的影响和可能的抑制机制。方法取TP不同浓度、不同时间作用HCT116细胞,MTT检测细胞的存活率,流式细胞术检测TP对细胞凋亡的影响,免疫印迹检测蛋白LC3-Ⅱ表达,MDC检测细胞自噬。结果TP能够抑制HCT116细胞的增殖,不同浓度的TP作用HCT116细胞48 h后,LC3-Ⅱ的水平随着TP浓度的增加而升高,呈浓度依赖性;用40 nmol·L-1TP作用HCT116细胞,LC3-Ⅱ蛋白水平随作用时间的延长而增加,呈时间依赖性,同时荧光显微镜观察到HCT116细胞中酸性自噬囊泡的数量增多。TP+3-MA作用HCT116细胞48 h,与对照组比较TP组细胞凋亡率下降;与TP组比较TP+3-MA组细胞凋亡率明显下降。TP+RAPA作用HCT116细胞24 h,与对照组比较TP组细胞凋亡率增加;与TP组比较TP+RAPA组细胞凋亡率明显增加。结论TP能够抑制人结肠癌HCT116细胞的增殖,诱导HCT116细胞凋亡,提示自噬和凋亡间可能有协同关系。
雷公藤甲素;结肠癌;HCT116细胞;增殖;自噬;凋亡
雷公藤是我国传统中草药,具有解毒散结、活血化瘀、扶正祛邪等多种功效,雷公藤多苷已在临床上普遍应用于类风湿病治疗,其药理作用较为安全稳定。雷公藤甲素(triptolide,TP)又称雷公藤内酯醇,是雷公藤多苷的主要有效成分。国内外报道,TP除有抗炎和免疫抑制作用外[1],还有较强的抗肿瘤的作用[2],但对结肠癌细胞的抑制作用少有研究。自噬和凋亡是机体的一种细胞死亡机制,对维持机体内环境的稳态有重要意义。经典的细胞凋亡被称为Ⅰ型程序性细胞死亡,自噬性细胞死亡又称为Ⅱ型程序性细胞死亡。二者的发生都是由一定的“程序”所调控,比如各种相关基因和蛋白质等。自噬和凋亡与肿瘤关系密切,而且自噬与凋亡间的相互“串扰”,进而对肿瘤的治疗产生影响[3-4]。因此,研究自噬与凋亡的发生过程、两者间相互关系及其对肿瘤的影响,可为今后的抗癌治疗提供新的思路。本研究将针对细胞内自噬相关蛋白LC3及自噬诱导剂为研究方向,探索TP诱导下自噬-凋亡通路在结肠癌HCT116细胞中的影响。
1 材料与方法
1.1试剂TP,上海融禾制药;RPMI 1640,Solarbio;胎牛血清,杭州四季青;5-FU、RAPA(rapamycin)Sigma;β-actin抗体,CST;LC3-Ⅱ抗体,Sigma;3-MA,Selleck;MDC,Sigma;ECL化学发光试剂盒,Pierce;Annexin V-FITC/PI 凋亡检测试剂盒,BD;其余试剂均为国产AR级分析纯。
1.2方法
1.2.1药液配制 TP用DMSO配成5.5 mmol·L-1贮液,-20℃保存,临用前以RPMI 1640细胞培养液稀释成5、10、20、30、40、80 nmol·L-1;5-FU配成40 nmol·L-1;3-MA配成100 mg·L-1;RAPA配成100 mmol·L-1。
1.2.2细胞培养人结肠癌HCT116细胞株,购自中国医学科学院,由江西省医学科学院保存。细胞常规复苏后,贴壁培养在RMPI 1640细胞培养液(含10% FBS,100 U·L-1青霉素和100 U·L-1链霉素)中,置37 ℃,5% CO2的细胞培养箱中培养,隔2~3 d消化传代。选取对数生长期细胞进行实验。
1.2.3MTT检测细胞活力胰酶消化HCT116细胞,接种于96孔板中,过夜培养后加入不同剂量(5、10、20、30、40、80 nmol·L-1)的TP处理,对照组加入PBS,阳性对照组孔内加入40 nmol·L-15-FU处理,培养24、48、72 h。终止培养前4 h,加20 μL MTT( 5 g·L-1) 于各个孔中。吸去培养基,加入150 μL·L-1DMSO,室温振荡10 min,490 nmol·L-1波长下测定各孔吸光度值。
1.2.4免疫印迹检测LC3-Ⅱ蛋白表达HCT116细胞经40 nmol·L-1TP处理24 h,PBS洗涤2次后,用预冷的RIPA蛋白裂解液冰上裂解20 min,然后4 ℃ 12 000 r·min-1离心20 min,收集上清,BCA法测定蛋白浓度。经SDS-PAGE 分离蛋白,将凝胶上的蛋白质电转至硝酸纤维素膜上。用5%脱脂奶粉封闭2 h,加入一抗,4 ℃ 摇床孵育过夜,TBST 洗膜3 次后加入二抗1 h。按ECL化学发光试剂盒说明,显色,曝光,保存图片。
1.2.5MDC检测细胞自噬取对数生长期的HCT116细胞,接种于24孔板培养24 h,PBS洗涤2次后,每孔加入含MDC(50 μmol·L-1)的培养基500 μL,培养10 min。取出24孔板,弃去孔内液体,PBS洗涤2次后,每孔加入500 μL 4%多聚甲醛室温静置固定15 min。PBS洗涤2次后,置荧光显微镜下,用355 nmol·L-1发射滤片和512 nmol·L-1阻断滤片观察、拍照。
1.2.6TP联合3-MA/RAPA对细胞凋亡的影响制备单细胞悬液,细胞计数调整细胞浓度为1×108·L-1,加入6孔板中,每孔1 mL,再加1 mL细胞培养液,37℃ 5% CO2细胞培养箱中过夜;次日分别加不同浓度TP(0、5、10、20、30、40 nmol·L-1)处理,继续培养48 h。待细胞贴壁后,将3-MA和RAPA分别加入相应组HCT116细胞中预处理3 h(37℃),然后再加入40 nmol·L-1TP分别作用HCT116细胞24 h和48 h,另设对照组。
1.2.7FCM检测细胞凋亡采用Annexin V-FITC/PI 双标法检测HCT116细胞凋亡,操作方法参照试剂盒说明书,根据荧光强度计算细胞凋亡百分率。

2 结果
2.1TP抑制HT116细胞增殖TP作用HCT116细胞24 h,20 nmol·L-1TP可诱导细胞存活率下降,当80 nmol·L-1TP时,细胞存活率降至65.75%;作用48 h,10 nmol·L-1TP可使HCT116细胞的存活率明显降低,此时40 nmol·L-1、80 nmol·L-1TP组的细胞存活率分别为35.18%、35.68%,表明TP剂量再增加,对HCT116细胞的存活率影响已不再明显;TP作用HCT116细胞72 h,5 nmol·L-1也能够明显降低细胞存活率;此外,40 nmol·L-1TP抑制HCT116细胞增殖的活性明显强于40 nmol·L-15-FU(Fig 1)。

Fig 1 Effects of different concentrations of TP on viability of

*P<0.05,**P<0.01vscontrol
2.2TP作用HCT116细胞后的LC3表达水平结果显示,不同浓度的TP(0 nmol·L-1、10 nmol·L-1、20 nmol·L-1、30 nmol·L-1、40 nmol·L-1)作用HCT116细胞48 h后,自噬标记蛋白LC3-Ⅱ的相对表达水平随着TP浓度的增加逐渐升高,呈浓度依赖性;用40 nmol·L-1TP作用HCT116细胞不同时长(0、3、6、12、24 h)后发现,LC3-Ⅱ蛋白的相对表达水平随着作用时间的延长不断增加,呈时间依赖性(Fig 2)。表明TP可以上调LC3-Ⅱ蛋白的表达,促进HCT116细胞产生自噬。
2.3TP促进HCT116细胞产生自噬囊泡 荧光显微镜下,40 nmol·L-1TP处理后的HCT116细胞内出现自噬囊泡,并呈点状结构,散在分布于核周及胞质。表明TP促使HCT116细胞中酸性自噬囊泡的数量增多,提示TP可能诱导HCT116细胞产生自噬,见Fig 3。
2.4TP联合3-MA作用HCT116细胞后的凋亡水平结果显示,对照组、TP组、TP+3-MA组与3-MA组作用HCT116细胞48 h后,其凋亡率分别为12.1%、31.6%、20.6%、7.5%(Fig 4A)。与对照组比较发现,TP组细胞凋亡率增加,RAPA组细胞凋亡率无变化;与TP组比较,TP+3-MA组细胞凋亡率明显增加(Fig 4B)。表明自噬诱导剂3-MA可以促进TP诱导HCT116细胞凋亡。

Fig 2 Effect of TP on expression of LC3-Ⅱproteins in HCT116 cells detected by Western ±s, n=3)
*P<0.05,**P<0.01vscontrol
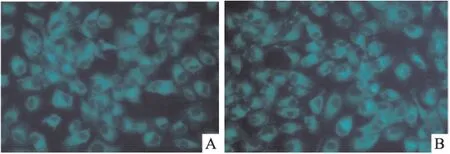
Fig 3 Number of acid autophagic vaculoes in HCT116 cells
After exposed to 40 nmol·L-1TP, the number of acid autophagic vacuoles in HCT116 cells had increased which was observed by fluorescence microscope(400×). A:control group; B: 40nmol·L-1TP group
2.5TP联合RAPA作用HCT116细胞后的凋亡水平结果显示,对照组、TP组、TP+RAPA组与RAPA组作用HCT116细胞24h后,其凋亡率分别为3.4%、34.0%、30.0%、2.4%(Fig 5A)。与对照组比较,TP组的细胞凋亡率明显增加,而RAPA组细胞凋亡率无明显变化;与TP组比较,RAPA组的细胞凋亡率明显降低(Fig 5B)。表明自噬抑制剂可以有效抑制TP诱导的HCT116细胞凋亡。
3 讨论
结肠癌(colorectal cancer,CRC)是临床最常见的消化道恶性肿瘤之一。2011年的统计数据显示,全球每年有CRC120万新发病例和60.87万死亡病例[5]。2012年,美国的结肠癌发病率及病死率均居癌症发病率和病死率的第3位[6]。在国内,随着民众生活水平的不断增高和饮食结构的改变,CRC的发病率也在呈逐年上升趋势[7]。CRC的治疗,目前尽管在以外科手术为主的综合治疗方面取得了一定的进展,但其5年生存率仍徘徊在50%左右[8]。我们的研究发现,TP可以抑制HCT116细胞的增殖,HCT116细胞的存活率随着TP浓度和作用时间的增加而下降,呈现出浓度和时间效应。此外,TP抑制HCT116细胞增殖的活性较5-FU增强,这只是初步有待深入研究。
自噬(autophagy)是细胞的一种基本代谢机制,在生存压力条件下如营养物质不足,可降解细胞内非必需组分,以提供营养保证细胞的生存[9]。已有的研究表明,在多种肿瘤中都存在着自噬水平的改变和异常,表现在肿瘤病理变化的不同阶段,从而促进或抑制肿瘤的发生和发展[10-11];研究发现[12],肝癌组织区域内的中性粒细胞大量高表达LC3,中性粒细胞自噬活性加强,可以增加迁移相关蛋白的表达,有助于癌细胞的侵袭转移。在营养缺乏时肝细胞内的自噬体明显增多,自噬体特异蛋白LC3从LC3-Ⅰ向LC3-Ⅱ的表型转化明显减少,表明营养缺乏时肝癌细胞的自噬能力是增强的,同时肝癌细胞的侵袭力是增强的[13]。我们的结果显示,不同浓度的TP作用HCT116细胞48 h后,LC3-Ⅱ的水平随着TP浓度的增加而升高,呈浓度依赖性;用40 nmol·L-1TP作用HCT116细胞,LC3-Ⅱ的水平随作用时间的延长而增加,呈时间依赖性。表明TP可以上调LC3-Ⅱ蛋白的表达,进而促进HCT116细胞产生自噬,这和MDC染色所观察到的结果一致。然而,自噬作为一种应激反应能够促进肿瘤细胞的存活。自噬通过清理化疗与电离辐射时受损的大分子或细胞器保护被化疗药物攻击与遭受电离辐射的肿瘤细胞,从而使之逃避凋亡而存活下来[4]。

Fig 4 Effect of TP combined with 3-MA on apoptosis of HCT116 cells by flow cytometry microscopy (a~d: control group; TP group; TP + 3-MA group; 3-MA group) **P<0.01 vs control
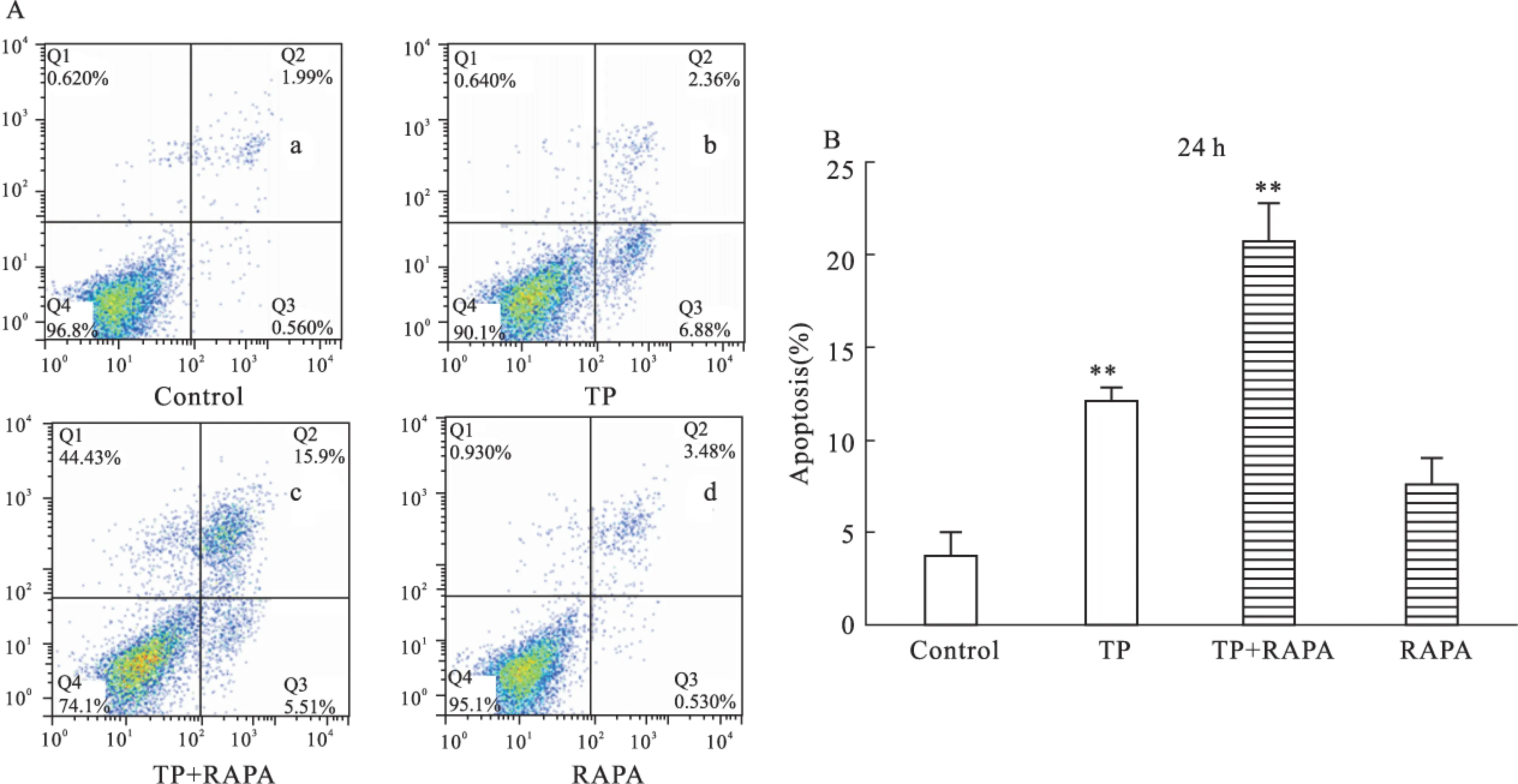
Fig 5 Effect of TP combined with RAPA on apoptosis of HCT116 cells by flow cytometry microscopy (a~d: control group; TP group; TP + RAPA group; RAPA group) **P<0.01 vs control
目前对于自噬与凋亡的研究结果显示,大部分研究提示自噬发生于凋亡之前,并可以进一步上调后者的活性;但是在部分细胞内部,细胞自噬却通过抑制凋亡因子的释放抑制了凋亡[15]。我们用TP联合自噬诱导剂RAPA作用HCT116细胞24 h,与对照组比较发现,TP组细胞凋亡率增加;与TP组比较,TP+RAPA组细胞凋亡率明显增加。TP联合RAPA作用HCT116细胞48 h的话,会出现细胞大量的死亡,表现出TP的毒性。另有研究发现[16],自噬抑制剂3-MA可使鼻咽癌细胞的增殖能力下降,细胞有典型凋亡形态学改变,提示自噬与凋亡之间的对抗关系。我们用TP联合自噬抑制剂3-MA作用HCT116细胞48 h,与对照组比较发现,TP组细胞凋亡率增加,RAPA组细胞凋亡率无变化;与TP组比较,TP + 3-MA组细胞凋亡率明显增加。基于自噬、凋亡以及二者相互作用后对肿瘤的发展过程产生的复杂影响,探讨如何利用自噬与凋亡的作用关系,促进对肿瘤的抑制,目前的研究虽然取得了一些进展,但是自噬与凋亡间相互作用的确切机制并不十分清楚,如何利用好自噬与凋亡之间的关系,促进肿瘤细胞死亡,达到理想的抗肿瘤效果仍将是今后研究的重点。
另外,TP能够诱导细胞凋亡、抑制鼻咽癌细胞CNE-2Z生长,作用的机制可能与其诱导氧化应激及抑制Akt的表达及活化有关[17]。在众多的凋亡调控基因中,bcl-2和bax是凋亡调控过程中一对相互对立的重要基因,caspase-3是凋亡过程中关键的凋亡执行蛋白酶,三者在细胞凋亡过程中的关系是当今研究中的热点,也是本研究的继续。
(致谢:本研究在江西省医学科学院实验中心完成,在此致以由衷的感谢!)
[1]Fan D, He X, Bian Y, et al. Triptolide modulates TREM-1 signal pathway to inhibit the inflammatory response in rheumatoid arthritis [J].IntJMolSci, 2016,17(4): 498(1-14).
[2]Wang H, Ma D, Wang C, et al. Triptolide inhibits invasion and tumorigenesis of hepatocellular carcinoma MHCC-97H cells through NF-κB signaling [J].MedSciMonit, 2016,22:1827-36.
[3]唐琪,布文奂,王丹丹,等. 自噬与凋亡的相互作用及其对肿瘤发展过程影响的研究进展 [J]. 吉林大学学报(医学版),2015,41(6):1303-6.
[3]Tang Q, Bu W H, Wang D D, et al. Advance research on interaction between autophagy and apoptosis and its influence in development of tumors[J].JJilinUniv(MedEdit), 2015,41(6):1303-6.
[4]张茂娜,汤志杰,陈莉. 自噬-凋亡通路在肿瘤靶向治疗中的意义 [J]. 肿瘤学杂志,2014,5(20):413-8.
[4]Zhang M N, Tang Z J, Chen L, et al. The significance of autophagy-apoptosis pathway in target therapy for cancer[J].JChinOncol, 2014,5(20):413-8.
[5]Jemal A, Bray F, Center MM, et al. Global cancer statistics [J].CACancerJClin, 2011, 61(2):69-90.
[6]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012 [J].CACancerJClin, 2012, 62(1): 10-29.
[7]郑荣寿,张思维,吴良有,等. 中国肿瘤登记地区2008年恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2012,21(1): 1-12.
[7]Zheng R S,Zhang S W, Wu L Y, et al. Report of incidence and mortality from china cancer registries in 2008[J].ChinaCancer, 2012,21(1): 1-12.
[8]Ransohoff D F. How much does colonoscopy reduce colon cancer mortality? [J].AnnInternMed, 2009, 150(1): 50-2.
[9]Kobayashi S. Choose delicately and reuse adequately:The newly revealed process of autophagy [J].BiolPharmBull, 2015, 38(8): 1098-103.
[10]Levine B, Sinha S C, Kroemer G. Bcl-2 family members:Dual regulators of apoptosis and autophagy [J].Autophagy, 2008, 4(5): 600-6.
[11]Maycotte P, Jones K L, Goodall M L, et al. Autophagy supports breast cancer stem cell maintenance by regulating IL6 secretion [J].MolCancerRes, 2015, 13(4): 651-8.
[12]Li X F, Chen D P, Ouyang F Z, et al. Increased autophagysustains the survival and pro-tumourigenic effects of neutrophils in human hepatocellularcarcinoma [J].JHepatol, 2015, 62(1):131-9.
[13]李俊, 杨斌, 郭瑜, 等. 营养剥夺通过诱导自噬促进肝癌细胞侵袭[J]. 华中科技大学学报(医学版),2012, 41(5): 513-7.
[13]Li J, Yang B, Guo Y, et al. Starvation-induced autophage promotes invasion of hepatocellular carcinoma cells[J].ActaMedUnivSciTechnolHuazhong, 2012, 41(5): 513-7.
[14]Kanzawa T, Kondo Y, Ito H, et al. Induction of autophagic celldeath in malignant glioma cells by arsenic trioxide[J].CancerRes, 2013,63(9): 2103-8.
[15]Bousman C A, Chana G, Glatt S J, et al. Preliminary evidence of ubiquitin proteasome system dysregulation in schizophrenia and bipolar disorder: convergent pathway analysis findings from two independent samples [J].AmJMedGenetBNeuropsychiatrGenet, 2010,153B(2):494-502.
[16]Song L L, Liu H, Linyan M A, et al. Inhibition of autophagy by 3-MA enhances ERS induced apoptosis in human nasopharyngeal carcinoma cells [J].OncolLetters, 2013,6(4):1031-8.
[17]王秀,张竞竞,张配,等. 雷公藤甲素诱导鼻咽癌细胞凋亡作用[J]. 中国药理学通报,2014,30(8):1147-50.
[17]Wang X, Zhang J J, Zhang P, et al. Effect of triptolide on apoptosis of nasopharynx cancer[J].ChinPharmacolBull, 2014,30(8):1147-50.
Effect of triptolide on human colorectal cancer HCT116 cell proliferation, autophagy and apoptosis
ZHAO Lin1, WU Peng2, ZHANG Ping-gui2, XIE Da-ze2, GAO Dian3, ZHOU Nan-jin2
(1.ExperimentCenterofJiangxiAcademyofMedicalSciences, 2.InstituteofMolecularMedicine,JiangxiAcademyofMedicalSciences,3.DeptofPathogenBiologyandImmunology,MedicalCollegeofNanchangUniversity,Nanchang330006,China)
AimTo investigate the effect of triptolide (TP) on human colorectal cancer HCT116 cell proliferation and explore the potential mechanism of TP in treating colon cancer. MethodsMTT assay was used for estimating the survival rates of HCT116 cells exposed to different concentrations and different duration time of TP. Western blot (WB) was used for testing the expression of LC3-Ⅱ. MDC staining was employed to detect cell autophagy. Flow cytometry (FCM) was applied to test the effects of TP on cell apoptosis. ResultsTP could inhibit cell proliferation in HCT116 cells. The expression of LC3-Ⅱ was enhanced with the increase of the concentration of TP after exposed to different concentrations of TP for 48 h and the duration time of TP after exposed to 40 nmol·L-1TP,and the number of acid autophagic vacuoles in HCT116 cells had increased, which was observed by fluorescence microscope. The HCT116 cells apoptotic rates in TP group had decreased compared to control group and decreased significantly compared to TP+3-MA group. The HCT116 cells apoptotic rates in TP group had increased compared to control group and increased significantly compared to TP+RAPA group. ConclusionTP could inhibit the proliferation of human colon cancer HCT116 cells and induce apoptosis in HCT116 cells, which indicates that synergy may exist between autophagy and apoptosis.
triptolide; colon cancer; HCT116 cell; proliferation; autophagy; apoptosis
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.028.html
2016-06-14,
2016-08-27
江西省自然科学基金资助项目(No 20142BAB205079)
赵林(1963-) ,男,高级实验师,研究方向:免疫学,E-mail:18970025900@189.com;
周南进(1959-),男,研究员,研究方向:免疫药理学,通讯作者,E-mail: jxznj@163. com
10.3969/j.issn.1001-1978.2016.10.014
A
1001-1978(2016)10-1399-06
R284.1;R329.24;R329.25;R735.350.22;R979.1
