Hsp90抑制剂FS-108抑制癌基因依赖肿瘤细胞增殖及运动的机制研究
2016-11-08平芳芳王月琴张敏敏陈丹琦
平芳芳,王月琴,张敏敏,石 峰,陈丹琦,丁 健
(1. 上海大学生命科学学院,上海 200444;2. 中国科学院大学上海药物研究所新药研究国家重点实验室,上海 201203;3.中国科学院大学上海药物研究所有机合成与药物化学实验室,上海 201203;4.中国药科大学药学院,江苏 南京 210009)
◇论著◇
Hsp90抑制剂FS-108抑制癌基因依赖肿瘤细胞增殖及运动的机制研究
平芳芳1,2,王月琴2,4,张敏敏2,石峰3,陈丹琦3,丁健2
(1. 上海大学生命科学学院,上海200444;2. 中国科学院大学上海药物研究所新药研究国家重点实验室,上海201203;3.中国科学院大学上海药物研究所有机合成与药物化学实验室,上海201203;4.中国药科大学药学院,江苏 南京210009)
目的探讨Hsp90抑制剂FS-108抑制癌基因依赖的肿瘤细胞EBC-1和A375的增殖及运动能力的作用机制。方法采用磺酰罗丹明B法检测FS-108对细胞增殖的影响;采用蛋白免疫印迹法检测FS-108对Hsp90客户蛋白、周期调控蛋白及凋亡调控蛋白的变化;采用流式细胞术检测FS-108作用后细胞周期分布及凋亡情况;采用Transwell小室方法检测FS-108对细胞运动能力的影响。结果FS-108对EBC-1和A375均有明显的增殖抑制作用,IC50分别为25.53 nmol·L-1和30.02 nmol·L-1。FS-108能有效降解肿瘤细胞中的客户蛋白c-Met和B-Raf并进而抑制下游AKT及ERK信号通路。FS-108能诱导细胞产生G2/M期阻滞及凋亡。同时,FS-108还能明显抑制EBC-1和A375细胞的运动能力。结论Hsp90抑制剂FS-108主要通过诱导肿瘤细胞产生G2/M期阻滞和细胞凋亡,发挥其抑制增殖的细胞生物学效应,同时,FS-108也具有一定抗转移潜能。
Hsp90;EBC-1和A375细胞;周期阻滞;细胞凋亡;caspase-3; 迁移
随着人们对肿瘤分子生物学机制的逐渐认识,分子靶向治疗理念日益兴起,开发新的药物靶点、研发分子靶向药物成为肿瘤治疗的重要研究方向[1]。热休克蛋白90(heat short protein 90, Hsp90)作为分子伴侣在维持其客户蛋白的分子构象及稳定性等方面发挥重要作用[2-3]。在肿瘤细胞中,Hsp90呈现高诱导表达且其众多客户蛋白与肿瘤细胞的增殖、血管生成、迁移和侵袭等密切相关[4-5],而抑制Hsp90能够同时抑制多条信号通路从而发挥抗肿瘤活性[6]。鉴于这一特性,Hsp90近年来已成为抗肿瘤药物治疗领域受到广泛关注的靶点之一,目前已有多个抑制剂处于不同的临床研究阶段[7-9]。研究发现,在肿瘤中异常激活的激酶,如EGFR突变、HER2扩增和EML4-ALK融合等,是Hsp90重要的客户蛋白,且这类癌基因依赖表型的肿瘤细胞对Hsp90抑制剂更为敏感,这一现象在临床试验中也得到证实[10-13]。以上结果提示,开发Hsp90抑制剂并在携带癌基因依赖表型的敏感病人中开展临床应用是值得探索的方向。
FS-108是本课题组与沈竞康研究员课题组合作开发的全新结构的Hsp90抑制剂,在分子、细胞及动物活体水平均显示出较强的活性[14],目前正在进行系统的临床前评价。为进一步阐明其抗肿瘤作用,我们在本实验中对FS-108在癌基因依赖肿瘤细胞EBC-1(MET扩增)和A375(B-Raf突变)中的相关生物学效应及机制进行考察,为后续的临床研究提供重要理论依据。
1 材料与方法
1.1材料受试化合物FS-108由中国科学院大学上海药物研究所沈竞康课题组提供,用DMSO配制成10 mmol·L-1的母液,-20 ℃保存待用。人肺癌细胞株EBC-1购自日本研究资源库,人黑色素瘤细胞株A375购自美国模式培养物保藏中心。
1.2试剂及仪器MEM培养基、胎牛血清购自Gibco公司;DMEM培养基购自Corning公司;胰蛋白酶(Trypsin)购自Amresco公司;抗体Cdc2、Cdc25C、Cyclin B1、Hsp90 α、Hsp70、β-actin购自Epitomics公司;c-Met、Phospho-c-Met(Tyr1234/1235)、B-Raf、Phospho-B-Raf(Ser445)、Phospho-Cdc2(Tyr15)、Phospho-Cdc25C(Ser216)、Akt、Phospho-Akt(Ser473)、Erk、Phospho-Erk(Thr202/Tyr204)、Cleaved PARP(Asp214)、Cleaved Caspase-3(Asp175)、Bcl-2、Bax等抗体均购自Cell Signaling Technology公司;Enhanced Chemiluminescence detection reagent(ECL)购自Bio-Rad公司;磺酰罗丹明B(Sulforhodamine B, SRB)染料购自Sigma公司;三氯乙酸(TCA)、无水乙醇、甲醇、甘氨酸、Tris、Tween-20等均购自国药集团化学试剂有限公司;PBS粉末购自Dycent Biotech;丙酮酸钠购自生工生物工程(上海)有限公司;BSA购自鼎国生物技术有限公司;丽春红染色液、BCA蛋白浓度测定试剂盒、碘化丙啶(propidium iodide, PI)和RNase A均购自江苏碧云天生物技术有限公司;Annexin V-FITC细胞凋亡检测试剂盒购自南京诺唯赞生物科技有限公司。
6孔和12孔细胞培养板购自美国Costar公司;3111型CO2细胞培养箱购自美国Thermo Scientific公司;荧光显微镜Olympus BX51购自日本Olympus 公司;Beckman 6605698型细胞计数仪购自美国Beckman Coulter公司;流式细胞仪FACSCaliburTM购自美国Becton Dickinson公司;蛋白垂直电泳装置Mini Protean 3 Cell购自Bio-Rad公司;可调波长式微孔板酶标仪VERSAmax购自Molecular Devices公司;5417R小型台式高速离心机购自德国Eppendorf公司。
1.3细胞培养EBC-1细胞培养于MEM培养基中,A375细胞培养于含有110 mg·L-1丙酮酸钠、灭活胎牛血清的体积分数为0.1的DMEM培养基中,均遵循细胞提供机构的指导条件培养于37 ℃、 体积分数为0.05的CO2恒温培养箱。
1.4SRB法检测FS-108对肿瘤细胞的生长抑制作用取对数生长期的细胞以每孔3×103的密度接种于96孔板中,培养24 h后分别加入10 μL不同浓度的化合物,对照孔加入等体积生理盐水。药物终浓度分别为1×104、 1×103、 500、 100、50、10、5和1 nmol·L-1,对照组及实验组均设置3复孔,作用72 h后弃去培养液,用预冷的体积分数为0.1的 TCA、4 ℃固定1 h,蒸馏水洗涤5次,空气中自然干燥后,每孔加入100 μL由体积分数为0.01的冰醋酸配制的4 g·L-1的SRB溶液,室温染色30 min,弃去染色液,体积分数为0.01的冰醋酸洗涤5次,空气中自然干燥后,每孔加入150 μL Tris-HCl溶液(10 mmol·L-1Tris, pH10.0),酶标仪560 nm波长下检测各孔的光密度值(D),并计算抑制率。
1.5流式细胞术检测FS-108对细胞周期分布的影响取对数生长期的细胞以每孔1×105接种于12孔板中,培养24 h后,加入62.5、125、250 nmol·L-1的FS-108作用细胞24 h。处理结束后,用不含EDTA的胰酶消化并收集细胞,4 ℃、500×g离心5 min,弃上清;用预冷的PBS重悬,4 ℃、500×g离心5 min,洗涤1次;弃上清,加入300 μL预冷PBS,将细胞重悬后缓慢加入预冷的无水乙醇(边加边涡旋),4 ℃固定过夜;500×g离心5 min,弃上清,用预冷的PBS洗涤两次,加入500 μL含有RNase A(200 mg·L-1)和PI(50 mg·L-1)的PBS,混匀,37 ℃避光孵育30 min,用300目滤网过滤,流式细胞仪(FACS)检测,每组样品至少分析1×104个细胞。实验结果用Flow Jo软件处理。
1.6Annexin V-FITC/PI双染法检测FS-108诱导的细胞凋亡采用Annexin V-FITC细胞凋亡检测试剂盒,加药处理肿瘤细胞72 h后,用不含EDTA的胰酶消化并收集,4 ℃、500×g离心5 min。弃上清,用预冷的PBS重悬,4 ℃、500×g离心5 min,洗涤1次。弃上清,加入100 μL含有5 μL Annexin V-FITC(1 g·L-1)和5 μL PI(1 g·L-1)的PBS,混匀,室温避光孵育10 min后用400 μL PBS重悬,用300目滤网过滤,流式细胞仪(FACS)检测,每组样品至少分析1×104个细胞。用Flow Jo软件处理实验结果。
1.7Transwell小室检测FS-108对细胞运动的影响取对数生长期的细胞用无血清的培养基重悬,制成8×108·L-1的悬浮溶液,吸取100 μL接种在Transwell小室上层,下室加入600 μL含有10%血清的完全培养基培养24 h,加药处理后放置于37 ℃、体积分数为0.05的CO2培养箱中,正常孵育12 h后,吸掉上室中培养基残液,加入100 μL 预冷的体积分数为0.9的乙醇,4 ℃放置1 h,取出,吸掉乙醇,加入体积分数为1×10-3结晶紫染液,室温染色30 min,用清水洗净。自然晾干后,在荧光显微镜下拍照。实验重复3次。对于迁移的细胞用体积分数为0.1的冰醋酸常温溶解20 min,酶标仪600 nm波长下检测各孔的光密度值(D)。
1.8蛋白免疫印迹法检测信号通路取对数生长期的细胞以每孔3×105接种于6孔板中,培养24 h后,加入不同浓度的FS-108进行处理。用预冷的PBS洗涤2次后加入RIPA裂解液冰上裂解30 min。按照BCA蛋白浓度测定试剂盒说明书进行蛋白定量。取蛋白样品置于不同密度的聚丙烯酰胺凝胶中进行电泳,用半干法将蛋白转移至NC膜,用封闭液室温封闭1 h,一抗4 ℃孵育过夜,TBST洗涤4次,每次10 min,将膜置于对应的二抗溶液中室温孵育1 h,TBST洗涤4次,每次10 min,选择合适的发光试剂显色。
2 结果
2.1FS-108可明显抑制EBC-1和A375细胞的增殖EBC-1是c-Met依赖的细胞株,A375是B-Raf依赖的细胞株,而c-Met和B-Raf均是Hsp90的客户蛋白。首先,我们采用SRB法检测FS-108对肿瘤细胞的增殖抑制作用,不同浓度的FS-108分别处理EBC-1和A375 72 h后(Fig 1A), 我们发现,100 nmol·L-1的FS-108对EBC-1和A375细胞的抑制率分别为77%和82%,FS-108对EBC-1和A375的IC50分别为25.53 nmol·L-1和30.02 nmol·L-1。进一步我们研究FS-108是否通过降解客户蛋白抑制细胞增殖。我们采用蛋白免疫印迹法检测了62.5、125、250 nmol·L-1FS-108处理24 h后EBC-1中c-Met和A375中B-Raf蛋白水平的变化。结果显示,FS-108能有效促进c-Met和B-Raf蛋白的降解,并能抑制其下游AKT及ERK信号通路(Fig 1B)。

Fig 1 Effects of FS-108 on cell viability and degradation of client onco-proteins of oncogene addicted EBC-1 and A375 cells


Fig 2 Effects of FS-108 on cell cycle distribution of oncogene addicted EBC-1 and A375 cells
A: Effects of FS-108 on cell cycle distribution. EBC-1 and A375 cells were treated with FS-108 at 62.5, 125 and 250 nmol·L-1for 24 h. Cell cycle distribution was analyzed by FACS after propidium iodide staining; B: Effects of FS-108 on G2/M transition regulators. EBC-1 and A375 cells were treated with FS-108 at 62.5, 125 and 250 nmol·L-1for 24 h and cells lysates were immunoblotted with indicated antibodies
2.2FS-108可诱导EBC-1和A375细胞产生G2/M期阻滞诱导细胞周期阻滞和凋亡是药物发挥增殖抑制作用的主要方式。为了研究FS-108抑制癌基因依赖肿瘤细胞增殖的机制,我们用62.5、125、250 nmol·L-1FS-108处理细胞24 h,采用流式细胞术检测细胞周期分布情况。如Fig 2A所示,FS-108能剂量依赖性的引起EBC-1和A375细胞产生G2/M期阻滞。我们进一步检测了G2/M期调节蛋白的变化。结果显示,Cdc2和Cdc25C及其磷酸化水平均被下调(Fig 2B)。以上结果提示,FS-108能抑制G2/M期调节蛋白Cdc2和Cdc25C来发挥G2/M期细胞周期阻滞的功能。
2.3FS-108可诱导EBC-1和A375细胞产生凋亡接下来我们检测了FS-108对EBC-1和A375细胞凋亡的影响。62.5、125、250 nmol·L-1FS-108处理细胞72 h后,采用流式细胞术检测细胞凋亡情况。如Fig 3A所示,较低剂量的FS-108即能明显诱导EBC-1和A375细胞凋亡,62.5 nmol·L-1的FS-108诱导凋亡的比例分别为44.3%和37%。为了探索FS-108诱导凋亡的机制,我们检测了凋亡相关调节蛋白的变化。使用62.5、125、250 nmol·L-1FS-108分别处理EBC-1和A375细胞72 h后,蛋白免疫印迹结果如Fig 3B所示,FS-108能剂量依赖性的引起PARP及caspase-3切割,Bcl-2蛋白家族的促凋亡蛋白Bax上调,抗凋亡蛋白Bcl-2逐渐下调。以上结果提示,FS-108通过诱导Bax上调,抑制Bcl-2表达,最终激活caspase-3促进其底物蛋白PARP的切割,共同诱导肿瘤细胞凋亡。
2.4FS-108可明显抑制EBC-1和A375细胞的运动能力侵袭转移是恶性肿瘤发展的关键,抑制侵袭转移是抗肿瘤的一个重要研究方向。为检测FS-108对癌基因依赖肿瘤细胞运动能力的影响,我们使用Transwell小室检测250、500、1 000 nmol·L-1FS-108处理12 h后的细胞迁移情况,Fig 4A为荧光显微镜拍照结果,统计结果如Fig 4B。检测结果表明,250 nmol·L-1的FS-108能明显抑制EBC-1和A375细胞迁移,抑制率分别为66.4%和62.25%。提示FS-108具有一定的抗转移潜能。
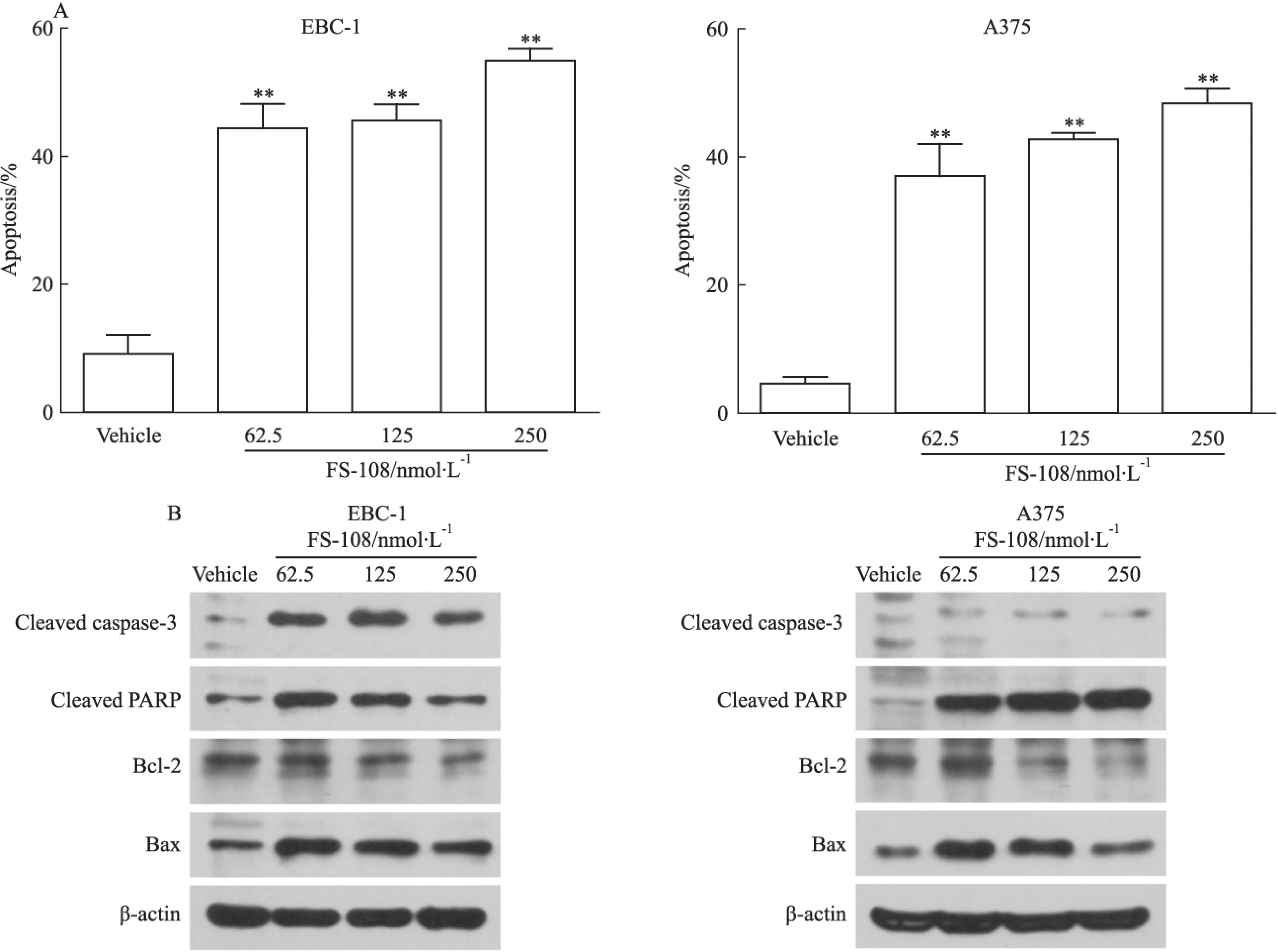
Fig 3 Effects of FS-108 on apoptosis induction of oncogene addicted EBC-1 and A375 cells
A: Effects of FS-108 on apoptosis induction. EBC-1 and A375 cells were treated with FS-108 at 62.5, 125 and 250 nmol·L-1for 72 h. Apoptosis was analyzed by FACS after Annexin V-FITC/PI staining.**P<0.01vsvehicle; B: Effects of FS-108 on apoptosis regulators. EBC-1and A375 cells were treated with FS-108 at 62.5, 125, 250 nmol·L-1for 72 h and cell lysates were immunoblotted with indicated antibodies
3 讨论
在本文中,我们对Hsp90抑制剂FS-108在癌基因依赖肿瘤细胞EBC-1和A375中的生物学效应及相关机制进行了考察。结果发现FS-108能明显抑制癌基因依赖肿瘤细胞的增殖,在EBC-1和A375中的IC50分别为25.53 nmol·L-1和30.02 nmol·L-1。为了探索FS-108是否通过抑制Hsp90活性抑制肿瘤细胞增殖,我们对Hsp90客户蛋白进行检测发现,在癌基因依赖的肿瘤细胞中,FS-108能有效降解细胞内的客户蛋白c-Met和B-Raf,并抑制下游AKT和ERK信号通路。细胞增殖相关生物学效应考察结果显示,FS-108作用24 h后,能剂量依赖性地下调G2/M期调控蛋白Cdc25C、p-Cdc25C(Ser216)、Cdc2和p-Cdc2(Thr15)从而引起G2/M期阻滞[15];FS-108作用72 h后,能明显抑制抗凋亡蛋白Bcl-2的表达,同时上调促凋亡蛋白Bax的表达,并进而促进caspase-3和PARP的切割诱导肿瘤细胞发生凋亡。同时,FS-108还能明显抑制EBC-1和A375的运动能力,显示一定的抗转移潜能。
选择适合人群对提高药物临床疗效具有重要指导意义[16]。EGFR突变、HER2扩增和EML4-ALK融合等是肿瘤中常见的异常表达形式,且是Hsp90的重要客户蛋白,其功能发挥高度依赖Hsp90的活性。众多临床前及临床研究亦表明,癌基因依赖的肿瘤细胞对Hsp90抑制剂更加敏感[17-18]。在本实验中我们同样发现FS-108可有效抑制MET扩增和B-Raf突变细胞的增殖。基于此,开发高效低毒的小分子抑制剂,并在携带癌基因依赖表型的肿瘤病人中开展临床试验是Hsp90抑制剂重要的研究方向之一。

Fig 4 Effects of FS-108 on migration of oncogene addicted EBC-1 and A375 cells
Effects of FS-108 on cell motility. EBC-1 and A375 cells were treated with FS-108 at 250, 500, 1 000 nmol·L-1for 12 h. Then, the migrated cells were observed using fluorescence microscope(A), and statistically analyzed(B)
综上所述,本研究初步考察了Hsp90抑制剂FS-108对癌基因依赖肿瘤细胞的增殖及运动能力的影响,并初步阐明了其作用机制,为其后续的临床研究提供了重要的理论依据。
(致谢:本文实验在中国科学院大学上海药物研究所国家新药研究重点实验室完成,由丁健研究员指导,平芳芳、王月琴、张敏敏、石峰和陈丹琦共同完成,感谢丁健研究员的指导,感谢石峰和陈丹琦提供FS-108化合物,感谢王月琴和张敏敏对实验做出的贡献。)
[1]Huang M, Shen A, Ding J,Geng M. Molecularly targeted cancer therapy: some lessons from the past decade[J].TrendsPharmacolSci, 2014, 35(1): 41-50.
[2]Pearl L H, Prodromou C. Structure and mechanism of the Hsp90 molecular chaperone machinery[J].AnnuReviBiochem, 2006, 75:271-94.
[3]Taipale M, Jarosz D F, Lindquist S. HSP90 at the hub of protein homeostasis: Emerging mechanistic insights[J].NatRevMolCellBiol, 2010, 11(7): 515-28.
[4]Chiosis G, Neckers L. Tumor selectivity of Hsp90 inhibitors: the explanation remains elusive[J].ACSChemBiol, 2006, 1(5): 279-84.
[5]Lachowiec J, Lemus T, Borenstein E, et al. Hsp90 promotes kinase evolution[J].MolBiolEvol, 2015, 32(1): 91-9.
[6]Roe S M, Prodromou C, O'brien R, et al. Structural basis for inhibition of the Hsp90 molecular chaperone by the antitumor antibiotics radicicol and geldanamycin[J].JMedChem, 1999, 42(2): 260-6.
[7]Sidera K, Patsavoudi E. HSP90 inhibitors: current development and potential in cancer therapy[J].RecentPatAnticancerDrugDiscov, 2014, 9(1):1-20.
[8]Jhaveri K, Ochiana S O, Dunphy M P, et al. Heat shock protein 90 inhibitors in the treatment of cancer: current status and future directions[J].ExpertOpinInvestigDrugs, 2014, 23(5): 611-28.
[9]Jhaveri K, Taldone T, Modi S, et al. Advances in the clinical development of heat shock protein 90(Hsp90) inhibitors in cancers[J].BiochimBiophysActa, 2012, 1823(3): 742-55.
[10]Normant E, Paez G, West K A, et al. The Hsp90 inhibitor IPI-504 rapidly lowers EML4-ALK levels and induces tumor regression in ALK-driven NSCLC models[J].Oncogene, 2011, 30(22): 2581-6.
[11]Polier S, Samant R S, Clarke P A, et al. ATP-competitive inhibitors block protein kinase recruitment to the Hsp90-Cdc37 system[J].NatChemBiol, 2013, 9(5): 307-12.
[12]Taipale M, Krykbaeva I, Whitesell L, et al. Chaperones as thermodynamic sensors of drug-target interactions reveal kinase inhibitor specificities in living cells[J].NatBiotechnol, 2013, 31(7): 630-7.
[13]Taipale M, Krykbaeva I, Koeva M, et al. Quantitative analysis of HSP90-client interactions reveals principles of substrate recognition[J].Cell, 2012, 150(5): 987-1001.
[14]Chen D, Shen A, Li J, et al. Discovery of potent N-(isoxazol-5-yl)amides as HSP90 inhibitors[J].EurJMedChem, 2014, 87:765-81.
[15]吉晓霞, 曾颖, 何洁. DADS通过Chk1/Cdc25C/CyclinB1/CDK1通路诱导白血病HL-60细胞G2/M期阻滞[J]. 中国药理学通报, 2015, 31(2): 221-6.
[15]Ji X X, Zeng Y, He J. DADS induces G2/M arrest through Chk1/Cdc25C/CyclinB1/CDK1 pathway in human leukemia HL-60 cells[J].ChinPharmacolBull, 2015, 31(2): 221-6
[16]Kelloff G J, Sigman C C. Cancer biomarkers: selecting the right drug for the right patient[J].NatRevDrugDiscov, 2012, 11(3): 201-14.
[17]Neckers L, Workman P. Hsp90 molecular chaperone inhibitors: are we there yet?[J].ClinCancerRes, 2012, 18(1): 64-76.
[18]Scaltriti M, Dawood S, Cortes J. Molecular pathways: targeting hsp90-who benefits and who does not[J].ClinCancerRes, 2012, 18(17): 4508-13.
FS-108, an Hsp90 inhibitor,impairs survival and motility of oncogene addicted cancer cells
PING Fang-fang1,2, WANG Yue-qin2,4, ZHANG Min-min2, SHI Feng3, CHEN Dan-qi3, DING Jian2
(1.CollegeofLifeScience,ShanghaiUniversity,Shanghai200444,China;2.StateKeyLaboratoryofDrugResearch,ShanghaiInstituteofMaterialMedicine,UniversityofChineseAcademyofSciences,Shanghai201203,China;3.SyntheticOrganicandMedicinalChemistryLaboratory,ShanghaiInstituteofMaterialMedicine,UniversityofChineseAcademyofSciences,Shanghai201203,China;4.CollegeofPharmacy,ChinaPharmaceuticalUniversity,Nanjing210009,China)
AimTo investigate the anti-tumor effects of FS-108 an Hsp90 inhibitor, on oncogene addicted EBC-1 and A375 cells. MethodsSRB assay was performed to investigate cell proliferation. Immunoblot was conducted to investigate the specific proteins. FACS was conducted to test cell cycle distribution and apoptosis. Transwell assay was conducted to investigate cell motility.ResultsFS-108 significantly suppressed cell proliferation of EBC-1 and A375 cancer cells with IC50at 25.53 nmol·L-1and 30.02 nmol·L-1respectively. FS-108 treatment triggered the degradation of key client proteins such as c-Met and B-Raf and thereby reduced their downstream AKT and ERK signaling pathways. The FACS analysis results demonstrated that FS-108 treatment induced G2/M phase arrest and apoptosis significantly. Furthermore, FS-108 inhibited the migration of EBC-1 and A375 cells.ConclusionAs a potent Hsp90 inhibitor, FS-108 can inhibit oncogene addicted cancer cells proliferation through induction of G2/M phase arrest and apoptosis.
Hsp90; EBC-1 and A375 cells; G2/M arrest; apoptosis; Caspase-3; migration
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.014.html
2016-06-09,
2016-08-23
国家自然科学基金资助项目(No 9122920)
平芳芳 (1991-),女,硕士生,研究方向:肿瘤药理学,E-mail: st1127665523@163.com;
王月琴(1987-),女,博士生,研究方向:肿瘤药理学,共同第一作者,E-mail: wangyueqin-good@163.com;
10.3969/j.issn.1001-1978.2016.10.007
A
1001-1978(2016)10-1357-07
R329.24;R329.25;R329.28;R979.1
丁健(1953-),男,博士,院士,博士生导师,研究方向:肿瘤药理学,通讯作者,E-mail: jding@simm.ac.cn
