恶性胸腔积液临床病理分析
2016-10-31韩军平王丽曾达春和罗文潇曾俊文马文霞
韩军平 王丽曾 达春和 罗文潇 曾俊文 马文霞
恶性胸腔积液临床病理分析
韩军平 王丽曾 达春和 罗文潇 曾俊文 马文霞
目的:探讨恶性胸腔积液肿瘤的病理类型、所占比例、临床病理特征及鉴别诊断。方法:利用细胞团块收集器收集体液中脱落细胞,进行病理切片观察细胞形态及免疫组化对108例恶性胸腔积液进行病理诊断及肿瘤病理分型。结果:在119例恶性胸腔积液中,肺腺癌64例,鳞癌6例,小细胞癌10例,恶性间皮瘤15例,胃癌3例,胰腺癌3例,胆囊癌3例,肠癌3例,卵巢癌3例,乳腺癌6例,非何杰金氏淋巴3例。男性61例,女性58例,年龄19~87岁,平均年龄67.8岁。临床主要症状是胸闷、气短、咳嗽、胸痛,伴有原发器官肿瘤病史等。CT表现为胸膜增厚、胸水、多发或单发胸膜结节和原发器官占位性病变。结论:恶性胸腔积液中以肺腺癌多见,其次为恶性间皮瘤,利用细胞团块收集器收集体液中脱落细胞,进行病理切片细胞形态观察及免疫组化,有助于提高癌细胞检出率及肿瘤病理分型,鉴别诊断。
细胞团块收集器;恶性胸腔积液;肺癌;免疫组化
人体正常生理状态下,胸膜腔内有少量液体(<20m l)起润滑作用,病理状态下液体量增多而形成胸腔积液[1],其量与病情严重程度和病变部位有关。恶性胸腔积液(malignant pleural effusion,MPE)是指原发于胸膜的恶性肿瘤或其他部位的恶性肿瘤转移到胸膜所致。MPE常见的病因是肺癌、乳腺癌、恶性淋巴瘤和多发性骨髓瘤,卵巢癌和胃癌少见,其中以肺癌最常见。MPE增长迅速,并产生压迫症状,其中最常见的是渐进性呼吸困难,并伴有胸痛和咳嗽。目前,恶性胸腔积液肿瘤病理类型的总结和鉴别诊断文献报道较少。本文现对119例恶性胸腔积液临床病理资料进行分析,旨在探讨恶性胸腔积液中各类恶性肿瘤的比例、病理特点及鉴别诊断。
1 材料与方法
1.1 材料 选取白银市第一人民医院2014~2015年临床送检恶性胸膜腔积液标本108例,所有标本均利用细胞团块收集器制作细胞团块。
1.2 方法 临床将抽取的胸水标本除做其他检验外,其余全部立即送检,一般以200~800m l适宜。将胸水标本测量体积,按照1∶10的比例加入甲醛溶液,使标本以10%福尔马林固定。将标本自然沉降30~ 60min,弃去上清液,留沉淀物30~50ml,置入50ml离心管中,以2000r/min离心10min。弃去上清液,取沉淀物1~2滴进行常规涂片,并在剩余沉淀物中加入1m l95%的乙醇,混匀沉淀物,加入1滴蛋白螯合剂,混匀;将混合液全部置入细胞团块收集器中,以2000r/min离心10min,取出细胞团块,进行包埋,常规脱水、透明、浸蜡后包埋,制成4μm厚的细胞块石蜡切片,进行HE染色,免疫组化检测CK5/6、MC、Calretinin、TTF-1、NapsinA、CEA、Ki-67、ER、PR、Villin、CA-125等免疫标记物的表达,细胞切片和细胞涂片对比观察,进一步鉴别胸水的良恶性,同时诊断肿瘤类型。
1.3 试剂 细胞团块收集器、蛋白螯合剂均为本实验室自己制作、研发,免疫组化染色过程所需单克隆抗体:CK5/6、MC、Calretinin、TTF-1、NapsinA、CEA、Ki-67、ER、PR、Villin、CA-125等鼠抗人单克隆抗体,试剂盒UltraSensitive SP均购自福州迈新生物技术开发有限公司,按试剂盒说明书进行操作,PBS代替一抗作阴性对照。
1.4 结果判断 细胞学诊断标准按照《细胞病理学诊断图谱及实验技术》[2]。所有涂片、切片需2位有经验的病理副主任医师阅片,胸水癌细胞阳性者,要得到病理活检资料证实或临床综合资料的验证;免疫组化染色中,CK5/6、MC、Calretinin、NapsinA、CEA、Villin、CA-125蛋白表达于细胞膜,Ki-67、TTF-1、ER、PR、蛋白表达于细胞核,均呈棕黄色颗粒;阳性细胞>10%为阳性。
1.5 统计学方法 采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,计数资料以率表示,两两间用χ2检验并行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床表现及影像学特点 119例恶性胸腔积液患者中,男性61例,女性58例,年龄19~87岁,平均年龄67.8岁。临床表现包括胸闷、气短、咳嗽、胸痛。CT表现为肺部有明显结节者64例,脏层胸膜局限或弥漫增厚者35例,纵隔肿物3例,其余17例患者有乳腺癌、胃癌、肠癌、胰腺癌、卵巢癌及胆囊癌相关病史。
2.2 恶性胸腔积液中肿瘤细胞的病理类型、肿瘤所占比例 在119例恶性胸腔积液中,肺腺癌最多(60.1%),其次为恶性间皮瘤(13.8%)和小细胞癌(9.2%),其他器官原发肿瘤转移至胸膜以乳腺癌最多(5.56%)。见表1。
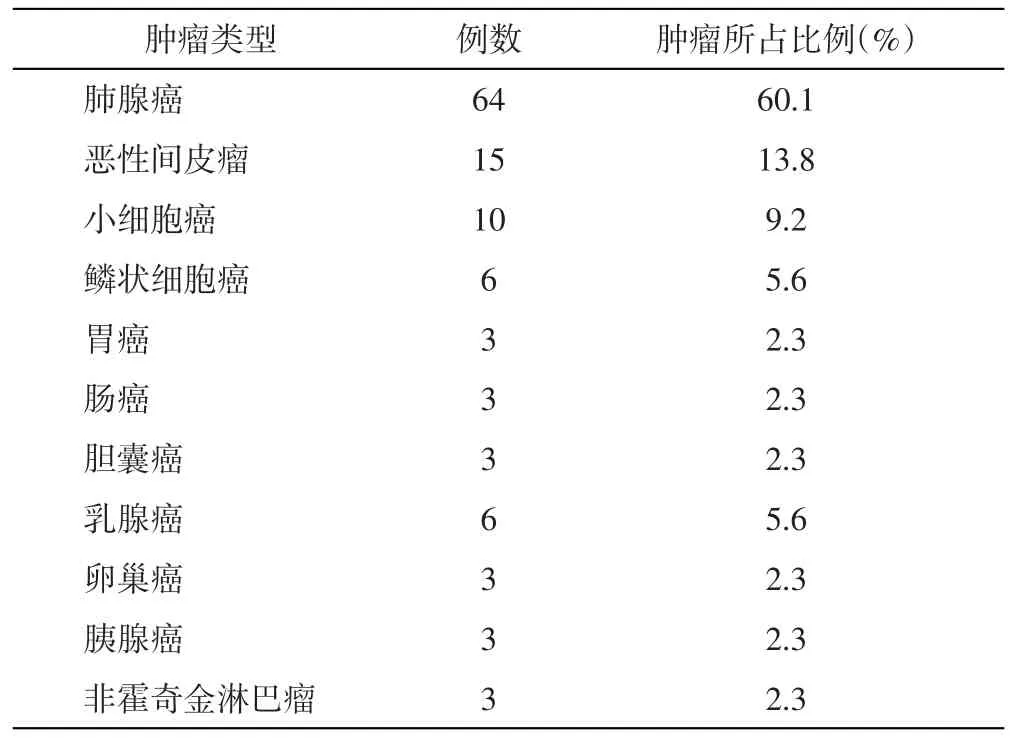
表1 恶性胸腔积液肿瘤细胞的病理类型、肿瘤所占比例(%)
2.3 肿瘤细胞形态,免疫组化结果及鉴别诊断 在恶性胸膜腔积液中,最常见的癌细胞为肺腺癌、恶性间皮瘤。癌细胞呈巢团状、乳头状、腺样或弥漫排列,需病理形态学结合免疫表型进行鉴别诊断。肺腺癌和恶性间皮瘤组织中TTF-1、NapsinA、CEA、MC、Calretinin的阳性表达率具有统计学意义(P<0.05),而CK5/6的表达无统计学意义(P>0.05)。其他类型的癌细胞,大多具有原发器官肿瘤病史及相关免疫表型。见表2。①肺腺癌:腺癌细胞聚集形成实性团、腺泡状结构,细胞胞浆丰富,核仁明显(图1),免疫表型主要表达TTF-1、NapsinA、CEA。②恶性间皮瘤(图2):瘤细胞聚集成桑葚球样细胞团,乳头状排列,细胞形态与正常间皮细胞相似,免疫表型主要表达MC、Calretinin。③鳞状细胞癌:癌细胞单个散在,核染色质均匀分布,核仁不明显,或巢团状排列,免疫表型主要表达CK5/ 6、P63、TTF-1、Ki-67。④小细胞癌:成串珠样或堆叠挤压呈椎骨节状结构,胞浆少或呈裸核样,核染色质细颗粒样,无核仁,免疫表型主要表达Syn、CgA、P56、TTF-1、Ki-67。⑤非霍奇金淋巴瘤:可见弥漫分布的大小一致的瘤细胞,细胞核不规则,可见核切迹或核凸起,可见核仁,T细胞淋巴瘤,主要表达CD3,CD45RO,B细胞淋巴瘤主要表达CD20,CD79α。⑥胃肠癌,胆囊癌,胰腺癌免疫表型主要表达CK20,Villin。乳腺癌免疫表型主要表达ER,RP。卵巢癌免疫表型主要表达CA-125,CK7。
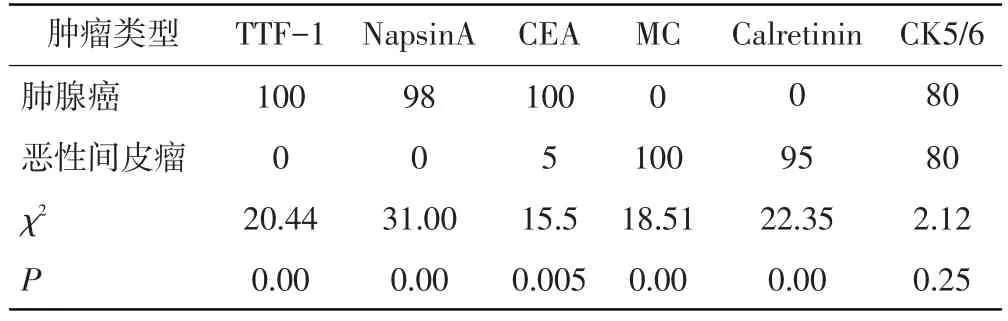
表2 肺腺癌和恶性间皮瘤免疫表型表达率(%)
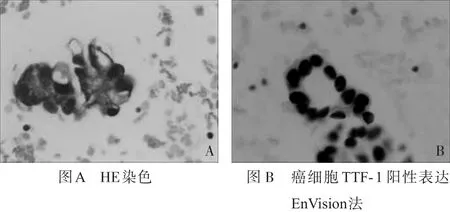
图1 肺腺癌胸水细胞切片镜下表现
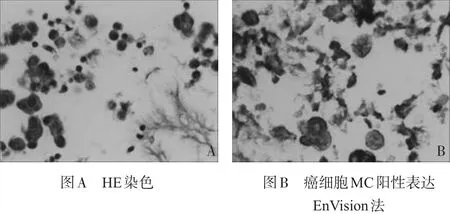
图2 恶性间皮瘤胸水细胞切片镜下表现
3 讨论
恶性胸膜腔积液大多由原发于肺脏及胸膜肿瘤引起,也有部分其他脏器原发肿瘤转移引起。肺和胸膜常见有肿瘤、肺腺癌、恶性胸膜间皮瘤、小细胞癌、鳞状细胞癌等。其中以肺腺癌最多见,占33%,其他脏器转移性腺癌以乳腺癌最多,占20.9%[3]。胸水脱落细胞是诊断恶性胸水重要的标本来源,临床肺和胸膜肿瘤患者80%伴有不同程度胸水[4]。在胸水中所查到的恶性肿瘤主要为肺腺癌和恶性间皮瘤,两者细胞形态相似,有时鉴别诊断很困难。此外,在胸水细胞学诊断面临另一难点是如何识别良性间皮细胞,在炎症和肿瘤因子的刺激下,间皮细胞会出现反应性增生的表现,细胞形态与腺癌或恶性间皮瘤相似,另一方面分化好的恶性间皮瘤和腺癌与正常间皮细胞形态也极为相似[5]。因此,利用细胞团块收集器收集体液中脱落细胞,进行病理切片细胞形态观察及免疫组化,提高癌细胞检出率及肿瘤病理分型,鉴别诊断[6]。
在119例恶性胸腔积液中,肺腺癌64例(60%),鳞癌6例(5.6%),小细胞癌10例(9.2%),恶性间皮瘤15例(13.8%),胃癌3例(2.3%),胰腺癌3例(2.3%),胆囊癌3例(1.3%),肠癌3例(1.3%),卵巢癌3例1.3%),乳腺癌6例(5.56%),非何杰金氏淋巴3例(2.3%)。肺腺癌最多,其次为恶性间皮瘤和小细胞癌。其他器官原发肿瘤转移至胸膜以乳腺癌最多。
肺腺癌与恶性间皮瘤两者的临床表现主要区别为肺腺癌一般有明确原发肺内病灶,本组64例肺腺癌影像学证实均可见肺内肿物,且均经支气管活检或肺穿刺活检病理诊断为腺癌,而本组15例恶性间皮瘤无肺内病灶,影像学主要表现为胸膜单发或多发结节并伴有不同程度胸膜增厚。文献报道如果见到连续的呈现“驼峰样”结节状阴影对诊断恶性间皮瘤具有意义[7]。在病理形态上,肺腺癌与恶性间皮瘤具有很多相似之处,本组中两者在形态上的主要区别为腺癌的乳头状和腺泡状排列中,检测各种分子标志物的表达是鉴别肺腺癌与恶性间皮瘤较可靠的方法[8]。本研究中Napsin-A、TTF-1、CEA、MC、CR是肺腺癌和恶性间皮瘤的重要标志物[6]。研究发现,Napsin-A对原发性肺腺癌、鳞状细胞癌及其他转移性恶性肿瘤的诊断具有较高的敏感性和特异性[9-13]。国内外关于TTF-1在肺癌中的研究报道较多,且研究结果显示,TTF-1主要在肺腺癌和小细胞癌中表达,肺腺癌中TTF-1的阳性表达率为27%~100%[14]。同时TTF-1在原发性肺腺癌中的表达具有较高的敏感性和特异性,可作为一种有价值的标记物,用于原发和转移性肺腺癌的鉴别;Calretinin是一种细胞内钙结合蛋白,和MC主要在正常和肿瘤性间皮细胞中表达。Ki-67是判断细胞增殖活性的指标,其高、低与许多肿瘤的分化程度、浸润转移及预后密切相关。
总之,在恶性胸膜腔积液中,以肺腺癌最为多见,其次为恶性间皮瘤;利用细胞团块收集器收集体液中脱落细胞,进行病理切片细胞形态观察及免疫组化检测Napsin-A、TTF-1、CEA、MC、CR,有助于肿瘤病理分型,鉴别诊断。
[1]王鸿利.实验诊断学[M].北京:人民卫生出版社,2005:400.
[2]曹月华,杨敏,陈隆文,等.细胞病理学诊断图谱及实验病理技术[M].北京:北京科学技术出版社,2009:401-403.
[3]刘彤华.诊断病理学[M].第2版.北京:人民卫生出版社,2006:249.
[4]Langman G,Rathinam S,Papadaki L.Primary localised pleural neurofibroma:expanding the spectrum of spindle cell tumours of the pleura[J]. J Clin Pathol,2010,63(2):116-118.
[5]Murugan P,Siddaraju N,Habeebullah S,et al.Review Immunohistochemical distinction between mesothelial and adenocarcinoma cells in serous effusions:a combination panel-based approach with a brief review of the literature[J].Indian J Pathol Microbiol,2009,52(2):175-181.
[6]韩军平,王丽曾,罗文潇,等.细胞团块收集器联合免疫标记在良、恶性胸水中的应用研究[J].中国现代医学杂志,2015,35(25):62-65.
[7]Delourme J,Dhalluin X,Cortot AB.Malignant pleural mesothelioma:diagnosis and treatment[J].Rev Pneumol Clin,2013,69(1):26-35.
[8]张艳梅,付红,张颖.免疫组化在胸膜上皮性恶性肿瘤鉴别诊断中的价值[J].中国肺癌杂志,2007,10(4):320-323.
[9]Johnson H,Cohen C,Fatima N,et al.Thyroid transcription factor-1 and napsin a double stain:utilizing different vendorantibodies for diagnosing lung adenocarcinoma[J].ActaCytol,2012,56(6):596-602.
[10]Agackiran Y,Ozcan A,Akyurek N,et al.Desmoglein-3 and napsin-A double stain,a useful immunohistochemical marker for differentiation of lung squamous cell carcinoma and adenocarcinomafrom other subtypes[J].Appl Immunohistochem Mol Morphol,2012,20(4):350-355.
[11]Turner Bm,Cacle Pt,Sainz Im,etal.Napsin-A,a newmarker for lung adenocarcinoma,is complementary and more sensitive and specific than thyroid transcription factor 1 in the differential diagnosis of primary pulmonary carcinoma:evaluation of 1674 cases by tissuemicroarray[J].Arch Pathol Lab Med,2012,136(2):163-171.
[12]周秋媛,张惠箴,蒋智铭,等.胸腹水沉渣包埋切片中Napsin-A、CK7、TTF-1等的表达及临床意义[J].临床与实验病理学杂志,2013,29(6):671-673.
[13]Downey P,Cummins R,Moran M,et al.If it's notCK5/6 positive,TTF-1 negative it's not a squamous cell carcinoma oflung[J].APMIS,2008,116(6):526-529.
Clinical pathological analysis of malignant pleural effusion
Han Junping1,Wang Lizeng1,Da Chunhe2,Luo Wenxiao1,Zeng Junwen1,Ma Wenxia1.1.Department of Pathology,the First People's Hospital of Baiyin,Baiyin 730900,China;2.Department of Respiration,the First People's Hospital of Baiyin,Baiyin 730900,China
Objective:To investigate the pathological types,the proportion,the clinical pathologic characteristics and the differential diagnosis in malignant pleural effusion.Methods:Using the cell mass collector to collect the shedding cells in body fluid,and to observe the pathological changes of 119 cases of malignant pleural effusion by pathological section and immunohistochemistry.Results:In 119 patients with malignant pleural effusion,pulmonary adenocarcinoma 64 cases,6 cases of Squamous cell carcinoma,10 cases of small cell carcinoma15 cases of malignant mesothelioma,3 cases of gastric cancer,3 cases of pancreatic carcinoma,3 cases of gallbladder cancer,3 cases of colorectal cancer,3 cases of ovarian cancer and 6 cases of breast cancer s,3 cases of Non-Hodgkin's lymphoma.Male 61 cases,female 58 cases,aged 19 to87 years old,with an average age of67.8 years.The main clinical symptoms was chest tightness,shortness of breath,cough,chest pain,with primary tumor organ disease.CT showed pleural thickening,pleural effusion,multiple or solitary pleural nodules and primary organ space occupying lesions.Conclusion:Lung adenocarcinoma was common,and the second was malignant mesothelioma in Malignant pleural effusion.Using cell clumps to collector fluid cytology and pathological section to observe cell morphology and immunohistochemical,to improve the detection rate and tumor histological type of cancer cells,differential diagnosis
cell mass collection;malignant pleural effusion;lung cancer;immunohistochemistry
A
1004-2725(2016)05-0332-04
甘肃省卫生行业科研计划项目(项目编号:GSWSKY-2015-69)
730900甘肃 白银,白银市第一人民医院病理科(韩军平、王丽曾、罗文潇、曾俊文、马文霞),呼吸科(达春和)
韩军平,E-mail:554235597@qq.com
