人工接种CMV后辣椒植株中病毒含量的时序变化及症状表型
2016-10-26王兴兴张正海曹亚从王立浩张宝玺
王兴兴 张正海 曹亚从 王立浩 张宝玺
(中国农业科学院蔬菜花卉研究所,北京 100081)
人工接种CMV后辣椒植株中病毒含量的时序变化及症状表型
王兴兴 张正海 曹亚从 王立浩 张宝玺*
(中国农业科学院蔬菜花卉研究所,北京 100081)
以5份不同类型的辣(甜)椒为供试材料,人工接种CMV重花叶型株系,通过DAS-ELISA方法,分别检测接种5、10、15、20、25、30 d后辣椒植株中CMV含量的时序变化,同时对供试材料进行人工接种抗性鉴定,并对2种方法得到的数据进行相关性分析。结果显示:不同类型供试材料接种5~15 d后的病毒含量逐渐增加,并于15 d时达到最高水平,之后略有回落;通过DAS-ELISA检测得到的植株病毒含量与人工接种抗性鉴定得到的病情指数呈正相关,说明2种鉴定方法获得的结果一致。
CMV;辣椒;DAS-ELISA;时序变化;症状表型
黄 瓜 花 叶 病 毒(Cucumber mosaic virus,CMV)属于雀麦花叶病毒科(Bromorididae)黄瓜花叶病毒属(Cucumovirus)。CMV首度在密歇根和纽约的黄瓜上发现(Doolittle,1916;Jagger,1916),该病毒可侵染茄科等多种作物,为害辣椒后,引起花叶、明脉、蕨叶、坏死斑、矮化和果实畸形等系统症状,损害果实的商品性状,严重影响经济效益(Palukaitis et al.,1992;方中达,1998;邹学校,2002),且寄主所表现出的病状与体内CMV的积累量有相关性。在为害辣椒生产的病毒病中,CMV已占到60%左右(毛爱军和耿三省,2002),成为我国辣椒生产上的主要病毒病之一。
长期以来,植物对病毒的抗性鉴定主要依据植株本身的外观症状或指示植物来进行,但这种生物学方法费时费力,鉴定周期长,且易受环境条件的影响,还存在反应不稳定、重复性差等弊端(兰玉菲 等,2006;杜琳 等,2007)。随着血清学技术的发展,血清学方法在病毒检测上的应用也越来越广泛,其中双抗体夹心酶联免疫吸附试验(double antibody sandwich enzyme-linked immunosorbent assay,DAS-ELISA)已成为常规的病毒检测方法,即根据抗原与抗体的特异免疫反应,使酶标抗体和抗原结合形成复合物,结合酶催化反应通过底物显色进行定量分析。在马铃薯病毒检测中,该方法已被列为国家标准检测方法(GB 18133—2012)(张志军 等,2015),在CMV的鉴定方面也已得到应用(王海河 等,1999;梁巧兰 等,2006;Mahmoud,2011)。分子生物学技术的发展,也为病毒的检测提供了高灵敏度、特异性强、应用范围广、时空限制小的新方法(杜琳 等,2007),其中荧光定量技术检测CMV已在花卉(Wei et al.,2012)、香蕉(孙洁,2014)、辣椒(黄娅,2015)等多种作物中应用,并建立起成熟的应用体系。虽然多种方法可以检测植物中病毒的存在,但目前植物对病毒的抗性水平主要是依据病情分级标准进行划分,而该方法受植物生物学性状以及人为因素的影响较大。
CMV系统侵染寄主之后,表现出一定的时间效应(陈集双 等,2003)。目前关于系统侵染后植株中CMV含量随时间的动态变化的研究还甚少(傅天珍 等,2006),通过ELISA鉴定辣椒对CMV抗性水平的研究也不多(Wang et al.,1997;Kang et al.,2010)。本试验利用DAS-ELISA探究人工接种后辣椒植株内CMV含量的时序变化,同时采用人工分级的方法对供试材料的抗性进行鉴定,研究植物组织内CMV负荷量的变化与植株症状之间的关系,以期为辣椒对CMV的抗性鉴定提供量化的鉴定标准。
1 材料与方法
1.1试验材料
选用5份不同类型的一年生辣(甜)椒(Capsicum annuum L.)材料,由中国农业科学院蔬菜花卉研究所辣椒课题组提供。Perennial:小果辣椒,叶片较小,叶色绿;Milord:中果甜椒,中型叶,叶色浅绿;茄门:中果甜椒,中型叶,叶色深绿;Yolo Wonder:大果甜椒,叶片较大,叶色绿;83-58:大果甜椒,叶片较大,叶色浅绿。
病原为CMV重花叶型株系,由中国农业科学院蔬菜花卉研究所病害课题组提供。CMV扩繁材料为三生烟(Nicotiana tabacum var.Samsun NN)。2015年5月于玻璃温室中种植三生烟,6月种植上述5份供试材料,每份材料3个重复,每个重复15株。
1.2试验方法
1.2.1人工接种及取样 将保存的病叶鲜质量(g)与0.03 mol·L-1pH值为8的PBS缓冲液体积(mL)按1∶5的比例,在冰浴中研磨成匀浆,3 000 r· min-1离心5 min(赵娟,2009),取上清液作为接种液。采用摩擦接种法,首先在烟草叶面上均匀撒上600目的金刚砂,再将接种液接种到具5~6片真叶的烟草幼苗上,以扩繁CMV,温度控制在28℃。将接种10 d后发病的烟草叶片按照上述方法制备接种液,转接具有3~4片叶的辣椒植株的第1、2片真叶(田如燕 等,1989),用连续加样器每片叶片接种20 μL接种液。用手指轻轻摩擦叶片,及时用水冲去叶面多余汁液;3 d后回接种1次。接种后温度控制在28 ℃左右(赵娟,2009)。分别于接种后5、10、15、20、25、30 d取上部新叶进行DAS-ELISA检测。每份材料每个时期取3个重复,每份样品取0.2 g,置于-20 ℃冰箱保存备用。
1.2.2辣椒植株中CMV含量的DAS-ELISA检测
参照美国Agdia公司DAS-ELISA检测试剂盒说明及前人的方法(张志军 等,2015),对人工接种CMV后辣椒植株中病毒含量进行DAS-ELISA检测。用酶标仪在405 nm波长处读取反应结果,OD405代表病毒外壳蛋白(CP)含量,即辣椒植株中CMV的含量。
1.2.3人工接种抗性鉴定 于接种后第25天,参照国家“八五”辣椒抗病育种攻关组分级标准(李树德,1995)(表1),对辣椒植株进行CMV抗性鉴定。

表1 辣椒CMV抗性鉴定病情分级标准
病情指数(DI)=〔∑(各级发病株数×病级数)/(9×调查株数)〕×100
抗病性划分标准:免疫(I):DI=0;高抗(HR):0<DI≤5;抗病(R):5<DI≤15;中抗(MR):15<DI≤30;感病(S):30<DI≤40;高感(HS):DI>40。
1.2.4不同抗性鉴定方法之间的相关性分析 利用SPSS软件对人工接种后同一材料不同时期以及同一时期不同供试材料植株中病毒含量进行单因素方差分析,并采用Bivariate功能对2种方法的抗性鉴定结果进行相关性分析。
2 结果与分析
2.1人工接种CMV后辣椒植株中的病毒含量
利用DAS-ELISA检测辣椒植株中的病毒含量,结果表明(图1),人工接种CMV后,5~15 d内辣椒植株中的病毒含量逐渐升高,15 d时病毒含量达到最大值;之后病毒含量有所回落,接种25 d后趋于平稳。不同材料的病毒含量与人工分级鉴定结果一致,但辣椒材料Milord的病毒含量值偏高。Perennial接种后各个时期植株中病毒含量差异不显著,其他4份材料接种5、10 d和15 d后,不同时期的植株中病毒含量均差异显著。
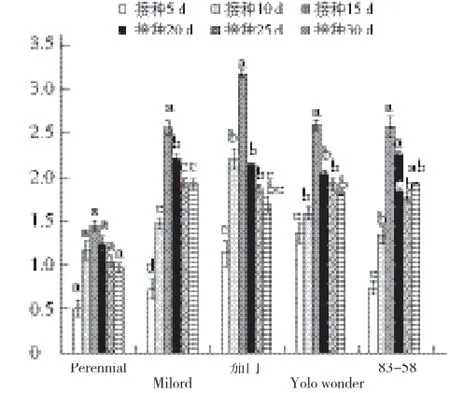
图1 人工接种后辣椒植株中CMV含量的时序变化
2.2人工接种抗性鉴定
对上述5份供试材料人工接种CMV后,参照国家“八五”辣椒抗病育种攻关组分级标准(表1)调查植株的发病情况,结果显示:接种前7 d大部分植株都未显示病症;10 d时出现轻微的症状,发病等级多为1、2级;15 d时发病症状明显,供试材料在表型上出现明显差异;20 d时病症进一步加强,25~30 d持续显现发病症状。接种25 d后的抗性鉴定结果表明,Perennial病情指数为15.12,对CMV表现为抗病,Milord病情指数为32.58,对CMV表现为中抗,83-58、Yolo Wonder、茄门3个材料的病情指数分别为50.71、55.70和65.06,为高感CMV品种,其中茄门的抗性最差。
2.3不同抗性鉴定方法之间的相关性分析
对接种后同一时期不同供试材料的病毒含量进行单因素方差分析,结果显示(表2):接种5 d后,各材料植株中病毒含量差异不显著;接种10 d后,抗性最差的茄门与抗性最强的Perennial植株中病毒含量差异显著;接种15 d后,抗CMV材料Perennial与其他材料植株中病毒含量差异显著。

表2 同一时期不同辣椒材料植株中CMV含量的差异显著性分析
利用SPSS软件对不同时期的辣椒材料病毒含量与抗性鉴定结果进行相关性分析,结果显示(表3):接种后各调查时期植株病毒含量与病情指数呈正相关,相关性系数分布范围为0.658~0.912,其中接种15 d后的相关系数最高,为0.912,且显著相关。

表3 不同抗性鉴定方法的相关性分析
3 结论与讨论
病毒在植株内积累、转移与植株的病症有一定的相关性,积累量具有一定的时间效应(陈集双等,2003)。本试验选取5份不同辣(甜)椒材料人工接种CMV后,5~30 d内各材料植株中病毒含量随时间变化表现出一致的趋势,即前15 d持续增加,15 d时达到最高水平,之后病毒含量有所回落,接种25 d后趋于平稳。并且,人工接种15 d后植株中病毒含量同病情分级抗性鉴定结果一致。该结果为病害防治及病毒检测提供了有效参考时期的依据。但本试验中人工接种CMV后,辣椒植株中的病毒含量变化趋势与傅天珍等(2006)的研究结论不完全一致,可能与取样方式存在差异有关。
通过DAS-ELISA检测植株内病毒含量与病情分级抗性鉴定均可反映寄主植物对CMV的抗性水平,本试验中2种方法鉴定获得的抗性结果基本一致。高病毒含量表示该品种的抗性弱,相反则表示抗性强。尽管不同时期病毒含量与病情分级抗性鉴定结果的相关性有差异,但这恰恰反映了供试材料在接种后的表型抗性滞后于病毒含量的表现,存在积累的过程。病情分级抗性鉴定的结果会因操作人的不同而有差异,同时,供试材料的植物学性状对鉴定结果也有一定影响。因而本试验尝试采用在设有抗、感对照的情况下,通过DAS-ELISA检测植株内病毒含量来表示供试材料的抗性水平,以期为辣椒CMV的抗性鉴定提供有价值的参考。
陈集双,柴立红,吴平.2003.系统侵染寄主中黄瓜花叶病毒及其卫星RNA的动态变化.生物化学与生物物理进展,30(2):285-289.
杜琳,钟先锋,陈剑泓,易军鹏.2007.植物病毒检测技术研究进展.农产品加工,(7):48-55.
方中达.1998.植病研究方法.3版.北京:中国农业出版社:251-253.
傅天珍,高永生,陈集双.2006.系统侵染的番茄植株中黄瓜花叶病毒的时序变化. 植物病理学报,36(4):359-365.
黄娅.2015.重庆辣椒病毒病的病原鉴定及多重RT-PCR检测体系的构建〔硕士论文〕.重庆:西南大学.
兰玉菲,郗丽君,张德满,李春霞,崔海涛,李向东.2006.植物病毒检测技术.山东农业科学,(5):58-62.
李树德.1995.中国主要蔬菜抗病育种进展.北京:科学出版社:523.
梁巧兰,魏列新,徐秉良.2006.利用DAS-ELISA检测侵染观赏百合黄瓜花叶病毒的研究.甘肃农业大学学报,41(1):61-64.
毛爱军,耿三省.2002.甜 (辣) 椒病毒病复合接种鉴定技术.长江蔬菜,(s1):20-22.
孙洁,王婉,周翎,阮小蕾,饶雪琴,李华平.2014.黄瓜花叶病毒荧光定量PCR检测方法的建立.华南农业大学学报,35(2):53-56.
田如燕,冯兰香,蔡少华,郭家珍,李佩华.1989.甜(辣)椒品种(系)对黄瓜花叶病毒和烟草花叶病毒的苗期抗性鉴定.作物品种资源,(4):32-33.
王海河,高文臣,魏宁生.1999.渭北烟区黄瓜花叶病毒酶联免疫检测方法.西北农业大学学报,27(4):7-11.
张志军,惠霖,吴玉峰,董璞.2015.应用酶联免疫吸附法 (DASELISA) 检测主要马铃薯病毒试验.种子世界,(12):40-43.
赵娟.2009.辣椒分子连锁图谱的构建及抗黄瓜花叶病毒 QTL 定位〔硕士论文〕.呼和浩特:内蒙古农业大学.
邹学校.2002.中国辣椒.北京:中国农业出版社:289-299.
Doolittle S P.1916.A new infectious mosaic disease of cucumber. Phytopathol,6:145-147.
Jagger I C.1916.Experiments with the cucumber mosaic disease. Phytopathol,6:148-151.
Kang W H,Hoang N H,Yang H B,Kwon J K,Jo S H,Seo J K,Kang B C.2010.Molecular mapping and characterization of a single dominant gene controlling CMV resistance in peppers(Capsicum annuum L.).Theoretical and Applied Genetics,120(8):1587-1596.
Mahmoud S Y M.2011.Detection of Cucumber mosaic virus in some ornamental plants and elimination of nonspecific ELISA reactions. Archives of Phytopathology and Plant Protection,44(14):1410-1424.
Palukaitis P,Roossinck M J,Dietzgen R G,Francki R I.1992. Cucumber mosaic virus.Advances in Virus Research,41:281-349.
Wang S,Pissawan C,Yang C.1997.Evaluation of pepper(sweet pepper)resistance to Cucumber mosaic virus 15(thai-isolate)at seedling and maturation stages of plants.Jiangsu Journal of Agricultural Sciences,14(1):21-26.
Wei T,Lebas B S M,Shiller J B,Quinn B D,Clover G R G. 2012.Detection of five viruses infecting dormant bulbs by TaqManbased real-time RT-PCR.Australasian Plant Pathology,41(1):93-98.
Temporal Change of CMV and Symptom Phenotype in Pepper after Artificial Inoculation
WANG Xing-xing,ZHANG Zheng-hai,CAO Ya-cong,WANG Li-hao,ZHANG Bao-xi*
(Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
Taking 5 pepper of different genotypes as experimental material,after artificial inoculating heavy mosaic strain CMV,we tested the temporal change of CMV content in 5,10,15,20,25,30 days by DASELISA.At the same time,the artificial classification method was used,and we carried out analysis on the correlation of data gained through these 2 methods.The results showed that the virus content increased at 5,10,15 days in turn,reached the highest level at 15 days.Then,the virus content reduced slightly.The virus content of the plants obtained by DAS-ELISA was positively correlated with the disease index obtained by artificial inoculation.The results obtained by the 2 methods were consistent.
CMV;Pepper;DAS-ELISA;Temporal Change;Symptom Phenotype
王兴兴,女,硕士研究生,专业方向:蔬菜遗传育种,E-mail:1021348247@qq.com
(
):张宝玺,研究员,硕士生导师,专业方向:蔬菜遗传育种,E-mail:zhangbaoxi@caas.cn
2016-02-29;接受日期:2016-04-19
国家“863”项目(2012AA100103002),中国农业科学院科技创新工程项目(CAAS-ASTIP-IVFCAAS),农业部大宗蔬菜产业技术体系项目(CARS-25),公益研究所基金项目(ICS,CAAS,1610032011011)
