小鼠冷冻胚胎、精子常见病原菌快速检测方法的建立
2016-10-26徐伟超强苏静顾剑洁葛蓉刘丽均徐平芮荣
徐伟超,强苏静,顾剑洁,葛蓉,3,刘丽均,徐平,4* ,芮荣
(1.上海斯莱克实验动物有限责任公司,上海 201615;2.南京农业大学动物医学院,南京 210095;3.南通大学生命科学学院,南通 江苏 226019;4.中科院上海实验动物中心,上海 201615)
小鼠冷冻胚胎、精子常见病原菌快速检测方法的建立
徐伟超1,2,强苏静1,顾剑洁1,葛蓉1,3,刘丽均1,徐平1,4*,芮荣2*
(1.上海斯莱克实验动物有限责任公司,上海201615;2.南京农业大学动物医学院,南京210095;3.南通大学生命科学学院,南通 江苏226019;4.中科院上海实验动物中心,上海201615)
目的 建立实验动物冷冻资源(胚胎、精子等)常见病原菌的微量、快速监测方法。 方法 以实验动物三个常见病原菌(金黄色葡萄球菌、肺炎克雷伯氏菌和乙型溶血性链球菌)为研究对象,分别提取三个阳性菌株的DNA,通过引物设计和相应PCR条件的优化,建立三种阳性菌株的PCR检测方法。然后提取冷冻资源(胚胎、精子等)中的DNA,按照三个阳性菌的PCR条件进行检测,并将一部分样品DNA用荧光定量PCR方法进行检测。结果①成功建立三个阳性菌株的PCR检测方法。三种病原菌的最低检测浓度,金黄色葡萄球菌为4.19×10-5ng/μL,肺炎克雷伯氏菌为1.98×10-5ng/μL,乙型溶血性链球菌为1.07×10-3ng/μL.②通过普通PCR和荧光定量PCR方法均未检测出样品中三种阳性菌的存在。结论建立了小鼠冷冻胚胎、精子常见病原菌微量、快速检测方法。
金黄色葡萄球菌;肺炎克雷伯氏菌;乙型溶血性链球菌;PCR检测
金黄色葡萄球菌、肺炎克雷伯氏菌和乙型溶血性链球菌广泛存在于自然环境中,是人和动物常见的条件性致病菌[1]。在某些应激情况下会引起实验动物的健康问题或者影响动物实验的结果。
目前,实验动物病原菌的检测主要是依靠传统的分离培养和生化鉴定方法,该方法容易得出明确的结论[2-4]。但是需要一定的样本量,且耗时、特异性低,需要检测人员对病原微生物的菌落形态、理化反应性质等有准确的判断,才能得出正确的结论[5]。与这些传统的形态分析方法相比,病原微生物的基因型比形态特征更具特异性和精确性,且敏感度高、快速、简便、样本量少,它不仅能检测出活的病原微生物,而且也能检测出死亡的和难以培养的病原微生物[6]。本研究拟建立一种微量、快速的PCR检测方法,以用于实验动物冷冻资源的质量控制。
1 材料和方法
1.1实验材料
1.1.1标准菌株
金黄色葡萄球菌(CMCC26003),肺炎克雷伯氏菌(CMCC46117)和乙型溶血性链球菌(CMCC32210),均来自于中国医学细菌菌种保藏管理中心。
1.1.2细菌培养基
常规营养肉汤和血琼脂平板。
1.1.3样品
随机采集保存于实验室液氮库中的胚胎、精子、卵子,冷冻复苏胚胎所需的各种抗冷冻液、培养液、复苏液和液氮等,每个样品有3个重复。
1.2主要试剂与仪器
DNA提取试剂盒购自北京赛百盛基因技术有限公司;GoTaq© Colorless Master Mix 购自普洛麦格(promega)公司;MarkerDL2000和5xGelRed琼脂糖电泳加样缓冲液(含核酸染料)购自上海捷瑞生物工程有限公司;引物(正向引物,反向引物)由生工生物工程(上海)股份有限公司合成;荧光定量PCR探针由上海捷瑞生物工程有限公司合成。
英国Techne T-512型PCR仪、ABI7500 荧光定量PCR仪、Bio-red 泳仪、凝胶成像系统、超净工作台、高速离心机、恒温水浴锅、移液枪及其它辅助设备。
1.3实验方法
1.3.1阳性菌株冻干粉的复苏保存
金黄色葡萄球菌、乙型溶血性链球菌和肺炎克雷伯氏菌均按照标准菌株的标准操作程序复苏并保存。
1.3.2阳性菌株DNA 抽提
按照赛百盛试剂盒说明的方法进行抽提。
1.3.3阳性菌株PCR检测
通过查阅文献与touch down PCR筛选,得出了检测三种病原菌的可用引物序列与PCR条件,引物序列如表1所示。PCR反应体系均为20 μL:2×promega mix colorless10 μL,上下游引物各0.2 μL,DNA模板2 μL,并补足超净水。反应程序相同: 95℃预变性5 min,94℃变性1 min,55℃复性2 min,72℃延伸1 min,循环40次,最后72℃延伸10 min。
1.3.4阳性菌株PCR产物测序
三个阳性菌株进行引物筛选和PCR条件的优化之后,为鉴定引物和条件的可行性,将PCR产物进行DNA测序并且在测序后进行比对。
1.3.5阳性菌PCR灵敏度检测
将阳性DNA进行稀释,得出PCR检测的最少检出量,来确定PCR反应的灵敏度,且通过前期预实验,只选取部分条带比较清晰、测序结果较好的引物进行后续实验。
1.3.6人工污染实验
将阳性菌株复苏后接入营养肉汤培养基中,过夜振荡培养,然后用蒸馏水倍比稀释,稀释后接种血平板的同时提取DNA,过夜培养后观察平板并计数,以阳性菌株的DNA为模板进行PCR反应,得出DNA提取和PCR方法的菌液最低检测浓度。
1.3.7样品的检测
1.3.7.1样品中细菌DNA提取
按照上述阳性菌提取方法提取液氮中冷冻资源(精子、卵子和胚胎)、冷冻复苏过程中所需要用的培养液和液氮中的DNA。
1.3.7.2样品中细菌普通PCR检测
按照阳性菌的PCR条件和体系对提取的15个样品DNA进行普通PCR检测。

表1 三种病原菌引物序列

表2 三种病原菌的荧光探针信息
1.3.7.3样品中细菌荧光定量PCR检测
针对金黄色葡萄球菌、肺炎克雷伯氏菌和乙型溶血性链球菌的保守序列设计荧光探针,探针设计好后以阳性菌株为模板进行三个菌株的多重荧光定量PCR检测(表2)。反应体系:2×qPCR Mix 10 μL,上下游引物各1 μL,cDNA模板8 μL。反应程序:95℃预变性10 min,95℃变性10 s,60℃退火延伸34 s,循环40次,同时采集熔解曲线。
2 结果
2.1阳性菌株PCR检测结果
2.1.1金黄色葡萄球菌
通过对金黄色葡萄球菌相关文献的查阅,共寻找到15对引物,用touch down PCR 进行筛选,发现其中有7对引物用阳性菌株DNA为模板可以扩增出目的条带,并对7对引物进行条件优化可以得出较亮的目的条带,产物大小分别为122 bp、132 bp、270 bp、94 bp、127 bp、168 bp、484 bp(图2A)。
2.1.2肺炎克雷伯氏菌

注:(A~G)金黄色葡萄球菌7对引物PCR产物BLAST结果;(H,I)肺炎克雷伯氏菌2对引物PCR产物BLAST结果;(J~N)乙型溶血性链球菌5对引物PCR产物BLAST结果。图1 细菌PCR产物BLAST结果Note.(A~G)The PCR products BLAST results of 7 pairs of primers of Staphylococcus auerus;(H,I)The PCR products BLAST results of 2 pairs of primers of Klebsiella pneumoniae;(J~N)The PCR products BLAST results of 5 pairs of primers of β-hemolytic streptococcus.Fig.1 The BLAST results of the PCR products of the bacteria
通过对肺炎克雷伯氏菌相关文献的查阅,共寻找到14对引物,用touch down PCR 进行筛选,发现其中有3对引物用阳性菌株DNA为模板可以扩增出目的条带,并对3对引物进行条件优化,其中2对条带非常亮,还有1对优化后条带依然较弱(图2B),产物大小为368bp、423bp、108bp,后续实验只挑选了368bp的引物进行实验。
2.1.3乙型溶血性链球菌
通过对乙型溶血性链球菌相关文献的查阅,共寻找到11对引物,用touch down PCR 进行筛选,发现其中有6对引物用阳性菌株DNA为模板可以扩增出目的条带(图2C),并对6对引物进行条件优化可以得出较亮的目的条带,产物大小分别为71bp、255bp、346bp、170bp、423bp、307bp。
2.2阳性菌株PCR产物测序
三个病原菌产物测序和比对结果(图1A~1N)金黄色葡萄球菌的DNA序列BLAST比对后与文献报道的金黄色葡萄球菌靶基因序列的同源性>98%;肺炎克雷伯氏菌的同源性>99%;乙型溶血性链球菌的同源性>95%。从而证实PCR扩增产物确为目的扩增产物。
2.3阳性菌PCR灵敏度检测结果(图2D~图2F)
金黄色葡萄球菌(3号引物和6号引物)、肺炎克雷伯氏菌(2号引物)和乙型溶血性链球菌(3号引物和5号引物)的最低检测DNA浓度分别为4.19×10-5ng/μL、1.98×10-5ng/μL和1.07×10-3ng/μL。
2.4人工污染实验结果
以阳性菌株的DNA为模板进行PCR反应,金黄色葡萄球菌的菌液检出浓度为4×105cfu/mL(图2G)、肺炎克雷伯氏菌的检出浓度为2.2×106cfu/mL(图2H)、乙型溶血性链球菌的检出浓度为6×102cfu/mL(图2I)。
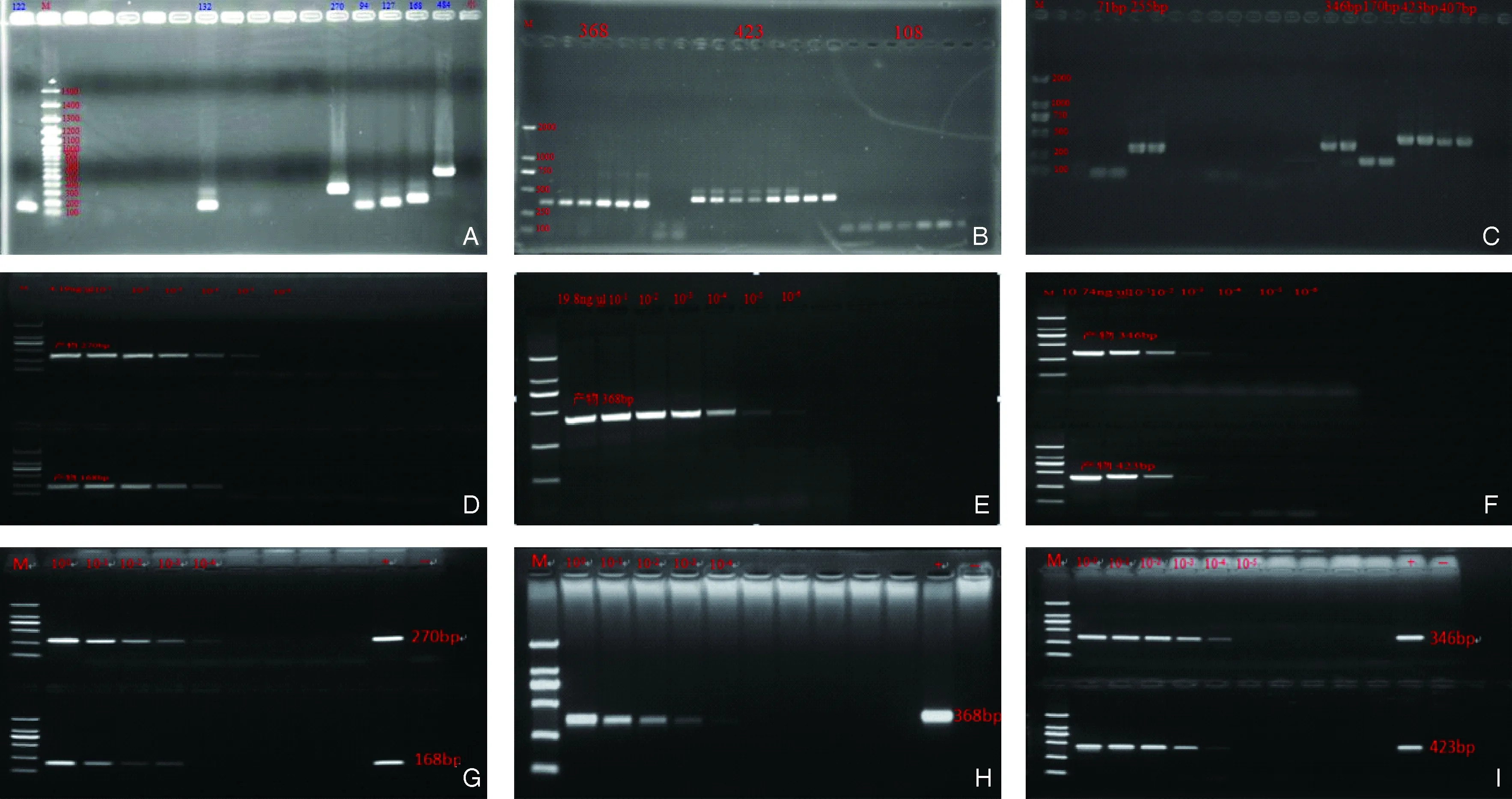
注:(A)金黄色葡萄球菌7对引物的扩增条带;(B) 肺炎克雷伯氏菌3对引物的扩增条带;(C) 乙型溶血性链球菌产物6对引物的扩增条带;(D) 金黄色葡萄球菌3号和6号引物结果;(E) 肺炎克雷伯氏菌2号引物结果;(F) 乙型溶血性链球菌3号和5号引物结果;(G) 金黄色葡萄球菌阳性菌液检出浓度;(H) 肺炎克雷伯氏菌阳性菌液检出浓度;(I) 乙型溶血性链球菌阳性菌液检出浓度。图2 细菌DNA的PCR检测结果Note.(A) The amplification bands of 7 pairs of primers of Staphylococcus auerus;(B) The amplification bands of 3 pairs of primers of Klebsiella pneumoniae;(C) The amplification bands of 6 pairs of primers of β-hemolytic streptococcus;(D) The results of primer 3 and primer 6 of Staphylococcus auerus;(E) The results of primer 2 of Klebsiella pneumoniae;(F) The results of primer 3 and primer 5 of β-hemolytic streptococcus;(G) The detectable concentration of Staphylococcus auerus positive bateria liquid;(H) The detectable concentration of Klebsiella pneumoniae positive bateria liquid;(I) The detectable concentration of β-hemolytic streptococcus positive bacteria liquid.Fig.2 The PCR detection results of the DNA of the bacteria
2.5样品的检测
2.5.1样品中细菌普通PCR检测
按照阳性菌的PCR条件对提取的15个样品DNA进行普通PCR检测。图3A~3E显示,本实验中的15个样品DNA中均不含有金黄色葡萄球菌、肺炎克雷伯氏菌和乙型溶血性链球菌。
2.5.2样品中细菌荧光定量PCR检测
2.5.2.1阳性菌株的多重PCR
以阳性菌株为模板,用设计好的探针进行三个菌株的多重荧光定量PCR检测,检测结果如图4A,得出设计的三个荧光探针是正确可用的。
2.5.2.2样品的荧光定量PCR检测
由荧光定量PCR结果(图4B~4D)得出15个样品未被三个目标菌株污染,15个样品的三个菌的曲线和阴性对照的曲线一致,未发生阳性扩增。
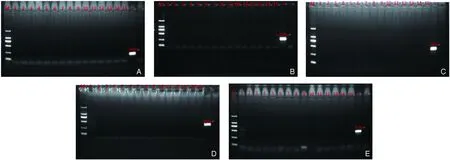
注:(A,B)样品中金黄色葡萄球菌检测结果(3、6引物);(C)样品中肺炎克雷伯氏菌检测结果(2号引物);(D,E)样品中乙型溶血性链球菌检测结果(3、5号引物)。1-15号都未检测出阳性条带,其中1号冷冻精子、2号冷冻卵子、3号冷冻胚胎、4号HTF、 5号KSOM、 6号DAP、 7号DMSO、 8号EFS20、 9号EFS40、 10号0.25蔗糖、 11号0.75蔗糖、 12号液氮、 13号M2、 14号M16、 15号R18S3。图3 样品中细菌PCR检测结果Note.(A,B) Detection results of Staphylococcus auerus in the sample(primer 3 and primer 6);(C) Detection results of Klebsiella pneumoniae in the sample(primer 2);(D,E) Detection results of β-hemolytic streptococcus in the sample(primer 3 and primer 5).The positive bands were not examined in sample NO.1 to sample NO.15. Sample name: NO.1 frozen sperm, NO.2 frozen oocyte, NO.3 frozen embryo, NO.4 HTF, NO.5 KSOM, NO.6 DAP, NO.7 DMSO, NO.8 EFS20, NO.9 EFS40, NO.10 0.25 sucrose, NO.11 0.75 sucrose, NO.12 liquid nitrogen, NO.13 M2, NO.14 M16, NO.15 R18S3.Fig.3 The PCR detection results of the bacteria in the samples

注:(A) 金黄色葡萄球菌、肺炎克雷伯氏菌和乙型溶血性链球菌Taqman qPCR三重扩增曲线(按CT值的大小从小到大排列,图中的曲线分别是肺炎克雷伯菌,金黄色葡萄球菌,乙型溶血链球菌);(B)样品中金黄色葡萄球菌荧光定量PCR检测结果;(C)样品中肺炎克氏菌荧光定量PCR检测结果;(D)样品中乙型溶血性链球菌荧光定量PCR检测结果。图4 细菌荧光定量PCR检测结果Note.(A) Taqman qPCR triple amplification curve of Staphylococcus aueru, Klebsiella pneumoniae and β-hemolytic streptococcus(The CT value increase as follows: Klebsiella pneumoniae, Staphylococcus aueru and β-hemolytic streptococcus);(B)Realtime pcr detection result of Staphylococcus auerus in the sample;(C)Realtime pcr detection result of Klebsiella pneumoniae in the sample;(D)Realtime pcr detection result of β-hemolytic streptococcus in the sample.Fig.4 Realtime PCR detection results of the bacteria
3 讨论
低温冷冻技术可以实现实验动物资源的长期保存, 既安全又能节省人力和物力[7]。但活体动物若带有病原微生物,将对生殖细胞的品质、保存及受胎效果等产生影响, 并且可能导致最后获得的实验动物中也带这些病原微生物,最终影响实验动物质量[8]。目前的冷冻操作都不是无菌操作技术[9],因此,在冷冻、储存、复苏或者实验室间的交换等过程中,都有可能被病原微生物污染,所以定期进行冷冻资源的微生物检测是有必要的。
PCR技术由于具有特异性强,灵敏度高,快速准确,自动化程度高等特点,已被广泛应用,应用PCR技术,只需数小时,就可用电泳法检测出0.1 mg DNA中仅含数个拷贝的模板序列,用PCR扩增细菌中保守的rDNA片段,还可对那些人工无法培养的微生物进行检测[10]。同时,实时荧光 PCR技术有效解决了传统 PCR中只能终点检测的局限,并且在封闭的条件下进行反应和分析,无需电泳等 PCR后处理操作,能有效预防PCR产物之间的相互污染[11]。并且由于其操作简便快速、特异性强、灵敏度高、假阳性低、可定量检测、误差小、稳定性好等特点已经广泛应用于食品中微生物的检测[12]。
本研究目的在于通过对实验动物的三个常见病原菌(金黄色葡萄球菌、肺炎克雷伯氏菌、乙型溶血性链球菌)特异性引物的筛选,阳性菌PCR产物的测序及灵敏度检测等,拟建立实验动物冷冻资源(生殖细胞、胚胎、生殖器官)的微生物质量控制快速检测方法。实验表明,在所选的引物中,金黄色葡萄球菌有7对(7/15)、肺炎克雷伯菌3对(3/14)、乙型溶血性链球菌6对(6/11)引物可以扩增出目的条带。测序结果表明,其PCR产物的DNA序列与各自的靶基因的同源性均达到95%以上。灵敏度试验显示,三种病原菌的最低检测浓度,金黄色葡萄球菌为4.19×10-5ng/μL、肺炎克雷伯氏菌为1.98×10-5ng/μL、乙型溶血性链球菌为1.07×10-3ng/μL。本实验中,对冷冻库内的部分冷冻资源进行抽样检测,从对样品的处理到检测结束大约需要6 h的时间,大大缩短了传统的国标法检测时间,更加符合快速检测的要求。检测结果显示本实验室冷冻保存的小鼠胚胎、精子等均没有检测到三种目的病原菌。也有可能由于存在于冷冻资源中的细菌量很少,提出的DNA量不足以通过PCR方法检测出来,因此计划将冷冻资源进行复苏、移植至SPF级受体母鼠,待出生后的小鼠长至断奶,对活体进行微生物学检测,以验证其是否携带这三种病原菌。
[1]邓奕,许迪莘,赵琳娜,等. 免疫磁球捕获-PCR检测牛奶中金黄色葡萄球菌的研究[J].食品工业科技, 2015, 07 :304-313.
[2]GB/T 14926.14-2001,实验动物金黄色葡萄球菌检测方法[S].
[3]GB/T 14926.13-2001,实验动物肺炎克雷伯杆菌检测方法[S].
[4]GB/T 14926.16-2001,实验动物乙型溶血性链球菌检测方法[S].
[5]林霖,兰全学,祝仁发,等. 荧光PCR快速检测A、C、G群溶血性链球菌[J].食品工业科技, 2012,33(08):78-82.
[6]邵彪,黄伟东,周鸣镝,等.多重荧光定量PCR 检测食品污染菌[J].中国食品学报. 2012. 12(1):176-180.
[7]黄馨,秦川.小鼠胚胎冷冻保存技术研究进展[J]. 中国比较医学杂志, 2006, 16(5): 309-312.
[8]Ahmady M,Kazemi S. Detection of the enterotoxigenic genes ( sei,sej) in Staphylococcus aureus isolates from bovine mastitis milk in the West Azerbaijan of Iran[J]. Comparative Clinical Pathology,2013,22( 4) : 649-654.
[9]Bielanski A, Bergeron H, Lau PC,etal. Microbial contamination of embryos and semen during long term banking in liquid nitrogen[J]. Cryobiology, 2003,46(2):146-152.[10]Park HJ, Kim HJ, Park SH,etal. Direct and quantitative analysis of salmonella enterica serovar typhimurium using real-time PCR from artificially contaminated chicken meat[J]. Microbiol Biotechnol, 2008, 18(8):1453-1458.
[11]Postollec F, Falentin H, Pavan S,etal. Recent advances in quantitative PCR( qPCR) applications in food microbiology[J]. Food Microbiology, 2011, 28(5) : 848-861.
[12]Martinon A, Cronin UP, Quealy J,etal. Swab sample preparation and viable real-time PCR methodologies for the recovery of Escherichia coli, Staphylococcus aureus or Listeria monocytogenes from artificially contaminated food processing surfaces[J].Food Control, 2012, 24(1-2):86-93.
Establishing a rapid monitoring method of common pathogens of frozen embryo and sperm in mice
XU Wei-chao1,2,QIANG Su-jing1, GU Jian-jie1, GE Rong1,3,LIU Li-jun1, XU Ping1,4*, RUI Rong2*
(1.Shanghai SLAC Laboratory Animal Co.Ltd, Shanghai 201615, China;2. College of Veterinary Medicine, Nanjing Agriculture University, Nanjing 210095, China;3.College of Life Science,Nantong University, Nantong 226019, China;4. Shanghai Institutes for Biological Sciences, CAS, Shanghai 201615, China)
Objective To establish a rapid monitoring method of the three common bacteria in mice frozen resources, such as embryo, sperm, etc. Methods To extract DNA of the three positive bacteria(Staphylococcus auerus, Klebsiella-pneumoniae and β-hemolyticstreptococcus), and establish PCR monitoring method of the three positive strains through designing primer and refining PCR condition. Then extract total DNA of the frozen resources, detect the DNA according to the PCR condition of the three positive bacteria, some samples were detect by fluorescence quantitative PCR at the same time. Results①successfully establish a PCR detection method of the three positive bacteria, the minimum detectable concentration of Staphylococcus auerus, Klebsiella pneumoniae and β-hemolytic streptococcus is 4.19×10-5ng/μL, 1.98×10-5ng/μL and 1.07×10-3ng/μL.②Proved that the three bacteria doesn’t exist in the sample by normal PCR and fluorescence quantitative PCR methods. ConclusionsEstablising a rapid monitoring method of common pathogens of frozen embryo and sperm in mice.
Staphylococcus auerus; Klebsiella pneumoniae; β-hemolytic streptococcus; PCR detection
国家科技支撑计划项目(2013BAK11B02);上海市科委实验动物专项基金(14140900500)。
徐伟超(1991-),男,硕士生,研究方向:动物生殖工程和低温生物学。E-mail: 932716206@qq.com。
徐平(1964-),男,研究员,研究方向:实验动物低温生物学和实验动物遗传性疾病模型。E-mail: pingxu@sibs.ac.cn;
芮荣(1962-),男,教授,研究方向:动物生殖调控与产科疾病。E-mail: rrui@njau.edu.cn。
技术方法
R-332
A
1671-7856(2016)09-0069-07
10.3969.j.issn.1671-7856. 2016.09.013
2016-04-06
