中重度脓毒症长期生存大鼠模型的建立
2016-10-26焦裕霞熊君宇
焦裕霞,熊君宇*
(大连医科大学附属第二医院麻醉科,辽宁 大连 116027)
中重度脓毒症长期生存大鼠模型的建立
焦裕霞,熊君宇*
(大连医科大学附属第二医院麻醉科,辽宁 大连 116027)
目的 建立中重度脓毒症长期生存大鼠模型,观察脓毒症自然转归的过程,为研究脓毒症提供新思路和方法。 方法 将40只SD大鼠分为对照组(sham组,8只)与盲肠结扎穿孔术组(cecal ligation and puncture,CLP组,32只),所有操作均在小动物麻醉机,七氟烷吸入麻醉下完成。所有大鼠在其右颈部建立动静脉通路。术后恢复24 h后,CLP组大鼠通过盲肠结扎穿孔术致脓毒症。手术完毕后将大鼠转移到恢复室(室内温度22~25℃),单笼饲养。术后静脉补液按1∶1比例分别给予6%HEAS和5%葡萄糖注射液,第1、2天补液量为20 mL/kg/12 h,之后液体减半直至大鼠开始饮食。根据大鼠生存情况CLP组大鼠自然分为生存组(survival组)和死亡组(dead组)。观察术后大鼠至30 d,记录大鼠的症状表现、体重变化、IL-10血浆浓度的变化,并解剖观察腹腔内脏器改变。结果(1)CLP组术后24 h内生存率为75%,72 h内生存率为62.5%,7 d内生存率为50%。(2)根据脓毒症严重程度评估系统,32只CLP组大鼠在术后24 h均达到中重度脓毒症程度。(3)手术后,survival组与sham组体重均有下降。survival组大鼠从第4天开始体重下降明显(P=0.017)。survival组大鼠在术后第6天体重下降至最低,较原体重下降(8.51±2.23)%;sham组则在术后第4天体重最低,较原体重下降(2.73±1.82)%,两组差异具有统计学意义(P=0.026)。两组大鼠在术后第30天时,体重的最大升高率(sham组(16.16±2.39)% 与survival组(13.03±3.74)%比无明显差异(P=0.29)。(4)术后1 d与术前(0 d)相比,三组IL-10血浆浓度均有升高,survival组(P=0.000)和dead组升高明显(P=0.010)。(5)腹部解剖见:dead组大量恶臭血性腹水,结扎肠管紫黑,无包裹,无粘连。survival组腹腔广泛粘连,大网膜失去原有形态及光泽,趋向结扎肠管,但无脓肿包裹。sham组解剖未见异常。survival组大鼠脾脏占体重的(2.64±0.37)‰,sham组大鼠脾脏占体重的比例为(1.63±0.20)‰,两者差异具有统计学意义(P=0.032)。 结论本实验为建立CLP中重度脓毒症长期生存者模型提供可靠的控制CLP的措施和筛选模型的方法,使其基本符合脓毒症的发生发展规律。
脓毒症;长期生存;大鼠模型
脓毒症(sepsis)是机体因为对感染的反应损伤了自身组织,从而出现的一种威胁生命的状态[1]。近40年来,尽管大量的基础与临床研究发现了脓毒症期间许多有意义的变化,脓毒症的发病机制仍未明确[2-4]。迄今为止也没有特异性和敏感度高的生物指标可以明确诊断脓毒症或判断预后[5]。在脓毒症治疗方面,除支持治疗外,还没有国际公认的治疗手段和药物[6,7]。这使得我们不得不重新思考研究脓毒症的思路和方法。脓毒症的死亡率很高,但终究有生存者[8-10]。那么生存者为何生存,生存机制对脓毒症治疗有无意义。这些问题都有待于在研究脓毒症生存者的实验中解决。本实验将介绍一种建立中重度脓毒症长期生存大鼠模型的方法和筛选方法。
1 材料和方法
1.1实验动物
清洁级雄性SD大鼠,8~9周龄,300~330 g,由大连医科大学动物实验中心提供[SCXK(辽)2013-0003]。所有实验操作均按照该实验中心的操作指南执行,并得到动物伦理委员会的许可。所有手术操作均在小动物麻醉机(Raymain,中国)下,吸入七氟醚(上海恒瑞,中国)麻醉下完成[SYXK(辽)2013-0006]。
1.2实验方法
1.2.1动物分组
手术前随机分为两组CLP组(n=32)和sham组(n=8),CLP 术后随脓毒症的不同发展结果CLP组自然分为:CLP术后死亡组(dead组)和CLP术后生存至30 d组(survival组)。
1.2.2建立动静脉通路
大鼠颈部备皮消毒,在胸骨上方偏右0.5 cm,开1 cm纵向切口,提起皮肤向右外侧寻找,即可看见暗紫色充盈的右颈外静脉,钝性分离出来,利用用插管引导器(BD,美国),置入PE-50导管(Smith Medical,英国,内径0.58 mm,外径0.96 mm,总长8 cm)1.5~2 cm结扎固定。注入约0.05 mL的150 U/mL的肝素钠注射液封管(塞帽用22 G的实心钝针头剪成1 cm制成)。沿切口继续分离开肌肉和筋膜,在左侧胸锁乳突肌外缘下方即可看见快速搏动的左颈动脉。用镊子将其轻轻挑出,再钝性分离开与其伴行的迷走神经,动作轻柔,勿损伤神经。用动脉夹于近心端夹闭动脉,置入PE导管,松开动脉夹,若置入成功即可见导管有动脉血涌入。同静脉固定封管。将两导管经颈后部皮下组织穿出,固定于大鼠两耳中间稍后处,缝合切口。在PE导管贴上红蓝不干胶以区分动脉和静脉导管。
1.2.3盲肠结扎穿孔(CLP)术
本实验通过盲肠结扎穿孔(CLP)术致大鼠脓毒症。建立静脉通路的大鼠,待其恢复24 h后,进行手术。将大鼠腹部备皮消毒,脐上沿中线开腹1~2 cm,找到盲肠并暴露出来。CLP组用2-0丝线(强生,中国)结扎距盲端约2 cm。用21G三角针在结扎肠段交叉贯穿3次,并挤出肠内容物0.2 mL,约绿豆大小,将盲肠回纳。sham组仅将盲肠暴露再回纳。两组大鼠均注入腹腔2 mL 0.9%氯化钠注射液,轻轻摇晃腹腔,使肠管自然摆列。冲洗切口并关腹。用0.125%的布比卡因注射液局部浸润切口部位作为术后镇痛。
1.2.4术后护理与观察
手术完毕后将大鼠转移到恢复室(室内温度22 ~25℃),单笼饲养。放入已知量的鼠粮和水,每天更换垫料,观察伤口及排泄物,记录体重变化和脓毒症评分。体重变化率=(原体重﹣现体重)/原体重×100%。术后静脉补液按1:1比例分别给予6%羟乙基淀粉溶液(北京费森尤斯卡比药业,中国)和5%葡萄糖注射液,第1、2天补液量为20 mL/kg/12 h,之后液体减半直至大鼠开始饮食。本实验观察术后大鼠至30 d,处死解剖观察腹腔内脏器改变。
1.2.5实验室检查
分别于手术前(0 d),手术后1 d,7 d,14 d,22 d,30 d取血1 mL,1000 g离心15 min,保存于-20℃冰箱,待用。选用大鼠白介素10(IL-10)酶联免疫试剂盒(CUSABIO,中国),按照说明书检测IL-10外周血血浆浓度。
1.3统计学方法
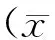
2 结果
2.1实验大鼠的生存情况
sham组30 d生存率100%。CLP组术后1 d内生存率为75%,3 d内生存率为62.5%,7 d内生存率为50%,其生存曲线如图1示。

图1 CLP后大鼠30天生存曲线Fig.1 Survival rate of rats after CLP for 30 days
2.2术后24 h脓毒症评估
根据脓毒症严重程度评估系统(表1)[11],对CLP组大鼠在术后24 h进行评估。每一大鼠需在外观和警惕性的评估标准中,至少满足两个条件,方可属于该等级。平均动脉压检测时,动脉波形需明显并且至少平稳10 min中,方可记录数值。16只CLP组大鼠在术后24 h均达到中重度脓毒症程度。除表中描述的表现外,CLP组大鼠还有口鼻周围见血渍,恶臭稀便,术后1~3 d无自主饮表现食的表现。

表1 脓毒症严重程度评估表
2.3体重变化
每天记录实验大鼠的体重,比较sham组与survival组平均体重变化趋势,如图2所示。手术后,survival组与sham组体重均有下降。survival组大鼠从第4天开始体重下降明显,至第12天均有统计学意义(P=0.017,0.001,0.001,0.003,0.017);sham组大鼠体重虽有降低,与原体重相比无统计学意义。survival组大鼠在术后第6天体重下降至最低,较原体重下降(8.51±2.23)%;sham组则在术后第4天体重最低,较原体重下降(2.73±1.82)%。两组大鼠的体重最大下降率相比较,具有统计学意义(P=0.026)。两组大鼠在术后第30天时,均超越原体重,均有统计学意义,但两组体重的最大升高率(sham组(16.16±2.39)% vs survival组(13.03±3.74)%)无明显差异(P=0.29),如图3所示。
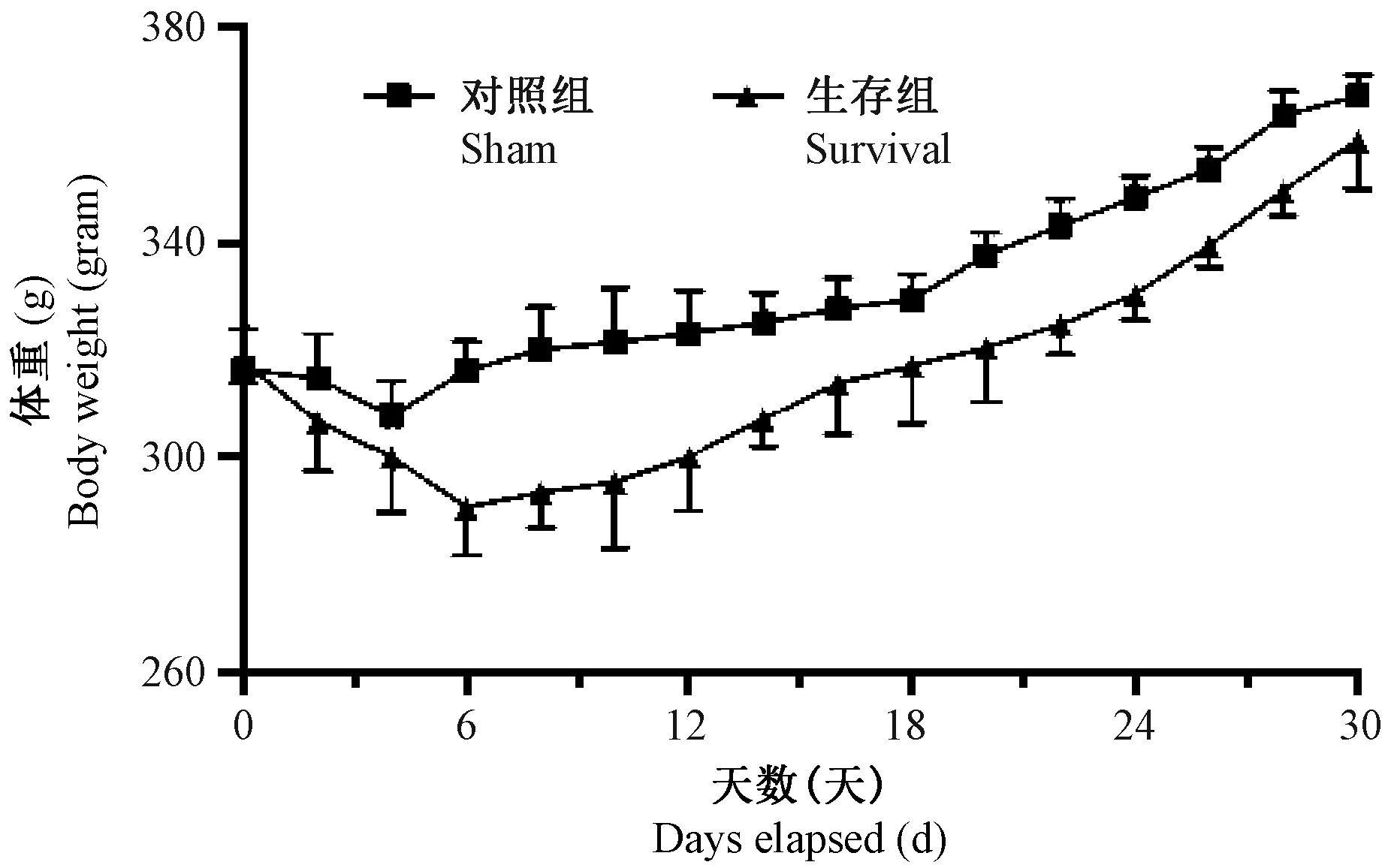
图2 sham组与组体survival组体重随时间的变化趋势Fig.2 Changes in body weight in the survival and sham group
注:ΔP < 0.05,与手术前(0 d)比较。图3 sham组与survival组体重变化率的比较Note.ΔP < 0.05, compared with preoperation (0 d).Fig.3 Compared with the maximum rates of loss and gain body weight
2.4实验室结果
手术后1 d与术前(0 d)相比, 三组IL-10血浆浓度均有升高,sham组升高不明显(P=0.122),survival组(P=0.000)和dead组升高明显(P=0.010)。如图4所示。

注:ΔP < 0.05,与手术前(0 d)比较。图4 三组大鼠IL-10血浆浓度在手术前后的组内比较。Note. ΔP < 0.05, compared with preoperation (0 d).Fig.4 Comparison of concentrations of IL-10 in three groups before and after surgery
2.5解剖
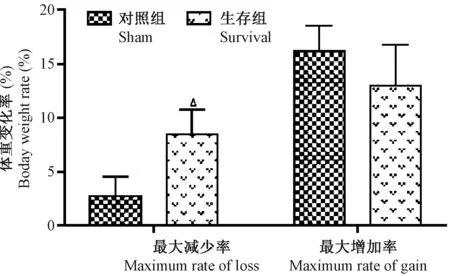
如图5所示,dead组:对术后死亡30 min内大鼠解剖见大量恶臭血性腹水,结扎肠管紫黑,无包裹,无粘连。survival组:对30 d CLP组生存大鼠CO2麻醉处死后立即解剖见:腹腔广泛粘连,大网膜失去原有形态及光泽,趋向结扎肠管,但无脓肿包裹。sham组:解剖未见异常。survival组大鼠脾脏增大明显,占体重的(2.64±0.37)‰,sham组大鼠脾脏未见明显变化,占体重的比例为(1.63±0.20)‰,两者差异具有统计学意义(P=0.032)如图6所示。
3 讨论
Hotchkiss RS等[12]总结了脓毒症可能的发生发展规律曲线,典型的脓毒症早期死亡即归因于促炎因子的瀑布式的级联反应。然而,多数患者可以度过这一时期,进入炎症后期,此时,若促炎反应与抗炎反应恢复平衡,患者即逐渐康复;若自然免疫和适应性免疫功能受损,患者则进入免疫抑制期,最终死于原发病恶化或二次感染。

注:A.肠管坏死;B.大网膜广泛粘连;C.脓肿包裹。图5 大鼠腹部解剖Nota.A.Necrosis of intestine; B.Adhesions of the greater; C.Encapsulated abscess.Fig.5 Abdominal anatomy of rat
注:ΔP < 0.05,与sham组比较。图6 sham组与survival组脾/体重(‰)比较Note. ΔP < 0.05, compared with sham group.Fig.6 Compared with the spleen/body weight
正如前言所述,研究脓毒症生存者模型,可以观察到脓毒症自然转归的过程。探讨其规律和发生机制,不仅对揭露脓毒症的发生发展机制,提供诊断治疗依据有重要意义,而且还有利于研究脓毒症的远期预后,包括远期生存率、患病率及生活质量等,是对脓毒症更深一层的探索。本部分实验建立中重度脓毒症长期生存者模型的关键在于确保急性炎症发生并持续(非一过性)的同时提高生存率,从症状表现,生理生化改变及解剖多方面筛选出符合要求的大鼠模型。
本部分实验选择通过盲肠结扎穿孔术致大鼠脓毒症。Wichterman等[13]于1980年发明的盲肠结扎穿孔术(CLP)致大鼠脓毒症模型是目前应用最广泛的脓毒症动物模型。CLP最大的优点是模拟阑尾炎穿孔致腹膜炎的病理过程,更接近临床的发病过程。缺点在于难以准确控制感染程度,感染过重导致快速死亡,感染过轻则无法满足实验要求,有可能成为局部脓肿包裹模型[14,15]。影响CLP严重程度主要有三个主要因素,即结扎盲肠的长度,穿刺针的粗细和术后护理条件。因此本实验采用统一的手术参数和术后护理条件保证其感染程度相似。我们经过反复试验,发现以下方法可以控制急性炎症严重程度,并且延续发展为腹膜炎,模拟脓毒症的发病过程。①结扎盲肠的长度为2 cm既可以导致急性胃肠道生理功能紊乱,表现为大鼠术后一天就有明显稀便,又可以缓慢自行恢复,有明确的发病过程和适当的生存率。②使用21G三角针经行穿刺可以避免穿孔过早闭合。③挤压肠内容物的量相对较多,全部回纳至腹腔,并且注入2 mL 0.9%氯化钠注射液,并轻轻摇晃腹腔。这样做即可以让肠管自然排列,避免绞窄性肠梗阻,又可以将肠内容物弥散至全腹腔,导致急性弥散性腹膜炎,避免大网膜早期包裹。④为了提高该模型的生存率,我们对术后大鼠进行液体治疗,这也是目前国际公认的唯一有效的治疗脓毒症的方法[6,7]。适当的胶体液可以有效扩充血容量,而葡萄糖注射液则可以提供因未进食缺失的能量[10]。⑤提高室温至25℃左右,也有利于脓毒症休克的恢复,提高生存率。
此外,本实验采用七氟烷吸入麻醉,麻醉诱导及苏醒迅速,对大鼠正常生理功能影响轻微。避免了腹腔注射麻醉药易造成大鼠腹腔出血和腹腔肠管黏连,不利于腹部手术操作,且时间不易控制,苏醒缓慢,术后死亡率高等缺点。建立动静脉通路作为临床麻醉常用的技术手段,能为监测和治脓毒症疗创造很多便利。本实验将该技术应用于大鼠,并将留置导管从颈后皮下引出使得导管不易被大鼠挣脱,对大鼠创伤应激小,便于动脉采血和监测,使在大鼠无束缚清醒状态下持续静脉补液或泵药成为可能。以上建立模型的方法,操作明确易行,重复性好。注:以上两段详细介绍操作要点,便于读者重复实验,建立模型,可反映模型的重复性。
模型的准确性,即可信性是确保实验顺利进行的基础。多方面的、准确的筛选方法是必不可少的。到目前为止,还没有公认的CLP脓毒症模型建立成功的量化评估指标。本实验通过症状表现,体重变化,相关细胞因子的增减以及解剖不同角度对模型严格筛选。大家常用的脓毒症严重程度评估表,可以初步从模型外观,警惕性及动脉血压上判断脓毒症的严重程度,可能受观察者主观影响。本实验发现CLP脓毒症大鼠的体重在炎症早期下降明显,这可能由于CLP导致胃肠功能紊乱有关,可以反映CLP的严重程度。体重变化是量化指标,相对客观,而且用体重的变化率进行比较还可以摈弃模型基础值的影响。脓毒症期间多种细胞因子发生变化,有促炎因子,也有抗炎因子,可以根据实验目的选择感兴趣的分子检测。检测的方法也是多种多样的,其中外周血中多种细胞因子,因为取材方便,多被选择。而检测方法也有包括酶联免疫法,流式细胞学在内的多种简单易操作的多种方法。本实验用酶联免疫法选择检测IL-10的血浆浓度,发现其在术后1 d发生明显变化,说明早期炎症剧烈发生。最后,对模型进行腹部解剖可以观察有无腹膜炎,有无局部脓肿包裹,更加直观,更加明确。此外,还可以观察其他脏器的变化。本实验着重观察脾脏的改变,并发现脓毒症30 d后脾脏明显增大,具体机制尚未明确[16,17],有待进一步研究,可能作为判断脓毒症严重程度的指标之一。注:该段说明了如何使得建立的模型具有可信性,需要上述多种方法进行验证和筛选。
综上所述,本实验通过多种措施控制CLP的严重程度和不同的筛选方法,成功建立了符合脓毒症发生发展规律的中重度脓毒症30 d生存者模型。研究脓毒症生存者模型为研究脓毒症致病机制,治疗方法,分期诊断,预后评估等提供新的研究思路和方式方法。
[1]Singer M, Deutschman CS, Seymour CW,etal. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3) [J]. JAMA,2016, 315(8): 801-810.
[2]Hutchins NA, Unsinger J, Hotchkiss RS,etal. The new normal: immunomodulatory agents against sepsis immune suppression[J]. Trends in Molecular Medicine,2014, 20(4): 224-233.
[3]Coopersmith CM, Wunsch H, Fink MP,etal. A comparison of critical care research funding and the financial burden of critical illness in the United States[J]. Crit Care Med,2012, 40: 1072-1079.
[4]Stoller J, Halpin L, Weis M,etal. Epidemiology of severe sepsis: 2008-2012[J]. Journal of Critical Care,2016, 31(1): 58-62.
[5]Prucha M, Bellingan G, Zazula R. Sepsis biomarkers[J]. Clinica Chimica Acta, 2015, 440: 97-103.
[6]Alan EJ, Micheal AP. The Surviving Sepsis Campaign Guidelines 2012: Update for Emergency Physicians[J]. Annals of Emergency Medicine, 2014, 63(1): 35-47. [7]Dellinger RP, Mitchell ML, Rhodes A,etal. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2012[J]. Critical Care Medicine, 2013, 41(2): 580-637.
[8]Carbajal-Guerrero J, Cayuela-Domínguez A, Fernández-García E,etal. Epidemiology and long-term outcome of sepsis in elderly patients.[J]. Med Intensiva,2014, 38: 21-32.
[9]Clark E, Bagshaw SM. Long-term risk of sepsis among survivors of acute kidney injury.[J]. Critical Care (London, England), 2014, 18: 103-105.
[10]Lemay AC, Antonio A, Restrepo MI.,etal. Predictors of Long-term Mortality After Severe Sepsis in the Elderly[J]. The American Journal of the Medical Sciences, 2014, 347: 282-288.
[11]Brealey D, Karyampudi S, Thomas S,etal. Mitochondrial dysfunction in a long-term rodent model of sepsis and organ failure[J]. Am J Physiol Regul Integr Comp Physiol, 2004, 286: R491-497.
[12]Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy.[J]. Nat Rev Immunol, 2013, 13: 862-874. [13]Fink MP. Animal models of sepsis. [J]. Virulence, 2014, 5:143-153.
[14]Saeed S, Gilroy D, Singer M. Clinical severity and local inflammatory responses in animal models of sepsis[J]. Critical Care, 2010, 14: 10-12.[15]Dyson A, Singer M. Animal models of sepsis: why does preclinical efficacy fail to translate to the clinical setting? [J]. Crit Care Med, 2009, 37: S30-37.[16]Valdes-Ferrer SI, Rosas-Ballina M, Olofsson1 PS,etal. HMGB1 mediates splenomegaly and expansion of splenic CD11b+Ly-6Chighinflammatory monocytes in murine sepsis survivors[J]. Journal of Internal Medicine, 2013, 274: 381-390.[17]Pozo AL, Godfrey EM, Bowles KM. Splenomegaly: investigation, diagnosis and management[J]. Blood Rev, 2009, 23: 105-111.
Establishment of long term survival following sepsis: a rat model
JIAO Yu-xia,XIONG Jun-yu*
(Department of Anesthesiology, the Second Hospital of Dalian Medical University, Dalian 116027, China)
Objective Establish a Long-term Survival Rat Model of Sepsis for recovery naturally, and the idea of researching about sepsis survivors may point out new research ideas and methods for sepsis. Methods40 SD rats were divided into the sham group (8) and the CLP group (32), with all surgical operations under the small animal anesthesia machine and sevoflurane inhalation anesthesia. PVC tubes were inserted into the right carotid artery and jugular vein, respectively. After a postoperative recovery of 24 hours, the rats in the CLP group received the cecal ligation and puncture (CLP), which caused sepsis. The rats were then transferred to the single cages in the recovery room (with the temperature kept between 22~25℃). After the surgery, we commenced fluid resuscitation, consisting of a solution 6% hetastarch and 5% Glucose in the ratio of 1:1. The amount was 20 mL/kg/12h on the first and second days after the surgery. Then it was halved until the rats started eating. These rats were observed about performance, weight and concentration of IL-10 until 30 days after the surgery, when they were anatomized and the change of their organs was watched. Results(1) The survival rate was 75% at 24 h, 62.5% at 72 h, 50% on 7 d after CLP in the CLP group. (2) Based on the severity of sepsis evaluation system, 32 rats at 24 h after CLP reached moderate to severe sepsis. (3) The body weight were decreased in both survival group and the sham group after CLP. The body weight of rats in survival group fell from the fourth day of survival was significantly (P=0.017), and to a minimum after the first six days, compared with the original weight loss (8.51±2.23)%. The body weight of rats in sham group fell to a minimum after the first four days, by which the lowest body weight loss (2.73±1.82)% than the original weight. The difference between two groups was statistically significant (P=0.026). After 30 days, the maximum weight increase rates[sham group (16.16±2.39)% vs survival group (13.03±3.74)%]were not different significantly (P=0.29). (4) Compared the preoperative (0 d) with postoperative 1d, all the plasma concentration of IL-10 in three groups was increased, which in survival group (P=0.000) and in dead group increased significantly (P=0.010). (5) Shown by abdominal anatomy, a large set of foetor and bloody ascites, black bowel, with no encapsulated abscess and adhesion in dead group; Abdominal adhesions, omental with losing shape and gloss and tending to ligation intestine, but no encapsulated abscess in survival group; no abnormal anatomy in sham group. The weight of spleen in total body weight ration was (2.64±0.37) ‰ in survival group and (1.63±0.20) ‰ in sham group. The difference between two group was statistically significant (P=0.032). ConclusionsThis experiment provided reliable measures of the CLP and methods of screening model, for the establishment of CLP in severe sepsis model of long-term survivors, which is basically in accordance with the occurrence and development of sepsis clinically.
Sepsis; Long-term survival; Rat medal
国家自然基金面上项目(81171791)。
焦裕霞(1981-),女,主治医师,博士研究生,专业:麻醉学。E-mail: jiaoyuxia@dmu.edm.cn。
熊君宇(1959-),男,教授,主任医师,博士生导师,研究方向:麻醉药对脓毒症机体的影响。E-mail:jyx0639@163.com。
研究报告
R-332
A
1671-7856(2016)09-0019-06
10.3969.j.issn.1671-7856. 2016.09.004
2016-04-05
