高龄大鼠血管钙化及血管壁骨桥蛋白、骨钙素表达的研究
2016-10-26刘菊菊李书国邓娟娟叶明张丹彭燕朱正庭
刘菊菊,李书国,邓娟娟,叶明,张丹,彭燕,朱正庭
(三峡大学第一临床学医学院&宜昌市中心人民医院老年病科,湖北 宜昌 443003)
高龄大鼠血管钙化及血管壁骨桥蛋白、骨钙素表达的研究
刘菊菊,李书国*,邓娟娟,叶明,张丹,彭燕,朱正庭
(三峡大学第一临床学医学院&宜昌市中心人民医院老年病科,湖北 宜昌443003)
目的 研究高龄大鼠血管钙化的发生情况,以及骨桥蛋白(osteopontin, OPN)、骨钙素(osteocalcin, OC)在高龄大鼠动脉血管壁表达的变化。方法选择20只20月龄的SD大鼠为实验组,20只3月龄的SD大鼠为对照组,取大鼠的主动脉条、心脏和肾组织备检。HE染色观察血管形态,Von Kossa染色判断钙盐沉积程度,免疫组化和蛋白质印迹法(Western-blot)测定血管壁OPN、OC的表达情况。结果实验组大鼠血管平滑肌细胞排列紊乱,中膜层厚度增加,弹力板断裂,血管纤维化程度增高;对照组大鼠血管内膜内皮细胞、血管平滑肌细胞排列整齐,弹力板完整。实验组大鼠的大动脉和微小动脉内均可见钙盐沉积,对照组动脉未见钙盐沉积。实验组大鼠血管壁OPN、OC的表达较对照组明显上调(P< 0.05)。结论血管中膜钙化可能是血管老化的病理表现,血管钙化的形成可能与骨形成相关蛋白OPN和OC的表达上调有关。
血管钙化;血管老化;骨桥蛋白;骨钙素
随着人口老年化的发展,血管老化的形成机制及血管老化相关疾病的防治正在成为人们研究的热点。血管钙化是动脉粥样硬化、高血压、糖尿病、慢性肾脏病和衰老等病理状态的共同表现[1]。它的主要特征是动脉壁弹性降低和血流阻滞,最终可导致缺血性心脏病和脑卒中,是心脑血管疾病高发病率和高死亡率的重要原因之一。目前研究表明血管钙化是一个与骨发育相似的主动的、高度可调的病理生理过程[2]。研究表明,衰老的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)向成骨样细胞表型转换在年龄相关的血管钙化中起重要作用[3]。通过对衰老的微阵列分析得出基因调节的差别与血管钙化有关,这些基因包括基质Gla蛋白,骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2),骨保护素(osteoprotegerin,OPG),I型胶原及骨桥蛋白(osteopontin,OPN),骨钙素(osteocalcin, OC)等[4]。本项研究拟观察自然衰老大鼠血管的钙化情况,通过检测大鼠血管壁OPN和OC表达,探讨OPN和OC与大鼠衰老以及钙化的关系。
1 材料和方法
1.1实验动物
3月龄健康雄性SD大鼠共20只,体重230~250 g;20月龄高龄雄性大鼠20只,体重750~900 g,由三峡大学医学院实验动物中心[SYXK(鄂)2011-0061] [SCXK(鄂)2011-0012]提供,符合国家医学动物使用标准[动物许可证号:42010200000381]。饲养条件:温度(24±2)℃,湿度50%~70%,采用12 h:12 h昼夜间断照明;大鼠自由进水,普通饮食,并按照实验动物使用的3R原则给予人道的关怀。
1.2主要试剂
Von kossa染色试剂盒(谷歌生物技术有限公司);OPN多克隆抗体(福州迈新);OC多克隆抗体(SANTA CRUZ 生物技术公司);SP免疫组化试剂盒和DAB显色试剂盒(福州迈新)。
1.3实验方法
1.3.1实验动物分组、标本收集与处理
青年大鼠为对照组,高龄大鼠为实验组。给予普通饲料喂养2周后,腹腔注射10%水合氯醛(0.3~0.4 mL/100g)麻醉大鼠。无菌条件下剪开胸、腹腔,采用4%的多聚甲醛灌注。灌注完成之后小心剥离出完整的主动脉(从主动脉根部至髂总动脉分叉处),并取下大鼠的心脏和肾脏放入4%多聚甲醛溶液中备检,常规石蜡包埋;一部分主动脉直接置于-80℃冰箱保存,以供Western-blot检测。
1.3.2标本组织的病理形态学观察
1.3.2.1苏木精 — 伊红染色(HE染色)
取出各组石蜡包埋切片,①二甲苯脱蜡和梯度乙醇脱水:二甲苯Ⅰ 20 min→二甲苯Ⅱ 15 min→二甲苯Ⅲ 10 min→无水乙醇Ⅰ 5 min→无水乙醇Ⅱ 3 min→95%酒精1 min→90%酒精1 min→80%酒精1 min→70%酒精1 min;②染色:苏木精染核7 min→自来水洗2 min;③分化和漂洗:1%盐酸酒精2~5s→自来水洗5~7 min;④:复染:1%水溶性伊红2~4 min→自来水洗1 min;⑤:脱水和透明:95%酒精1 min→无水乙醇Ⅰ 1 min→无水乙醇Ⅱ 2 min→二甲苯Ⅱ 2 min;⑥封片:切片风干后中性树胶封片,显微镜下观察。
1.3.2.2冯库萨染色(Von Kossa染色)
首先石蜡切片脱蜡脱水;之后在良好的日光下或紫外灯下用2%硝酸银侵染20~60 min;随后蒸馏水洗5 min;然后用5%的硫代硫酸钠水溶液处理2 min;之后用自来水洗5 min;然后再用0.1%核固红染液复染2~3 min;之后蒸馏水洗5~10 s;最后无水乙醇脱水,二甲苯透明,风干后中性树脂胶封片,显微镜下观察。
1.3.3标本组织的免疫组织化学染色
取大鼠组织进行石蜡切片后,采用免疫组织化学三步法,OPN抗体为工作液、OC抗体采取1:30稀释。整个过程按照试剂盒说明书进行。依次对切片进行脱蜡、梯度酒精水化、抗原修复、血清封闭、一抗孵育、二抗标记、DAB显色、苏木素复染、脱水、透明、干燥、封片等主要步骤。每批免疫组化均设有PBS代替的阴性对照。
1.3.4Western-blot
将主动脉剪碎后置于玻璃匀浆器中,每20 mg组织加入150~250 μL RIPA裂解液。充分裂解后,按BCA蛋白定量检测试剂盒测定组织总蛋白含量。取适量各组总蛋白样品与5×Sample Buffer混匀,100℃煮沸5 min,按蛋白定量25 μg/孔上样,进行电泳、转膜、丽春红染色、封闭、一抗孵育、二抗孵育、DAB显影。胶片风干后经电脑成像系统获取蛋白条带图像,以内参β-actin的蛋白条带灰度值作为对照,分析OPN、OC表达的相对量。
1.4统计学方法
2 结果
2.1组织病理形态学观察
HE染色光镜观察,可见血管的基本结构。对照组血管内皮细胞、血管平滑肌细胞排列整齐,弹力板完整、无断裂(如图1-A);实验组血管内皮细胞脱落,VSMCs增殖、排列紊乱、并向内膜迁移,中膜层厚度增加,弹力板断裂(如图1-B)。
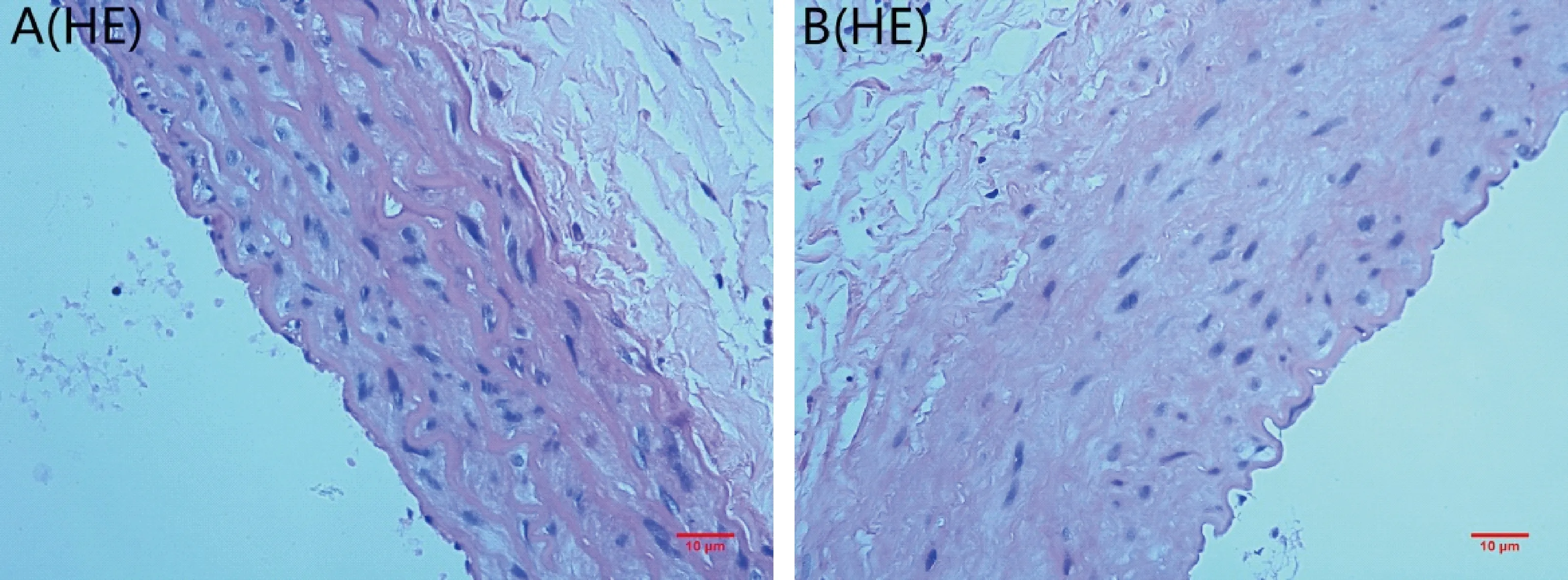
注:(A)对照组;(B)实验组。图1 各组大鼠主动脉HE染色(×40,bar=10 μm)Note.(A)control group;(B)experimental group. Fig.1 HE staining of rat,s thoracic aorta
2.2Von Kossa染色评估血管钙化
各组大鼠的标本经Von Kossa染色后,若有钙盐沉积,则该区域呈黑褐色,背景呈红色。青年组大鼠血管未见明显钙盐沉积,核染为粉红色(如图2-A1,A2,A3);高龄组大鼠主动脉、冠状动脉和肾脏内的微小动脉均可见大量明显的黑色钙盐沉积(如图2-B1,B2,B3)。
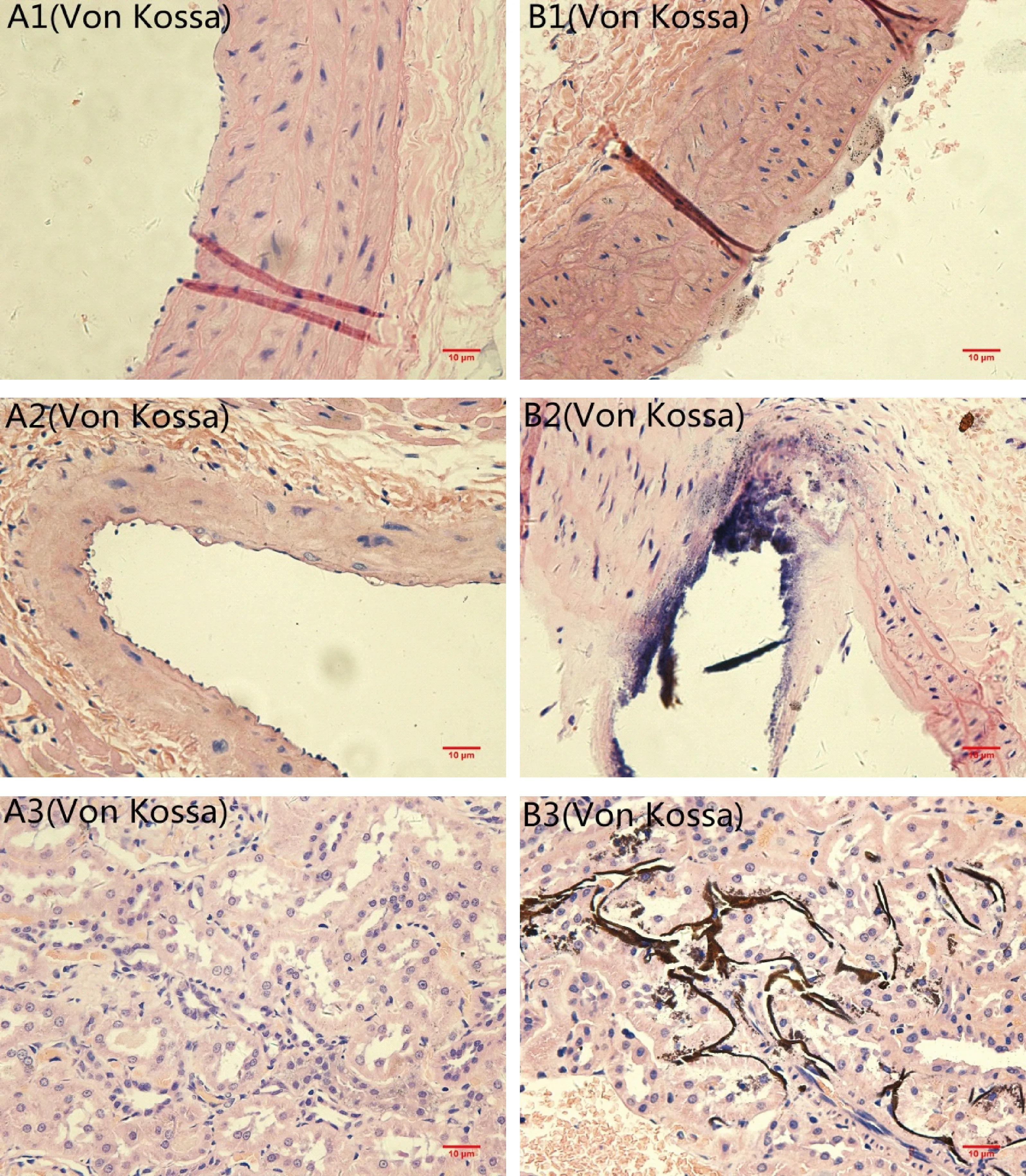
注:(A)对照组;(B)实验组;(1)胸主动脉;(2)冠状动脉;(3)微动脉。图2 各组标本Von Kossa染色(×40,bar=10 μm) Note.(A)control group;(B)experimental group;(1)thoracic aorta;(2)coronary;(3)arterioles.Fig.2 Von Kossa staining of the specimens
2.3各实验组大鼠标本OPN免疫组化结果
OPN可表达于不同动物的不同组织中,在正常的骨组织和肾组织中均有表达,但正常的血管中OPN基本不表达或表达甚微,而在钙化的血管中OPN的表达则会明显增加,主要位于细胞质或细胞核。本实验免疫组化结果显示,OPN在青年大鼠的胸主动脉、冠状动脉和肾脏中的小动脉呈弱阳性表达(如图3-A1,A2,A3);在高龄大鼠的胸主动脉,冠状动脉和肾脏的微小血管中均呈强阳性表达,可见血管壁的中膜和外膜处有大量棕黄色物质沉积(如图3-B1,B2,B3)。
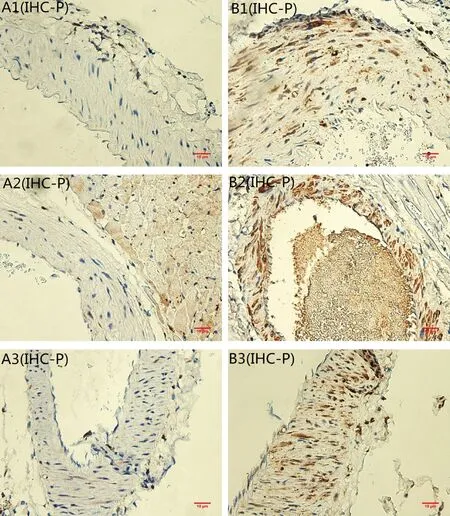
注:(A)对照组;(B)实验组;(1)胸主动脉;(2)冠状动脉;(3)微动脉。图3 各组OPN免疫组化染色(×40,bar=10 μm)Note.(A)control group;(B)experimental group;(1)thoracic aorta;(2)coronary;(3)arterioles.Fig.3 OPN immunohistochemical staining of the thoracic aorta
2.4各组大鼠标本OC免疫组化结果
OC是由成骨细胞和类似成骨细胞的钙化血管细胞分泌的蛋白。本实验免疫组化结果显示,实验组胸主动脉、心脏和肾脏的血管壁上VSMCs包浆内出现明显的棕黄色颗粒(如图4-B1,B2,B3),而对照组大鼠极少见(如图4-A1,A2,A3)。

注:(A)对照组;(B)实验组;(1)胸主动脉;(2)冠状动脉;(3)微动脉。图4 各组OC免疫组化染色(×40,bar=10 μm)Note.(A)control group;(B)experimental group;(1)thoracic aorta;(2)coronary;(3)arterioles.Fig.4 OC immunohistochemical staining of thoracic aorta
2.5各组大鼠动脉OPN、OC Western-blot检测结果
用Western-blot 检测各组大鼠主动脉组织OPN和OC蛋白的表达水平,用电脑成像系统观察蛋白条带,以内参β-actin条带的灰度值作为对照,分析蛋白表达的相对量,结果如下图5所示。实验组大鼠主动脉OPN和OC蛋白的表达量较对照组明显升高,其差异有统计学意义。
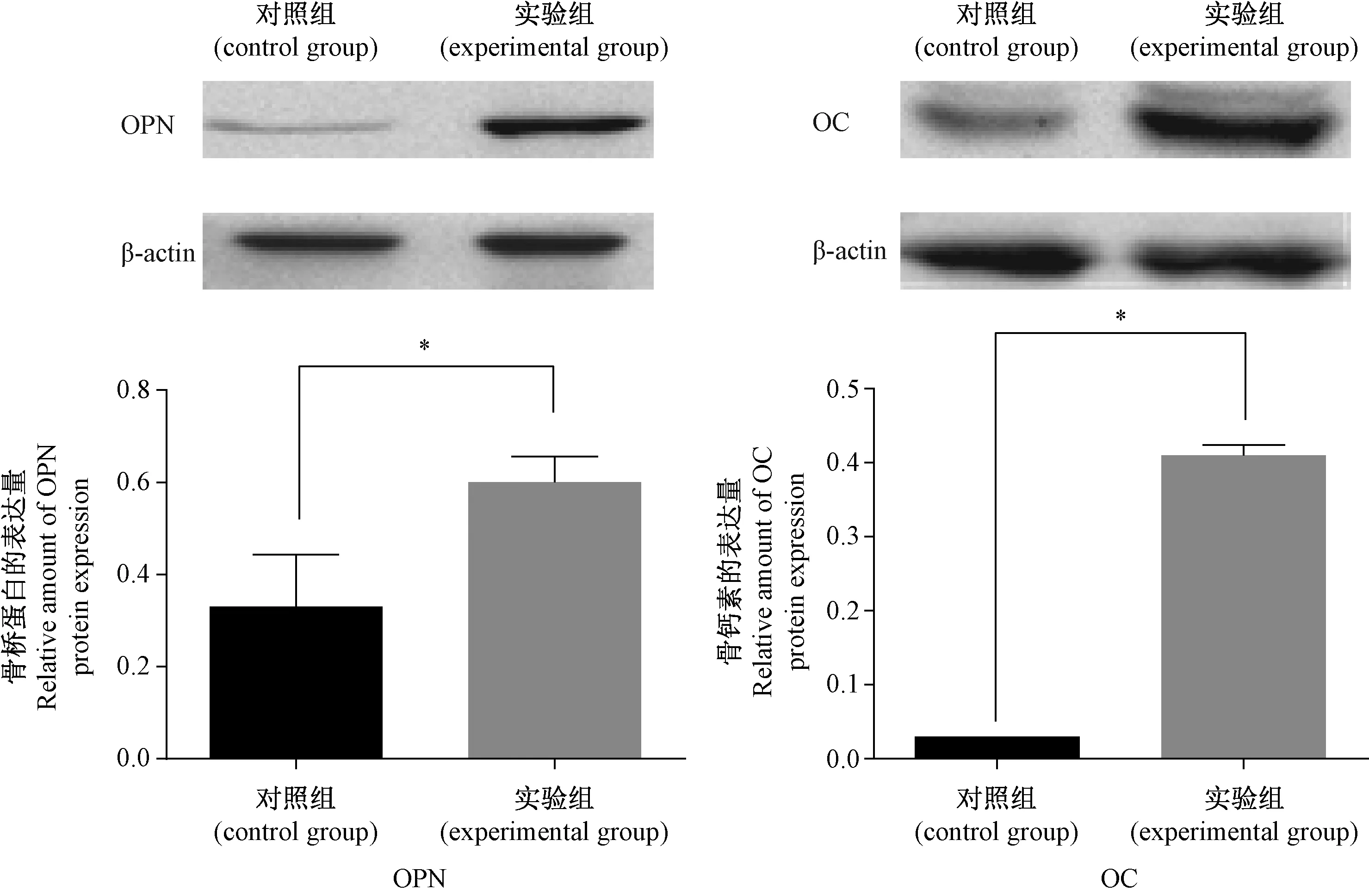
注:*P < 0.05,与对照比较。图5 各组大鼠胸主动脉OPN和OC Western blot检测结果Note. *P < 0.05,compared with the control group.Fig.5 OPN and OC Western blot results of thoracic aorta
2.6统计学分析
采用Spearman分析血管组织中OPN和OC蛋白表达的相关性得,r=0.641,P< 0.01,即高龄大鼠血管壁OPN和OC表达同时增加有相关性。采用2检验分析OPN和OC的表达与血管钙化的关系,OPN与血管钙化的2值为17.128,P<0.05;OC与血管钙化的2值为14.169,P< 0.05,可见高龄大鼠血管壁钙化与OPN和OC的表达增加有关。
3 讨论
引起生物体衰老的原因几乎涉及到每一个细胞和生物学过程。Lopez-Otin等[5]总结认为个体衰老可能与:基因损伤应答改变、端粒丢失、基因调节改变、蛋白质平衡失调、营养信号通路改变、线粒体功能紊乱、细胞衰老、干细胞损耗以及炎症等过程相关。随着年龄的增长,这些因素相继发生作用,器官和细胞老化程序进展。血管作为机体的主要器官之一,其衰老过程亦是整个机体衰老过程的关键因素。血管老化时心血管疾病危险因子增加,发病率和死亡率增高,血管钙化的发生率也逐渐增加。
通过HE染色发现,青年组大鼠血管壁内膜较薄,中膜VSMCs排列规则,结构完整;高龄大鼠的血管壁较青年大鼠而言其中膜明显增厚,VSMCs增生、排列紊乱并向内膜迁移,弹力板有断裂,还可见内皮细胞部分脱落。这提示年龄的增加会导致大鼠的动脉发生老化。VSMCs是组成血管中膜的主要细胞,其主要功能是维持血管张力,VSMCs的异常增殖和迁移是血管老化的主要病理变化[6]。VSMCs的增殖与迁移受到多种生长刺激因子和抑制因子的双重调节,在正常情况下VSMCs的增值与凋亡维持平衡,血管老化时某些细胞因子通过刺激信号转导网络使维持这一平衡的基因表达发生异常改变,VSMCs的增殖失控。生玉平等[7]通过对大鼠主动脉衰老进程的比较蛋白质组学研究发现老年组与成年组相比较,有49个差异蛋白点,其中有17个蛋白的差异在1.5倍以上,其中包含Profilin-1和PrelaminA。Profilin-1是一种低分子量的肌动蛋白结合蛋白,能够参与调控肌动蛋白的聚合-解聚平衡,在血管细胞增殖及重塑中有着极为重要的作用。有研究表明[8],Profilin-1能够通过激活丝裂原活化蛋白激酶(MAPK)信号通路,参与血管老化过程。在高龄大鼠血管中,Profilin-1表达水平上调,激活MAPK,活化的MAPK可激活转录因子,增加VSMCs的DNA合成,促进其增殖、迁移,以及向成骨细胞转化。Warren DT等[9]研究发现,PrelaminA在细胞内的大量堆积会破坏了核染色体和DNA损伤修复途径,干扰了细胞核的空间划分,进而促进了VSMCs的衰老。
我们通过Von Kossa染色发现,高龄大鼠的大动脉(见图-2B1)和微小动脉(见图-2B2)均有钙化,可见血管钙化与血管老化一样是系统性的过程,这可能与血管老化时,衰老的VSMCs向成骨细胞表型转化有关。Johnson RC等[3]研究发现,VSMCs衰老时向成骨细胞表型转换在年龄相关的血管钙化中起着重要作用。该研究通过对衰老的血管平滑肌细胞和年轻的血管平滑肌细胞对比研究发现,在成骨细胞中高表达的基因如:核心结合蛋白因子2(runt-related transcription factor-2,RUNX-2),碱性磷酸酶(ALP)和I型胶原等均在衰老的VSMCs中高表达。
OC是构成骨基质的重要成分之一,绝大部分OC是由成骨细胞和类似成骨细胞的钙化血管细胞分泌的,是成骨细胞最终分化的特异性标志[10]。有研究显示[11],OC的表达在成骨细胞的表型发育过程中呈阶段特异性,只有在成骨细胞成熟的最后一个阶段,即基质矿化期开始之后,OC基因才被诱导表达。本研究的免疫组化结果显示在高龄大鼠的血管中OC的表达较青年大鼠而言明显上调,这进一步说明在血管老化的过程中VSMCs确实会向成骨细胞分化,并且非常成熟。OC与羟基磷灰石有很高的结合力[12],这说明它能够促进血管钙化。
多项研究显示[13,14],OPN是骨形成过程中重要的细胞因子,也是血管钙化的标志性蛋白。OPN是一种磷酸糖蛋白粘附分子,主要存在于富含矿物的牙齿和骨骼中,它可与破骨细胞表面的整合素ανβ3受体相结合,使局部的微环境酸化,矿物质溶解,进而抑制羟基磷灰石结晶的生长。有研究发现[15],OPN可以通过其精氨酸-甘氨酸-天冬氨酸序列与羟基磷灰石晶体表面结合阻止其增大,进而抑制血管钙化的形成。体外实验研究表明[16],成骨细胞中OPN mRNA水平随着钙化的进展而进一步升高。Hofbauer等[17]通过对OPN-/-MGP-/-和OPN+/+MGP-/-的小鼠对比研究发现,OPN-/-MGP-/-小鼠模型的钙化速度加快了,由此证明了OPN可以抑制血管钙化。在本研究发现,高龄大鼠的血管中OPN表达明显上调,这可能是由于血管老化引起血管钙化的正反馈作用,具体机制有待进一步研究。
综上所述,通过对高龄大鼠血管钙化以及相关蛋白的研究发现:高龄大鼠的血管壁中膜厚度增加,VSMCs增生、排列紊乱并向内膜迁移,血管纤维化程度增高;血管老化时,VSMCs发生增殖、迁移及向成骨细胞转化,OC的表达上调,促进血管中膜钙化;老化血管的钙化可以促进钙化抑制因子OPN的表达。
[1]Adam Harvey,Montezano AC,Touyz RM.Vascular biology of ageing—Implications in hypertension[J].Journal of Molecular and Cellular Cardiology,2015,83(6):112-121.
[2]Leopold JA. Vascular calcification:Mechanisms of vascular smooth muscle cell calcification [J].Trends Cardiovasc Med,2015,24(4):267-274.
[3]Nakano-Kurimoto R,Ikeda K,Uraoka M,etal.Replicative senescence of vascular smooth muscle cells enhances the calcification through initiating the osteoblastic transition [J].Am J Physiol Heart CircPhysiol, 2009,297(5):1673-1684.
[4]Lau WL,Festing MH,Giachelli CM. Phosphate and vascular calcification: Emerging role of the sodium-dependent phosphate co-transporter PiT-1[J].Thromb Haemost, 2010,104(3):464-470.[5]López-Otín C,Blasco MA,Partridge L,etal.The hallmarks of aging [J]. Cell,2013,153(6),1194-1217.
[6]陶丽丽.益气活血中药延缓增龄与高血压所致血管老化的机制研究[D].中国中医科学院, 2011.
[7]生玉平.大鼠主动脉衰老进程的比较蛋白质组学研究 [D].山东大学,2013.
[8]Evans NJ, Walker JW. Endothelin-1 mobilizes profilin-1-bound PIP2 in cardiac muscle [J]. ExpBiol Med (Maywood),2006,231:882-887.
[9]Warren DT, Shanahan CM.Defective DNA-damage repair induced by nuclear lamina dysfunction is a key mediator of smooth muscle cell aging [J].BiochemSoc Trans, 2012,39:1780-1785.
[10]Qiao W, Chen L, Zhang M,etal. MicroRNA-205 regulates the calcification and osteoblastic differentiation of vascular smooth muscle cells[J].Cell PhysiolBiochem,2014,33(6):1945-1953.
[11]Stein GS, Lian JB, Owen TA. Relationship of cell groth to the regulation of tissue-specific gene expression during osteoblast differentiation [J].FASEBJ, 1990,4(13):3111-3123.
[12]李琳琳,冯淑芝.骨钙素在动脉粥样硬化形成中的作用研究进展[J].医学综述, 2015,(11):1942-1945.
[13]Wolak T. Osteopontin - a multi-modal marker and mediator in atherosclerotic wvascular disease.[J].Atherosclerosis.2014,236(2):327-337.
[14]Scialla JJ,Kao WH,Crainiceanu C,etal.Biomarkers of vascular calcification and mortality in patients with ESRD[J].Clin J Am SocNephrol,2014,9(4):745-755.
[15]Yamaguchi A, Akashi T.Vascular calcification: mutual interaction between bone and blood vessel[J].Clin Calcium,2010,20(11):1669-1676.[16]Bishop E,TheophilusEH,Fearon IM.In vitro and clinical studies examining the expression of osteopontin in cigarette smoke exposed endothelial cells and cigarettes mokers[J].BMC Cardiovasc Disord,2012,12:75.
[17]Hofbauer LC,Brueck CC,Shanahan CM,etal.Vascular calcification and osteoporosis:from clinical observation towards molecular understanding[J]. OsteoporosInt,2007,18(3):251- 259.
Research on the vascular calcification and the expressions of osteopontin and osteocalcin in the arterial wall of aged rats
LIU Ju-ju, LI Shu-guo*, DENG Juan-juan, YE Ming, ZHANG Dan, PENG Yan, ZHU Zheng-ting
(Department of Geriatrics,The First College of Clinical Medical Science, China Three Gorges University &Yichang Central People,s Hospital, Yichang, 43003, China)
Objective This study was designed to investigate the morphology of vascular calcification in aged rats and the expressions of osteopontin and osteocalcin in the arterial wall of old rats. Methods 20 20-month-old SD rats were recruited in experimental group and 20 3-month-old SD rats were recruited in control group. Aorta, heart and kidney of the rats were collected for assay. HE staining and Von Kossa staining were used to determine the vascular calcification. The expressions of OPN and OC in vascular wall were tested by Immuno- histochemistry and Western-blot. ResultsIn the experimental group, vascular smooth muscle cells are disordered arrangement, thickness of membrane layer is increased, elastic plate fracture and the vascular fibrosis is increased. In the control group, vascular endothelial cells and smooth muscle cells are arranged in neat, elastic plate is complete. In the experimental group, the large artery and small artery were observed the calcium salt deposits. In the control group,arteries were not observed calcium salt deposits. Compared with the control group, the expressions of OPN and OC were significantly increased in the experimental group (P< 0.05). ConclusionsVascular medial calcification may be pathological features of vascular aging. Vascular calcification may be related with the up - regulated expression of bone-associated protein OPN and OC.
Vascular calcification; Vascular aging; Osteopontin; Osteocalcin
刘菊菊(1991-),女,硕士研究生,专业:内科学。E-mail: 286051889@qq.com。
李书国(1969-),男,硕士生导师, E-mail: alener508@126.com。
研究报告
R-332
A
1671-7856(2016)09-0054-08
10.3969.j.issn.1671-7856. 2016.09.010
2016-03-07
