多倍体彩色马蹄莲抗寒性初步研究
2016-10-21高静吴景芝郭彦兵吴红芝
高静 吴景芝 郭彦兵 吴红芝

摘 要 彩色马蹄莲对低温较敏感,当温度低于6℃就会产生低温伤害。为摸清彩色马蹄莲多倍体是否在抗寒性方面有所改善,以2个彩色马蹄莲品种(Ym039、Gold affair)的四倍体及二倍体试管苗为材料,炼苗移栽成活后,进行低温胁迫和常温对照处理,并检测抗寒性相关生理指标。结果表明:(2±0.5)℃下10 d后二倍体死亡率超过50%,四倍体死亡率30%左右;(6±0.5)℃低温胁迫下,多倍体品种游离脯氨酸、MDA含量低于二倍体,而游离脯氨酸含量、可溶性蛋白含量、POD活性、SOD活性均不同程度高于二倍体。上述生理指标均表明,多倍体抗寒性比二倍体增强,通过多倍体途径培育抗寒性品种具有可行性。
关键词 彩色马蹄莲 ;低温胁迫 ;抗寒性 ;生理生化指标 ;成活率
中图分类号 S682.2 文献标识码 A Doi:10.12008/j.issn.1009-2196.2016.07.012
彩色马蹄莲(Zantedeschia hybrida)属天南星科(Araceae)马蹄莲属(Zantedeschia)多年生草本球根花卉[1],原产于非洲南部及埃及的河流、沼泽地。因其佛焰苞喇叭形(部分品种先端长尖)、形似马蹄状而得名,佛焰苞色彩丰富艳丽有红色、黄色,粉红色、橙色等。叶为基生型,叶柄较长,叶片多为箭形或戟形鲜绿色,部分品种叶片上有银星斑点分布。由于彩色马蹄莲色彩丰富、形态高雅、用途广泛,被誉为“21世纪花卉之星”。近几年彩色马蹄莲在国内外都越来越受欢迎,其中以鲜切花和盆花发展较好。
与二倍体相比,多倍体由于基因剂量效应会带来植株器官巨大性的变化,同时多倍体基因剂量的倍增,使植株内的基因活性及酶的差异性得以增强,从而加强了植株的生态适应力和逆境抗性,使其在生活力、对环境的适应性、抗旱、抗寒及抗病虫害等方面都表现出明显优势[2-3]。
彩色马蹄莲对环境条件要求比较严格,高温高湿容易诱发软腐病,温度过低会使植株受冻。最适合彩色马蹄莲生长的温度范围为18~23℃,冬季温度过低或夏季温度过高,植株叶会枯萎,进入休眠状态[4]。彩色马蹄莲喜温暖湿润环境,低温仍然是影响彩色马蹄莲产量和品质的主要因子之一。因此,研究提高彩色马蹄莲抗寒性,减少低温造成的损失,在生产上有着重要的现实意义[5]。
国外已有体细胞染色体加倍培育彩色马蹄莲多倍体品种的报道,国内也有关于使用秋水仙素[6]及除草剂Oryzalin[7]对彩色马蹄莲多倍体诱导的报道。但对马蹄莲多倍体的生物学特征、生理生化特性等的研究报道甚少。因此,研究彩色马蹄莲多倍体抗逆性具有重要意义,其中多倍体抗寒性特征可为抗寒性品种的筛选及培育提供理论依据。
1 材料与方法
1.1 材料
彩色马蹄莲Ym039、Gold affair的无性四倍体及二倍体组培苗,云南农业大学园林园艺学院提供。
1.2 方法
1.2.1 多倍体幼苗离体培养
多倍体幼苗离体培育包括无菌体系建立、增殖、壮苗、生根等阶段。增殖培养基为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L+蔗糖30g/L,壮苗培养基MS+6-BA1.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L,生根培养基:MS+NAA 0.1 mg/L+蔗糖30 g/L。以上过程均在温度(23±2)℃,光照1 000~2 000 lx的培养室内培养。
1.2.2 炼苗移栽
选取生长健壮、根系发达且大小一致的Ym039和Gold affair的二倍体及四倍体试管苗各75瓶(每瓶5株),从培养室搬到准备室放置1 d后,揭开瓶膜使其适应与培养室不同的环境。移栽前准备工作:(1)小心将苗从瓶子取出,去除根部培养基;(2)用洗涤剂小心清洗残留的培养基,清水清洗3遍;(3)用500~1 000倍液的多菌灵或百菌清浸根30 min;(4)清水清洗2~3遍;(5)配制基质及种植。按上述方法分2批种植4种彩色马蹄莲试管苗,分别于揭膜后第1天和第3天种植,观察其成活率。
1.2.3 低温处理
(2±0.5)℃低温处理:2013年冬天昆明遭遇雨雪低温天气约一周,种植于简易大棚中(温度为2~10℃),彩色马蹄莲受到严重影响。采收后发现二倍体的死亡率明显高于四倍体。为了验证多倍体的抗寒性是否优于二倍体,以不同倍性的Ym039及Gold affair的植株为材料,每个品种挑选40株,转入温度为(2±0.5)℃的光照培养箱中培养,光照时间14 h,10 d后统计死亡率。
6℃低温处理:将不同倍性彩色马蹄莲植株连花盘一同移入光照培养箱中,在平均温度(6±0.5)℃,光照时间14 h条件下进行低温胁迫处理。7 d后,分别取对照与低温处理的植株叶片,测定其生理生化指标并作对比分析。
1.2.4 生理指标及测定
脯氨酸(Pro)用茚三酮显色法测定[8];过氧化物酶(POD)用愈創木酚法测定;超氧化物歧化酶(SOD)用NBT显色法测定;丙二醛(MDA)用硫代巴比妥酸法测定;可溶性蛋白用考马斯亮蓝G-250染色法测定[9]。
1.2.5 数据分析
用DPS6.55crack分析数据。文中显著性分析均是在同一品种不同倍性间进行,不同品种间无相关性。
2 结果与分析
2.1 不同移栽时间对彩色马蹄莲移栽成活率的影响
不同移栽时间对彩色马蹄莲成活率的影响见表1。由表1可以看出,试管苗炼苗移栽分揭膜后1 d和3 d两批进行,其炼苗成活率差异巨大。揭膜1 d后移栽成活率均高于90%,揭膜3 d后移栽的成活率在66%~76%,同一时间移栽的多倍体与二倍体植株间成活率无显著差异,同一品种不同时间移栽成活率有极显著差异。
2.2 低温处理对成活率的影响
低温对彩色马蹄莲的影响见表2。由表2可以看出,(2±0.5)℃低温处理后,部分植株死亡,多倍体的死亡率在30%左右,二倍体死亡率超过50%。低温胁迫处理后四倍体死亡率明显低于二倍体,与二倍体相比,多倍体的抗寒能力有所增强。(6±0.5)℃低温处理7 d后,并未发现完全死亡的植株,Gold affair四倍体体和二倍体均正常生长,未出现严重冻害的症状。Ym039(2X)部分叶片出现叶片水渍状及失水变软等受害症状,取出放置于室温,几天后部分受害叶片恢复正常生长,Ym039(4X)无明显受害症状。
2.3 游离脯氨酸含量
在植物体内,脯氨酸作为渗透物质,起着渗透调节的作用[10]。植物在正常条件下,游离脯氨酸含量很低,但遇到干旱、低温、盐碱等逆境时,游离脯氨酸含量便会大量积累,并且积累量与植物抗逆性有关[8]。由表3可以看出,低温胁迫处理后植株体内脯氨酸含量有所增加。运用DPS进行显著性分析可得,各品种经过低温胁迫处理的植株脯氨酸含量都显著高于对照。经过低温胁迫处理的Ym039(2X)其游离脯氨酸含量显著高于Ym039(4X),常温下对照组无显著性差异;低温胁迫处理的Gold affair(2X)其游离脯氨酸含量极显著高于Gold affair(4X),常温对照组二倍体显著高于四倍体。脯氨酸含量与植物品种抗寒性呈负相关。
2.4 超氧化物歧化酶(SOD)活性
超氧化物歧化酶(SOD)是需氧生物体内普遍存在的一种含金属的保护性酶。SOD活性和超氧阴离子自由基产生速率都可以表示植物抗寒过程中的生理状况[11],所以测定SOD活性的变化可以作为植物抗逆性分析的参考指标。由表4可以看出,经过低温胁迫处理的植株SOD活性都不同程度高于常温对照。使用DPS进行显著性分析后,Ym039四倍体SOD活性在低温胁迫后显著高于二倍体,常温下对照组无显著性差异。Gold affair在低温处理后,多倍体极显著高于二倍体,常温对照组四倍体与二倍体之间都没有显著性差异。根据SOD活性分析,抗寒性强弱顺序为:Ym039(4X)>Ym039(2X),Gold affair(4X)>Gold affair(2X)。
2.5 过氧化物酶(POD)活性
POD是膜保护系统的组成部分,它是植物内的自由基的有效清除剂[14]。从表5可以看出,低温胁迫处理后,所有植株的POD活性都有不同程度上升。Ym039四倍体POD活性增加幅度大于二倍体,Ym039(2X)比Ym039(4X)对低温更敏感;Gold affair四倍体POD活性增加幅度大于二倍体,Gold affair (2X)比Gold affair (4X)对低温更敏感。运用DPS软件分析得到经过低温胁迫处理的Ym039(4X)的POD活性极显著高于Ym039(2X),对照组无显著性差异。经过低温胁迫处理的Gold affair(4X) SOD活性极显著高于Gold affair(2X),对照组多倍体显著高于二倍体。根据POD活性比较,抗寒性强弱顺序为:Gold affair(4X)>Gold affair(2X),Ymo39(4X)>Ym039(2X)。
2.6 丙二醛(MDA)含量
当植株受到低温、高温、干旱等逆境后,细胞膜透性会发生变化,细胞内相应的酶系统和代谢过程遭到破坏,引发和加剧了膜脂过氧化作用,膜脂过氧化产物 MDA 增多,并且扩散到其他部位,影响了组织内生理活动的正常进行[12-13]。MDA含量增加越多说明膜脂过氧化程度越严重。由表6可以看出,低温胁迫后,二倍体MDA上升均明显。通过DPS显著性分析可知,Gold affair低温胁迫处理二倍体MDA含量显著高于多倍体,常温对照组无显著性差异。Ym039低温胁迫处理二倍体MDA含量显著高于多倍体,常温对照组无显著性差异。
2.7 可溶性蛋白质含量
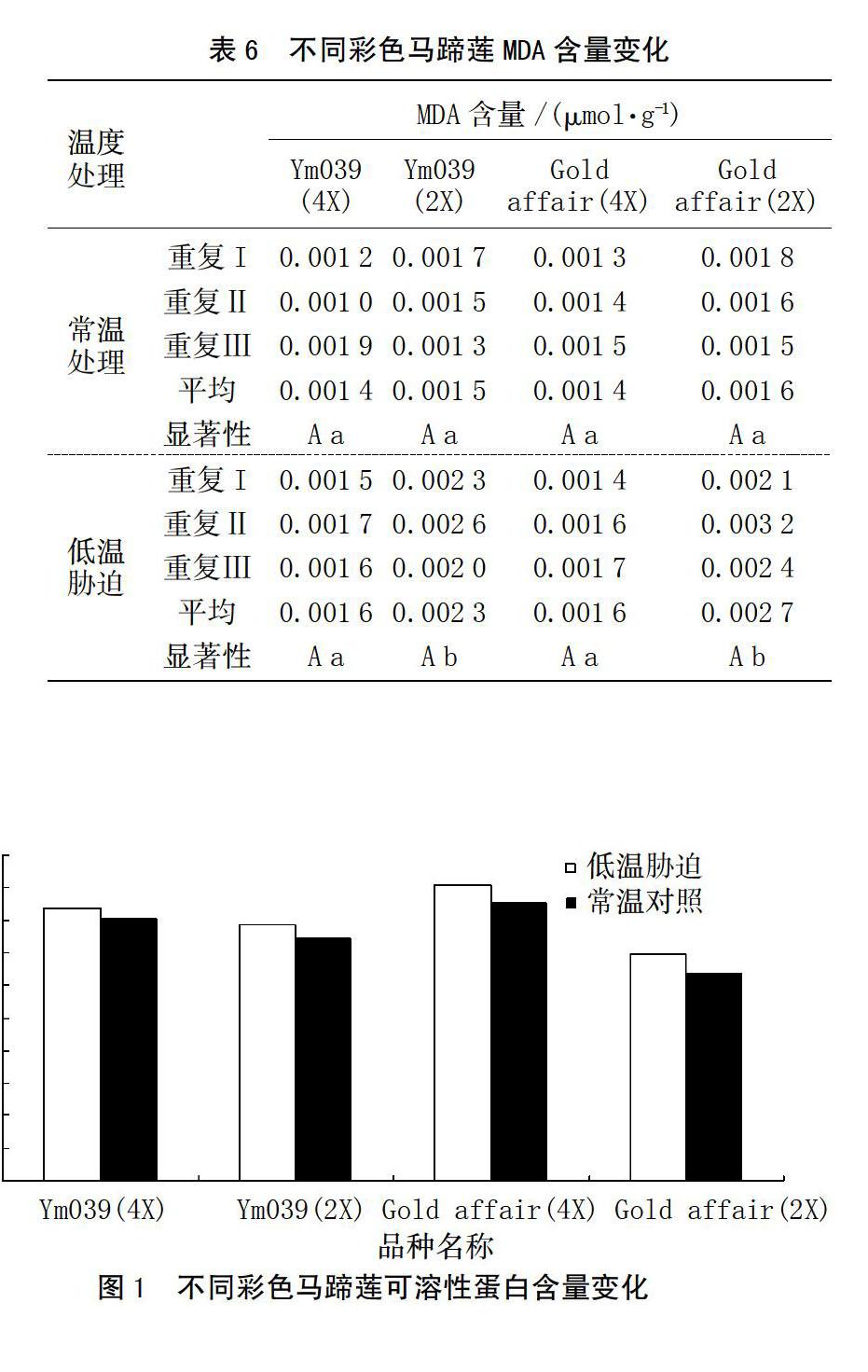
在植物体内,可溶性蛋白可以作为渗透调节物质、能量物质和信息传递物质,在植物抵御逆境过程中起到较大的作用[15]。植物生长过程中遇到低温胁迫时,植物会通过改变体内可溶性蛋白含量来增加保水能力以防止组织结冰而造成伤害。从图1可以看出,低温胁迫后Ym039(4X)的可溶性蛋白含量比Ym039(2X)增加了6.4%,Gold affair(4X)可溶性蛋白含量比Gold affair(2X)增加了23%。2个品种的四倍体可溶性蛋白含量均大于二倍体。
3 结论与讨论
3.1 影响彩色马蹄莲无菌苗移栽成活的关键因子
张馨月等报道,揭膜3 d后进行移栽,那时彩色马蹄莲的叶片由嫩绿色转变为深绿色,成活率达到95%以上[16]。本试验结果表明:揭膜1 d后移栽的成活率高于90%,揭膜3 d后移栽的成活率只有66%~76%。试管苗炼苗移栽的成活率受许多因素的影响,如苗本身质量、光照、温度、基质、移栽时间等。试管苗揭膜后无菌的环境被破坏,培养基上可能滋生不同种类的菌类使幼苗被感染,实际感染情况因幼苗本身的健壮程度及环境因子的不同而不同,高温尤其促进病菌的滋长。因此,用于炼苗的试管苗要生长健壮,根系发达,并在揭膜1 d后尽快移栽,尤其是高温季节,以此来提高移栽成活率。
3.2 彩色马蹄莲多倍体抗低温生理反应特征
20世纪90年代起,很多学者以辣椒[17]、黄瓜[18],茄子[19]为实验材料,对POD酶、SOD酶等保护酶活性变化与抗寒性的关系进行研究,抗寒性强的品种相应的酶活性也高。本研究结果表明,低温胁迫处理后彩色马蹄莲体内SOD及POD活性都增強,其中多倍体的增加显著高于二倍体。说明在受到低温胁迫的时候,彩色马蹄莲多倍体通过增加细胞氧化相关酶SOD、POD的活性抵御低温伤害的能力提高。
国内学者对杏[20-21]、紫椴[22]、珊瑚树[23]等的研究结果表明,可溶性蛋白质含量高的品种抗寒性亦强,在抗寒锻炼过程中可溶性蛋白含量有增加的趋势,其中抗寒性差的品种增加幅度较小,反之则大[24]。本研究结果表明,彩色马蹄莲多倍体可溶性蛋白含量高于二倍体,且在低温胁迫时可溶性蛋白含量增加幅度比二倍体大。可溶性蛋白的含量高可提高细胞的保水能力,降低冰点从而提高植物的抗寒能力。因此,彩色马蹄莲四倍体对低温胁迫的抵抗能力比二倍体强。低温胁迫处理时,4种彩色马蹄莲体内的MDA含量都有所增加,但多倍体增加幅度小于二倍体。膜脂过氧化产物MDA含量增加越多,说明膜脂过氧化程度越严重[13],彩色马蹄莲多倍体MDA含量增加低于二倍体,彩色马蹄莲多倍体抗寒性强于二倍体。
3.3 彩色马蹄莲多倍体抗低温脯氨酸调节
近年来,不少学者在抗寒育种中运用脯氨酸含量变化作为判断其抗寒性强弱的指标之一,但是观点尚未统一。包括以下几种观点:①在低温胁迫下脯氨酸的积累能力与品种抗寒性成正相关性[25-26]。②在低温胁迫下脯氨酸的积累能力与品种的抗冻寒力成负相关[27-28]。③低温胁迫下脯氨酸的积累不稳定[29]。试验结果表明,彩色马蹄莲多倍体在低温胁迫时游离脯氨酸增加显著低于二倍体,属于第二种类型,脯氨酸的积累能力与品种的抗冻寒力成负相关。持这一观点的研究者认为,抗寒性弱的品种在受到低温胁迫后,为适应寒冷、保护体内组织免受冻害过早地积累了大量的游离脯氨酸,而游离脯氨酸积累高峰出现晚的品种,抗寒性强;或者认为,游离脯氨酸积累是植物的被动反应,作为植物低温下的伤害程度指标。
生理指标测定与分析结果表明:低温胁迫下不同品种多倍体的可溶性蛋白含量、POD活性、SOD活性均高于二倍体,MDA含量、游离脯氨酸含量低于二倍体,彩色马蹄莲多倍体抗寒性比二倍体增强。研究结果仅限于2个品种的数据,对于其他彩色马蹄莲品种多倍体的抗寒性是否都优于二倍体,还有待进一步试验探索。除抗寒性外,需要对马蹄莲多倍体抗旱性、抗病性、耐盐胁迫性等逆境的能力进行试验,以便更好地为马蹄莲多倍体优良品种的培育提供支持。
参考文献
[1] 余树勋,吴应祥. 花卉寶典[M]. 北京:农业出版社,1993:312
[2] 杨 辉,缑 辉,周 涤,等.彩色马蹄莲不同品种多倍体诱导研究初探[J]. 云南农业大学学报,2014,29(2):229-234.
[3] Bre T F,Thompson J D. Gametes with the somatic chromosome number: mechanisms of their formation and role in the evolution of autopoly ploid plants[J]. New Phytologist, 1995, (129): 1-22.
[4] 赵志昆,赵晓光,宋仪农. 盆栽马蹄莲栽培管理技术[J]. 江西园艺,2003,(2):33-34
[5] 阙生全,胡 丹,张 燕. 低温胁迫对彩色马蹄莲生理生化特性的影响[J]. 安徽农业科学,2009,37(2):486-487.
[6] 刘晓静,华小平,陆 波,等.彩色马蹄莲品种‘Parfait多倍体诱导及其生物学特征变化[J]. 植物资源与环境学报,2014,23(3):81-85,101
[7] 张锡庆,吴红芝,周 涤,等. 新型除草剂 Oryzalin的浓度和处理时间对诱导彩色马蹄莲多倍体的影响[J]. 云南农业大学学报,2008,23(6):806-810
[8] 苍 晶,赵会杰. 植物生理学实验教程[M]. 北京:高等教育出版社,2013.
[9] 史树德,孙亚卿,魏 磊,等. 植物生理学实验指导[M]. 北京:中国林业出版社,2011.
[10] 李 志,王 刚,吴忠义,等.脯氨酸与植物抗渗透胁迫基因工程改良研究进展[J]. 河北师范大学学报(自然科学版),2005,29(4):405-408
[11] 高俊凤. 植物生理实验技术[M]. 西安:世界图书出版公司,2000.
[12] Wang C Y, Adams D O. Chilling-induced ethylene production in cucumbers (Cucumis sativus L.)[J].Plant Physiol, 1982, 69(2): 424-427.
[13] 石雪晖,刘昆玉,杨国顺,等. 低温胁迫对柑桔离体叶片膜脂透性和MDA及Vc量的影响[J]. 湖南农业大学学报,1997,23(1):36-40.
[14] 陈少裕. 膜脂过氧化对植物细胞的伤害[J]. 植物生理学通讯,1991,27(2):84-90.
[15] 张继澍. 植物生理学[M]. 西安:世界图书出版公司,1999:370-376.
[16] 张馨月,冉婷婷,刘小菊. 彩色马蹄莲组培快繁工厂化育苗途径研究[J]. 吉林蔬菜,2010(2):98-100.
[17] 邹志荣,陆帼一. 低温对辣椒幼苗膜脂过氧化和保护酶系统变化的影响[J]. 西北农业大学学报,1994,3(3):51-56.
[18] 马德华,孙其信. 温度逆境对不同品种黄瓜幼苗膜保护酶系统的影响[J]. 西北植物学报,2001,21(4):656-661.
[19] 李建设,耿广东,程智慧.低温胁迫对茄子幼苗抗寒性生理生化指标的影响[J]. 西北农林科技大学学报(自然科学版),2003,31(3):90-92,96.
[20] 张成军,李 捷,范惠萍,等.不同杏品种幼果抗寒性研究[J].西北林学院学报,2008,23(3):29-32.
[21] 黄永红,沈洪波,陈学森.杏树抗寒生理研究初报[J]. 山东农业大学学报:自然科学版,2005,36(2):191-195.
[22] 唐凤德,蔡天革. 化控物质对紫椴苗木抗寒生理特性的影响[J]. 辽宁大学学报:自然科学版,2004,31(4):355-357.
[23] 杨志刚. 春季珊瑚树芽抗寒物质及抗氧化酶系的变化[J]. 常熟高专学报,2002,16(2):47-49.
[24] 姚立新,朱 锐,马雯彦,等. 植物抗旱、抗寒性鉴定与生理生化机理研究进展[J]. 安徽农业科学,2009,37(25):11 864-11 866.
[25] 王小华,庄南生.脯氨酸与植物抗寒性的研究进展[J]. 中国农学通报,2008,24(11):398-402.
[26] 陈杰中,徐春香,梁立峰. 低温对香蕉叶片中蛋自质及脯氨酸的影响[J]. 华南农业大学学报,1999,20(3):54-58.
[27] 刘国华,陈立云,李国泰. 杂交晚稻新组合及其恢复系耐冷性生理生化指标分析[J]. 杂交水稻,1993(4):32-35.401.
[28] 魏 娜,欧小平,董 丽. 10 种宿根花卉抗寒性研究初报[J]. 中国农学通报,2008,7(24):314-317.
[29] 李 莉,任金平,曲柏宏,等. 水分胁迫对苹果梨叶片可溶性糖、脯氨酸含量的影响[J]. 吉林农业科学,2007,32(1):51-54.
