新型农药助剂在大蒜及土壤中的残留
2016-10-21潘波杜章留张庆忠李正刘迎姜蕾林勇
潘波 杜章留 张庆忠 李正 刘迎 姜蕾 林勇
摘 要 为研究新型助剂醇醚磷酸酯型助剂在环境中的残留降解性,通过对大蒜施用新型农药助剂和传统助剂配制农药进行应用试验,采用硫氰酸钴法和液相色谱法分别检测了采收后大蒜及其种植土壤中的乙氧基型表面活性剂和降解产物壬基酚的残留量。结果显示:施用3种新型农药助剂配制农药后的大蒜样品中乙氧基型表面活性剂的残留量分别为220.223、217.086、185.721 mg/kg,土壤样品的残留量分别为61.798、46.816、48.689 mg/kg,均低于施用传统助剂配制农药后的大蒜和土壤样品;使用传统助剂的土壤和大蒜样品中壬基酚的检出率高于新型绿色助剂。研究表明,新型农药助剂的降解性能及其对环境的安全性均优于传统助剂。
关键词 新型农药助剂 ;传统助剂 ;壬基酚 ;残留量 ;大蒜 ;土壤
中图分类号 S19 文献标识码 A Doi:10.12008/j.issn.1009-2196.2016.07.018
几乎所有农药原药都不能直接使用,必须经过添加各种助剂才能加工成能够使用的农药制剂,农药助剂能够提高农药药效、改善药剂性能、稳定其质量等作用。目前,中国农药助剂使用的品种非常多,约4 000多种[1],使用量非常巨大,约每年40~50万t。一般农药产品中1%~90%的成分为各种农药助剂和溶剂[2],研究发现,部分农药助剂在进入环境后,在微生物的作用下发生降解,其降解产物具有比母体化合物更强的毒性,甚至能扰乱内分泌系统[3-4]。张灿光等[5]通过蚯蚓的急性毒性试验发现,壬基酚聚氧乙烯醚系列表面活性剂中TX-5和TX-10毒性较高;刘红玉等[6]发现,一些低浓度的表面活性剂进入水环境后,能够对大藻(Pistia stratiotes L.)、稀脉浮萍(Lemna paucicostata L.)、水绵(Spirogyra)等水生植物的细胞结构造成损伤,但是对其生理活动影响较小;龚宁[7]研究发现,当表面活性剂直链烷基苯磺酸钠(SDBS)、十六烷基三甲基溴化铵(CTMAB)和吐温80(TW-80)浓度大于0.5 mg/L时,能显著抑制小白菜、韭菜、胡萝卜等蔬菜种子的萌发。大量研究表明,壬基酚类表面活性剂能对一些水生生物产生较大影响,并且最终降解产物毒性增加,并具有雌性激素效应[8-11]。所以农药助剂如果不具备良好的降解性能,其伴随农药一起进入环境以后大部分将残留于土壤、水体及大气环境中,污染水体和土壤,对环境生物及人类健康造成影响,所以研发对环境友好的易降解绿色助剂已成为农药助剂开发的热点。
脂肪醇聚氧乙烯聚氧丙烯醚磷酸酯助剂是近些年开发的一种新型环境友好型助剂,广泛应用于日用化工、纺织工业等行业,该助剂对非靶标动物毒性低,亲水性强,在自然中易于降解,对人体刺激性低,是一类绿色环保产品。传统助剂壬基酚聚氧乙烯醚应用也相当广泛,但是其降解产物NP1EO、NP2EO、NP等短链降解产物具有亲脂性、难降解性和生物积累性,并且在生物体内能产生雌激素效应。李正等[12-13]通过蚯蚓和食蚊鱼的急性毒性试验发现,这种新型助剂对环境生物的毒性较传统助剂壬基酚聚氧乙烯醚低。而通过田间试验比较传统助剂壬基酚聚氧乙烯醚与这种新型助剂助剂在土壤和大蒜中的残留降解性能尚未见报道。由于醇醚磷酸酯和烷基酚聚氧乙烯醚都含有乙氧基,所以采用GB/T 15818-2006中的方法检测这2种助剂的残留[14]。本研究以新型助剂和传统助剂配制的3种农药制剂为研究对象,检测了施药后大蒜和土壤中的乙氧基型表面活性剂和壬基酚的残留,为新型助剂的发展提供基础数据。
1 材料与方法
1.1 仪器与试剂
恒温振荡器;水果搅拌机;旋转蒸发仪;Alltech固相萃取装置;Waters氨基固相萃取小柱;岛津紫外分光光度计;KL512型氮吹仪;Waters 600E型液相色谱,2475荧光检测器,Empower色谱工作站。乙腈、氯化钠、甲醇、二氯甲烷、硫酸钴(六水合物)、硫氰酸铵、苯、三氯甲烷,均为分析纯;40%新型助剂(中国农业科学院环境与可持续发展研究所提供);40%毒死蜱乳油,5%啶虫脒可湿性粉剂,40%辛硫磷乳油(河北盛世基农生物科技有限公司);甲醇(色谱纯);壬基酚(标准品)。
1.2 方法
1.2.1 试验设计
试验在山东省莱芜市莱城区寨里镇魏王许村开展,选用分别由传统壬基酚聚氧乙烯醚和新型助剂配制的毒死蜱、啶虫脒、辛硫磷,新型助剂配制的农药制剂与传统助剂配制的农药制剂有效成分含量相同。设空白对照共7个处理,每个处理3次重复,共设21个小区,每小区面积为25 m2。分别于病虫害用药高峰期进行2次施药,2次施药间隔2周,每个小区每次施用传统啶虫脒制剂5 g,新型助剂啶虫脒依据原药用量相等的原则,吸取对应量的悬浊液进行稀释喷施。传统辛硫磷、传统毒死蜱及其相對应的新型助剂农药每次每小区用量筒抽取20 mL,然后稀释后喷施。施药后2周采集样品,土壤样品采用土钻采集0~10 cm土层土样,每个重复采集5个点,然后混成一个土样;每个小区随机采集5颗大蒜样品,每颗取出一部分,混合组成约200 g大蒜样品。
1.2.2 土样与大蒜样品的保存与预处理
大蒜样品放入-20℃冰箱冷冻保存,使用时取出解冻,切碎放入水果搅拌机中,以18 000 r/min高速匀浆1 min,待测。
1.2.3 大蒜和土壤中乙氧基型表面活性剂的测定[15]
土壤样品的前处理:取土壤样品2.000 g,分别使用40、20、20 mL甲醇恒温振荡提取1 h,合并3次滤液于圆底烧瓶中,旋蒸浓缩近干,待测。
大蒜样品的前处理:取匀浆过的大蒜样品20.000 g,加入6~7 g氯化钠,50 mL乙腈恒温振荡提取1 h后静置,取上清液(乙腈相)20 mL,旋蒸浓缩。甲醇-二氯甲烷(体积比1∶99)2.0 mL溶解残渣,待净化。
大蒜样品的净化:将氨基小柱用4.0 mL甲醇-二氯甲烷(体积比1∶99)洗脱液预洗条件化,当溶剂液面到达柱吸附层时,立即加入上述带净化溶液,收集洗脱液,用2.0 mL洗脱液过柱,并重复1次。氮吹蒸发至近干,待测。
样品的检测:分别用5、3、2 mL甲醇将前处理后的样品洗至250 mL分液漏斗中,依次加入90 mL蒸馏水、15 mL硫氰酸钴铵溶液,35.5 g氯化钠,振荡1 min,静置后加入三氯甲烷15 mL萃取3次,取三氯甲烷层定容50 mL,混匀。用紫外分光光度计于波长319、10 mm比色池,以空白参比液做参比,测定试液的吸光度。
标准曲线的绘制:准确移取0.1 g/L乙氧基型表面活性剂溶液0(空白参比液)、10、20、40 mL,按照上述乙氧基型表面活性剂的测定方法测定,以表面活性剂质量(mg)为横坐标,净吸光值为纵坐标,绘制标准曲线y=0.105 8 x-0.012 4,相关系数R2=0.995 5。
1.2.4 大蒜和土壤中壬基酚的测定[16-17]
土壤样品的前处理:称取土壤样品5.00 g。移取30.0 mL甲醇-二氯甲烷(体积比1∶4),超声提取50 min后离心,取上清液旋蒸,用2.0 mL乙腈分2次将其洗出待净化。
大蒜样品的前处理:称取5.00 g样品,依次加入3~5 g氯化钠,50.0 mL乙腈恒温振荡提取1 h,取20 mL上清液旋蒸,用2.0 mL乙腈分2次将其洗出待净化。
样品的净化:取氨基净化小柱,5.0 mL的甲醇-二氯甲烷(体积比1∶4)洗脱液活化小柱,当溶剂液面到达吸附层表面时,立即加入待净化溶液,收集洗脱液,再用10 mL洗脱液分2次洗柱,收集洗脱液,氮吹蒸发近干,并用色谱纯甲醇定容至2.0 mL。过0.45 μm滤膜,待测。
液相色谱条件,色谱柱:Waters C18 3.9 mm×150 mm Column;流动相:甲醇-水(体积比85∶15);流速:1.0 mL/min;柱温:25 ℃;进样量:20 μL;荧光检测条件:荧光激发波长Ex=275 nm,发射波长Em=308 nm。
标准曲线的绘制:将储备液用甲醇稀释成质量浓度0.1、0.2、0.4、0.8、1.6 mg/L的标准溶液,分别进行测定,以峰面积y对标准品浓度x绘制标准曲线,其线性方程为y=1.825×105x-4 009,相关系数R2=0.999 6。相关色谱峰见图1~3。
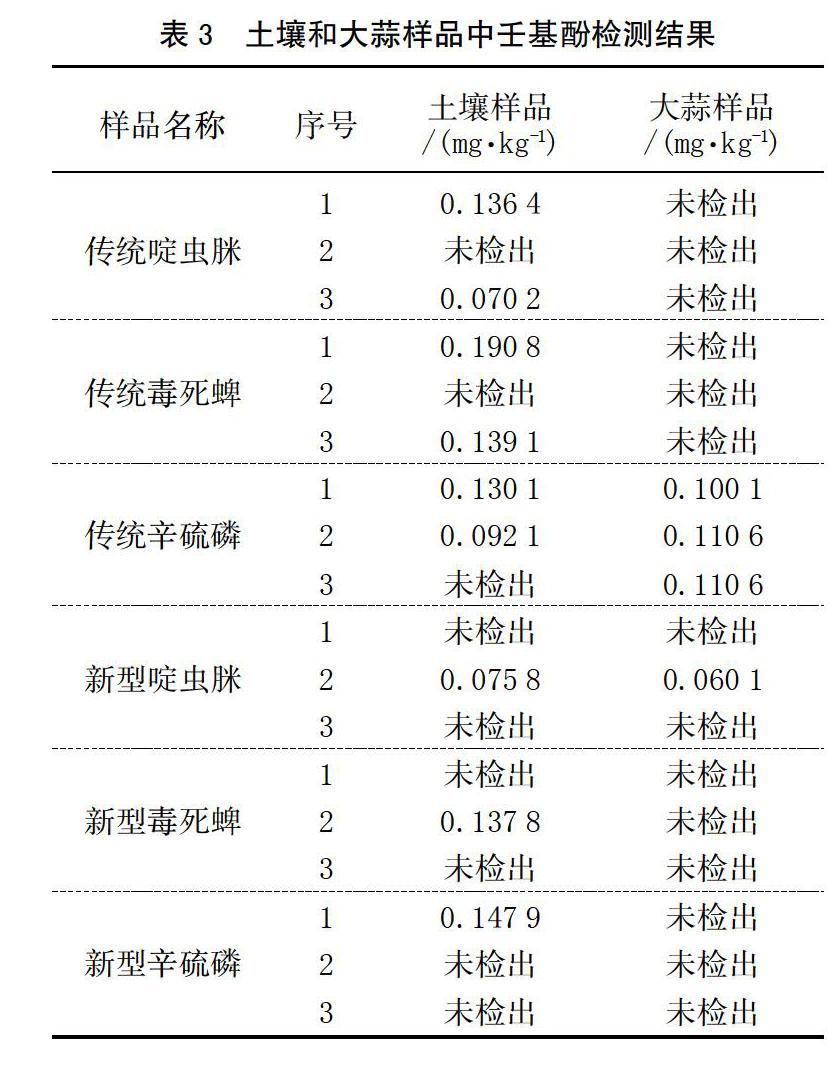
方法的回收率:取空白无污染的土壤做添加回收试验。称取5.00 g样品按照上述试验方法分别进行3个质量浓度的添加回收试验。每个质量浓度重复3次。结果见表1,可知土壤和大蒜样品壬基酚回收率在80%左右,符合农残检测要求。
2 结果与分析
2.1 大蒜和土壤中乙氧基型表面活性剂的测定
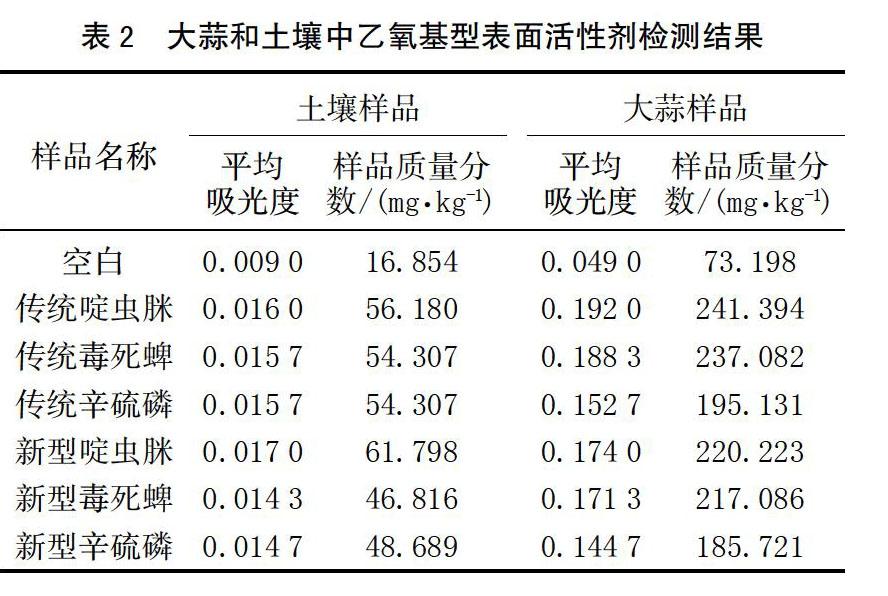
由于醇醚磷酸酯和烷基酚聚氧乙烯醚都含有乙氧基,所以采用GB/T 1581-2006中的方法检测这2种助剂的残留,大蒜样品中检测结果见表2。2组样品均能检出乙氧基型表面活性剂的残留。新型助剂配制的啶虫脒、毒死蜱和辛硫磷在大蒜中残留的乙氧基型表面活性剂量在185.721~220.223 mg/kg,在土壤中的残留量在46.816~61.789 mg/kg;传统助剂壬基酚聚氧乙烯醚配制的啶虫脒、毒死蜱和辛硫磷在大蒜中残留的乙氧基型表面活性剂量在195.131~241.394 mg/kg,在土壤中的残留量在54.307~56.180 mg/kg,可见新型助剂配制的啶虫脒、毒死蜱和辛硫磷在大蒜和土壤中的残留量小于由传统助剂。但空白土壤样品中乙氧基型表面活性剂检测浓度为16.854 mg/kg,空白大蒜样品中乙氧基型表面活性剂检测浓度为73.198 mg/kg,特别是大蒜样品,可以利用这种方法定性比较土壤和大蒜中乙氧基型表面活性剂含量。
2.2 大蒜和土壤中壬基酚的测定
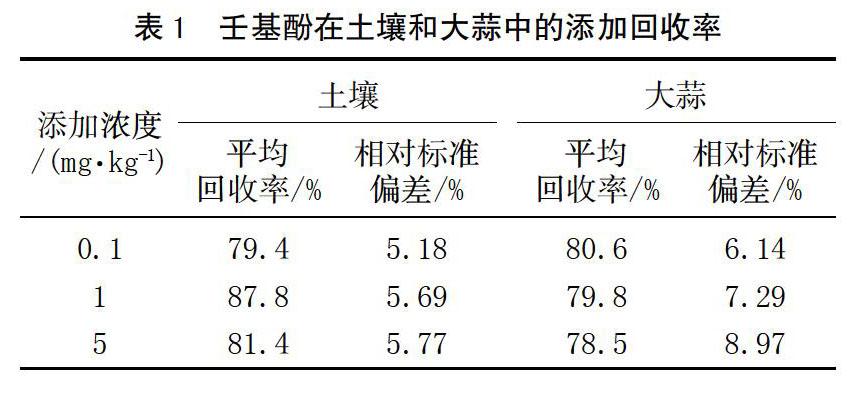
土壤及大蒜中壬基酚的残留量检测结果见表3。
由表3可以看出,由新型助剂配制的啶虫脒、毒死蜱和辛硫磷在土壤中壬基酚的检出率为33.33%,在0.075 8~0.147 9 mg/kg;而使用传统助剂土壤中壬基酚的检出率为66.7%,在0.070 2~0.190 8 mg/kg,檢出率明显高于新型助剂。使用新型助剂配制农药的大蒜样品中啶虫脒中一个样品检出壬基酚含量为0.060 1 mg/kg,其他均为检出壬基酚;使用传统助剂配制的农药大蒜样品中,辛硫磷全都检出壬基酚,在0.100 1~0.110 6 mg/kg,其它样品均未检出壬基酚,检出率明显高于新型助剂。表明传统助剂比新型助剂更易降解出壬基酚。
3 结论与讨论
随着环境保护得到越来越广泛的关注,世界各国对农药及农药助剂实施了日益严格的管理和限制。为了解我国几种常用农药助剂的残留降解性能,加强我国农药助剂的环境管理,加快传统农药制剂向绿色环保农药制剂的研发方向转变,课题组通过田间试验比较农药制剂中传统助剂与新型助剂在土壤和大蒜中的降解性能。由检测结果可知,传统烷基酚聚氧乙烯醚助剂在土壤和大蒜中的残留量显著大于新型助剂的残留量。这可能与其本身理化性质有关,醇醚磷酸酯型助剂是由醇醚型化合物与磷酰化剂酯化而成,而醇醚化合物含有易被生物降解的羟基基团,使得这种新型助剂也拥有良好的降解性,并最终被微生物降解为磷酸根离子和二氧化碳[15]。而传统的烷基酚聚氧乙烯醚型助剂由不同聚合度的环氧乙烷与烷基酚发生聚合反应而成,其结构上的含有比较稳定的苯环和烷基基团,致使进入环境中的烷基酚聚氧乙烯醚很难降解成对环境无害的小分子化合物[18]。
由于烷基酚聚氧乙烯醚广泛应用于日常生活和化学农药杀虫剂的配方中,大部分通过各种途径进入环境,进入环境中的烷基酚聚氧乙烯醚经过光解、水解、微生物降解等作用,转化为短链的壬基酚聚氧乙烯醚、壬基酚等主要代谢产物[19],研究发现,这些物质能在环境中广泛分布,并且化学性质稳定,难降解,具有疏水性、脂溶性[20]和生物积累性等特点,因而具有比母体更强的毒性,进入生物体后能产生很强的内分泌干扰活性和生殖毒性[21-23]。美国和欧盟已经对烷基酚聚氧乙烯醚类表面活性剂采取了比较严格的管理措施。使用HPLC法测定土壤和大蒜中壬基酚的结果显示,传统助剂土壤样品中壬基酚的检出率达66.7%,新型助剂中均壬基酚检出率为33.3%,大蒜样品中传统助剂的壬基酚的检出率高于新型农药助剂,可见这种新型农药助剂是一种环境友好型助剂,其降解性能及对环境的影响均优于传统助剂。
综上所述,由于传统的烷基酚聚氧乙烯醚型助剂难生物降解,并且具有环境毒害作用,已經成为我国农业产地环境与大部分农产品的重要污染源。开发新型绿色助剂替代传统的有害助剂,是我国环境安全与农业环保事业发展的必然要求。新型醇醚磷酸型助剂脂肪醇聚氧乙烯聚氧丙烯醚磷酸酯具有很多独特的性能和用途,并且生物降解性好,对人体刺激低,毒性低,对鱼类也很安全,再加上其合成原料简单,合成技术不复杂,是一类比较有前途的新型绿色表面活性剂。
参考文献
[1] 卜元卿,王昝畅,智 勇,等. 农药制剂中助剂使用状况调研及风险分析[J]. 农药,2014,53(2):932-936.
[2] 张宗俭. 农药助剂的应用与研究进展[J]. 农药科学与管理,2009,30(1):42-47.
[3] Teneyck M C, Markee T P. Toxicity of nonylphenol, nonylphenol monoethoxylate, and nonylphenol diethoxylate and mixtures of these compounds to pimephales promelas (Fathead Minnow) and Ceriodaphnia dubia[J]. Arch Environ Contam Toxicol, 2007, 53: 599-606.
[4] Bechmann R K. Effect of the endocrine disrupter nonylphenol on the marine copepod tisbe battagliai[J]. Science of the Total Environment, 1999, 233(1/3): 33-46.
[5] 张灿光,杜军辉,李 华,等. 农药助剂对蚯蚓 (Eisenia foetida)的急性毒性[J]. 生态毒理学报,2014, 9(3):593-602.
[6] 刘红玉. 表面活性剂对水生植物的损伤及生物降解研究(博士论文)[D]. 长沙:湖南农业大学,2001.
[7] 龚 宁. 表面活性剂对蔬菜生长及食用安全的影响研究[D]. 杨凌:西北农林科技大学,2011.
[8] Naylor C G, Mieure J P, Adams W J, et al. Alkylphenol ethoxylates in the environment[J]. Journal of the American Oil Chemists Society, 1992, 69(7): 695-703.
[9] Park C J, Kang H S, Gye M C. Effects of nonylphenol on early embryonic development, pigmentation and 3,5,3'-triiodothyronine-induced metamorphosis in Bombina orientalis(Amphibia: Anura)[J]. Chemosphere, 2010, 81(10): 1 292-1 300.
[10] 李玉白,曾琦斐,刘劭钢. 壬基酚毒性作用的研究[J]. 医学理论与实践,2006,19(4):375-376.
[11] Correa-reyes G, Viana M T, Marouez-rocha F J, et al. Nonylphenol Algal Bioaccumulation and Its Effect Through the Trophic Chain[J]. Chemosphere, 2007, 68(4): 662-670.
[12] 李 正,潘 波,林 勇,等. 3种助剂对赤子爱胜蚓的急性毒性[J]. 生态与农村环境学报,2013,29(4):519-523.
[13] 李 正,潘 波,林 勇,等. 3种农药助剂对野生食蚊鱼的急性毒性[J]. 农药,2013,52(5):354-359.
[14] 赵郁梅,秦 勇. GB/T 15818-2006. 表面活性剂生物降解度试验方法[S]. 北京:中国标准出版社,2006.
[15] 曹素珍. 醇醚磷酸酯型助剂生物降解性的研究(硕士论文)[D]. 北京:中国农业科学院,2011.
[16] 葛 洪,韦林洪,顾 杰,等. 高效液相色谱荧光检测法检测香蕉中壬基酚残留[J]. 扬州大学学报:农业与生命科学版,2013(3):86-89.
[17] 王艳平,杨正礼,李 正,等. 壬基酚在土壤中的降解和吸附特性[J]. 农业环境科学学报,2011,30(8):1 561-1 566.
[18] Schmitz-Afonso I, Loyo-Rosales J E, de la Paz Aviles M, et al. Determination of alkylphenol and alkylphenolethoxylates in biota by liquid chromatography with detection by tandem mass spectrometry and fluorescence spectroscopy[J]. Journal of Chromatography A, 2003, 1010(1): 25-35.
[19] 吴 伟,瞿建宏,陈家长. 水体中微生物对壬基酚聚氧乙烯醚的生物降解[J]. 安全与环境学报,2003,3(3):17-20.
[20] Myllymaki S A, Karjalainen M, Haavisto T E, et al. Infantile 4-tert-octylphenol exposure transiently inhibits rat ovarian steroidogenesis and steroidogenic acute regulatory protein (StAR) expression [J]. Toxicology and Applied Pharmacology, 2005, 207(1): 59-68.
[21] Preuss T G, Gehrhardt J, Schirmer K, et al. Nonylphenol isomers differ in estrogenic activity [J]. Environ. Sci. Health., 2006, (40): 5 147-5 153.
[22] Khanal S K, Xie B, Thompson M L, et al. Fate, transport, and biodegradation of natural estrogens in the environment and engineered systems. Environ. Sci. Health., 2006, (40): 6 537-6 546.
[23] Borrell B. Toxicology: The big test for bisphenol A[J]. Nature, 2010, 464(7292): 1 122-1 124.
