低温贮藏条件下青鱼肉中蛋白和组织结构的变化对鱼肉品质的影响
2016-10-21杨宏旭刘大松李珺珂贺云周鹏
杨宏旭,刘大松,李珺珂,贺云,周鹏
(江南大学 食品学院,食品科学与技术国家重点实验室,江苏 无锡,214122)
低温贮藏条件下青鱼肉中蛋白和组织结构的变化对鱼肉品质的影响
杨宏旭,刘大松,李珺珂,贺云,周鹏*
(江南大学 食品学院,食品科学与技术国家重点实验室,江苏 无锡,214122)
采用低场核磁共振技术、差示扫描量热法和组织切片等方法,研究了贮藏温度(4、-0.5、-3和-20 ℃)对青鱼肉中水分和蛋白变化及其青鱼肉品质的影响。差示扫描量热法测定结果显示:在4和-0.5 ℃下主要是肌浆蛋白发生变化,而在-3和-20 ℃下主要是肌球蛋白结构发生改变。组织切片结果显示:在4和-0.5 ℃条件下鱼肉肌纤维结构相对完整,而在-3和-20 ℃条件下受冰晶影响,鱼肉肌纤维结构破坏严重。低场核磁共振结果同差示扫描量热法测定结果和组织切片结果一致,在4和-0.5 ℃条件下青鱼肉中水分分部状态稳定,不易流动水变化缓慢,而在-3和-20 ℃条件下水分分布状态变化明显,其中不易流动水变化最明显。与此对应,汁液流失率在4和-0.5 ℃条件下较低,而在-3和-20 ℃条件下较高。鱼肉剪切力在-0.5和-3 ℃下逐步下降,而在4和-20 ℃下,前3 天变化迅速,随后变化缓慢。不同贮藏温度下,青鱼肉中蛋白和组织结构的变化会影响鱼肉中水分的分布状态,进而导致鱼肉汁液流失率和质构的变化呈现出不同的趋势。
青鱼肉;差示扫描量热法;组织切片;低场核磁共振技术;汁液流失率;剪切力
温度是影响鱼肉在贮藏过程中品质变化的重要因素之一。常见的低温保鲜技术可分为冷藏和冻藏。冷藏的鱼肉保质期较短,而冻藏会导致鱼肉组织结构的破坏以及汁液流失增加等问题。随着鱼肉保鲜技术的发展,低温保鲜所采用的温度范围也逐渐扩大和细化,比如冰温和微冻保鲜技术[1-3]。不同的贮藏手段对于温度有其特定的要求,不同的贮藏温度又对鱼肉中水分的分布状态有很大的影响。水作为鱼肉中含量最多的成分,其状态的变化对于鱼肉的贮藏品质有很大的影响。之前的研究多从微生物作用、理化作用和内源酶作用等方面探究鱼肉品质的变化,鲜有报道鱼肉中水的变化对鱼肉品质的影响[4-7]。因此,本研究旨在探究不同的贮藏温度下,青鱼肉中水的变化及其对青鱼肉品质的影响。
淡水鱼中水的含量占其体重总质量的80%左右,水与蛋白的作用及其分布状态对于鱼肉的持水力、贮藏稳定性和质构都有很大的影响[8]。对于鱼肉的加工和贮藏而言,汁液流失和质构是质量评价的重要因素,同时也是工厂和商家面临的一个重大课题。同畜肉和禽肉相比,鱼肉更加细嫩、水分含量更高,在贮藏过程中更容易腐败变质。鱼肉是由肌原纤维、细胞内外基质以及膜结构所构成的空间网络结构,而水分就以不同的形式分布其中。不同的贮藏条件会导致鱼肉蛋白和组织结构的变化,进而加速汁液流失,导致鱼肉质构发生变化。
低场核磁共振技术(low-fieldnuclearmagneticresonance,LF-NMR)是一种非破坏性和非入侵性的无损检测分析技术,其在生命科学领域具有广泛的应用前景,在食用油、谷物、果蔬和肉类等相关研究领域已有文献报道[9-12]。低场核磁技术对于水分分布状态的检测是通过自旋-自旋弛豫时间(spin-spinrelaxationtime, T2)来表征的。通过设定一定的脉冲序列来对样品进行检测,得到自由感应衰减曲线,再通过软件迭代反演得到T2图谱。新鲜鱼肉的T2图谱显示鱼肉中的水分存在3种状态:结合水、不易流动水和自由水,其中不易流动水含量最多。因此,本研究采用低场核磁共振技术检测鱼肉贮藏过程中水分分布状态的变化,并采用差示扫描量热法、光学组织切片等技术,探究不同贮藏温度下鱼肉中蛋白和组织结构的变化对鱼肉品质的影响。
1 材料与方法
1.1材料及预处理
鲜活青鱼购买于无锡雪浪市场,重约6kg。在4 ℃冷室敲击青鱼头部以致死,去鳞、内脏和鱼皮,取鱼体中段侧线上方的白肉部分用于实验。
1.2主要试剂和仪器
NaCl、HCl、乙酸、乙醇、二甲苯、苯胺蓝、酸性复红、石蜡、磷钼酸,分析纯,国药集团;苦味酸,分析纯,西陇化工股份有限公司;中性树胶、苏木精,碧云天生物技术有限公司。
铝坩埚,耐驰科学仪器商贸有限公司;封口膜,PlechineyPlasticPackaging公司;LRH-250CA低温培养箱,上海一恒医疗器械有限公司;705超低温冰箱,赛默飞世尔科技公司;UT322高精度接触式温度计、K型热电偶,优利德集团有限公司;EL204电子天平,梅特勒-托利多仪器(上海)有限公司;差式扫描量热仪214Polyma,耐驰科学仪器商贸上海有限公司;MesoMR23-060H-I核磁共振分析仪,上海纽迈电子科技股份有限公司;石蜡包埋机、石蜡切片机、DM2000生物显微镜,徕卡显微系统(上海)贸易有限公司;TAXTPlus质构仪,英国StableMicroSystem公司。
1.3实验方法
1.3.1样品贮藏处理
将青鱼肉片切成2cm×2cm×1cm,用聚乙烯袋密封包装。随机将样品分为4组,第1组放入4 ℃冷藏室,第2和第3组分别浸入冰点为-0.5 ℃和-3 ℃的冰盐水混合物中,第4组放入-20 ℃的冰箱中。分别在第1、3、6、12和21天取样。新鲜(第0天)青鱼肉样品作为对照。所有指标平行测定3次。
1.3.2青鱼肉冰点
青鱼肉的冰点采用冷却曲线法测定,将热电偶插入新鲜青鱼肉块(2cm×2cm×2cm)的中心,随后将青鱼肉块置于-80 ℃的超低温冰箱中,并记录青鱼肉中心温度的变化,每20s记录1次,直到青鱼肉样品完全冻结,最终绘制冻结曲线,确定青鱼肉冰点。
1.3.3差式扫描量热技术(differentialscanningcalorimetry,DSC)
准确称取5.0~7.0mg鱼肉于铝坩埚中,压盖密封。以空坩埚作为参比,设定扫描程序为10 ℃恒温1min,以10 ℃/min升温至95 ℃。用In、Se、B、Zn、CsCl标准品做温度校准。
1.3.4光学组织切片
将青鱼肉切成5mm×5mm×3mm的小块,迅速浸没Bouin固定液中(体积分数70%苦味酸饱和液、25%甲酸和 5%乙酸),在4 ℃条件下固定24h,然后采用体积分数70%、80%、90%、95%和100%的乙醇梯度脱水。脱水后的样品浸入乙醇-二甲苯混合物(体积比1∶1)中1h,随后浸入二甲苯(100%)中1h。最后,将样品浸入62 ℃石蜡中3h,重复浸蜡1次。浸蜡完成后,用石蜡包埋机进行包埋,待蜡块冷却后,用石蜡切片机切片(5μm)。采用三色染色法,肌纤维呈红色,结缔组织呈蓝色。
1.3.5低场核磁共振技术
准确称取6~8g鱼肉样品,装入玻璃样品瓶中,用MesoMR23-060H-I核磁共振分析仪检测青鱼肉中水分的分布状态。水分分布状态变化通过横向弛豫时间T2图谱表征。采用多脉冲回波序列(multiplepulseechosequence,CPMG)对样品进行扫描。磁场强度为(0.5±0.05 )T,质子共振频率为23.3MHz。测量参数如下:回波时间TE=0.4ms,重复时间TR=3 000ms,回波个数NECS=3 000,采样点数TD=120 302,累加采集次数NS=8。实验数据采用用MultiExpInv软件分析。
1.3.6汁液流失率
取出贮藏样品,放置在25 ℃培养箱中恒温1h,平衡温度后称量,记为m1。随后撕开包装袋,用厨房用纸吸干流出汁液,包括粘附在包装袋内壁的液体。最后准确称取剩余样品的质量和包装袋的总质量,记为m2,以及包装袋的质量,记为m3,汁液流失率。

1.3.7鱼肉剪切力
将鱼肉样品切成2cm×2cm×1cm的小块,选用A/CKB探头垂直于纤维方向进行切割,触发力为5g,剪切速度为1mm/s,探头下行距离为0.95cm。将剪切过程中的最大力记作剪切力,平行6次。
2 结果与分析
2.1青鱼肉冰点的测定
将青鱼肉块放入超低温冰箱中,记录鱼块中心温度变化,得到青鱼肉的冻结曲线如图1所示。从图1中可以看出,初期温度迅速下降,至-0.8 ℃时,温度保持不变直至1 000s之后,温度迅速下降。从图1中可以判断,第一个拐点的温度即为鱼肉的冰点,即-0.8 ℃[13]。

图1 新鲜青鱼肉冻结曲线Fig.1 Freezing curve of fresh Black Carp muscle
2.2DSC测青鱼肉蛋白的变化
图2可以看出,随着贮藏时间的延长,不同贮藏温度下,青鱼肉中蛋白的DSC扫描曲线呈现出不同的变化趋势。图2中不同的峰代表不同的蛋白,其中峰1代表肌球蛋白,峰2代表肌浆蛋白,峰3代表肌动蛋白[1]。
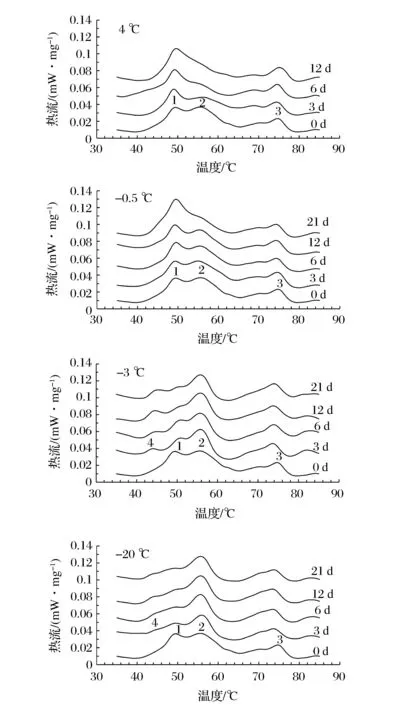
图2 青鱼肉DSC扫描曲线随贮藏时间的变化Fig.2 The change of DSC curves in the Black Carp muscle with the storage of time
图2显示,4 ℃条件下随着贮藏时间的延长,肌球蛋白峰和肌动蛋白峰峰形不变,而肌浆蛋白峰逐渐消失。在-0.5 ℃条件下,峰形变化同4 ℃条件相似,但是肌浆蛋白峰变化趋势更慢,直到第21天才基本消失。在-3 ℃条件下,肌浆蛋白峰和肌动蛋白峰变化不明显,但是肌球蛋白峰明显变弱,并且从第3天起在肌球蛋白的左侧出现了新的肩峰。在-20 ℃条件下,肌球蛋白峰在第3天就有明显减弱,并且肌球蛋白左侧逐渐出现了与-3 ℃条件下类似的肩峰,但变化缓慢。
在4和-0.5 ℃条件下,主要是肌浆蛋白的变化,而在-3和-20 ℃条件下,主要是肌球蛋白会发生部分的变性。有研究报道鱼肉的持水力主要是由肌球蛋白等肌原纤维蛋白决定的[14]。
2.3青鱼肉组织结构的变化
采用三色染色法,将肌纤维染成红色,结缔组织染成蓝色,通过两种颜色的对比,更容易观察肌肉组织的变化。图3中白色区域为肌纤维与结缔组织分离的区域,一些有规则的浅红色区域为冰晶。

图3 青鱼肉组织结构随时间的变化Fig.3 The change of tissue structure in the Black Carp muscle with the storage of time
可以看出,新鲜青鱼肉的肌纤维规则完整,肌纤维之间以及肌纤维与结缔组织排列紧密,蓝色的结缔组织充满了肌纤维之间的间隙。在4 ℃条件下,随着贮藏时间的延长,肌纤维结构完整,但是其与结缔组织逐渐分离,间隙不断变大,并且细微处的蓝色结缔组织已经消失。在-0.5 ℃条件下,鱼肉的组织结构保持的较完整,直到第21天,肌纤维之间只是有较小的分离,并且还可以看到细微处的结缔组织。在-3和-20 ℃条件下,鱼肉的组织结构都受到了冰晶的影响。在-3 ℃条件下,随着贮藏时间的延长冰晶缓慢增大,而在-20 ℃条件下,冰晶在第3天已经形成,并且在随后的贮藏期间冰晶尺寸一直比较稳定。
2.4LF-NMR测定青鱼肉中水分状态的变化
图4为鱼肉中水的横向弛豫时间T2图谱。

图4 青鱼肉横向弛豫时间T2随贮藏时间的变化Fig.4 The change of the transverse relaxation time T2 in the Black Carp muscle with the storage of time
青鱼肉中的水分主要存在3或4种状态,表现为3或4个峰,其中峰面积代表水分的相对含量。弛豫时间越短表示水分越不易流动,而弛豫时间越长表示水的流动性越强。通常会将这些水分为3种状态:结合水(1~10ms)、不易流动水(40~60ms)和自由水(>100ms)[14-17]。有文献中报道,结合水主要是同大分子紧密结合的那部分水,不易流动水主要分布在肌纤维和结缔组织构成的空间网状结构中、自由水主要分布在肌纤维和结缔组织构成的空间网状结构外[18-20]。图4中结合水表现为T2a和T2b,表示2种与大分子结合程度不同的水,不易流动水表现为T21、自由水表现为T22。
从图4中可以看出,4 ℃条件下,在第3天,水分分布状态已有明显的变化,尤其是不易流动水T21,其变化更有规律性,可以看到T21峰变低变宽,说明不易流动水的分布状态逐渐变多。结合水变化不是太明显,但是自由水相对含量有明显的增多。在-0.5 ℃条件下,水分状态变化较缓慢,结合水的变化没有规律性,但是自由水从第3天起就明显地增多,不易流动水的分布状态到第21天才有明显的变化,T21峰向右偏移,不易流动水变得更易流动。在-3 ℃条件下,水分分布状态的变化呈现明显的梯度变化趋势,T21峰变得越来越低,逐渐向两边拓宽,并且到最后几乎将T22峰掩盖,说明其流动性逐渐接近自由水。在-20 ℃条件下,第3天水分分布状态已经发生了明显的变化,其状态比较接近-3 ℃条件下第12天的鱼肉中水的状态,并且随后一直保持比较稳定的分布状态。水分分布状态的变化可能与鱼肉蛋白结构的变化和鱼肉组织结构的变化有关,这些变化导致了鱼肉组织中水分分布状态变多,流动性更强。
2.5汁液流失率的变化
图5显示不同贮藏温度下,青鱼肉汁液流失率的变化。

图5 青鱼肉汁液流失率随贮藏时间的变化Fig.5 The change of the drip loss of the Black Carp muscle with the storage of time
从图5中可以看出,随着贮藏时间的延长,各组的汁液流失率都不断地增大。在4和-0.5 ℃条件下,青鱼肉汁液流失率变化相对缓慢,其中-0.5 ℃条件下汁液流失率一直较低。-3和-20 ℃组汁液流失率在第3天迅速增大,随后变化缓慢,并且在-20 ℃条件下这种变化更明显。
贮藏温度不同,汁液流失率的变化趋势也不同。4组温度下,青鱼肉汁液流失率的增加与图2~图4显示的结果一致。在-3和-20 ℃条件下,冰晶的形成导致肌肉组织的局部收缩,局部离子浓度升高,引起肌球蛋白质变性,持水力下降,同时对细胞结构造成机械破坏,会在肌肉组织中形成汁液流失的通道,水分分布状态也会发生明显的变化[21]。在4和-0.5 ℃条件下,可能是由于微生物和内源性蛋白酶对于肌浆蛋白和鱼肉组,织结构的破坏作用较小,因此汁液流失率相对较低[22-26]。
2.6青鱼肉剪切力的变化
图6显示不同贮藏温度下,青鱼肉剪切力的变化。青鱼肉剪切力的变化反应的是青鱼肉质构的变化。青鱼死后会经过僵硬、解僵与自溶、腐败的过程,青鱼肉的质构也随之发生变化。
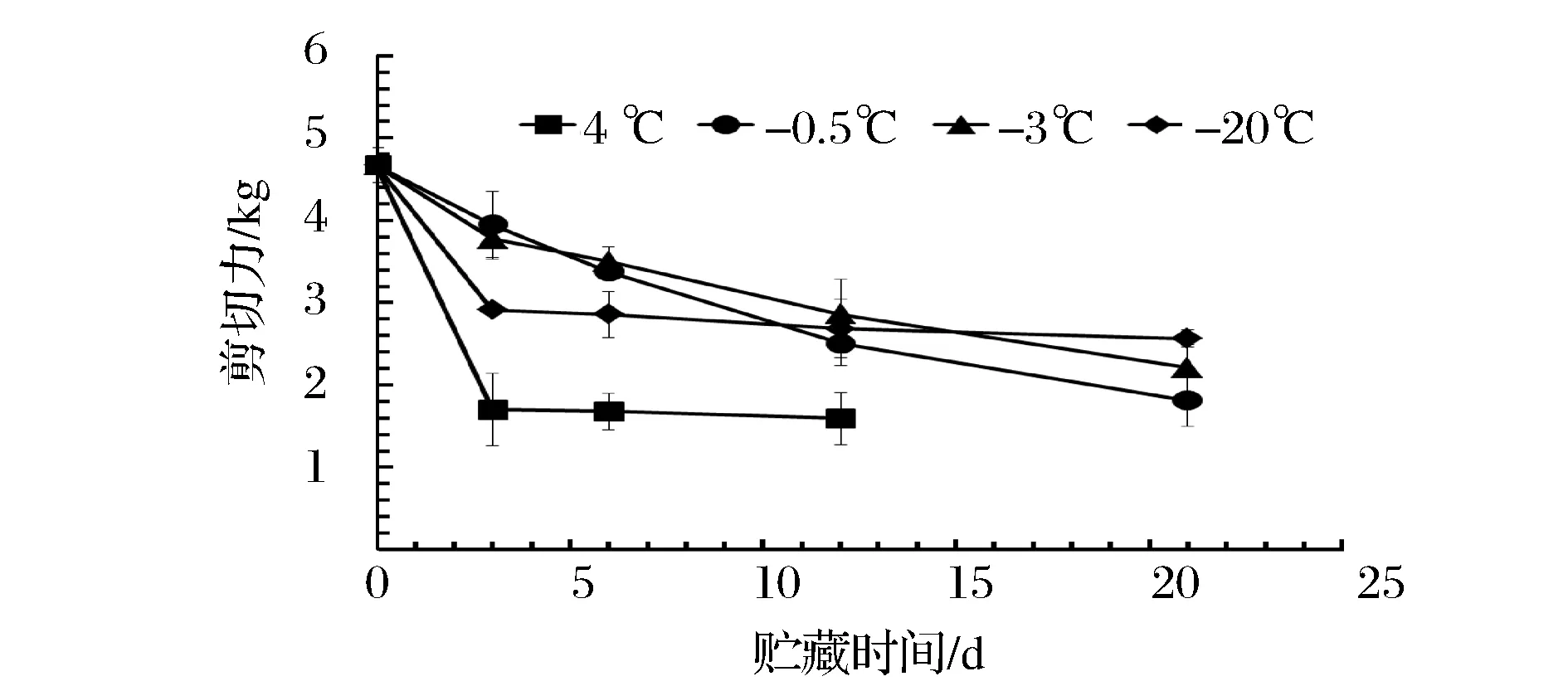
图6 青鱼肉剪切力随时间的变化Fig.6 The change of shear force in the Black Carp muscle with the storage of time
图6可以看出,从第3天起,4组青鱼肉的剪切力都开始减小,其中4 ℃时变化最迅速,第3天已经下降了63.6%。在-20 ℃条件下,青鱼肉的剪切力从第0天到第3天变化迅速,随后变化缓慢。在-0.5和-3 ℃条件下,青鱼肉的剪切力随贮藏时间的延长持续下降。
从图6可以看出,在-20 ℃条件下冰晶形成后比较稳定,从第3天起,鱼肉组织结构没有进一步破坏,因此青鱼肉剪切力在第3天之后变化缓慢。在-3 ℃条件下,由于水的重结晶对青鱼肉质构破坏更严重,导致剪切力持续下降。在-0.5 ℃条件下,青鱼肉剪切力的变化趋势与-3 ℃条件下相似,可能更多受到内源酶和微生物的作用,导致肌纤维蛋白和肌浆蛋白的降解,进而导致剪切力下降[27]。
3 结论
贮藏温度对于青鱼肉贮藏品质有很大的影响,尤其是对于青鱼肉组织中水和青鱼肉质构的影响。贮藏期间,随着青鱼肉品质的下降,鱼肉中水分和青鱼肉的质构呈现不同的变化趋势。在4和-0.5 ℃条件下,肌浆蛋白结构发生明显变化,鱼肉组织结构保存较完整,同时鱼肉中水分分布状态较稳定,变化缓慢,很可能是受到内源酶和微生物的作用,导致汁液流失率的增大和鱼肉剪切力的下降。而-3和-20 ℃条件下,肌球蛋白结构发生明显的变化,鱼肉组织结构受冰晶的破坏作用严重,同时水分分布状态变化较大,呈多状态分布,很可能是受到了低温和冰晶破坏作用的影响,导致了青鱼肉较高的汁液流失率和剪切力的降低。
[1]LIUD,LIANGL,XIAW,etal.Biochemicalandphysicalchangesofgrasscarp(Ctenopharyngodonidella)filletsstoredat3and0 ℃[J].FoodChemistry, 2013, 140(1):105-114.
[2]ARASHISAR,HISARO,KAYAM,etal.Effectsofmodifiedatmosphereandvacuumpackagingonmicrobiologicalandchemicalpropertiesofrainbowtrout(Oncorynchusmykiss)fillets[J].InternationalJournalofFoodMicrobiology, 2004, 97(2):209-214.
[3]SIVERTSVIKM,ROSNESJT,KLEIBERGGH.EffectofmodifiedatmospherepackagingandsuperchilledstorageonthemicrobialandsensoryqualityofAtlanticsalmon(Salmosalar)fillets[J].JournalofFoodScience, 2003, 68(4):1 467-1 472.
[4]OCAO-HIGUERAVM,MARQUEZ-ROSE,CANIZALES-DVILAM,etal.Postmortemchangesincazonfishmusclestoredonice[J].FoodChemistry, 2009, 116(4):933-938.
[5]ÖZOGULF, ÖZOGULY,KULEYE.Nucleotidedegradationandbiogenicamineformationofwildwhitegrouper(Epinephelusaeneus)storediniceandatchilltemperature(4 ℃)[J].FoodChemistry, 2008, 108(3):933-941.
[6]SKJERVOLDPO,RØRÅAMB,FJRASO,etal.Effectsofpre-,in-,orpost-rigorfilletingoflivechilledAtlanticsalmon[J].Aquaculture, 2001, 194(3):315-326.
[7]GAARDERMØ,BAHUAUDD,VEISETH-KENTE,etal.Relevanceofcalpainandcalpastatinactivityfortextureinsuper-chilledandice-storedAtlanticsalmon(SalmosalarL.)fillets[J].FoodChemistry, 2012, 132(1):9-17.
[8]HILLSBP.MagneticResonanceinFoodScience[M].NewYork:JohnWiley&Sons,1998.
[9]RUBELG.Simultaneousdeterminationofoilandwatercontentsindifferentoilseedsbypulsednuclearmagneticresonance[J].JournaloftheAmericanOilChemists’Society, 1994, 71(10):1 057-1 062.
[10]CHENP,MCCARTHYMJ,KAUTENR.NMRforinternalqualityevaluationoffruitsandvegetables[J].TransactionsoftheASAE(USA), 1989,32(5):1 747-1 753.
[11]ANDERSENCM,RINNANÅ.Distributionofwaterinfreshcod[J].LWT-FoodScienceandTechnology, 2002, 35(8):687-696.
[12]BERTRAMHC,WUZ,VANDENBERGF,etal.NMRrelaxometryanddifferentialscanningcalorimetryduringmeatcooking[J].MeatScience, 2006, 74(4):684-689.
[13]RAHMANMS,GUIZANIN,AL-KHASEIBIM,etal.Analysisofcoolingcurvetodeterminetheendpointoffreezing[J].FoodHydrocolloids, 2002, 16(6):653-659.
[14]PUOLANNEE,HALONENM.Theoreticalaspectsofwater-holdinginmeat[J].MeatScience, 2010, 86(1):151-165.
[15]ERIKSONU,STANDALIB,AURSANDIG,etal.UseofNMRinfishprocessingoptimization:areviewofrecentprogress[J].MagneticResonanceinChemistry, 2012, 50(7):471-480.
[16]SNCHEZ-ALONSOI,MARTINEZI,SNCHEZ-VALENCIAJ,etal.Estimationoffreezingstoragetimeandqualitychangesinhake(Merlucciusmerluccius,L.)bylowfieldNMR[J].FoodChemistry, 2012, 135(3):1626-1634.
[17]SNCHEZ-ALONSOI,MORENOP,CARECHEM.Lowfieldnuclearmagneticresonance(LF-NMR)relaxometryinhake(MerlucciusmerlucciusL.)muscleafterdifferentfreezingandstorageconditions[J].FoodChemistry, 2014, 153:250-257.
[18]LØJEH,GREEN-PETERSEND,NIELSENJ,etal.Waterdistributioninsmokedsalmon[J].JournaloftheScienceofFoodandAgriculture, 2007, 87(2):212-217.
[19]BERTRAMHC,ERSENHJ.ApplicationsofNMRinmeatscience[J].AnnualReportsonNMRSpectroscopy, 2004, 53:157-202.
[21]DUUNAS,RUSTADT.Qualitychangesduringsuperchilledstorageofcod(Gadusmorhua)fillets[J].FoodChemistry, 2007, 105(3):1 067-1 075.
[22]OLSSONGB,OLSENRL,OFSTADR.Post-mortemstructuralcharacteristicsandwater-holdingcapacityinAtlantichalibutmuscle[J].LWT-FoodScienceandTechnology, 2003, 36(1):125-133.
[23]HERREROAM,CARMONAP,CARECHEM.Ramanspectroscopicstudyofstructuralchangesinhake(MerlucciusmerlucciusL.)muscleproteinsduringfrozenstorage[J].JournalofAgriculturalandFoodChemistry, 2004, 52(8):2 147-2 153.
[24]ZHONGC,CAIQF,LIUGM,etal.PurificationandcharacterisationofcathepsinLfromtheskeletalmuscleofbluescad(Decapterusmaruadsi)andcomparisonofitsrolewithmyofibril-boundserineproteinaseinthedegradationofmyofibrillarproteins[J].FoodChemistry, 2012, 133(4):1 560-1 568.
[25]WUJL,GESY,CAIZX,etal.Purificationandcharacterizationofagelatinolyticmatrixmetalloproteinasefromtheskeletalmuscleofgrasscarp(Ctenopharyngodonidellus)[J].FoodChemistry, 2014, 145:632-638.
[26]EINARSSONH.Deepchilling(Superchilling,partialfreezing)-aliteraturesurvey[J].SIKsServiceseries(30).Gothenburg,Sweden,SIK-TheSwedishFoodInstitute,ChalmersUniversityofTechnology, 1988.
[27]GEL,XUY,XIAW.Thefunctionofendogenouscathepsininqualitydeteriorationofgrasscarp(Ctenopharyngodon idella)filletsstoredinchillingconditions[J].InternationalJournalofFoodScience&Technology, 2015, 50(3):797-803.
Theeffectofproteinandtissuestructurechangeonthequalityofblackcarpfishmeatatdifferenttemperature
YANGHong-xu,LIUDa-song,LIJun-ke,HEYun,ZHOUPeng*
(StateKeyLaboratoryofFoodScienceandTechnology,SchoolofFoodScienceandTechnology,JiangnanUniversity,Wuxi214122,China)
NMR,DSCandtissuesectionwereusedtostudytheeffectofdifferentstoragetemperature(4、-0.5、-3and-20 ℃)onwatercontentandproteinmoleculesandoverallchangeoftextureofblackcarpfishmeat.DSCresultsshowedthatsarcoplasmicproteinsshoweddenaturationat4and-0.5 ℃;myosinstructuredenaturedmoresignificantlyat-3and-20 ℃.Tissuesectionresultsshowedthatmyofiberswaskeptintactat4and-0.5 ℃,butweredisruptedbytheicecrystalat-3and-20 ℃.LF-NMRresultswereinaccordancewiththeDSCresultsandshowedthewatermoleculesinthemusclestableat4and-0.5 ℃,butchangedrapidlywhenstoredat-3and-20 ℃.Driplosskeptrelativelylowat4and-0.5 ℃,andhighat-3and-20 ℃.Shearforcedeclinedgraduallyat-0.5and-3 ℃,butdecreasedquicklyonthethirddayofthestorageat4and-20 ℃,andthenchangedslowly.Atdifferentstoragetemperaturethewatermoleculeswasaffectedbythechangeofproteinsandtissuestructure,andthisleadtothedifferentappearanceofthedriplossandtexture.
blackcarp;differentialscanningcalorimetry(DSC);tissuesection;low-fieldnuclearmagneticresonance(LF-NMR);driploss,shearforce
10.13995/j.cnki.11-1802/ts.201608037
硕士研究生(周鹏教授为通讯作者,E-mail:zhoupeng@jiangnan.edu.cn)。
国家自然科学基金(31471697); 教育部科学技术研究项目(113032A);其他(CARS-46-22)
2015-11-26,改回日期:2016-02-02
