黄瓜对B型和Q型烟粉虱取食的不同生理生化反应
2016-10-14刘明杨雷彩燕李静静卢少华白润娥汤清波闫凤鸣
刘明杨,雷彩燕,李静静,卢少华,白润娥,汤清波,闫凤鸣
黄瓜对B型和Q型烟粉虱取食的不同生理生化反应
刘明杨,雷彩燕,李静静,卢少华,白润娥,汤清波,闫凤鸣
(河南农业大学植物保护学院,郑州 450002)
【目的】烟粉虱()B生物型(中东-小亚细亚1种)和Q生物型(地中海种)是农业生产上的重要害虫,杀虫剂的滥用造成害虫产生抗药性,并危害到生态安全与人类健康,因此,制定安全有效的防控措施十分必要。利用植物抗性是害虫综合治理的重要方面,论文旨在探讨黄瓜植株被B型、Q型烟粉虱取食后营养和防御相关酶系的反应差异,阐明黄瓜植株应对烟粉虱取食防御反应的生理生化机制,为利用植物抗性防控不同烟粉虱生物型提供依据。【方法】以实验室长期培养的B型、Q型烟粉虱和黄瓜博杰1号品种为供试材料,在黄瓜植株4片真叶期分别接B型、Q型烟粉虱成虫200头,同时分别以不接虫的黄瓜植株为对照,在烟粉虱持续取食1、3、5、7、9 d后,分别测定黄瓜叶片中营养物质(可溶性糖和可溶性蛋白质)含量、多酚含量、防御物质合成相关酶活性以及保护酶活性。【结果】在整个实验期内,B型烟粉虱取食3 d后,黄瓜叶片中可溶性糖和蛋白含量均显著高于对照植株,而Q型烟粉虱取食1 d后,黄瓜叶片内可溶性糖和蛋白质含量均比对照植株显著下降。黄瓜叶片中多酚含量及其合成关键酶苯丙氨酸解氨酶(PAL)活性在两种生物型烟粉虱取食后均升高,但对Q型烟粉虱取食更敏感,即活性更高。B型烟粉虱取食后引起黄瓜叶片中超氧化物歧化酶(SOD)和过氧化氢酶(CAT)酶活性均升高、过氧化物酶(POD)酶活性下降;而Q型烟粉虱取食后则引起SOD活性升高、POD和CAT酶活性下降。【结论】烟粉虱B型和Q型取食诱导黄瓜的营养物质含量、防御酶或保护酶活性发生不同变化。B型、Q型烟粉虱取食均能诱导黄瓜植株防御物质多酚的合成,导致叶片内多酚含量升高;但二者对黄瓜营养物质及保护酶的活性诱导存在差异,B型烟粉虱诱导黄瓜营养物质增加,Q型取食导致营养物质下降,而黄瓜防御物质在Q型烟粉虱取食后活性更强。两种烟粉虱生物型在寄主适应性上存在差异,在制定防治策略上,应该因不同烟粉虱生物型或不同寄主植物而有所不同。
烟粉虱;B和Q生物型;取食诱导;黄瓜;营养物质;防御物质;保护酶
0 引言
【研究意义】烟粉虱()是一种重要的世界性害虫,目前已报道至少有36个生物型[1-2],其中B生物型(中东-小亚细亚1种)和Q生物型(地中海种)烟粉虱是中国重要的外来入侵物种[3-4]。B型烟粉虱自20世纪90年代末侵入中国,并迅速蔓延,已经取代了许多本地种[5]。Q型烟粉虱2003年在国内发现,随后在国内扩散,在许多地区已经取代B型烟粉虱成为优势种[6-7]。烟粉虱成虫、若虫均以口针刺吸取食植物韧皮部汁液,取食过程分泌的唾液蛋白会引起植物生理异常[8]。烟粉虱在取食过程中还会大量分泌蜜露,诱发煤污病,导致植物光合作用下降,影响植物产量和品质。除此之外,烟粉虱是传播植物病毒效率最高的介体之一,能够传播5个科212种植物病毒,给世界各地的农业生产造成了巨大的经济损失[9-10]。因此,制定烟粉虱安全有效的治理策略刻不容缓。寄主植物抗性利用是害虫治理中经济有效且实用的措施。黄瓜是烟粉虱重要寄主植物之一,研究B型和Q型烟粉虱取食诱导黄瓜生理生化的反应差异,从植物诱导抗性的角度探索寄主对不同生物型烟粉虱的防御反应,可为利用植物抗性制定烟粉虱综合治理措施提供理论依据。【前人研究进展】植物在长期进化过程中形成了复杂的防御系统,被植食性昆虫取食后,其生理生化状态可发生一系列的改变,如可引起植物营养物质的变化。棉铃虫()危害诱导棉花植株可溶性糖含量升高[11];松树受马尾松毛虫()危害后针叶中氨基酸含量降低[12]。植食性昆虫取食还可诱导植物防御物质的变化,如酚类、萜类、烟碱类等次生物质[13]。酚类物质是其中重要的一种,它具有限制昆虫取食和毒害两方面的作用[14]。而苯丙氨酸解氨酶(phenylalanin ammonialyase,PAL)和多酚氧化酶(polyphenol oxidase,PPO)是植物体内多酚代谢过程中的关键酶。另外,植物在受到昆虫或其他不良环境胁迫时,体内会产生和积累活性氧物质,对其造成毒害作用。植物体内的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等氧化酶能有效地清除这些自由基,抑制活性氧自由基对机体的伤害,提高生物体抗逆能力。植食性昆虫取食能够诱导植物中相关防御酶活性的变化,例如稻飞虱(和)取食水稻[15]、苜蓿蚜()取食苜蓿[16]都会引起植物中防御酶活性改变。因此,营养物质改变、防御物质累积和防御酶活性提高可能是植物抵御害虫危害的重要途径。【本研究切入点】目前关于烟粉虱与寄主植物互作的关系研究,主要集中在B型烟粉虱与寄主植物互作,研究范围通常是寄主植物中酶活性的变化[17-19],很少涉及植物中的营养物质变化以及B型和Q型烟粉虱与寄主互作的差异比较。【拟解决的关键问题】以黄瓜()为材料,通过研究B型、Q型烟粉虱取食诱导的植物中主要营养物质可溶性糖和可溶性蛋白含量、植物体内防御物质合成积累及防御酶系活性的变化,从生理生化角度深化对烟粉虱与其寄主植物相互作用机理的认识。同时,对两种生物型烟粉虱取食诱导的植物生理生化反应进行比较,探讨其在寄主适应方面所采取的不同策略。
1 材料与方法
试验于2015年5—9月在河南农业大学化学生态学实验室进行。
1.1 供试材料
黄瓜(品种博杰1号)购于天津德瑞特种业有限公司,于河南农业大学人工温室内(温度26—27℃,光暗比为14 h﹕10 h,光照强度为2 500—3 000 lx,相对湿度75%,土壤采用营养土,花盆为直径10 cm,高12 cm圆盆)培养,待到4片真叶期用于试验。
B型和Q型烟粉虱采自河南农业大学科教园区,并在室内饲养笼(60 cm×40 cm×80 cm)内的烟草()(品种为中烟100)上标准化饲养(温度27—28℃,相对湿度75%,光暗比为16 h﹕ 8 h)多年,每代用(线粒体细胞色素氧化酶I基因)标记检测烟粉虱种群的生物型纯度[20]。选取羽化24 h内的烟粉虱成虫用于试验。
1.2 黄瓜处理
选取龄期一致、长势一致的黄瓜植株(4片真叶期),置于饲养笼(60 cm×40 cm×80 cm)内,分别接入B型、Q型烟粉虱成虫,平均虫口密度每株200头。同时设置未接虫的植物作为对照。在接入烟粉虱1、3、5、7、9 d后取植物叶片(最新长出的两片叶),测定可溶性糖、多酚、蛋白质,或-70℃保存用于酶活性测定。
1.3 可溶性糖及蛋白质含量测定
可溶性糖含量测定采用蒽酮比色法[21]。取新鲜植物叶片0.2 g,剪碎放入刻度试管,加入10 mL蒸馏水,塑料膜封口,于沸水浴中提取30 min(提取两次),提取液过滤入25 mL容量瓶中,反复漂洗试管及残渣,定容。吸取样品提取液0.5 mL于20 mL刻度管中,加1.5 mL蒸馏水,向刻度管中加入0.5 mL蒽酮乙酸乙酯试剂和5 mL浓硫酸,充分振荡后立即将试管放入沸水浴中保温1 min,取出后冷却至室温,以空白做参比,在630 nm波长下测其吸光度。以蔗糖做标准曲线。
可溶性蛋白质含量测定采用考马斯亮蓝G-250染色法[21]。称取新鲜植物叶片0.2 g,用5 mL 0.05 mol·L-1磷酸缓冲液(pH 7.0)研磨成匀浆,3 000 r/min离心10 min。取1 mL上清液放入具塞试管(每个样品3个重复),加入5 mL考马斯亮蓝G-250溶液,充分混合,放置2 min后在595 nm下测吸光度。以牛血清蛋白做标准曲线。
1.4 多酚含量测定
多酚含量测定采用福林-酚比色法[22]。称取0.2 g新鲜叶片置于预冷的研钵,加入液氮研磨至粉末,移入2 mL离心管中,加入1.5 mL 80%甲醇。用锡箔纸包裹离心管,25℃下150 r/min摇床下振荡过夜。提取物在12 000 r/min在离心10 min,将上清液转移到新的离心管中,-20℃保存,用于测定。测定时加入150 μL提取液和150 μL 1 mol·L-1Folin-酚试剂(Folin and Ciocalteu’s Phenol reagent),摇匀,室温下保持5 min。接着加入200 μL的1 mol·L-1Na2CO3溶液,摇匀,在室温下保持10 min。向混合物中加入双蒸水使反应液体积到1.5 mL,摇匀,室温下(在暗处)保持1 h。混合物在725 nm下比色,测定吸光度。以邻苯二酚做标准曲线。
1.5 酶活性测定
粗酶液提取:将冷冻保存的黄瓜叶片(0.5 g)置于研钵中,加入4℃预冷的pH 7.0的磷酸缓冲液2—3 mL和少许石英砂研磨成匀浆,4℃下8 000 r/min低温离心20 min,上清液即为粗酶液,置于4℃冰箱保存备用。
1.5.1 苯丙氨酸解氨酶(PAL)活力测定 PAL活性测定参考Lee等[23]的方法。取0.1 mL酶液,加1 mL 0.02 mol·L-1的苯丙氨酸和1.9 mL 0.1 mol·L-1Tris-HCl(pH 8.0)缓冲液,30℃水浴锅中反应15 min,加入200 μL 6 mol·L-1HCl终止反应,于290 nm处测定吸光度值(OD290)。以每克叶片鲜重每分钟0.01个290 nm吸光值的变化为一个PAL活性单位(U)。
1.5.2 过氧化氢酶(CAT)活性测定 参考王学奎[24]的方法。取试管3支,分别依次加入粗酶液0.2 mL,0.05 mol·L-1磷酸缓冲液(pH 7.0)1.5 mL,蒸馏水1.0 mL,其中对照管的酶液为煮沸的粗酶液。25℃条件下水浴5 min后加入0.1 mol·L-1的H2O20.3 mL。以双蒸水调零,于240 nm波长下测定4 min内OD值的变化。以每克叶片鲜重每分钟0.01个240 nm吸光值的变化为一个CAT活性单位(U)。
1.5.3 过氧化物酶(POD)活性测定 参考高俊凤[25]的方法并略作改进。取4支管,分别加入0.05 mol·L-1磷酸缓冲液(pH 7.0)2.9 mL,1.0 mL 0.05 mol·L-1愈创木酚,0.1 mL酶液,最后加入2% 1 mL H2O2催化激活反应,470 nm处测4 min内吸光值变化。以每克叶片鲜重470 nm处吸光值变化量为一个POD活性单位(U)。
1.5.4 多酚氧化酶(PPO)活性测定 参考Anderson等[26]的方法并改进。取试管4支,分别加入pH 6.8的0.05 mol·L-1磷酸缓冲液(pH 7.0)1.50 mL和0.02 mol·L-1邻苯二酚1.50 mL,测定管加入0.1 mL的粗酶液,空白管以0.05 mol·L-1磷酸缓冲液代替粗酶液;30℃反应2 min后,在398 nm波长下测4 min内OD值变化。
1.5.5 超氧化物歧化酶(SOD)活性测定 参考高俊凤[25]的方法。取试管5支,分别依次加入0.05 mol·L-1磷酸缓冲液(pH 7.0)1.5 mL,130 mmol·L-1甲硫氨酸0.3 mL,750 μmol·L-1氮蓝四唑溶液0.3 mL,100 μmol·L-1EDTA-Na2溶液0.3 mL;测定管依次加入0.1 mL酶液,0.5 mL蒸馏水,对照管以蒸馏水代替粗酶液;混合均匀后,暗对照管用锡箔纸包裹避光,将所有试管放入28℃的光照培养箱反应9 min,反应结束后以暗对照为空白,560 nm测OD值。
1.6 数据处理与分析
数据采用SPSS16.0统计软件进行分析,不同处理间采用独立样本检验。
2 结果
2.1 烟粉虱取食对黄瓜中营养物质含量的影响
2.1.1 可溶性糖含量 B型和Q型烟粉虱危害均会导致黄瓜植株中可溶性糖含量发生改变。黄瓜植株中的可溶糖含量,在B型烟粉虱取食后的3、5和7 d显著高于对照植株(≤0.05),9 d极显著高于对照植株(≤0.01);Q型烟粉虱取食则导致黄瓜植株中可溶性糖含量降低,在取食后1、3、9 d黄瓜植株中可溶性糖含量极显著低于对照植株(≤0.01)(图1)。

“*”表示差异显著(P≤0.05),“**”表示差异极显著(P≤0.01)。下同
2.1.2 可溶性蛋白含量 B型和Q型烟粉虱取食对黄瓜中可溶性蛋白含量的影响不同。B型烟粉虱取食后黄瓜植株中可溶性蛋白含量除了第7天显著高于对照植株外(≤0.05),其他时间和对照植株之间没有显著性差异;Q型烟粉虱取食后除第1天外,其余观察时间点黄瓜中可溶性蛋白含量均下降,其中第3和7天后显著低于对照(≤0.05),而第9天极显著低于对照(≤0.01)(图2)。

图2 B型、Q型烟粉虱取食诱导的黄瓜中可溶性蛋白含量变化
2.2 烟粉虱取食对黄瓜中防御物质多酚合成和积累的诱导
2.2.1 多酚含量 B型和Q型烟粉虱危害都能够提高黄瓜中防御物质多酚的含量。黄瓜植株中多酚含量在B型烟粉虱危害后3 d开始显著高于对照植株,增幅最大是第5和9天,分别达24.99%和46.67%;Q型烟粉虱危害后,在第1、5天黄瓜中多酚含量显著高于对照(≤0.05),第7天极显著高于对照(≤0.01),增幅最大是第1和5天,分别达15.34%和25.08%(图3)。

图3 B型、Q型烟粉虱取食诱导的黄瓜中多酚含量的变化
2.2.2 PAL活性 B型和Q型烟粉虱危害均能提高黄瓜中PAL活性。B型烟粉虱危害后,黄瓜中PAL活性在第7和9天显著高于对照(≤0.05),第3天黄瓜中PAL活性极显著高于对照(≤0.01),在第3和7天增幅最高,分别达31.41%和14.06%;Q型烟粉虱取食后,除第3天外,其余观察时间黄瓜中多酚含量均显著高于对照,其中第1、5、7天黄瓜中PAL活性极显著高于对照(≤0.01),第1、5、7、9天PAL酶活性增幅分别高达115.38%、60.22%、60.71%和30.82%(图4)。

图4 B型、Q型烟粉虱取食诱导的黄瓜中PAL活性变化
2.2.3 PPO活性 B型、Q型烟粉虱危害后黄瓜中PPO活性变化不一致。B型烟粉虱危害后,黄瓜中PPO活性没有显著性变化。而Q型烟粉虱危害后,黄瓜中PPO活性的在第1天显著高于对照(≤0.05),而第9天极显著高于对照(≤0.01)(图5)。

图5 B型、Q型烟粉虱取食诱导的黄瓜中PP0活性变化
2.3 烟粉虱危害对黄瓜中保护酶活性的影响
2.3.1 SOD活性 B型、Q型烟粉虱危害后都能诱导黄瓜中SOD活性的增加。B型烟粉虱危害后第3、5、7天后黄瓜中SOD活性的增幅分别为20.97%、36.64%、30.96%,达显著水平(≤0.05)。Q型烟粉虱危害后第7和9天的增幅分别为45.51%、52.92%,显著高于对照(≤0.05)(图6)。

图6 B型、Q型烟粉虱取食诱导的黄瓜中SOD活性变化
2.3.2 POD活性 B型、Q型烟粉虱危害后都能显著降低黄瓜中POD活性。B型烟粉虱危害后黄瓜中POD活性第1天差异显著(≤0.05),第3、5、7天差异达到极显著水平(≤0.01);Q型烟粉虱危害后黄瓜中POD活性也降低,第1、5、7天黄瓜中POD活性显著低于对照(≤0.05),第3、9天黄瓜中POD活性极显著低于对照(≤0.01)(图7)。
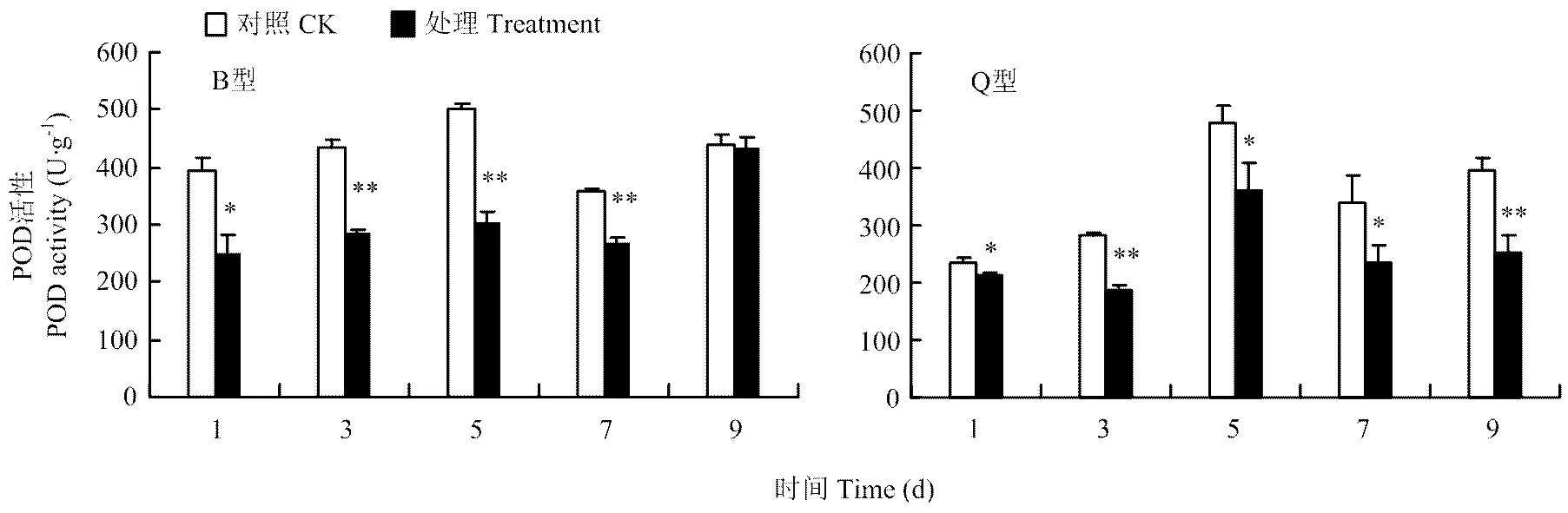
图7 B型、Q型烟粉虱取食诱导的黄瓜中POD活性的变化
2.3.3 CAT活性 B型、Q型烟粉虱危害都能够影响黄瓜中CAT活性,但变化趋势不同。B型烟粉虱危害后,黄瓜植株中的CAT活性增加,且第3和5天CAT活性显著高于对照植株(≤0.05);而Q型烟粉虱危害后,黄瓜植株中CAT活性降低,在危害第7和9天CAT活性显著低于对照植株(≤0.05)(图8)。

图8 B型、Q型烟粉虱取食诱导的黄瓜中CAT活性变化
3 讨论
植物遭受植食性昆虫危害后,其生理生化方面可能发生变化,表现为营养物质、防御蛋白、次生代谢产物及有毒物质在质或量上的改变,而这些改变不利于植食性昆虫的生长发育和繁殖[27]。寄主植物营养物质在质和量上的变化都足以影响昆虫的生长发育,因此植物营养物质的改变是植物化学防御机制的一种对策。可溶性糖是昆虫生长发育必要的氨基酸和不饱和脂类的前体[11],蛋白质尤其是氨基酸的种类和比例,是昆虫生长发育的重要因素,因此植物中可溶性糖含量和蛋白质的变化是植物抵御植食性昆虫取食的一种手段,这种变化会因昆虫和寄主植物的不同而异。刺吸式口器害虫褐飞虱危害水稻后,其寄主植物体内可溶性糖、蛋白质等含量大大降低[28];覃金萍等[29]研究表明灰同缘小叶蝉()危害秋枫叶后可溶性糖和蛋白质含量明显升高。本研究发现,两种生物型烟粉虱取食后,诱导黄瓜中营养物质发生不同变化:B型烟粉虱取食诱导黄瓜可溶性糖和蛋白质均显著高于对照,而Q型烟粉虱取食后,可溶性糖和蛋白质含量显著低于对照(图1、图2)。这一结果表明,两种烟粉虱生物型诱导的黄瓜营养物质变化差异很大,这从客观上使得B型烟粉虱更易从受害植物中获取足够的营养物质,而Q型的取食则阻碍了植物营养物质的合成或积累。笔者实验室之前的研究表明,在无农药压力下B型烟粉虱适应性更强[30],本研究结果为这种结论提供了营养方面的依据。
植物体内抗性物质的含量水平与其抗虫性高低密切相关。植物体内次生物质种类较多,包括酚类、黄酮类、萜类和生物碱等,这些物质通过驱避、拒食或毒性的作用,影响昆虫的搜索行为、抑制生长发育或阻碍昆虫取食等[31]。汤德良等[11]研究表明,棉铃虫取食棉花后,叶片内次生物质棉酚和单宁含量均明显高于未被取食的叶片。本研究发现,B型和Q型烟粉虱危害后,黄瓜中多酚的含量均高于对照,但二者变化略有差异。Q型烟粉虱取食后第1天黄瓜中多酚含量即显著高于对照,而B型烟粉虱取食后第1天多酚含量没有显著变化(图3),这说明黄瓜对Q型烟粉虱的胁迫较敏感,能够对其迅速作出防御反应。植物体内多酚均由苯丙烷类代谢途径合成,苯丙氨酸解氨酶PAL是这一途径的关键酶和限速酶[32],本试验研究了B型和Q型烟粉虱危害后黄瓜中PAL活性变化,结果表明两种生物型烟粉虱取食都能够诱导黄瓜中PAL活性的提高,但Q型烟粉虱取食后PAL活性增加更迅速,增加幅度更高(图4)。多酚氧化酶(PPO)在植物中主要存在于细胞器类囊体,而其酚底物在液泡中,所以植食性昆虫危害能使植物体内PPO活性升高。PPO对植食性昆虫具有防御功能,一方面昆虫通过咀嚼和进食将PPO与食物中的蛋白混合形成醌类,从而降低已摄入植物蛋白的营养价值形成抗营养;另一方面醌类物质本身有一定的毒性,在某种程度上也可对抗植食性昆虫[33]。本研究中B型烟粉虱危害后黄瓜中PPO活性没有明显变化,而Q型烟粉虱取食直接诱导了黄瓜中PPO活性提高(图5),这表明黄瓜中PPO对Q型烟粉虱危害更敏感,即Q型烟粉虱取食能引起寄主植物黄瓜更激烈迅速的反应。
植物在受到昆虫或其他不良环境胁迫时,体内会产生和积累活性氧物质,对其自身造成毒害作用,但同时植物体内的SOD、POD、CAT等氧化酶能有效地清除这些自由基,抑制活性氧自由基对机体的伤害,提高生物体的抗逆性能。不同植物受不同害虫危害后体内保护酶活性变化存在一定差异[28,34]。苜蓿蚜、高粱蚜()、温室粉虱等昆虫取食危害均导致其寄主植物体内防御酶活性的提高。但张金锋等[15]研究表明,受白背飞虱()危害后,稻株体内的SOD活性增加,CAT活性下降;孔海龙等[35]研究发现Q型烟粉虱危害后辣椒中POD活性降低。本研究发现,B型、Q型烟粉虱危害后都导致黄瓜中SOD活性增加、POD活性则降低,但二者对CAT活性的影响则相反,即B型烟粉虱诱导黄瓜中CAT活性增加,Q型烟粉虱导致CAT活性降低。这说明在对于昆虫取食的诱导反应中,植物总体上可以提高抗性水平,但不同的昆虫-植物组合可能诱导植物启动不同的防御系统,因而造成不同防御或保护酶活性的不同变化。从昆虫反适应的角度看,昆虫唾液成分在对付植物诱导反应上发挥作用,不同昆虫唾液成分的差异,会导致在压低植物的防御反应上效果不同。此外,近年来的许多研究表明,昆虫内共生菌在昆虫适应植物防御物质和利用植物营养方面发挥着重要作用。
许多研究都证明B型和Q型烟粉虱在寄主适应性、传毒能力等方面存在差异,本研究从黄瓜诱导防御反应的角度揭示了两种烟粉虱生物型与寄主植物不同的相互作用关系,为其暴发、演化、取代机制的研究提供了证据。要阐明两种生物型诱导植物不同防御反应的内在机理,还需要进行生物化学和分子生物学方面的研究。同时,两种烟粉虱生物型在中国不同地区分布和危害上存在差异,它们与不同寄主植物的相互关系也会有不同表现,因此,针对不同烟粉虱生物型的危害和不同的寄主植物,在制定防治策略上,特别是以利用植物抗性为重点的综合治理措施上,应该因烟粉虱生物型或寄主植物而有所不同,从而使防控更有针对性。比如,B型烟粉虱取食可以诱导寄主植物营养增加,应该辅以药剂防控,而Q型烟粉虱取食降低了植物营养,同时诱导植物较高的防御水平,加上Q型本身就很高的抗药性,应以植物抗性利用为主,药剂防治为辅。
4 结论
对B型、Q型烟粉虱取食诱导的黄瓜生理生化反应进行了研究,发现两种生物型烟粉虱危害后黄瓜中营养物质、抗性物质及保护酶活性存在差异。B型烟粉虱危害后,黄瓜中营养物质含量增加,Q型烟粉虱危害后,黄瓜中营养物质含量降低;抗性物质多酚及抗性代谢关键酶PAL活性在两种生物型烟粉虱取食后都增加,但对Q型烟粉虱取食更敏感,增加更迅速、幅度更高;保护酶SOD和POD在两种生物型烟粉虱取食后活性都增加,但B型烟粉虱取食导致CAT活性增加,而Q型烟粉虱取食则导致CAT活性降低。这些差异可能与两种生物型烟粉虱的唾液蛋白成分及其体内共生菌不同以及两种生物型的不同适应性有关。
References:
[1] Tay W T, Evans G A, Boykin L M, De Barro P J. Will the realplease stand up?, 2012, 7(11): e50550.
[2] Firdaus S, Vosman B, Hidayati N, Supena E D J, Visser R G F, van HeusdenA W. Thespecies complex: Additions from different parts of the world., 2013, 20(6): 723-733.
[3] Xu J, De Barro P J, Liu S S. Reproductive incompatibility among genetic groups ofsupports the proposition that the whitefly is a cryptic species complex., 2010, 100(3): 359-366.
[4] Lee W, Park J, Lee G S, Lee S, Akimoto S. Taxonomic status of thecomplex (Hemiptera: Aleyrodidae) and reassessment of the number of its constituent species., 2013, 8(5): e63817.
[5] Liu S S, Barro P J D, Xu J, Luan J B, Zang L S, Ruan Y M, WAN F H. Asymmetric mating interactions drive widespread invasion and displacement in a whitefly., 2007, 318(5857): 1769-1772.
[6] Pan H P, Chu D, Ge D Q, Wang S L, Wu Q J, Xie W, Jiao X G, Liu B M, Yang X, Yang N, Su Q, Xu B Y, Zhang Y J.Further spread of and domination by(Hemiptera: Aleyrodidae) biotype Q on field crops in China.,2011,104(3): 978-985.
[7] 李洪冉, 刘馨, 刘小龙, 李长友, 沈长朋, 陶云荔, 褚栋. 田间系统调查表明山东省农区烟粉虱优势种为Q隐种. 昆虫学报, 2015, 58(7): 811-816.
Li H R, Liu X, Liu X L, Li C Y, Shen C P, Tao Y L, Chu D. Widespread displacement of the exotic whitefly speciesB byQ in fields in Shandong, China., 2015, 58(7): 811-816. (in Chinese)
[8] Chu C C, Margosan D A, Buckner J S, Freeman T P, Henneberry T J.(Hemiptera: Aleyrodidae) nymph feeding in cotton () leaves., 2007, 14(5): 375-381.
[9] Polston J E, DeBarro P J, Boykin L M. Transmission specificities of plant viruses with the newly identified species of thespecies complex., 2014, 70(10): 1547-1552.
[10] Bragard C, Caciagli P, Lemaire O,Lopez-Moya J J, MacFarlane S, Peters D, Susi P, Torrance L. Status and prospects of plant virus control through interference with vector transmission., 2013, 51(2): 177-201.
[11] 汤德良, 王武刚, 谭维嘉, 郭予元. 棉铃虫危害诱导棉花内物质含量变化. 昆虫学报, 1997, 40(3): 332-333.
Tang D L, Wang W G, Tan W J, Guo Y Y. Changes of contents of some substances in cotton leaves induced by cotton bollworm(Hübner) attack., 1997, 40(3): 332-333. (in Chinese)
[12] 戈峰, 李典谟, 邱业先, 王国红. 松树受害后一些化学物质含量的变化及其对马尾松毛虫种群参数的影响. 昆虫学报, 1997, 40(4): 337-342 .
Ge F, Li D M, Qiu Y X, Wang G H. Studies on the changes of some chemical in damaged pine needles and their effects on population parameters of pine caterpillar., 1997, 40(4): 337-342.(in Chinese)
[13] 秦秋菊, 高希武. 昆虫取食诱导的植物防御反应. 昆虫学报, 2005, 48(1): 125-134.
Qin Q J, Gao X W. Plant defense responses induced by insect herbivory., 2005, 48(1): 125-134. (in Chinese)
[14] 赵福庚, 何龙飞, 罗庆云. 植物逆境生理生态学. 北京: 化学工业出版社, 2004: 15-17.
Zhao F G, He L F, Luo Q Y.Beijing: Chemical Industry Press, 2004: 15-17. (in Chinese)
[15] 张金锋, 薛庆中. 稻飞虱危害胁迫对水稻植株内主要保护酶活性的影响. 中国农业科学, 2004, 37(10): 1487-1491.
Zhang J F, Xue Q Z. The activity dynamics of main protective enzymes in rice plants under feeding stresses ofand., 2004, 37(10): 1487-1491. (in Chinese)
[16] 程璐, 贺春贵, 胡桂馨, 王森山, 张亚灵. 苜蓿斑蚜危害对5种苜蓿品种(系) PAL、POD、PPO 酶活性的影响. 植物保护, 2009, 35(6): 87-90.
Cheng L, He C G, Hu G X, Wang s S, Zhang Y L. The effects ofon the activities of PAL, POD and PPO in fivevarieties., 2009, 35(6): 87-90.(in Chinese)
[17] Zhang S Z, Zhang F, Hua B Z. Enhancement of phenylalanine ammonia lyase, polyphenoloxidase, and peroxidase in cucumber seedlings by(Gennadius) (Hemiptera: Aleyrodidae) infestation., 2008, 7(1): 82-87.
[18] 安志兰, 褚栋, 郭笃发, 范仲学, 陶云荔, 刘国霞, 张友军. 寄主植物对B型烟粉虱 ()几种主要解毒酶活性的影响. 生态学报, 2008, 28(4): 1536-1543.
An Z L, Chu D, Guo D F, Fan Z X, Tao Y L, Liu G X, ZHANG Y J. Effects of host plant on activities of some detoxification enzymes inbiotype B., 2008, 28(4): 1536-1543. (in Chinese)
[19] Togni P H B, LaumannR A, Medeiros M A, Sujii E R. Odour masking of tomato volatiles by coriander volatiles in host plant selection ofbiotype B., 2010, 136(2): 164-173.
[20] Shatters R G, Power C A, Boykin L M, He L, Mckenzie C L. Improved DNA barcoding method forand related Aleyrodidae: development of universal andbiotype- specific mitochondrial cytochromecoxidase I polymerase chain reaction primers., 2009, 102(2): 750-758.
[21] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 184-185, 194-195.
Li H S.. Beijing: Higher Education Press, 2000: 184-185,194-195. (in Chinese)
[22] 吴晓敏, 韩利文, 王希敏, 陈维云, 杨官娥, 刘可春. 不同产地新鲜紫色马铃薯中花色苷及总酚的含量测定. 中国食物与营养, 2014, 20(5): 24-26.
Wu X M, Han L W, Wang X M, Chen W Y, Yang G E, Liu K C. Quantitative determination of anthocyanin and total phenols in fresh purple potato from different habitats., 2014, 20(5): 24-26. (in Chinese)
[23] Lee H J, Park K H, Shim J H, Park R D, Yong W K, Cho J Y. Quantitative changes of plant defense enzymes in biocontrol of pepper (L.) late blight by antagonisticHJ927., 2005, 15(5): 1073-1079.
[24] 王学奎. 植物生理生化实验原理和技术. 2版. 北京: 高等教育出版社, 2006: 169.
Wang X K... Beijing: Higher Education Press, 2006: 169. (in Chinese)
[25] 高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006: 211-213, 217.
Gao J F.Beijing: Higher Education Press, 2006: 211-213, 217. (in Chinese)
[26] Anderson J V, Morris C F. An improved whole-seed assay for screening wheat germplasm for polyphenol oxidase activity., 2001, 41(6): 1697-1705.
[27] Chen M S. Inducible direct plant defense against insect herbivores: A review., 2008, 15(2): 101-114.
[28] 陈建明, 俞晓平, 程家安, 吕仲贤, 徐红星. 不同水稻品种受褐飞虱危害后体内生理指标的变化. 植物保护学报, 2003, 30(3): 225-231.
Chen J M, Yu X P, Cheng J A, Lü Z X, Xu H X. The change of physiological indexes in different varieties of rice damaged by(Stal)., 2003, 30(3): 225-231.(in Chinese)
[29] 覃金萍, 孙艳娟, 杨振德, 张增强, 李诺, 巨伟云. 灰同缘小叶蝉取食对寄主植物秋枫叶片生理生化的影响. 植物保护导刊, 2009, 29(12): 10-12.
Qin J P, Sun Y J, Yang Z D, Zhang Z Q, Li N, Ju W Y. Effect of feeding byDworakowska on physiological and biochemical indexes of host plantleaves., 2009, 29(12): 10-12. (in Chinese)
[30] 卢少华, 李静静, 刘明杨, 白润娥, 汤清波, 闫凤鸣. 烟粉虱B型和Q型竞争能力的室内比较分析. 中国农业科学, 2015, 48(7): 1339-1347.
Lu S H, Li J J, Liu M Y, Bai R E, Tang Q B, Yan F M. Comparative analysis of the competitiveness between B and Q biotypes ofunder laboratory conditions., 2015, 48(7): 1339-1347. (in Chinese)
[31] 林凤敏, 吴敌, 陆宴辉, 张永军, 王沫, 吴孔明. 棉花主要抗虫次生物质与其对绿盲蝽抗性的关系. 植物保护学报, 2011, 38(3): 202-208.
Lin F M, Wu D, Lu Y H, Zhang Y J, Wang M, Wu K M. The relationship between the main secondary metabolites and the resistance of cotton to., 2011, 38(3): 202-208. (in Chinese)
[32] Fukasawa-Akada T, Kung S D, Watson J C. Phenylalanine ammonia-lyase gene structure, expression, and evolution in., 1996, 30(4): 711-722.
[33] 王曼玲, 胡中立, 周明全, 宋运淳. 植物多酚氧化酶的研究进展. 植物学通报, 2005, 22(2): 215-222.
Wang M L, Hu L Z, Zhou M Q, Song Y C. Advances in research of polyphenol oxidase in plants., 2005, 22(2): 215-222. (in Chinese)
[34] 许秀淡, 郑少泉, 黄金松, 许家辉, 陈菁瑛, 刘惠玉. 角颊木虱危害对龙眼叶片活性氧代谢的影响. 福建农业学报, 2000, 15(3): 60-63.
Xu X D, Zheng S Q, Huang J S, Xu J H, Chen J Y, Liu H Y. Injurious effects byon active oxygen metabolism in longyan leaves., 2000, 15(3): 60-63. (in Chinese)
[35] 孔海龙, 吕敏, 吴琳, 祝树德. Q型烟粉虱危害对不同品种辣椒保护酶活性及次生物质含量的影响. 应用昆虫学报, 2014, 51(6): 1553-1560.
Kong H L, Lü M, Wu L, Zhu S D. Effects ofdamage on the protective enzyme activity and the secondary metabolite content of leaves in different pepper varieties., 2014, 51(6): 1553-1560. (in Chinese)
(责任编辑 岳梅)
Differential Physiological and Biochemical Responses of Cucumber to the Feeding byB and Q Biotypes
LIU Ming-yang, LEI Cai-yan, LI Jing-jing, LU Shao-hua, BAI Run-e, TANG Qing-bo, YAN Feng-ming
(College of Plant Protection, Henan Agricultural University, Zhengzhou 450002)
【Objective】B (Middle East-Asia Minor 1)and Q (Mediterranean) biotypes, two cryptic species ofspecies complex, are important agricultural pests. Extensive applications of insecticides for control of the pests have resulted in pesticide resistance in the whiteflies, have endangered ecological safety and human health. Implementation of safe pest management strategy is therefore becoming very important and urgent. Utilization of plant defense is one of the important components in integrated pest management. The objective of this study is to investigate the differential responses of nutrients and defensive enzymes in cucumber induced by the feeding ofB and Q biotypes and thereby to elucidate the physiological and biochemical mechanism underlying defence responses of cucumber to.【Method】Adults ofB and Q biotypes and cucumber plants (var. Bojie-I) from the laboratory cultures were used for the experiments. The cucumber plants at four-leaf stage were respectively used to feed 200 adults ofB and Q biotypes, with healthy plants as controls, and the contents of nutrients (soluble sugar and soluble protein) and polyphenolic contents, activity of phenylalanine ammonialyase (PAL), the enzyme of defensive substance biosynthesis, and activity of protective enzymes in cucumber were determined after continuously feeding for 1, 3, 5, 7 and 9 days by B and Q biotypes of. 【Result】Within the experimental period, the contents of soluble sugar and protein in cucumber increased after 3 d byB biotype, but decreased after 1 d byQ biotype, compared to those in controls. The contents of polyphenols and activity of PAL, the key enzyme in its biosynthesis pathway, increased after infested both by B and Q biotypes,with higher activities to Q biotype feeding. The activity of superoxide dismutase (SOD) and catalase (CAT) increased and the activity of peroxidase (POD) decreased after feeding by B biotype, while the activities of SOD increased and the activity of POD and CAT decreased after feeding byQ biotype. 【Conclusion】Differential changes of nutrients and defensive enzymes in cucumber after the feeding ofB and Q biotypes were found in the present study. Both B and Q biotypes ofwere able to induce the synthesis of defensive substance polyphenols, and increased the content of polyphenols in cucumber; but there were differences in inducing the contents of nutrients and the activities of protective enzymes, i.e., more nutrients in cucumber by B biotype feeding, while higher activities of defensive enzymes by Q biotype feeding. Those different changes in induced physiological and biochemical responses in plants to the herbivore may result from the difference in host plant adaptability between B and Q biotypes of.These results provide a basis for pest management strategies, especially for utilization of plant defense as the main control tactic, so as to target different biotypes ofon different host plants.
; B and Q biotypes; feeding induction; cucumber; nutrients; defensive substances; protective enzymes
2015-11-20;接受日期:2016-02-02
国家自然科学基金(31471776)
刘明杨,E-mail:yangmingliu730@163.com。通信作者闫凤鸣,Tel:0371-63558172;E-mail:fmyan@henau.edu.cn
