诱导型一氧化氮合酶和细胞凋亡在急性百草枯中毒大鼠肾损伤中的作用
2016-10-11赵艳霞李海霞李爱军陈惠敏崔卫正
王 鑫,赵艳霞,李海霞,李爱军,刘 爽,陈惠敏,崔卫正
(河北省邯郸市中心医院,河北 邯郸 056001)
诱导型一氧化氮合酶和细胞凋亡在急性百草枯中毒大鼠肾损伤中的作用
王鑫,赵艳霞,李海霞,李爱军,刘爽,陈惠敏,崔卫正
(河北省邯郸市中心医院,河北 邯郸 056001)

目的观察急性百草枯中毒大鼠肾组织中诱导型一氧化氮合酶(iNOS)的表达和细胞凋亡情况,探讨百草枯导致肾损伤发生的病理生理机制。方法将84只成年健康SD大鼠(雌雄各半)随机分为对照组、染毒组各42只,染毒组给予20%百草枯溶液25 mg/kg腹腔内一次性注射,对照组大鼠给予等量0.9%氯化钠溶液腹腔内注射。分别于注射1 d、3 d、7 d、14 d、21 d、28 d、35 d,每组各取6只,在乙醚麻醉下,留取肾组织标本,免疫组织化学法检测iNOS蛋白表达水平,原位末端标记法(TUNEL法)标记凋亡细胞,RT-PCR检测肾组织中iNOS mRNA表达情况。结果染毒组不同时点大鼠肾组织中iNOS 蛋白和iNOS mRNA表达量均明显高于对照组(P均<0.05),细胞凋亡率均明显高于对照组(P均<0.05)。结论急性百草枯中毒大鼠肾组织中iNOS含量和细胞凋亡率明显升高,它们可能参与了百草枯导致肾损伤的过程。
百草枯;iNOS;细胞凋亡;肾损伤
百草枯是一种高效、非选择性、接触性除草剂,目前在世界范围内广泛使用。百草枯除草效果好,但它对人畜具有很强毒性,每年因自服或误服引起的急性中毒时有发生。我国虽无百草枯中毒的正式统计资料,但根据诸多文献报道,百草枯中毒已成为最常见的农药中毒之一,在有些地区已成为继有机磷农药中毒之后排第二位、死亡绝对数占第一位的农药中毒类型[1]。由于百草枯中毒病死率高,也无特效解毒药物,因此已成为当前中毒治疗学研究的热点。肾脏是百草枯损伤的主要脏器,也是百草枯排泄的主要器官,所以肾功能的损伤程度与百草枯患者的预后密切相关[2]。然而,在急性百草枯中毒中,肾损伤的病理生理机制目前尚未完全阐明。本研究通过观察急性百草枯中毒大鼠模型的肾组织病理学改变及肾组织中诱导型一氧化氮合酶(iNOS)的表达和细胞凋亡情况,探讨了急性百草枯中毒导致肾损伤的病理生理机制,现将结果报道如下。
1 实验资料
1.1实验动物清洁级成年健康SD大鼠84只(雌雄不拘),体质量250~300 g,由河北医科大学实验动物中心提供,动物合格证号:SCXK(冀)2011-0004。
1.2实验试剂与仪器20%百草枯溶液(英国捷利康股份有限公司生产),SABC免疫组化染色试剂盒、兔抗鼠iNOS多克隆抗体、iNOS试剂盒购自南京建成生物工程研究所,RNA提取试剂Trizol Reagent购自Invitrogen公司。核糖核酸酶抑制剂、逆转录酶、Taq DNA聚合酶、dNTP、琼脂糖(agarose)和随机引物(Random primers)均购自美国Promega公司。原位末端标记(TUNEL)试剂盒由武汉博士德生物工程有限公司生产提供。离心机、-85 ℃超低温冰箱、电热恒温水箱等均由河北医科大学第二医院提供。
1.3动物分组及模型制备将84只SD大鼠随机分成对照组和染毒组各42只,染毒组一次性腹腔内注射百草枯25 mg/kg建立中毒模型,对照组腹腔内注射等量0.9%氯化钠溶液。
1.4取材及样品制备在第1,3,7,14,21,28,35天清晨,空腹状态下每组中各取出6只大鼠,行乙醚麻醉后开腹,使用预先灭酶的器械剪取肾组织,用4 ℃、0.1%DEPC水迅速洗去血液,液氮罐速冻,储存于-85 ℃超低温冰箱,行iNOS mRNA的检测。PBS缓冲液冲冼,10%甲醛固定,保存于4 ℃冰箱,常规石蜡包埋连续切片以备HE染色、免疫组化染色及TUNEL染色。
1.5免疫组化染色及TUNEL染色①按照SABC试剂盒说明进行免疫组化染色操作:取出大鼠肾组织,常规中性甲醛液固定、脱水,制成3 μm石蜡切片,高压修复抗原,3%H2O2室温孵育10 min,以消除内源性过氧化物酶的活性,滴加兔抗鼠iNOS一抗工作液,4 ℃ 孵育过夜,滴加适量生物素标记二抗工作液,37 ℃孵育30 min,二氨基联苯胺(DAB)显色剂显色10 min。从每组选取切片5张,每张切片随机选取10个完整并且不重叠的高倍视野,结果判定:以细胞核和/或细胞质出现棕黄色颗粒为阳性细胞,光学显微镜观察每张切片的阳性细胞并拍照,应用图像分析软件Image- Pro Plus(IPP)6.0处理,测定各个视野下的平均吸光度值,同时测定同一切片的平均吸光度值作为背景值,最后,前者减去后者,算出矫正后的平均吸光度值进行统计学处理。②TUNEL法标记:严格参照检测试剂盒说明书操作,在脱氧核苷酸末端转移酶的作用下,用生物素化的dUTP标记到DNA断裂后形成3'-OH末端,并将过氧化物酶连接至DNA断点,加入底物,通过3,3-DAB显色剂显色。结果判定:细胞质和/或细胞核出现棕黄色颗粒为阳性细胞,每张切片随机选取10个完整且不重叠的10×40倍显微镜视野,用MoticMed6.0图像分析系统进行处理,计算出平均阳性细胞的百分数。
1.6RT-PCR检测iNOS mRNA表达按照Invitrogen公司生产的RNA试剂盒说明书提取大鼠肾组织总RNA。RT-PCR试剂盒检测iNOS mRNA表达,磷酸甘油醛脱氢酶(GAPDH)作为内参。iNOS及内参GAPDH引物由上海生物工程技术服务有限公司按照基因库基因序列设计、合成。引物序列:iNOS上游链5’-CCT CAA GTC TTA TTT CCT CAA-3’,下游链5’-TCA GCA GCA AGT TCC ATC GTT-3’,扩增产物长度为185 bp;GAPDH上游链5’-TTC AAC GGC ACA GTC AAG-3’,下游链5’- CGA CAT ACT CAG CAC CAG-3’,扩增产物长度为125 bp。PCR循环过程:45 ℃ 15 min,94 ℃ 5 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,重复进行第3步至第5步,共计35个循环,然后72 ℃延伸5 min。取RT-PCR扩增产物10 μL,滴入缓冲液1 μL,在2%琼脂糖凝胶上进行电泳45 min,两端电压80 V,溴化乙啶染色。扩增产物电泳条带用UVP凝胶图像扫描系统进行密度扫描,记录并分析光密度值。实验重复3次。

2 结 果
2.12组大鼠肾组织病理学表现对照组:光镜下观察可见肾小球、肾小管、肾间质及血管周围无充血及增宽,无炎细胞浸润。染毒组:大体标本观察可见肾体积增大,色呈暗红,表面有点片状出血点和/或淤斑,切面皮髓质有明显的分界;光镜下见肾小球内红细胞增多,肾间质有不同程度的充血、水肿、空泡变性,伴有小灶状和/或大片状炎细胞浸润。染毒1 d,肾小管近曲上皮细胞呈现充血水肿、空泡变性、管腔变窄,部分上皮细胞坏死、脱落,随着时间延长上述现象逐渐加重;染毒7 d,上皮细胞重度水肿、空泡变性,胞浆脱失,核溶解、破裂,大量上皮细胞可见坏死、脱落堵塞管腔,见图1;染毒28 d以后肾小管上皮细胞可见水肿明显好转,管腔坏死物逐渐减少、消失,堵塞减轻,见图2。
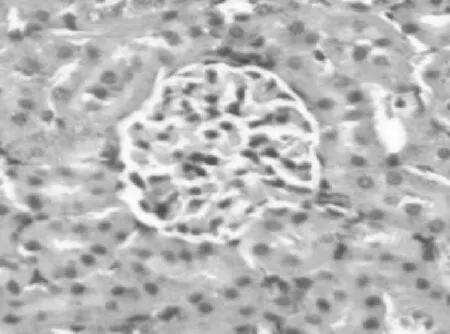
图1 染毒组7 d肾组织病理表现(HE,×400)
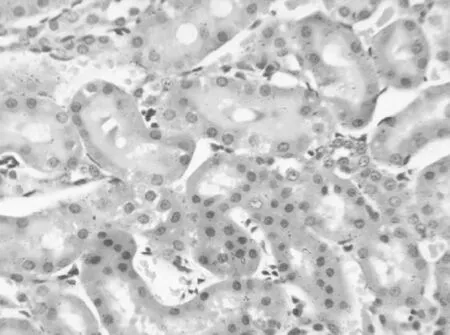
图2 染毒组28 d肾组织病理表现(HE,×400)
2.22组大鼠肾组织中iNOS蛋白表达情况对照组大鼠肾组织中iNOS多不表达,有少数在近曲肾小管上皮细胞、皮质部肾小球内皮细胞呈弱表达。染毒组染毒1 d在近曲肾小管上皮细胞、皮质部肾小球内皮细胞呈阳性表达,随着时间的延长,表达显著增强,染毒3 d iNOS蛋白表达量显著升高,7 d达高峰,此后逐渐下降,但仍维持在较高水平。染毒组不同时点肾组织中iNOS 蛋白表达量均明显高于对照组(P均<0.05)。见表1。

表1 2组不同时点大鼠肾组织中iNOS蛋白表达情况±s)
注:①与对照组比较,P<0.05。
2.32组大鼠肾组织中细胞凋亡情况染毒组染毒1 d在肾小管可观察到标记阳性的凋亡细胞,染毒7 d显著增加(见图3),染毒21 d达到高峰(见图4),染毒28 d明显下降,但各时间点细胞凋亡率均明显高于对照组(P均<0.05),见表2。
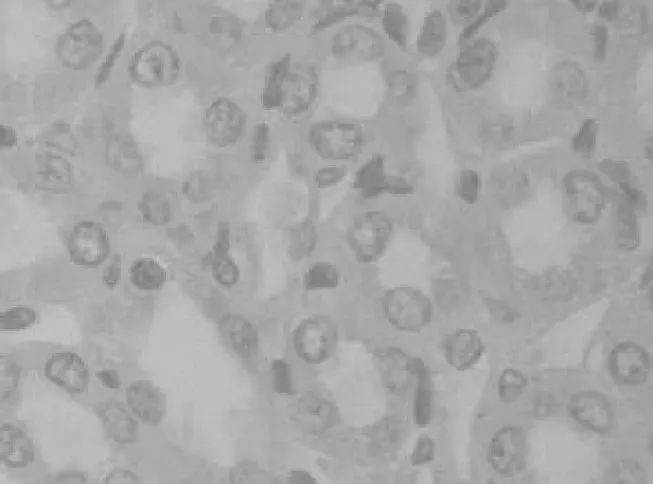
图3 染毒组7 d肾组织细胞凋亡情况(TUNEL,×400)
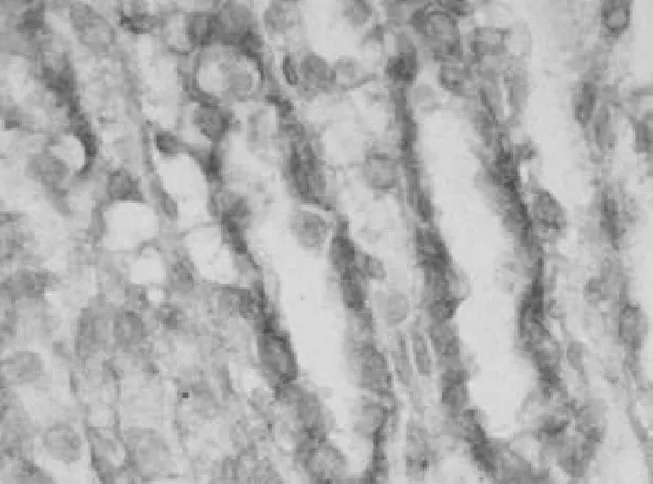
图4 染毒组21 d肾组织细胞凋亡情况(TUNEL,×400)
2.42组大鼠肾组织中iNOS mRNA表达情况对照组大鼠肾组织中iNOS mRNA多不表达,少数在皮质部肾小球内皮细胞呈弱表达。染毒组染毒1 d在近曲肾小管上皮细胞、皮质部肾小球内皮细胞呈阳性表达,伴随着时间的延长,表达逐渐增强,染毒3 d iNOS mRNA就达高峰,以后逐渐下降,但仍然维持较高水平。染毒组不同时点肾组织中iNOS mRNA表达量均明显高于对照组(P均<0.05)。见表3。

表2 2组不同时点大鼠肾组织中细胞凋亡情况±s,%)
注:①与对照组比较,P<0.05。
3 讨 论
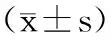
表3 2组不同时点大鼠肾组织中iNOS mRNA表达情况
注:①与对照组比较,P<0.05。
百草枯又名对草快、克芜踪,绿色无味、易溶于水,在酸性环境下较稳定,遇碱易分解。百草枯中毒可以导致多脏器功能损伤,其中肾功能受损程度是决定患者预后的关键因素[3]。近年的文献报道,百草枯中毒肾损伤主要表现为近曲小管上皮细胞水肿、变性、坏死、脱落,管腔变窄,甚至堵塞,肾小球内红细胞增多,肾间质伴有小灶状和/或大片状炎细胞浸润[4],与本实验观察到的病理变化一致。目前研究认为,百草枯引起的肾损伤与其吡啶阳离子还原和再氧化过程中生成的大量氧自由基有关。大量氧自由基的形成可以使细胞遭受氧化损伤,组织内炎症因子、黏附分子和生长因子聚集,从而出现应激、炎症和免疫反应及细胞凋亡。
Christmann等[5]采用TUNEL法检测急性百草枯中毒大鼠肾组织细胞凋亡情况,结果显示,中毒组肾组织细胞凋亡显著多于对照组,在中毒20 d后,细胞凋亡更为显著。本实验也采用TUNEL法检测大鼠肾组织细胞凋亡率,结果显示,染毒组各时间段肾组织细胞凋亡数明显多于对照组。可见,急性百草枯中毒导致肾损伤的机制之一即细胞凋亡。然而,百草枯导致肾组织细胞凋亡的分子机制目前仍不清楚。
NO是一种气体自由基, 由一氧化氮合酶 (NOS)催化氧分子与L- 精氨酸经多步氧化还原反应生成,主要发挥第二信使作用,调节细胞内信号传导、免疫反应、抑制血小板凝聚和血压生理调控等功能。大量的NO(纳摩尔级)可以调节免疫系统的细胞生长和细胞毒作用,大量NO也可直接引起细胞毒性作用, 与过氧化物一起导致过氧化,从而引起细胞损伤[6]。由于 NO半衰期短,性质活泼,因此众多关于 NO的研究都集中在 NOS的研究上。现已知NOS有3种亚型,即内皮型、神经元型和诱导型,前两种主要分布在内皮组织和神经系统,负责基础的一氧化氮合成,以调节机体各种生理功能。当机体受到过氧化、炎症等刺激时,细胞内的iNOS大量合成,呈现高表达状态,大量的iNOS可催化NO的大量合成,非生理浓度的NO可以通过其细胞毒作用,使细胞产生一系列病理生理改变,如细胞能量代谢障碍、氧化损伤及DNA断裂等,最终引起细胞不同程度的损伤,发生炎症反应及细胞凋亡[7]。有研究证实,在百草枯中毒所致大鼠肺细胞脂质过氧化及炎症反应的过程中,iNOS可能是主要的启动因子,并参与中毒肺组织的损伤过程[8]。Chen等[9]通过建立百草枯中毒大鼠模型,应用免疫组化法检测大鼠肺细胞iNOS蛋白表达情况,结果显示,中毒组iNOS蛋白表达显著增高。Liu等[10]应用RT-PCR方法检测到百草枯染毒后大鼠肾组织中iNOS mRNA高表达。本实验采用免疫组化和RT-PCR法检测大鼠肾组织中iNOS蛋白和mRNA的表达,结果显示,各时间段染毒组iNOS蛋白表达和iNOS mRNA表达均显著高于对照组。可见,肾组织中iNOS高表达可能是急性百草枯中毒导致肾损伤的分子机制之一。此外,可能还存在其他机制参与百草枯中毒所致肾损伤,如c-fos、c-jun蛋白的过度表达以及氧化应激中JNK信号转导通路的激活等。然而,目前的研究仍不十分明确。
综上所述,百草枯可能通过诱导iNOS mRNA及其蛋白的高表达,从而导致肾组织细胞的凋亡,iNOS的参与可能是百草枯致肾组织损伤的重要机制之一。然而,百草枯中毒致肾组织中iNOS的高表达与其他分子机制之间的关系还有待进一步研究探讨。
[1]中国医师协会急诊医师分会. 急性百草枯中毒诊治专家共识(2013)[J]. 中国急救医学,2013,33(6):484-489
[2]张伟,张剑锋,李浩,等. 甘草酸二铵对百草枯中毒大鼠肾组织TOLL样受体4表达的影响[J]. 中华急诊医学杂志,2015,21(11):1214-1219
[3]李静,李勇,田建元,等. 急性百草枯中毒患者的肾功能指标变化及其临床意义[J]. 中国社区医师,2104,14(40):69-72
[4]郑丹,吴斌,卢中秋,等. 急性百草枯中毒肾损伤机制及治疗进展[J]. 医学研究杂志,2015,44(4):167-169
[5]Christmann RB,Sampaio-Barros P,Stifano G,et al. Association of interferon and transforming growth factor β-fegulated genes and macrophage activation with systemic sclerosis-related progressive kidney fibrosis[J]. Arthritis Rheumatol,2014,66(3):714-725
[6]王克胜,王晓雷,金延武,等. 缺氧诱导因子-1α-诱导型一氧化氮合酶-一氧化氮信号通路在肺缺血再灌注损伤中的作用[J]. 中华实验外科杂志,2015,32(8):1798-1801
[7]马轶杰,崔薇,李建华,等. 热应激预处理对创伤性休克大鼠早期脑组织中一氧化氮、诱导型一氧化氮合酶的表达与脑损伤的影响[J]. 中国现代医学杂志,2015,25(27):14-17
[8]李瑞,刘江伟,钱建辉,等. 沙漠干热环境创伤失血性休克大鼠继发性肺损伤时一氧化氮合酶等变化研究[J]. 中华医学急诊杂志,2015,24(2):163-167
[9]Chen T,Nie H,Gao X,et al. Epithelial-mesenchymal transition involved in pulmonary fibrosis induced by multi-walled carbon nanotubes via TGF-beta/Smad signaling pathway[J]. Toxicol Lett,2014,226(2):150-162
[10]Liu XW,Ma T,Qu B,et al. Prognostic value of initial arterial lactate level and lactate metabolic clearance rate in patients with acute paraquat poisoning[J]. Am J Emerg Med,2013,31(8):1230-1235
Effect of iNOS and cell apoptosis on renal injury in rats with acute paraquat poisoning
WANG Xin, ZHAO Yanxia, LI Haixia, LI Aijun, LIU Shuang, CHEN Huimin, CUI Weizheng
(Handan Central Hospital, Handan 056001, Hebei, China)
Objective It is to observe the expression of inducible nitric oxide synthase (iNOS) and cell apoptosis in renal tissue in acute paraquat-intoxication rats, thus to explore the pathological and physiological mechanism of renal injury induced by paraquat. Methods Eighty-four healthy adult Sprague-Dawley rats (42 male, 42 female) were randomly divided into two groups:control group and poisoned group, each group had 42 rats. The poisoned group was given 20% paraquat liquid 25 mg/kg once by intraperitoneal injection, while the control group was given the same dosage of normal saline by intraperitoneal injection. On 1st、3rd、7th、14th、21st、28th、and 35th day,six rats in each group were used to get their renal tissue to detect the levels of iNOS by immunohistochemistry, mark the apoptosis cells by TUNEL method, detect the expression of iNOS mRNA in renal tissue by RT-PCR method. Results Compared with control group, the levels of iNOS mRNA and protein in poisoned group were significantly higher while the apoptosis rate was significantly lower than that at every time point (P<0.05). Conclusion The levels of inducible nitric oxide synthase (iNOS) and cell apoptosis in kidney of acute paraquat-induced rats were significantly increased. They could participate in the mechanism leading to renal damage.
paraquat; iNOS; cell apoptosis; renal injury
王鑫,男,硕士,副主任医师,研究方向为急诊医学。
10.3969/j.issn.1008-8849.2016.25.004
R-332
A
1008-8849(2016)25-2747-04
2016-03-20
