不同铁稳态水平下马铃薯幼苗碳水化合物分配特征和根形态建成
2016-09-26王玉萍张绍梅王瑞新
王玉萍,张绍梅,王瑞新
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070;2.甘肃农业大学园艺学院,甘肃 兰州 730070)
不同铁稳态水平下马铃薯幼苗碳水化合物分配特征和根形态建成
王玉萍1,2,张绍梅1,2,王瑞新2
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州730070;2.甘肃农业大学园艺学院,甘肃 兰州730070)
【目的】 为了探究铁(Fe)缺乏下马铃薯碳水化合物分配特征和根形态建成.【方法】 以马铃薯栽培品种‘大西洋’试管苗为材料,在5个Fe水平(0、10、20、40、124 μmol/L)的液体MS培养基上培养,17 d后测定叶绿素、花青素、葡萄糖、果糖、蔗糖、淀粉等以及总根的长度、平均直径、表面积和体积,并用ICP-OES分析幼苗茎叶中各元素的含量.【结果】 与对照(124 μmol/L)相比,无Fe时,叶绿素显著降低(62%),花青素显著增加(130%);葡萄糖、果糖在茎、叶和根中均显著高于对照,蔗糖在茎、叶中显著降低13%,根中显著增加31%,茎、叶中淀粉显著增加13倍,根中显著降低67%;总根的长度、表面积和体积在Fe缺乏下均降低(20 μmol/L Fe处理下均高于对照除外),平均直径在无Fe时显著增加26%;此外,Fe缺乏促进Mn、Zn含量增加.【结论】 缺Fe影响碳水化合物代谢和根系建成,单糖在根中积累而多糖在茎、叶中积累,总根长度减少而平均直径增加,同时,Mn、Zn含量的增加有助于缓解幼苗铁缺乏.
铁缺乏;碳水化合物;根系形态;必需元素;马铃薯幼苗
铁是植物生长发育所必需的元素之一.在植物体内,铁是一些重要的氧化还原酶催化部分的组分,存在于血红蛋白的电子转移键上,作为重要的电子传递体或催化剂.然而,在碱性和石灰性土壤中,植物对铁的吸收通常比较困难,主要是由于其土壤pH值较高,铁容易形成三价铁氧化物、氢氧化物等沉淀而降低了铁在土壤中的移动性[1-3].在这样的土壤环境中,植物可以吸收利用的铁有限,以致植物易发生铁缺乏症而影响生长和发育,在作物中主要表现为影响产量与品质[4].为了应对缺铁胁迫,植物在长期进化中演变出生理上的适应机制和根系形态可塑性来增加根际内有效铁的吸收和利用.植物在缺铁胁迫下主要有2种生理适应机制:机理I,以还原系统为基础的双子叶和非禾本科的单子叶植物;机理II,以螯合作用为基础的禾本科植物[5-8].研究表明,缺铁胁迫时马铃薯主要通过机理I来实现缺铁适应机制的建立,在根细胞的原生质膜上分泌H+(H+-ATPase)、Fe3+螯合还原酶(Fe (Ⅲ)-Chelates Reducates,FCR;如有机酸、氨基酸、铁载体)和诱导Fe2+转运蛋白基因的表达(IRT1、FRO2、FER/FRU、FIT1)[9],并在根际生成螯合态的铁,提高铁的溶解、还原和吸收.此外,在缺铁胁迫下,植物通过增加根毛的长度和密度等根表型的可塑性来提高铁的吸收和利用[10].
铁的稳态对高等植物的光合作用、碳水化合物的积累与分配和根系发育起着决定性的作用.叶绿素是植物光合作用的主要参与者,叶绿素在缺铁条件下,镁原卟啉IX和镁原卟啉单甲酯IX就会大量积累,不能合成叶绿素而致光合作用受阻,失绿症则是植物缺铁的典型可见的形态指征[11].在缺铁胁迫下,糖酵解代谢参与营养失调的响应,磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvatecarboxylase,PEPC)活性增加并参与FCR、H+-ATPase和有机酸的生物合成.对于以机理I适应缺铁胁迫的植物来说,Fe3+的还原和H+的外排等都依赖于NADPH和ATP提供能量[12].因此,植物对铁缺乏耐受性与其对碳水化合物代谢调节密切相关.当植物受到缺铁胁迫时,根系将发生一系列变化过程,从土壤中获得可利用的铁,根毛形成会增加、主根会生长并形成侧根,主根和侧根的增加会增加根的吸收面积,从而适应铁缺乏的环境[13].当前缺铁胁迫的研究主要集中铁的稳态,这些研究主要从生物量的积累,茎和根的长度、面积,叶片的数目,相对生长率等缺铁特征开展研究[14],而从缺铁条件下碳水化合物的积累到根系形态建成方面去研究的还未见报道.本研究从缺铁下碳水化合物的积累和根系形态建成,并结合元素的吸收和变化规律进行分析,以期探究马铃薯幼苗在铁缺乏下的碳水化合物积累和根系形态变化规律.
1 材料与方法
1.1试验材料
选用马铃薯(SolanumtuberosumL.)栽培品种‘大西洋’试管苗为供试材料,由甘肃省作物遗传改良与种质创新重点实验室提供.
1.2试验方法
1.2.1培养基及培养条件以MS 培养基[15]为基础培养基,进行液体培养.正常MS培养基中的铁含量(124 μmol/L)为对照,设置4个浓度梯度(培养基配方如表1),试验进行3次重复.试验所用药品均为优级纯(Sinopharm Chemical Reagent Co.L td).组培室的条件为光照时间16/8 h,光照强度2 000 lx,室内温度(23±2)℃.
1.2.2指标测定植株培养14 d时,进行表型分析(Canon EOS 5D Mark II),17 d后进行叶绿素、花青素、碳水化合物及P、K、Ca、Mg、S、Fe、Mn、Zn、Cu、Mo、B、Al和Na元素含量的测定,并对根系WK9,WK9*2,WK28形态进行扫描.

表1 缺铁处理MS培养基组成Tab.1 The composition of the modified MS medium under Fe deficiency
1.2.2.1缺铁下植株糖类、叶绿素和花青素含量测定葡萄糖和果糖含量的测定参照Yoshida等的方法[16],蔗糖含量的测定参照Yoshida等的方法[16],还原糖和可溶性糖含量的测定参照Sharma等的方法,淀粉含量测定参照Bustos等的方法[17],叶绿素含量的测定参照Wang等的方法[18],花青素的提取参照Rabino等的方法[19].
1.2.2.2缺铁下根系形态分析挑选典型性的马铃薯试管苗,剪下不同处理下单株幼苗的根系,清洗干净后,用扫描分析仪(EPSON EXPRESSION 10000XL Scanner),对根系进行扫描,并用WinRHZIO Regular Software定量分析总根长、总根平均直径、总根表面积和总根体积.
1.2.2.3缺铁下各元素含量分析马铃薯幼苗去除根后,先用蒸馏水清洗3遍,再以超纯水(UP,18.25 MΩ·cm;RO,2.3 μS/cm)清洗3遍以避免幼苗上及蒸馏水中元素的污染.然后,烘干(60 ℃,48 h),用玻璃研钵将干净的马铃薯材料均匀研碎,称质量(0.3~0.5 g),随后在微波消解炉(Ultraclave 4;MLS)中用酸(8 mL KNO3)消解,进而在电感耦合等离子体发散光谱仪(ICP-OES)下测定P、K、Ca、Mg、S、Fe、Mn、Zn、Cu、Mo、B、Al、Na元素的含量.
1.3数据处理

2 结果与分析
2.1缺铁条件下植株碳水化合物含量的变化
对马铃薯幼苗在0,10,20,40,124 μmol/L Fe条件下的叶绿素、花青素和碳水化合物进行分析.缺铁导致茎、叶中叶绿素含量显著降低,在0 μmol/L Fe处理下降低了62%(图1),花青素含量在0和10 μmol/L Fe下分别增加了130%和83%(图2),与对照差异显著.与对照相比,在40 μmol/L Fe处理下,茎中葡萄糖(Glu)含量显著降低了54%,而根中的Glu含量却显著升高了92%;在完全缺Fe条件下,茎叶和根均显著增加,分别达34%和120%(图3-A).与对照相比,茎中果糖(Fru)在40,20 μmol/L Fe浓度时变化不显著,根趋于减少,但随Fe缺乏的加剧,茎和根中果糖含量在分别显著增加了200%和130%(0 μmol/L Fe,图3-B).与充足铁水平相比,在20 μmol/L Fe处理下,幼苗茎中蔗糖(Suc)含量显著升高(5%),而在其他浓度铁缺乏下均降低;幼苗根中蔗糖质量体积分数在10、20、40 μmol/L Fe处理下均显著减少,而在完全缺Fe条件下显著增加了31% (图3-C).与对照相比,茎中的淀粉质量体积分数在0 μmol/L Fe处理时增加约13倍,而根的淀粉含量却降低了67%(图3-D).缺铁胁迫下幼苗中还原糖含量与Glu含量变化趋势相同(图3-E),幼苗中可溶性糖含量变化趋势与Fru相似(图3-F).

图1 茎、叶中叶绿素含量Fig.1 Chlorophyll content in shoots

图2 茎、叶中花青素含量Fig.2 Anthocyanin content in shoots

A.葡萄糖含量;B.果糖含量;C.蔗糖含量;D.淀粉含量;E.还原糖含量;F.可溶性糖含量;误差为±s(n=6). 图3 铁缺乏下幼苗碳水化合物含量Fig.3 Carbohydrates content of seedings under Fe deficiency
2.2缺铁条件下根系形态的变化
铁缺乏条件下,马铃薯幼苗叶片出现黄化,叶片颜色明显变红、变紫,茎高度降低(图4).在0、10、40 μmol/L Fe条件下,总根长分别较对照减少46%,20%和70%,但在20 μmol/L Fe处理时,根总长却显著增加了19% (图5-A).同时,总根平均直径也增加并在0 μmol/L Fe处理时显著增加了26%(图5-B),总根的表面积和体积在完全缺Fe下显著减少了64%和54%(图5-C-D).
2.3缺铁条件下各元素含量的变化
利用ICP-OES对大量元素(P、K、Ca、Mg、S和Na)和微量元素(Fe、Mn、Zn、Cu、Mo、B和Al)进行测定.结果表明,不同铁缺乏条件下(0、10、20、40 μmol/L Fe),17 d后幼苗茎、叶中铁含量分别为15、34、41、37 μg/g,而对照为89 μg/g(表2).

图4 铁缺乏下幼苗植株表型Fig.4 The morphology of seeding under Fe deficiency

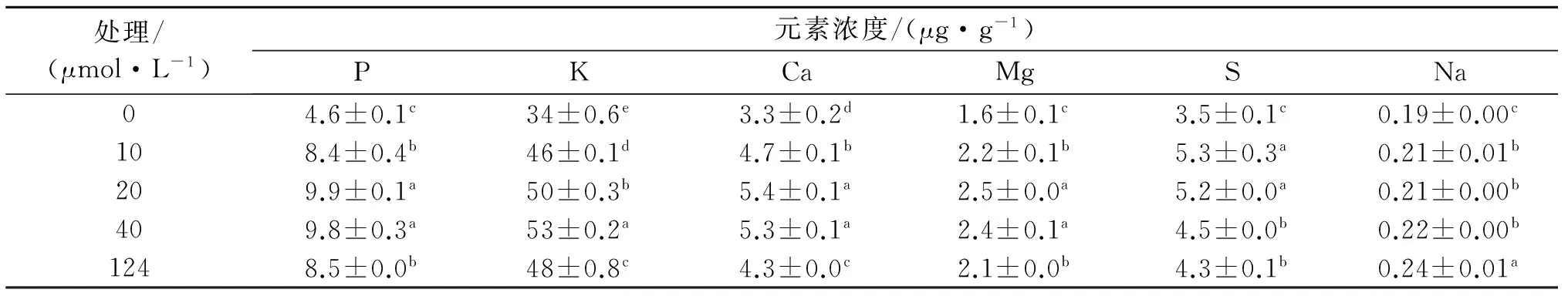
A:总根长度;B:总根平均直径;C:总根表面积;D:总根体积.误差为±s(n=6). 图5 铁缺乏下幼苗根系形态Fig.5 The root system morphology of seeding under Fe deficiency表2 铁缺乏对大量元素和钠的影响Tab.2 The effect of Fe deficiency on major element and Na element
处理/(μmol·L-1)元素浓度/(μg·g-1)PKCaMgSNa04.6±0.1c34±0.6e3.3±0.2d1.6±0.1c3.5±0.1c0.19±0.00c108.4±0.4b46±0.1d4.7±0.1b2.2±0.1b5.3±0.3a0.21±0.01b209.9±0.1a50±0.3b5.4±0.1a2.5±0.0a5.2±0.0a0.21±0.00b409.8±0.3a53±0.2a5.3±0.1a2.4±0.1a4.5±0.0b0.22±0.00b1248.5±0.0b48±0.8c4.3±0.0c2.1±0.0b4.3±0.1b0.24±0.01a

表3 铁缺乏对微量元素和铝的影响Tab.3 The effect of Fe deficiency on minor element and Al element
表2表明,P、Ca、Mg含量均在20 μmol/L Fe处理下达到最高,分别增加26%、19%和16%,与对照差异显著.和对照相比,K含量在40 μmol/L Fe处理时显著增加10%,0 μmol/L Fe处理时降低26%,S含量在10 μmol/L Fe处理时显著增加23%,完全缺Fe时降低19%.此外,Na含量在Fe缺乏下逐渐降低,在0 μmol/L Fe处理时降低21%.
表3表明,缺Fe胁迫下Mn、Zn含量增加.Mn在10、20、40 μmol/L Fe 处理下分别增加了39%、61%、47%,Zn含量在0、10、20 μmol/L Fe 处理下分别增加11、11%、10%,均与对照差异显著.Al含量在0 μmol/L Fe处理下较对照增加了33%.
3 讨论与结论
铁作为植物生长和发育的必需元素之一,在植物的光合作用、呼吸作用、羟基化作用、物质和能量的代谢中承担重要功能[20].铁胁迫下,叶绿体形态结构异常,叶绿素含量减少,光合速率降低,呼吸强度减弱,使植物产量和产品品质下降[21].本研究表明,缺铁胁迫下马铃薯幼苗叶片叶绿素含量逐渐降低而花青素显著积累,表观形态表现为叶片黄化且略带有紫红色.缺铁胁迫还影响碳水化合物的含量及其在茎、叶和根中的分配.糖类等碳水化合物作为光合作用的产物,对外界环境的变化及其敏感,植物通过感受外界信号导致适当基因的表达并调控糖类在根和茎中的分配[22].单糖是光合作用合成的初级产物,铁缺乏下单糖最敏感,缺铁造成的糖信号的传递也是由单糖完成的,铁缺乏下葡萄糖和果糖含量的增加导致单糖信号向根部位传递,这种信号传递将缺铁的胁迫信号转变成根部皮层细胞诱导根毛的形成,这种根毛形成的原因被认为与糖类出液泡的转运蛋白基因有关[22].蔗糖,兼有代谢物和信号分子的双重作用,它对铁缺乏的响应是只在根中显著积累,说明马铃薯幼苗的根对缺铁胁迫的敏感性比茎、叶高,这种差异的主要原因是由于铁吸收和运输过程中组织浓度差异造成的,这种浓度差异既是根形态初期形成的原因,也是叶片中铁缺乏造成叶绿素合成障碍,光合效率下降和碳水化合物合成和运输障碍造成的结果.另外,多糖大量地在马铃薯幼苗的茎、叶中积累,根中的淀粉却逐步减少,说明铁缺乏还会影响淀粉的降解,多糖的下降可能是应对缺铁胁迫的反应,也是单糖含量增加的主要原因.铁缺乏和铁过量的界定在不同的植物中有不同的界定范围,在正常MS培养基的铁充足(124 μmol/L)供给条件下和40 μmol/L Fe处理时幼苗的总根长度、表面积和体积均低于20 μmol/L Fe处理水平,这种结果的原因可能是植物根系对40 μmol/L Fe缺乏不敏感,而在20 μmol/L Fe缺乏下由于锰、锌的显著增加而提高根系的总生物量造成的[23].
马铃薯幼苗受到铁缺乏(≤40 μmol/L Fe),轻度铁缺乏(≤20 μmol/L Fe)和重度缺乏时,植株各部位铁含量均呈下降趋势.硫含量在铁缺乏时(0、10、20 μmol/L Fe)均较对照高,通常硫和铁在植物体内能够共同形成的Fe-S簇,包括[2Fe-2S]、[2Fe-2S]等,是许多蛋白的辅助因子,参与光合作用,呼吸作用,硫代谢和氮代谢,植物激素和辅酶的合成[24].研究认为,在铁缺乏时,硫的增加有助于辅因子铁硫簇的形成及功能的执行.另一方面,硫含量增加可以调控乙烯的合成[24],乙烯信号调控表皮细胞的分化,最终形成根毛有助于提高植物对铁的吸收[25-27].铁缺乏时幼苗茎、叶的锰、锌含量显著增加,这与锰、锌元素可以替代铁元素的部分生理功能有关,或者植物细胞膜上的铁转运蛋白IRT1、FRO2能够运输锰、锌元素,因为这些转运蛋白本身对于铁、锰和锌元素就没有特异性的选择能力,从而导致植株在缺铁胁迫时锰、锌含量的增加[28-29].
总之,铁缺乏阻碍马铃薯试管苗叶绿素的合成,并导致淀粉在茎叶中大量积累,幼苗根中的可溶性糖含量增加和总根的吸收面积和体积的增加是应对缺铁胁迫的响应机制,锰和锌含量在缺铁胁迫下增加能够缓解马铃薯植株的铁供应不足.
[1]Bashir K,Nagasaka S,Itai R,et al.Expression and enzyme activity of glutathione reductase is upregulated by Fe-deficiency in graminaceous plants[J].Plant Molecular Biology,2007,65(3):277-284
[2]Schenkeveld W C,Reichwein A,Temminghoff E M,et al.Considerations on the shuttle mechanism of FeEDDHA chelates at the soil-root interface in case of Fe deficiency[J].Plant and Soil,2014,379(1-2):373-387
[3]Lindsay W L and Schwab A P.The chemistry of iron in soils and its availability to plants[J].Journal of Plant Nutrition,1982,5(4-7):821-840
[4]Briat J F,Dubos C,Gaymard F.Iron nutrition,biomass production,and plant product quality[J].Trends in Plant Science,2015,20(1):33-40
[5]Abadía J,López-Millán A F,Rombolà A,et al.Organic acids and Fe deficiency:a review[J].Plant and Soil,2002,241(1):75-86
[6]Takahashi M.Overcoming Fe deficiency by a transgenic approach in rice[J].The Plant Cell,Tissue and Organ Culture,2003,72(3):211-220
[7]Molassiotis A N,Diamantidis G C,Therios I N,et al.Oxidative stress,antioxidant activity and Fe(III)-chelate reductase activity of fivePrunusrootstocksexplants in response to Fe deficiency[J].Plant Growth Regulation,2005,46(1):69-78
[8]Vigani G.Discovering the role of mitochondria in the iron deficiency-induced metabolic responses of plants[J].Journal of Plant Physiology,2012,169(1):1-11
[9]Eide D,Broderius M,Fett J,et al.A novel iron-regulated metal transporter from plants identified by functional expression in yeast[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(11):5624-5628
[10]Bates T R and Lynch J P.Stimulation of root hair elongation inArabidopsisthalianaby low phosphorus availability[J].Plant,Cell and Environment,1996,19(5):529-538
[11]Ma Z,Bielenberg D G,Brown K M,et al.Regulation of root hair density by phosphorus availability inArabidopsisthaliana[J].Plant,Cell and Environment,2001,24(4):459-467
[12]M'sehli W,Dell'Orto M,Donnini S,et al.Variability of metabolic responses and antioxidant defence in two lines ofMedicagociliaristo Fe deficiency[J].Plant and Soil,2009,320(1-2):219-230
[13]Schmidt W,Schikora A,Pich A,et al.Hormones induce an Fe-deficiency-like root epidermal cell pattern in the Fe-inefficient tomato mutantfer[J].Protoplasma,2000,213(1-2):67-73
[14]Vigani G,Zocchi G,Bashir K,et al.Signals from chloroplasts and mitochondria for iron homeostasis regulation[J].Trends in Plant Science,18(6):305-311
[15]Murashige T and Skoog F.A revised medium for rapid growth and bio assays with tobacco tissue cultures[J].Physiologia Plantarum,1962,15(3):473-497
[16]Yoshida M,Ono H,Chuda Y,et al.Acrylamide in japanese processed foods and factors affecting acrylamide level in potato chips and tea[J].Advances in Experimental Medicine and Biology,2005,561(5):405-413
[17]Bustos R,Fahy B,Hylton C M,et al.Starch granule initiation is controlled by a heteromultimeric isoamylase in potato tubers[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(7):2215-2220
[18]Wang L,Yue C,Cao H,et al.Biochemical and transcriptome analyses of a novel chlorophyll-deficient chlorina tea plant cultivar[J].Bio Med Central Plant Biology,2014,14(12):352
[19]Rabino I and Mancinelli A L.Light,temperature,and anthocyanin production[J].Journal of Experimental Botany,1986,147(11):1291-1298
[20]Vert G,Grotz N,Dédaldéchamp F,et al.IRT1,an Arabidopsis transporter essential for iron uptake from the soil and for plant growth[J].The Plant Cell 2002,14(6):1223-1233
[21]Whatley J M.Ultrastructural changes in chloroplasts of phaseolus vulgaris during development under conditions of nutrient deficiency[J].New Phytologist,1971,70(4):725-742
[22]Guo W J,Nagy R,Chen H Y,et al.SWEET17,a facilitative transporter,mediates fructose transport across the tonoplast ofArabidopsisroots and leaves[J].Plant Physiology,2014,164(2):777-803
[23]冯致,郁继华,颉建明,等.锌对青花菜幼苗生长的影响[J].甘肃农业大学学报,2005,40(4):471-474
[24]Muneer S,Lee B,Bae D,et al.Changes in expression of proteins involved in alleviation of Fe-deficiency by sulfur nutrition inBrassicanapusL[J].Acta Physiologiae Plantrum,2013,35(10):3037-3045
[25]López-Bucio J,Cruz-Ramírez A,Herrera-Estrella L,et al.The role of nutrient availability in regulating root architecture[J].Current Opinion in Plant Biology,2003,6(3):280-287
[26]Andriunas F A,Zhang H M,Weber H,et al.Glucose and ethylene signalling pathways converge to regulate trans-differentiation of epidermal transfer cells inVicianarbonensiscotyledons[J].The Plant Journal,2011,68(6):987-998
[27]刘英,裴瑞芳,王洁,等.马铃薯ACS基因克隆及生物信息学分析[J].甘肃农业大学学报,2015,50(1):37-41
[28]Gruber B D,Giehl R F,Friedel S,et al.Plasticity of theArabidopsisroot system under nutrient deficiencies[J].Plant Physiology,2013,163(1):161-179
[29]Muneer S,Jeong B,Kim T H,et al.Transcriptional and physiological changes in relation to Fe uptake under conditions of Fe-deficiency and Cd-toxicity in roots ofVignaradiataL[J].Journal of Plant Research,2014,127(6):731-742
(责任编辑李辛)
Distribution of carbohydrates and root morphogenesis of potato seedlingsinvitrounder Fe deficiency
WANG Yu-ping1,2,ZHANG Shao-me1,2,WANG Rui-xin2
(1.Gansu Key Laboratory of Crop Genetic & Germplasm Enhancement,Lanzhou 730070,China;2.College of Horticulture,Gansu Agricultural University,Lanzhou 730070,China)
【Objective】 The physiological response mechanism and root growth pattern of potato seedling under iron (Fe) deficiency were investigated.【Method】 Potato cultivars ‘Atlantic’ seedlings were cultured on liquid MS medium at five levels (0,10,20,40,124 μmol/L) of Fe treatments,after culturing 17 d,the following indexes were determined including the content of chlorophyll,anthocyanin,glucose,fructose,sucrose,starch,reducing sugar and soluble sugar,total root length,average root diameter,root surface area and root volume.The content of P,K,Ca,Mg,S,Fe,Mn,Zn,Cu,Mo,B,Al and Na in shoots was analyzed by ICP-OES.【Result】 Compared with CK(with 124 μmol/L Fe),under the condition without Fe,the chlorophyll content,sucrose content in shoots and leaves,starch content in roots,total root length,root surface area,root volume of seedlingsinvitrodecreased significantly by 62%,13%,67%,70%,64% and 54%,respectively.With the decreasing of Fe deficiency,the content of glucose,fructose,sucrose in roots,and starch content in shoots,and average root diameter increased by 120%,130%,31%,13 times and 26%,respectively.Fe deficiency improved the increase of Mn and Zn content.【Conclusion】 Fe deficiency influenced the carbohydrate metabolism and root morphogenesis so that monosaccharide accumulated in roots and polysaccharide accumulated in shoots and leaves,total root length decreased and average diameter increased.Meanwhile the increase of Mn and Zn of seedlings was also an adaptive response to Fe deficiency.
Fe deficiency;carbohydrates;root morphology;essential elements;potato seedlings
王玉萍(1974-),女,博士,副教授,主要从事植物逆境生理研究.E-mail:wangyp@gsau.edu.cn
甘肃省农业厅生物技术专项(GNSW-2008-07);甘肃省基础研究创新群体(1308RJIA005);国家国际科技合作专项(2014DFG31570);甘肃省高校基本科研业务费;甘肃省自然科学基金项目(1506RJZA013);国家自然科学基金项目(31260094).
2015-03-30;
2015-05-05
S 532
A
1003-4315(2016)04-0070-08
