羽衣甘蓝抗寒生理特性研究
2016-09-23张亚玲幸宏伟王桂香
张亚玲,幸宏伟,郭 宁,韩 硕,宗 梅,刘 凡,王桂香
(1.重庆工商大学 环境与资源学院,重庆 400067;2.北京市农林科学院 蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,北京 100097)
羽衣甘蓝抗寒生理特性研究
张亚玲1,2,幸宏伟1,郭宁2,韩硕2,宗梅2,刘凡2,王桂香2
(1.重庆工商大学 环境与资源学院,重庆400067;2.北京市农林科学院 蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,北京100097)
观赏羽衣甘蓝作为秋冬季节重要的园林绿化植物,抗寒性直接影响其推广和应用。为了阐明羽衣甘蓝响应低温的生理特性,揭示抗寒机理,以北京市农林科学院蔬菜研究中心生物技术课题组选配的优良F1杂种作为研究试材,分析不同低温处理下叶片电导率变化和半致死温度,以及渗透调节物质含量和抗氧化酶活性的变化。结果显示,羽衣甘蓝叶片电导率在-5 ℃以下迅速升高,-10 ℃左右达到最大值;半致死温度为-10.3~-13.7 ℃,红色类型低于白色类型,羽叶和圆叶低于皱叶类型。上述研究结果与观赏羽衣甘蓝田间抗寒表现一致。低温处理下渗透调节物质含量和抗氧化酶活性响应特性表明,不同指标呈现不同的变化趋势,除了可溶性糖在-10 ℃含量最高外,可溶性蛋白和游离脯氨酸含量,以及超氧化物歧化酶(SOD)和过氧化物酶(POD)活性均在-5 ℃或-8 ℃达到最大值,并随温度进一步降低而下降。主成分分析结果表明半致死温度、可溶性糖和游离脯氨酸含量是导致羽衣甘蓝抗寒性差异的主要因素。研究结果为建立羽衣甘蓝抗寒性评价体系,进一步解析抗冻机理,培育抗寒新品种奠定理论基础。
羽衣甘蓝;抗寒性;半致死温度;渗透调节物质;抗氧化酶
温度是植物生长的重要环境因子,低温严重影响植物的生长发育并限制作物的分布和产量[1-3]。我国北方冬季寒冷干燥,既不利于园林植被生长,也限制了蔬菜等作物的生产。提高作物自身的抗寒性,培育抗寒新品种,是建设绿色都市、保障冬季菜篮子工程的重要途径。
羽衣甘蓝 (Brassicaoleraceavar.acephala) 系十字花科芸薹属甘蓝种的一个变种,两年生草本,叶形丰富,叶色绚丽,营养丰富,既可用于城市绿化,也是餐桌上的美食,为赏食兼用的优良材质[4]。它抗寒耐冻性强,耐旱,形态结构上表现为叶表具蜡质、叶片全缘或深裂,根系生长旺盛,细胞对低温和脱水胁迫的调控能力强,是研究芸薹属蔬菜作物非生物逆境,特别是抗寒机制及抗性基因的优良材料。
本试验以北京市农林科学院蔬菜研究中心生物技术课题组选配的优良羽衣甘蓝F1杂种为试材,分析不同羽衣甘蓝材料在不同低温处理下相对电导率和半致死温度,不同温度处理渗透调节物质可溶性糖和蛋白、游离脯氨酸的含量,以及抗氧化酶POD和SOD活性变化,阐明羽衣甘蓝响应低温的生理特性,为揭示羽衣甘蓝抗寒机理,建立抗寒性综合评价体系,培育抗性新品种提供理论依据。
1 材料和方法
1.1试验材料
电导率和半致死温度研究选用北京市农林科学院蔬菜研究中心生物技术课题组培育的14个羽衣甘蓝F1杂种/杂交组合(表1),以不耐寒的49菜心作为对照;渗透调节物质含量和抗氧化酶活性分析选用不同叶形叶色,并且半致死温度存在差异的9份F1杂种/杂交组合(表1中下划线标示的材料)。所有材料于2014年8月15日播种,9月16日定植于18 cm×18 cm的花盆中,于北京市农林科学院蔬菜研究中心温室中进行常规管理,每个品种(品系)每个处理设置3次重复,均选取定植60 d,经过不同低温处理后中层相同部位的健康叶片。
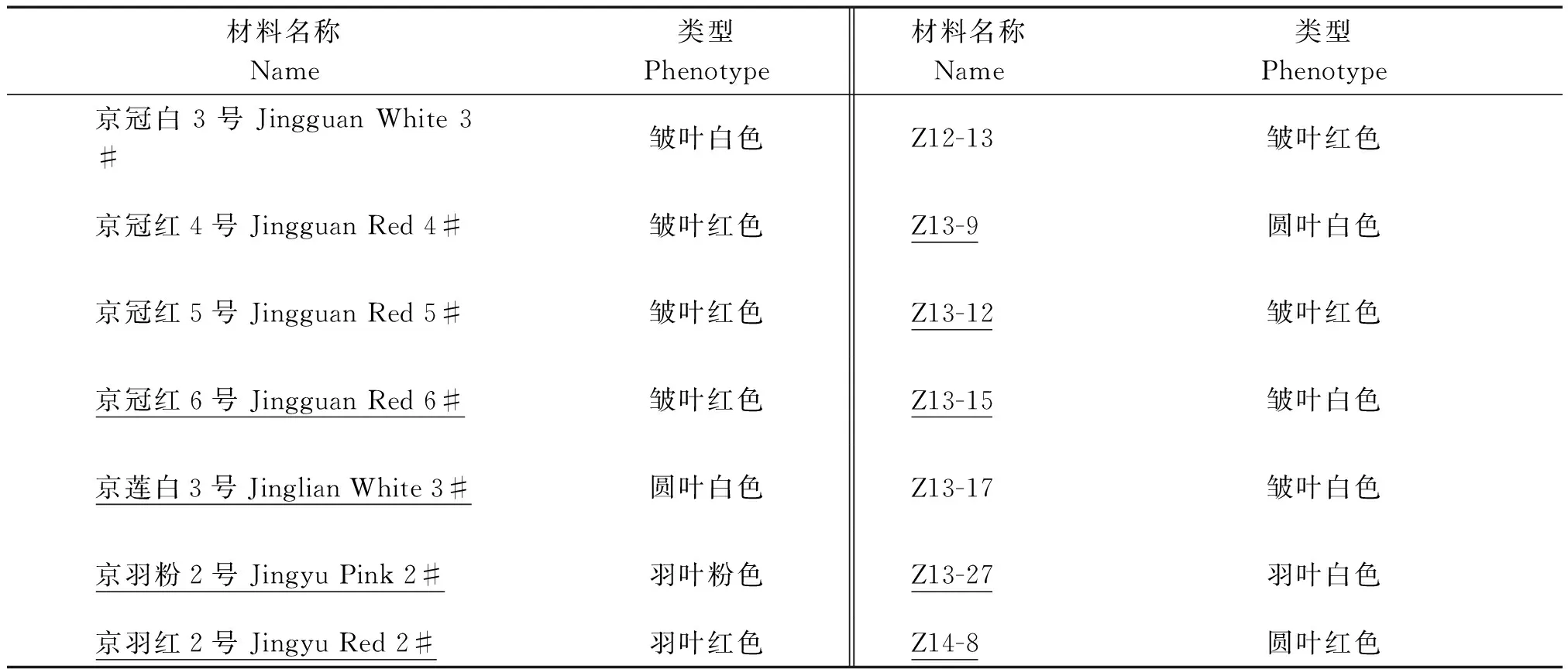
表1 试验材料名称和来源及表现型
1.2试验方法
1.2.1相对电导率测定与半致死温度的计算取定植后生长60 d羽衣甘蓝试验材料中层相同部位的健康叶片,用蒸馏水洗净、拭干,在低温培养箱(SANYO公司,Model:MIR-254)中设置0,-5,-8,-10,-15,-20 ℃等6个低温环境条件,离体处理16 h,将叶片用剪刀剪为0.5 cm×0.5 cm的碎片置于装有20 mL去离子水的玻璃试管中,放于真空泵中抽取真空15 min,静置15 min后,应用电导率仪(上海雷磁仪器,Model:DDS-307)测定电导值S1,然后沸水浴处理20 min后再测得电导值S2,前后比值即是相对电导率(Relative electrical conductivity,REC),计算各温度处理条件下的相对电导率。在此基础上应用Logistic方程计算各试材的半致死温度(LT50),参考郭海林等[5]的计算方法。
1.2.2渗透调节物含量和抗氧化酶活性测定处理条件:在定植后生长60 d的9个不同品种(品系)的羽衣甘蓝试材中选取生长势和生长量相同的试材,置于低温恒温培养箱(SANYO公司,Model:MIR-254)中,设置6个不同的温度(20,5,0,-5,-8,-10 ℃)分别处理16 h,每个品种每个处理温度均设置3次重复。
母液提取:称取1 g叶片,在5 mL的磷酸缓冲液(50 mmol/L,pH值7.8)中研磨成匀浆,4 ℃、4 000 r/min离心20 min,吸取上清液作为可溶性糖、蛋白、游离脯氨酸和酶测定的粗提液。
测定方法:分别采用硫代巴比妥酸比色法、Bradford法和酸性茚三酮法测定可溶性糖、可溶性蛋白和游离脯氨酸的含量[6]。应用氮蓝四唑氧化法[7]和愈创木酚法[8]测定超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性。所有指标的吸光度值均应用岛津UV1800分光光度计进行测定。
1.2.3数据分析数据的统计分析采用Excel 2010软件,方差分析和主成分分析应用SPSS (IBM SPSS Statistic 19.0.1) 软件。
2 结果与分析
2.1不同温度处理对羽衣甘蓝叶片电导率变化的影响与半致死温度差异
当植物受到冻害时,生物膜发生相变,引起膜结构破坏,透性增加,电解质大量外渗[9],电导率及半致死温度与所测试材的抗寒性密切相关[10]。羽衣甘蓝叶片相对电导率随着处理温度的降低,变化曲线表现为“S”型。从0~-5 ℃相对电导率的值低,变化小,-5 ℃相对电导率急剧升高,在-10 ℃左右时达到最高值(图1)。结果表明(图2),试验材料的半致死温度均低于-10 ℃,京莲白3号的半致死温度最高,为-10.3 ℃,京羽红2号最低,为-13.7 ℃。方差分析结果显示,受试羽衣甘蓝试材与对照试材49菜心的半致死温度具有显著差异(P<0.05)。多重比较分析结果显示,不同羽衣甘蓝试材半致死温度均显著低于对照试材49菜心,表明供试14个羽衣甘蓝品种均比49菜心具有更好的耐寒性。进一步分析不同类型羽衣甘蓝的半致死温度,结果显示,红色类型的平均半致死温度(-12.53 ℃)低于白色类型(-11.79 ℃),羽叶类型的平均半致死温度(-12.97 ℃)低于圆叶类型(-12.03 ℃),皱叶类型平均半致死温度(-11.99 ℃)最高。
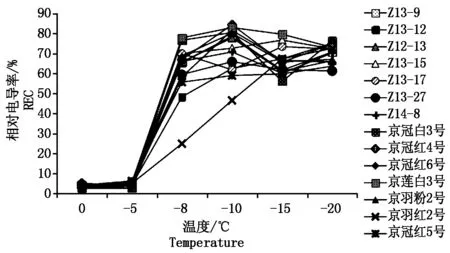
图1 不同温度处理下14份羽衣甘蓝试材相对电导率变化
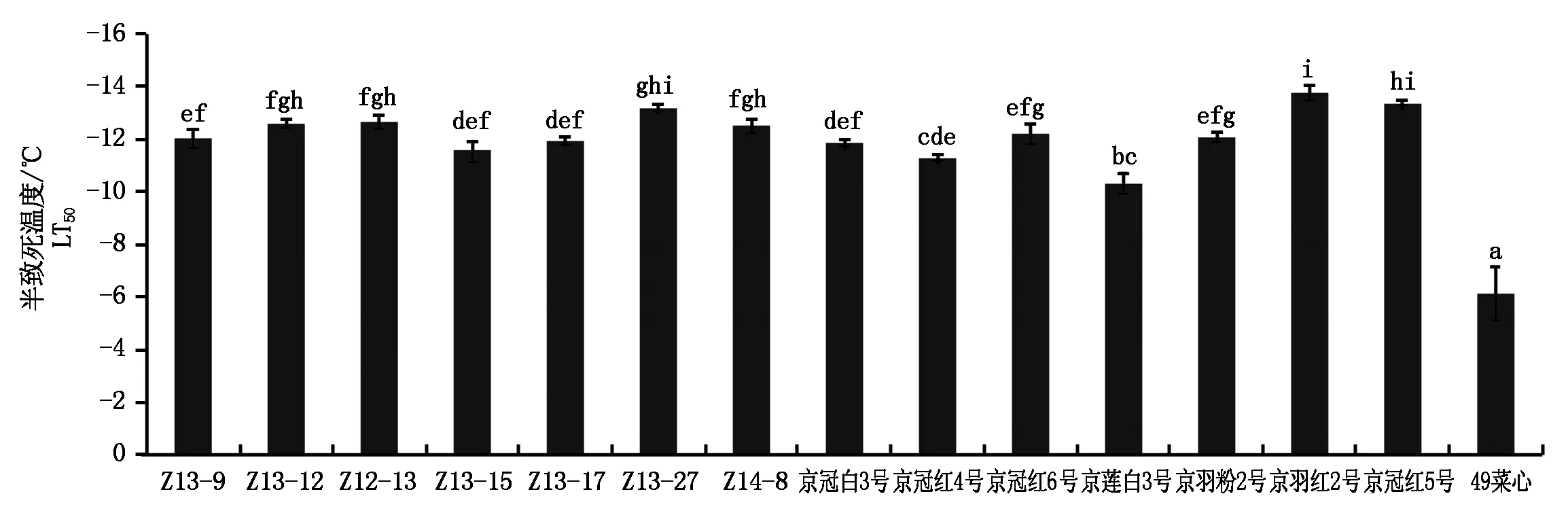
a、b、c、d、e等字母为 Duncan grouping 表示值,字母相同者为差异不显著。
2.2不同温度处理对不同品种渗透调节物质含量变化的影响
渗透调节是植物在逆境胁迫时表现出的一种调节方式,由细胞生物合成和吸收累积某些物质来完成其调节过程。在逆境条件下,细胞内主动积累溶质来降低细胞液的渗透势,以防止细胞过度失水。渗透调节物质主要包括可溶性糖、可溶性蛋白、脯氨酸等[11-15]。
2.2.1可溶性糖含量变化分析可溶性糖是冷害和冻害条件下细胞内外的保护物质,通过糖的积累降低冰点,增强细胞的保水能力,并且通过糖的代谢可产生其他保护性物质及能源,对细胞起到保护作用,其含量多少与植物的抗寒性相关[16]。本试验中不同温度处理,羽衣甘蓝叶片中可溶性糖含量呈现出先小幅度降低后升高的变化规律(图3)。随着温度的降低,可溶性糖含量在5 ℃或0 ℃时降至最低水平,然后迅速升高,在-10 ℃时达到最高值。其中京羽红2号在-10 ℃时,可溶性糖含量最高。
2.2.2可溶性蛋白含量变化分析低温环境下,可溶性蛋白含量增加能有效增强细胞的持水能力,减少原生质因结冰而致死的几率。低温胁迫后组织内可溶性蛋白增加是植物产生抗寒性的重要过程,随着组织内可溶性蛋白含量的增加,植物的抗寒性也随之增强[17]。试验结果显示,羽衣甘蓝叶片中可溶性蛋白含量随着温度的降低呈现出先降低后升高再降低的变化规律,从20~5 ℃可溶性蛋白含量降低,5~-8 ℃含量逐渐升高,-8 ℃处理含量最高,-10 ℃又开始降低。可溶性蛋白含量在不同温度和不同品种间存在差异,其中红色圆叶品种Z14-8在-8 ℃时可溶性蛋白含量最高(图4)。
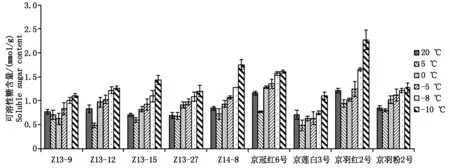
图3 不同温度处理下可溶性糖含量变化
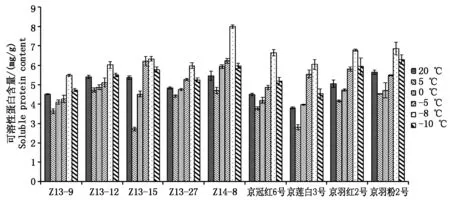
图4 不同温度处理下可溶性蛋白含量变化
2.2.3游离脯氨酸含量变化分析游离脯氨酸作为渗透调节物质具有水溶性和水势高、在细胞内积累无毒性等特点,能保持原生质与环境渗透平衡。植物受到冷胁迫时,游离脯氨酸能促进蛋白质水合作用,由于亲水、疏水表面的相互作用,蛋白质胶体亲水面积增大,保护酶的空间结构为生化反应提供足够的自由水和生理活性物质,从而对细胞起到一定的保护作用[18]。试验结果表明,羽衣甘蓝叶片中游离脯氨酸含量随着温度的降低,呈现出先升高后降低的变化趋势,20 ℃时含量最低,-5 ℃达到最高水平,随着温度降低含量又逐渐下降。不同温度处理和不同试材间游离脯氨酸含量均存在差异,其中京羽红2号在各温度间游离脯氨酸含量均表现为最高,这可能是京羽红2号半致死温度最低,抗寒表现较好的原因之一(图5)。
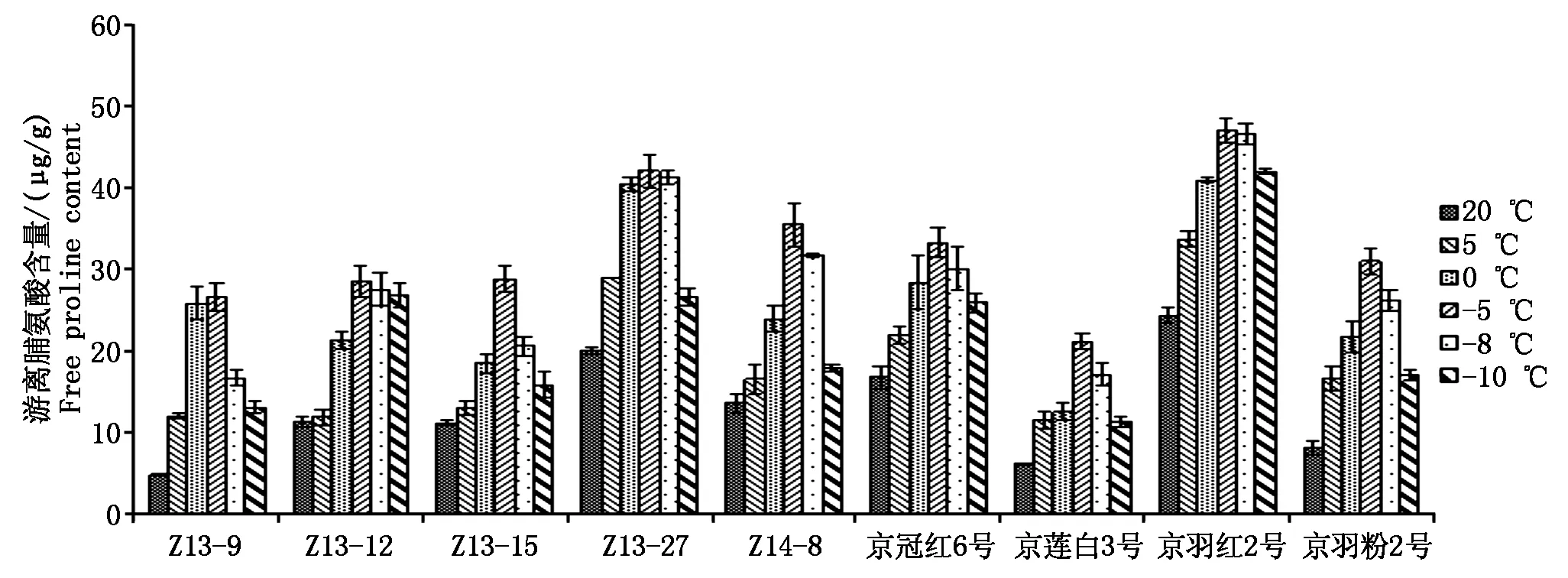
图5 不同温度处理下游离脯氨酸含量变化
2.3不同温度处理对超氧化物歧化酶(SOD)和过氧化物酶(POD)活性变化的影响

随着处理温度的逐渐降低,羽衣甘蓝叶片中超氧化物歧化酶(SOD)的活性(以鲜质量计)均呈现出先小幅度降低后急剧升高的变化趋势,在5 ℃或0 ℃时活性最低,可能是由于环境温度降低抑制了酶的活性,但是随着温度的进一步降低,SOD的活性急剧升高,达到最低水平的1.76~3.20倍。0~-5 ℃其活性变化最大,随着温度的进一步降低趋于平稳(图6)。这说明-5 ℃的低温胁迫能够激发羽衣甘蓝SOD活性的快速升高,抵御冻害胁迫产生的活性氧对膜系统等造成的伤害。
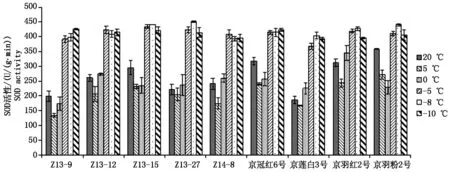
图6 不同温度处理下SOD活性变化
羽衣甘蓝叶片中过氧化物酶(POD)活性(以鲜质量计)随着处理温度的降低,呈现出先升高后降低的变化趋势。20 ℃时羽衣甘蓝叶片中POD的活性最低,温度降低POD的活性升高,在-5 ℃或-8 ℃时达到最大值,随着温度的进一步降低活性又有所下降(图7)。POD的响应温度较SOD要高,0 ℃以上的低温冷害可诱导其活性升高,催化水解胁迫产生的细胞毒性物质过氧化氢,从而对细胞起到保护作用。
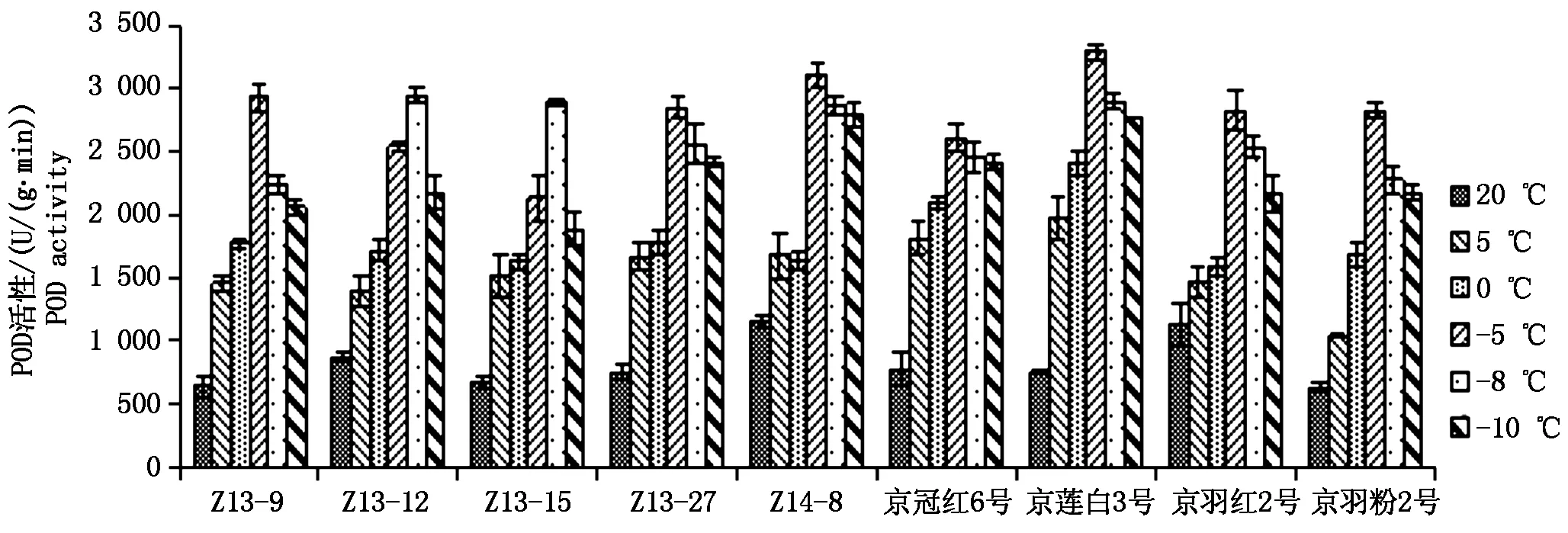
图7 不同温度处理下POD活性变化
2.4不同温度处理下羽衣甘蓝各生理指标相关性分析
在分析羽衣甘蓝抗寒相关化合物含量和抗氧化酶活性受低温影响变化规律的基础上,进一步研究了各生理指标之间的相关性关系。试验结果显示(表2),可溶性糖、可溶性蛋白、游离脯氨酸以及SOD和POD在不同温度处理下含量或活性之间在0.01水平上极显著相关。各指标之间的相关系数为0.381~0.705,其中相关系数最大的为可溶性蛋白与SOD,其次为POD与SOD,相关系数最小的为可溶性糖与POD。相关性分析结果表明,羽衣甘蓝各生理指标对低温的响应趋势具有显著的相关性,因此,可以利用部分代表性指标的变化衡量羽衣甘蓝的抗寒特性。
进一步对不同试材的半致死温度与不同温度条件下各指标的含量与活性进行了相关性分析(表3)。结果显示,各个温度条件下的游离脯氨酸含量均与半致死温度呈显著负相关,说明游离脯氨酸含量越高,半致死温度越低。特别是处理温度达到0 ℃以下时游离脯氨酸含量与半致死温度呈现出极显著负相关关系(0.01水平),这说明游离脯氨酸的含量与羽衣甘蓝抗寒性关系密切,在一定程度上能代表羽衣甘蓝的抗寒性强弱。
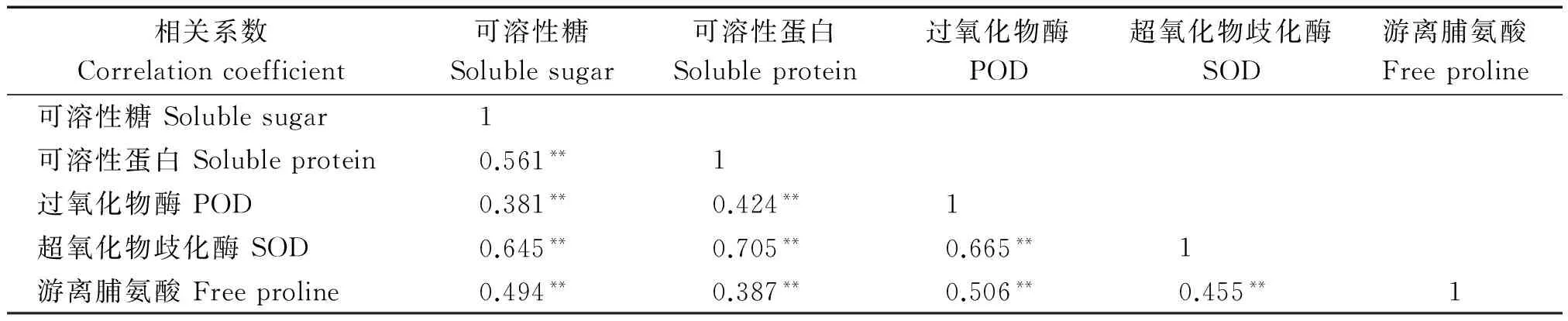
表2 不同生理指标之间相关系数
注:*.显著差异(P<0.05);**.极显著差异(P<0.01)。表3同。
Note:*.Significant at the 0.05 probability level;**.Significant at the 0.01 probability level.Tab same as Tab.3.
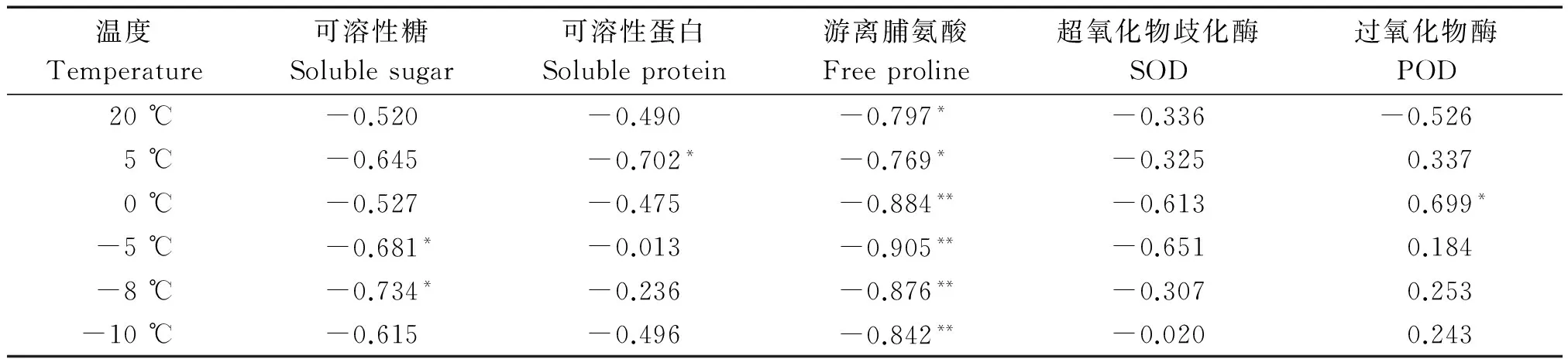
表3 不同生理指标与半致死温度的相关系数
2.5不同温度处理下羽衣甘蓝各生理指标主成分分析
对9份试材(京莲白3号、京冠红6号、京羽粉2号、京羽红2号、Z13-9、Z13-12、Z13-15、Z13-27、Z14-8)的半致死温度和不同温度处理下各生理指标的含量和活性进行主成分分析。结果显示,前7个主成分的累计贡献率达到97.426%,第1主成分44.945%,所占的比重最高(表4)。在第1主成分中得分最高的指标为不同试材的半致死温度,以及不同处理温度条件下可溶性糖和游离脯氨酸含量(图8),这些指标可能是导致羽衣甘蓝不同材料抗寒性差异的主要因素。
根据主成分分析结果,前2个主成分累计贡献率为62.510%,利用前2个主成分分别作为横纵坐标绘制9份羽衣甘蓝试材低温处理不同生理指标的主成分得分图(PSL-DA score plot)进行主成分分类(图9)。结果显示,根据不同试材在第1主成分(PC1,44.945%)上的得分,9份羽衣甘蓝试材可以明显分为两大类,第1类包括:京莲白3号、Z13-9、Z13-15、Z13-27,全部为白色叶色品种;第2类包括:Z14-8、Z13-12、京冠红6号、京羽粉2号、京羽红2号,全部为红色类型品种(图9)。
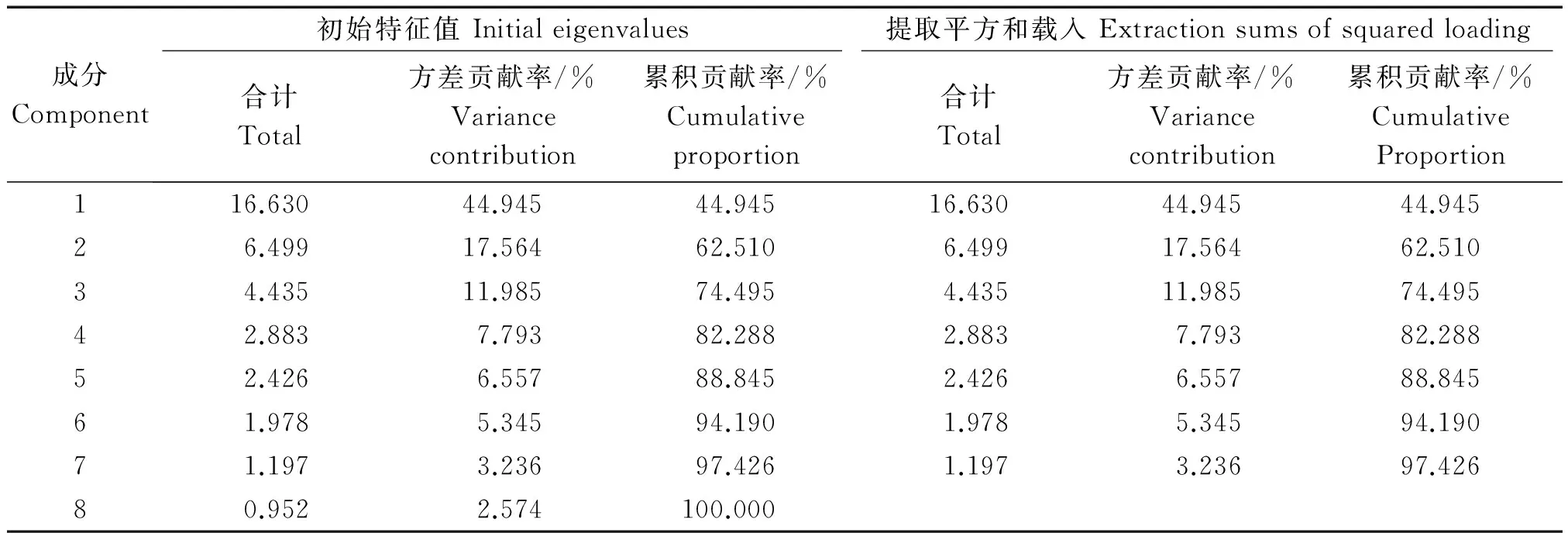
表4 指标主成分贡献率
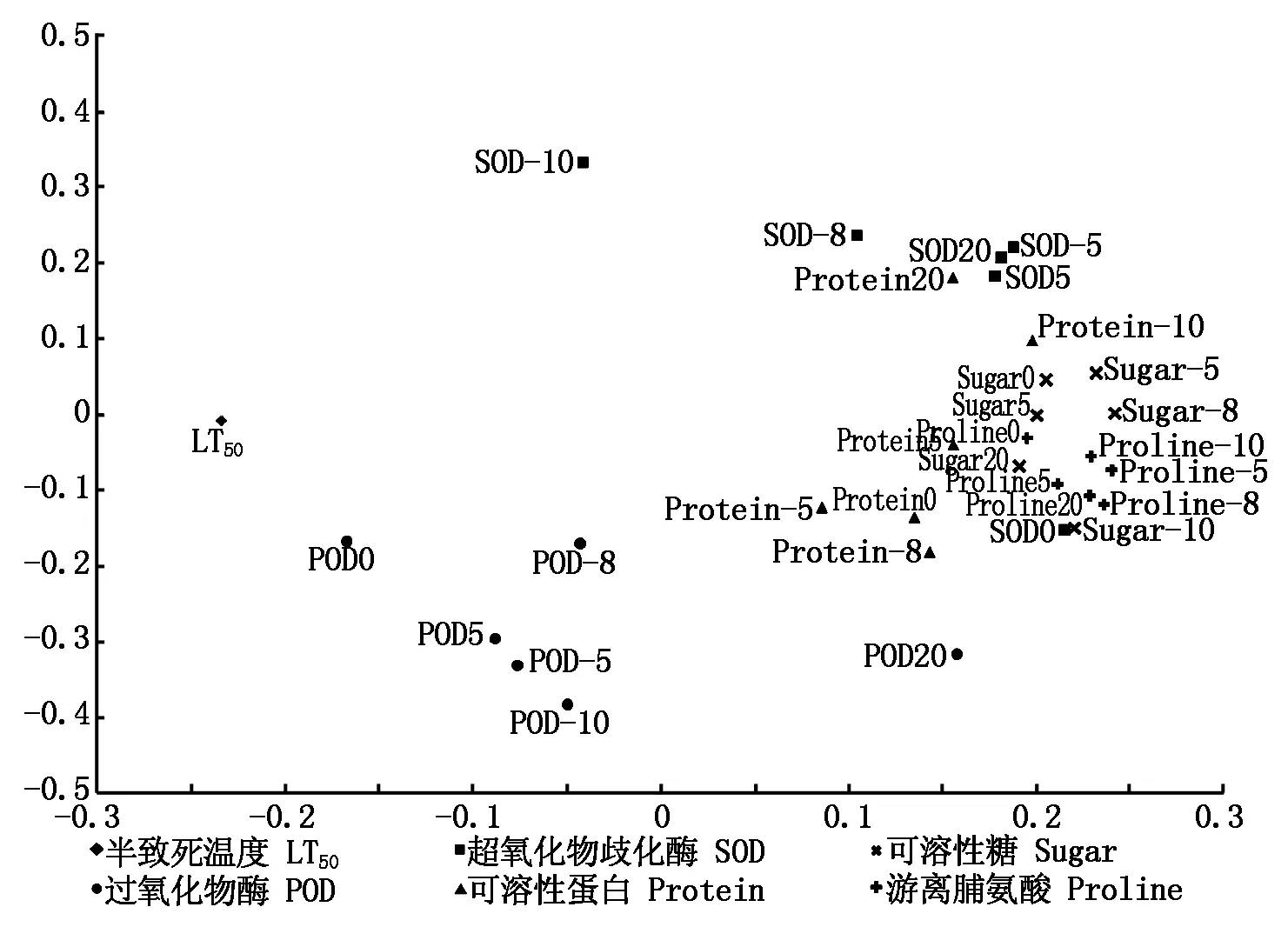
图8 九份羽衣甘蓝试材半致死温度和不同温度下生理指标主成分分析负载图
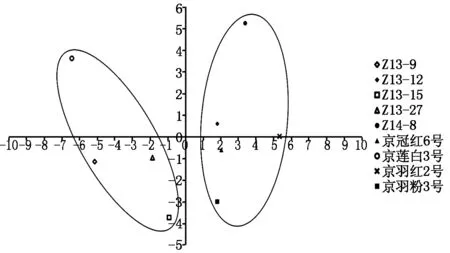
图9 九份羽衣甘蓝试材主成分分类图
2.6试验材料的半致死温度与田间抗冻表现
根据羽衣甘蓝在冻害中叶片不同的损伤程度,羽衣甘蓝可分为5个冻害等级(表5),等级越低抗冻性越强,等级越高冻害越严重。表6列出了不同类型试材2008-2014年田间抗寒性调查结果,数值为冻害等级。不同类型的试材之间抗冻性存在差异,根据多年的抗寒性调查结果发现,羽叶和圆叶类型材料抗寒性优于皱叶类型,红色材料优于白色。半致死温度分析结果与田间表现一致,红色类型的平均半致死温度低于白色类型,不同叶形平均半致死温度高低为:羽叶<圆叶<皱叶。这说明半致死温度可以作为衡量羽衣甘蓝抗寒性的重要指标。
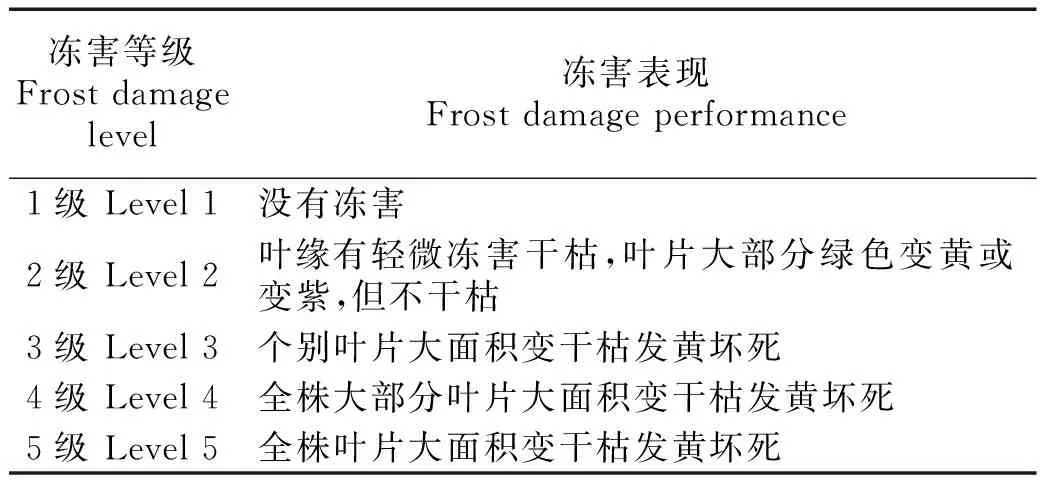
表5 冻害级别
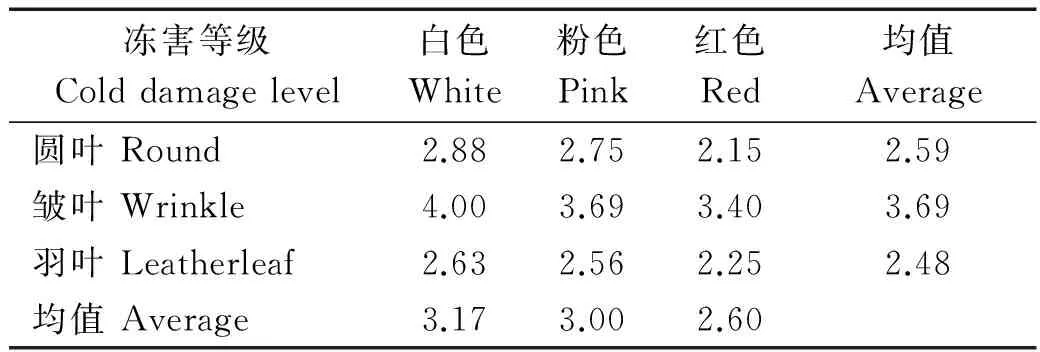
表6 2008-2014年田间抗冻性调查结果
3 结论与讨论
3.1羽衣甘蓝的半致死温度体现抗寒特性
本试验结果显示不同品种羽衣甘蓝的半致死温度(-10.3~-13.7 ℃)低于冬油菜(-3.23~-5.86 ℃)[20]、菊花(-3.55~-8.58 ℃)[21]和茶树无性苗(-6.75~-10.21 ℃)[22],高于绣线菊(-20.7~-32.6 ℃)[23]和杨树无性系(-25~-32 ℃)[24]。
在多年育种与栽培生产实践中发现,观赏羽衣甘蓝喜欢冷凉气候,在环境夜间最低温度低于15 ℃时中心叶片开始显色。环境温度达到0 ℃以下时羽衣甘蓝生长受到抑制,可以耐受环境最低温度-5 ℃以上的长期低温。环境温度到达-5 ℃以下时羽衣甘蓝表现出不同程度的冻害,可以耐受-7~-10 ℃的短期低温。当环境温度达到-10 ℃以下时,绝大部分试材出现较严重冻害,地上部分表现出萎蔫、干枯等而失去观赏价值,但地下部分仍然存活,待春季气温回升后,地下部分可以发出新的枝芽,抽薹开花进行种子繁育。本试验中不同羽衣甘蓝试材叶片低温处理后相对电导率变化的研究结果与羽衣甘蓝的抗寒特性相一致,半致死温度很好的揭示了羽衣甘蓝的抗寒特性。当处理温度从0 ℃降到-5 ℃时,羽衣甘蓝叶片的电导率变化非常小,但是从-5 ℃降到-8 ℃时,电导率急剧升高,在-10~-15 ℃时达到最大值。这说明环境温度低于-5 ℃时,羽衣甘蓝叶片的膜系统开始受到破坏,电解质外渗;当环境温度低于-10 ℃,膜系统明显损伤,表现出冻害。
3.2渗透调节物质含量和抗氧化酶活性变化体现羽衣甘蓝抗寒特性
不同品种类型羽衣甘蓝叶片中可溶性糖含量随着处理温度的降低呈现出先降低后升高的变化趋势,在5 ℃或0 ℃时最低,-10 ℃最高。随着处理温度的降低,可溶性蛋白含量先降低后升高再降低,分别在5,-8 ℃时达到最低和最高水平;游离脯氨酸的含量呈现出先升高后降低的变化趋势,在-5 ℃时达到最高水平然后又逐渐降低。这说明相对于可溶性蛋白,脯氨酸含量响应温度的变化更加敏感。超氧化物歧化酶(SOD)活性随着温度的降低先小幅度降低,然后从0~-5 ℃时迅速大幅度升高,然后趋于稳定,-5~-10 ℃变化较小,变化曲线呈现出“S”型。过氧化物酶(POD)对低温的响应较SOD早,接收到低温信号后活性就开始升高,在-5 ℃或-8 ℃达到最大值,随着温度的进一步降低,活性也下降。
本试验检测的3种渗透调节物质含量和2种抗氧化酶活性,除了可溶性糖含量外,其余指标均在-5 ℃或-8 ℃时达到最大值,随着温度进一步降低呈现出下降趋势。这可能也是羽衣甘蓝能够耐受-5 ℃低温,但是在-10 ℃及其以下温度出现明显冻害的生理基础。
3.3半致死温度、可溶性糖和游离脯氨酸含量是区分羽衣甘蓝抗寒性强弱的主要指标
相关性分析表明,3种渗透调节物质和2种抗氧化酶之间均存在极显著的相关性,其中不同温度游离脯氨酸的含量,以及-5,-8 ℃条件下可溶性糖含量与半致死温度间呈现出显著或极显著正相关。主成分分析研究发现,在第1主成分(贡献率44.945%)中,半致死温度,以及不同温度处理条件下可溶性糖和游离脯氨酸含量的得分最高,是区分羽衣甘蓝抗寒性强弱的主要指标。主成分分类结果与田间抗寒表现一致,在第1主成分上可以明显地将白色和红色类型试材进行区分,在第2主成分上大体可以将不同叶形试材加以区分。相关分析和主成分分析为评价羽衣甘蓝的抗寒性,进一步建立抗寒评价体系提供理论依据。
本试验研究分析了低温处理条件下不同羽衣甘蓝试材的电导率变化和半致死温度差异,以及3种渗透调节物质含量和2种抗氧化酶活性的变化;进一步通过相关性和主成分分析揭示羽衣甘蓝低温抗性差异的主要生理指标;结合多年的不同类型羽衣甘蓝抗寒性表型表现,证实了主要生理指标与抗性表现的一致性关系。本研究阐明了羽衣甘蓝抗寒性生理特性,为建立抗寒性评价体系,进一步挖掘抗寒基因,培育抗寒新品种奠定基础。
[1]Graham D,Patterson B D.Responses of plants to low,nonfreezing temperatures:proteins,metabolism,and acclimation[J].Annual Review of Plant Physiology,1982,33:347-372.
[2]王慧,周小梅.低温胁迫对辣椒相关生理生化指标的影响[J].山西农业科学,2015,43(2):152-154.
[3]苗永美,宁宇,魏庆镇,等.低温对不同基因型黄瓜幼苗生长及生理特性的影响[J].华北农学报,2013,28(6):140-146.
[4]赵秀枢,李名扬,张文玲,等.观赏羽衣甘蓝高频再生体系的建立[J].基因组学与应用生物学,2009,28(1):141-148.
[5]郭海林,刘建秀,朱雪花,等.结缕草属杂交后代抗寒性评价[J].草地学报,2006,14(1):24-28.
[6]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2001:167-258.
[7]Beyer W F,Fridovich I.Assaying for superoxide dismutase activity:some large consequences of minor changes in conditions[J].Analytical Biochemistry,1987,161(2):559-566.
[8]Prasad K V S K,Paradha Saradhi P,Sharmila P.Concerted action of antioxidant enzymes and curtailed growth under zinc toxicity inBrassicajuncea[J].Environmental and Experimental Botany,1999,42(1):1-10.
[9]Steponkus P L.Role of the plasma membrane in freezing injury and cold acclimation[J].Annual Review of Plant Physiology,1984,35:543-584.
[10]Lindén L P,Lindén M.Relating freeze-induced electrolyte leakage measurements to lethal temperature in red raspberry[J].Journal of the American Society for Horticultural Science,2000,125(4):429-435.
[11]Beck E H,Bhattarai T.Specific and unspecific responses of plants to cold and drought stress[J].Journal of Biosciences,2007,32(3):501-510.
[12]Krasensky J,Jonak C.Drought,salt,and temperature stress-induced metabolic rearrangements and regulatory networks[J].Journal of Experimental Botany,2012,63(4):1593-1608.
[13]Wisniewski M,Gusta L,Neuner G.Adaptive mechanisms of freeze avoidance in plants:a brief update[J].Environmental and Experimental Botany,2014,99(3):133-140.
[14]肖小君,黄作喜,陈文年,等.外源NO对铅胁迫下水果黄瓜种子萌发和幼苗生理特性的影响[J].华北农学报,2015,30(3):123-128.
[15]徐传保,戴庆敏.低温胁迫对竹子3种渗透调节物质的影响[J].河南农业科学,2011,40(1):127-130.
[16]Shao X,Zhu Y,Cao S,et al.Soluble sugar content and metabolism as related to the heat-induced chilling tolerance of loquat fruit during cold storage[J].Food and Bioprocess Technology,2013,6(12):3490-3498.
[17]Chabot B F.IX.Metabolic and enzymatic adaptations to low temperature[M].Comparative Mechanisms of Cold Adaptation.New York:Academic Press,INC,1979:283-301.
[18]谢虹,杨兰,李忠光.脯氨酸在植物非生物胁迫耐性形成中的作用[J].生物技术通报,2011,(2):23-27.
[19]Chen L J,Li T L,Miao Y,et al.An overview of cold resistance in plants[J].Journal of Agronomy and Crop Science,2014,200(4):237-245.
[20]杨宁宁,孙万仓,刘自刚,等.北方冬油菜抗寒性的形态与生理机制[J].中国农业科学,2014,47(3):452-461.
[21]许瑛,陈发棣.菊花8个品种的低温半致死温度及其抗寒适应性[J].园艺学报,2008,35(4):559-564.
[22]宋绪忠.茶树无性系苗期抗寒特性研究[D].泰安:山东农业大学,2002.
[23]冯楠楠,张超,樊超,等.6种绣线菊抗寒能力的比较[J].佳木斯大学学报:自然科学版,2007,25(4):565-568.
[24]史清华,高建社,王军,等.5个杨树无性系抗寒性的测定与评价[J].西北植物学报,2003,23(11):1937-1941.
The Physiological Characteristics of Ornamental Kale for Cold Resistance
ZHANG Yaling1,2,XING Hongwei1,GUO Ning2,HAN Shuo2,ZONG Mei2,LIU Fan2,WANG Guixiang2
(1.Department of Environment and Resources,Chongqing Technology and Business University,Chongqing400067,China;2.Beijing Vegetable Research Center,Beijing Academy of Agricultural and Forestry Sciences,Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(North China),Ministry of Agriculture,P.R.China,Beijing100097,China)
Kales,which are widely cultivated as ornamental plants in wintertime or cold areas,play important roles for urban landscaping.Cold stress which can reduce the ornamental value is one of the most important characters for the improvement and breeding of kales.In order to elucidate the physiological characteristics during low temperature and reveal cold resistance mechanism,several varieties and strains which were bred by our group were used as research materials.The relative electrical conductivity (REC) under different low temperature treatment,semi-lethal temperature (LT50) of different accessions,as well as the osmoregulation substances contents and antioxidant enzymes activities under different temperature treatment were analyzed.It was showed that the REC of kale leaves increased rapidly when temperature under -5 ℃,and reached maximum values at about -10 ℃.The TL50values of kale accessions were -10.3--13.7 ℃.The TL50s of red types were lower than white types,as well as round and leatherleaf types were lower than wrinkle types.These results were consistent with field cold resistance performances of the varieties.Changing characteristics of the detected osmoregulation substances and antioxidant enzyme activities were different under different temperature treatments.These physiological indexes reached maximum values at -5 ℃ or -8 ℃ and decreased at lower temperature,except soluble sugar which reached maximum value at -10 ℃.The principal component analysis revealed that LT50value,soluble sugar and free proline contents were main components causing cold resistance variations among different varieties.These results will provide theoretical basis for the establishment of kale cold resistance evaluation system,and lay foundation for the development of new varieties with excellent cold resistance.
Brassicaoleraceavar.acephala;Cold resistance ability;Semi-lethal temperature;Osmoregulation substances;Antioxidant enzymes
2016-04-16
国家自然科学基金项目(31501752);北京市农林科学院财政专项(KJCX20140423);国家星火计划项目(2015GA600004)
张亚玲(1990-),女,重庆人,在读硕士,主要从事生态园林研究。
幸宏伟(1965-),女,重庆人,副教授,硕士,硕士生导师,主要从事生态园林研究。
郭宁(1983-),男,河北沧州人,助理研究员,博士,主要从事蔬菜生物技术与育种研究。
S635.01
A
1000-7091(2016)04-0168-09
10.7668/hbnxb.2016.04.027
