枯草芽孢杆菌BSD-2的GFP标记及其在黄瓜上的定殖研究
2016-09-23郝慧娟刘洪伟尹淑丽刘倩倩张丽萍宋水山
郝慧娟,刘洪伟,尹淑丽,刘倩倩,张丽萍,宋水山
(1.河北工业大学 化工学院,天津 300130;2.河北省科学院 生物研究所,河北 石家庄 050081;3.河北省主要农作物病害微生物控制工程技术研究中心,河北 石家庄 050081)
枯草芽孢杆菌BSD-2的GFP标记及其在黄瓜上的定殖研究
郝慧娟1,2,3,刘洪伟2,3,尹淑丽2,3,刘倩倩2,3,张丽萍2,3,宋水山2,3
(1.河北工业大学 化工学院,天津300130;2.河北省科学院 生物研究所,河北 石家庄050081;3.河北省主要农作物病害微生物控制工程技术研究中心,河北 石家庄050081)
为研究枯草芽孢杆菌BSD-2在黄瓜植株上的定殖情况,采用稍加改进的电击转化方法将含有GFP基因的pGFP4412质粒导入枯草芽孢杆菌BSD-2菌株中,并测定了其生长曲线、质粒遗传稳定性及其对枯萎病菌和灰霉病菌的抑制作用。结果表明,成功获得具有绿色荧光的菌株BSD-2-GFP;标记菌株的生长趋势与野生型菌株基本一致;在无选择压力条件下连续培养56 h,菌株BSD-2-GFP的遗传稳定性为86%;其对植物枯萎病菌和灰霉病菌具有很强的抑制作用,与野生型菌株相当。通过荧光显微镜观察发现,标记菌株处理24 h后即可在黄瓜根内部发现,5 d后可在叶脉发现,且50 d后仍可在叶脉观测到。结果表明,菌株BSD-2-GFP可以很好地在黄瓜体内定殖,从而阻止病原菌的侵入。
枯草芽孢杆菌;绿色荧光蛋白;枯萎病;灰霉病;抑菌作用
由尖孢镰刀菌引起的枯萎病和由灰葡萄孢菌引起的灰霉病是危害农作物尤其是设施蔬菜的两大主要病害[1-7]。而常规化学防治由于使用大量的化学农药导致农药残留严重超标,食品安全事件频发,严重危害着人们的生命健康和生存环境[8-9],植物病害生物防治是绿色、安全,实现农业持续发展的重要措施,而生防拮抗菌的应用是生物防治的重要途径之一[10]。芽孢杆菌类能够产生多种抗菌物质(包括伊枯草菌素[11]、表面活性素和丰原素等脂肽[12],蛋白酶和几丁质酶等降解真菌结构性聚合物[13],以及抗真菌挥发性物质),具有良好的拮抗活性,因此,成为在生物防治中使用最广泛的一类细菌[14-16]。本试验前期筛选获得一株拮抗枯草芽孢杆菌BSD-2,该菌株有较宽的抑菌谱,对10种植物病菌有显著的抑制作用[17],对其抗菌活性物质进行了较深入的研究[18-19],田间试验结果表明其与其他菌株组成的复合制剂对花生等作物连作病害有较好的防治作用[20],具有良好的应用开发前景。为了进一步阐明枯草芽孢杆菌BSD-2在植物上的定殖、扩散和生存竞争能力,揭示其抗病作用机理,本试验利用基因标记示踪技术,通过电转化的方法将带有绿色荧光蛋白基因(GFP)的质粒转到枯草芽孢杆菌BSD-2菌株中,通过连续稀释培养和皿内拮抗分别测定菌株的遗传稳定性和抑菌活性,利用荧光显微镜观察其在黄瓜植株上的定殖情况,以期为实际应用提供理论指导依据。
1 材料和方法
1.1试验材料
BSD-2菌株系河北省科学院生物研究所微生物科室分离得到。病原菌为尖孢镰刀菌(Fusariumoxysporum)和灰葡萄孢菌(Botrytiscinerea)。质粒pGFP4412由中国农业大学王琦教授惠赠,带有氨苄青霉素、新霉素(Neomycin sulphate,Neo)抗性基因和GFP基因。菌株BSD-2及DH5α的培养基为LB 培养基。新霉素购自生工生物工程(上海)股份有限公司。电转化仪(新芝JY 2000-1B)为宁波新芝科器研究所产品。荧光显微镜(Leica DM4000B)为德国莱卡仪器公司产品。NB培养基:牛肉膏5 g、蛋白胨10 g、氯化钠 5 g、葡萄糖10 g,pH值 7.0~7.2。
1.2BSD-2的电击转化及转化子的验证
质粒提取和感受态制备参考王培培等[21]的方法,电击转化过程如下:取100 μL感受态细胞,向其中加入1.4 μg质粒,轻轻混匀后转移至电击杯中,冰浴30 min后,进行电击。电击完毕后迅速加入预热的复苏培养基,轻轻混匀后转移至1.5 mL离心管中,37 ℃、150 r/min振荡培养5 h,然后取100 μL菌液涂布于含有新霉素的LB 平板培养基上,37 ℃培养过夜。试验重复3 次。
随机挑选在新霉素平板上生长的菌落进行PCR验证,PCR所用引物为GFP-1和GFP-2,PCR反应条件为95 ℃预变性4 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,32个循环;72 ℃延伸反应7 min。电泳检测PCR结果。
引物序列如下:
GFP-1:5′-GCCTCTAGAATGAGTAAAGGAGAAG AAC-3′;GFP-2:5′-GCCAAGCTTTTATTTGTATAGTT CAT C-3′。
1.3标记菌株BSD-2-GFP生长特性
1.3.1菌株BSD-2-GFP的生长曲线测定将BSD-2-GFP在含Neo的LB 平板上划线培养,挑取单菌落接种到含Neo的LB 液体培养基中培养12 h。以4%接种量接种于100 mL LB 液体培养基,30 ℃、180 r/min 培养。以原始菌株BSD-2为对照,同等条件下培养,每隔2 h 测定菌液的OD600值,绘制原始菌株BSD-2和标记菌株BSD-2-GFP的生长曲线。每处理重复3次。
1.3.2菌株BSD-2-GFP遗传稳定性测定遗传稳定性测定参考田涛[22]的方法,进行连续稀释培养,每隔7 h取样,以0.1%接种量接种到无抗生素LB 液体培养基中,重复直至56 h。然后分别涂布无抗生素LB平板和有抗生素的LB平板,每个处理重复3次,以抗性菌株所占百分比计算工程菌株的遗传稳定性。
1.4菌株BSD-2-GFP对枯萎病菌和灰霉病菌抑制作用
采用平板对峙法[23]对标记菌株和野生型菌株的抑菌效果进行检测,所用病原指示菌为尖孢镰刀菌和灰葡萄孢菌。
1.5标记菌株BSD-2-GFP在黄瓜上的定殖初探
将黄瓜种子依次用75%酒精浸泡10 min、无菌水洗净、1%次氯酸钠浸泡5 min、无菌水清洗至包衣颜色褪去,之后放入垫有滤纸的无菌培养皿上,添加无菌水,26 ℃催芽。将发芽后(根长约1 cm)的种子放入花盆中(土壤和蛭石2∶1),待第3片真叶展开时在根表附近注入10 mL(1.42×109cfu/mL)BSD-2-GFP菌液,每隔1 d浇1次无菌水,浇灌时保持土壤湿润但水不能从盆底流出。在浇灌后第1,3,5,7,9,11,20,30,40,50 d时用荧光显微镜观察标记菌株在黄瓜根部、茎部、叶柄、主叶脉和次叶脉的定殖情况。
2 结果与分析
2.1阳性转化子获得及其荧光检测
挑取在含有新霉素抗性平板上生长的菌株进行PCR验证,琼脂糖凝胶电泳(图1),说明标记菌株为阳性转化子。标记后的菌株菌落为圆形(图2),与原始菌株无差异(图3)。在莱卡荧光显微镜下观察可看出菌体为绿色(图4),说明质粒在BSD-2菌株中得到高效表达。

1.核酸标准分子量;2~9.GFP的PCR产物。
图2 GFP标记后的BSD-2菌株

图3 野生型BSD-2菌株

图4 携带GFP质粒的BSD-2菌株在荧光显微镜下的荧光表现
2.2标记菌株BSD-2-GFP生长特性
2.2.1菌株BSD-2-GFP的生长曲线试验结果见图5。2个菌株的生长变化趋势大体一致,野生型菌株和标记型菌株几乎同时进入对数期。而标记型菌株在延迟期停留时间较长,野生型菌株指数生长期开始于培养后12 h,而标记型菌株指数生长期开始于培养后13 h,比野生型菌株滞后了1 h。

图5 BSD-2和标记菌株BSD-2-GFP的生长曲线
2.2.2标记菌株BSD-2-GFP遗传稳定性试验结果表明:在没有选择压力的情况下,随着转接次数的增加,标记菌株的稳定性有降低的趋势。在连续稀释培养56 h后的质粒稳定性为86%,说明GFP在BSD-2菌株中有较好的遗传稳定性。芽孢杆菌在营养丰富的实验室条件下分裂1代大约需要20~30 min,而在自然条件下繁殖1代需要50~100 h,所以认为标记菌株BSD-2-GFP遗传稳定性可以满足后续试验需求(图6)。
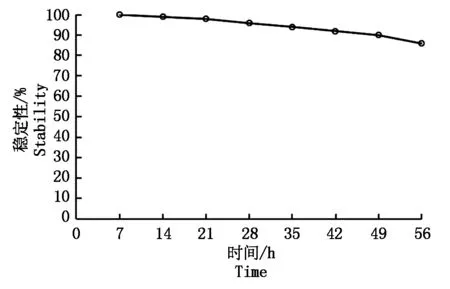
图6 标记菌株的遗传稳定性
2.3标记菌株BSD-2-GFP对枯萎病菌和灰霉病菌的抑菌作用
对峙培养试验见图7,对尖孢镰刀菌的抑制作用见图7-A,标记后菌株BSD-2-GFP与野生型BSD-2菌株的抑菌圈平均直径分别为2.8,2.7 cm。对灰葡萄孢菌的抑制作用见图7-B,两者的抑菌带平均直径分别为4.5,4.3 cm,对2种病原菌都无明显差异。以上结果表明,BSD-2菌株经过GFP标记后其对尖孢镰刀菌和灰葡萄孢菌的抑菌效果并未受到较大影响。
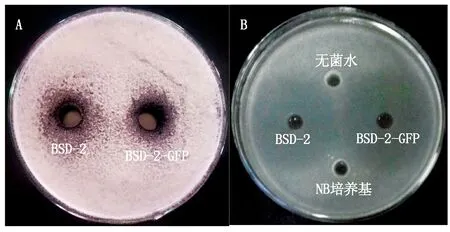
A.BSD-2和BSD-2-GFP对枯萎病菌的抑制作用;B.BSD-2和BSD-2-GFP对灰霉病菌的抑制作用。
2.4标记菌株BSD-2-GFP在黄瓜上定殖情况
标记菌株BSD-2-GFP在黄瓜上的定殖结果表明,灌根24 h时在荧光显微镜下可以看到有微量菌株定殖,第3天时在茎部可以检测到标记菌株的定殖,到达叶脉时需要5 d时间。在处理11 d时可以看到大量绿色菌体定殖根部(图8-A),形成一层绿色的保护膜,防止病原菌侵入,处理13 d时大量绿色菌体定殖在茎部(图8-B),15 d时叶柄部有大量聚集(图8-C),同时在19 d时可以看到主叶脉(图8-D)和次叶脉(图8-E)中有大量绿色菌体。在第50天时仍能在黄瓜叶脉中观测到绿色菌体(图8-F)。说明标记菌株在黄瓜体内有一定定殖能力,并且可以随着植物体内养分的运输而迁移到茎秆和叶片中。
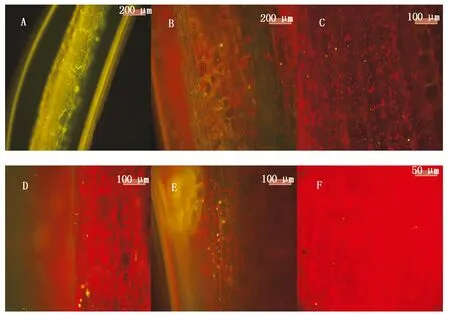
A.根部;B.茎部;C.叶柄部;D.主叶脉部;E.次叶脉部;F.次叶脉部。
3 讨论
本试验成功地对枯草芽孢杆菌BSD-2进行了GFP标记,标记菌株具有较高的遗传稳定性。标记菌株的获得为深入研究BSD-2的抗病作用机制奠定了基础。GFP 因其对细胞功能无影响、体内易表达、化学性质稳定等优点[24-27],常常被作为标记物广泛应用到分子生物学和细胞生物学研究当中[28-29]。已有多种革兰氏阴性菌和革兰氏阳性菌被GFP标记[30-32],并用于定殖研究。但一般来说,GFP在菌体内的高效表达会赋予转化菌株额外的代谢负担,可能影响其生理代谢活动和生物学功能。本试验中,标记菌株与原始菌株BSD-2的生长特性、拮抗活性无明显差异,说明GFP蛋白表达并未对生防菌BSD-2的生理代谢和生防功能产生明显的影响。
不同来源的GFP穿梭质粒在菌体内的荧光强度和稳定性不同,而同一来源的GFP在不同菌体内的遗传稳定性也不尽相同。本试验获得的GFP标记菌株其质粒遗传稳定性为86%,不及范晓静等[24](93%)和田涛[22](92%)的稳定性高,可能与BSD-2的生长特性、培养条件等有关,如何增加其稳定性有待进一步探讨。同时对于在遗传稳定性试验中遇到的在抗性平板上能生长即抗性基因没丢失的前提下,不能发出荧光的原因也有待进一步研究。
拮抗菌株具有较宽的抑菌谱是衡量其具有生防价值的指标之一。本试验中标记菌株对枯萎病和灰霉病有较好的抑制作用,同样为枯草芽孢杆菌对枯萎病的抑制作用好于田兆丰等[33]研究的菌株对枯萎病的抑制作用。标记菌株携带的GFP基因能在荧光显微镜下被观察到,所以通过定殖试验可以直观的监测其定殖部位。任嘉红和黄其玲等[34-35]只研究了标记菌株在根部的定殖情况,本试验通过荧光显微镜在黄瓜的根、茎和叶部观察到了有绿色菌体成功定殖。此外,本试验中标记菌株在根部定殖数量最多时是接菌后11 d,比蒋晓玲等[36]研究的菌株提前了1 d。与魏春燕等[37]研究结果相同的是标记菌株可以由根部向上迁移到叶片,并且稳定繁殖。一些病原菌主要从植物的根部、细胞之间的缝隙、初生根和次生根的分叉处侵入植株,标记菌株优先占据这些有利的生态位,暗示着生防拮抗菌可以改善局部微环境,阻止病原菌侵入,防止病害发生[38-39]。
致谢:感谢中国农业大学王琦教授惠赠pGFP4412质粒。
[1]Kidd B N,Kadoo N Y,Dombrecht B A,et al.Auxin signaling and transport promote susceptibility to the root-infecting fungal pathogenFusariumoxysporuminArabidopsis[J].Molecular Plant-Microbe Interactions,2011,24(6):733-748.
[2]Jiao X L,Lu X H,Chen A J,et al.Effects ofFusariumsolaniandF.oxysporuminfection on the metabolism of ginsenosides in American ginseng roots[J].Molecules,2015,20(6):10535-10552.
[3]Sperschneider J,Gardiner D M,Thatcher L F,et al.Genome-wide analysis in threeFusariumpathogens identifies rapidly evolving chromosomes and genes associated with pathogenicity[J].Genome Biology and Evolution,2015,7(6):1613-1627.
[4]Wilman K,Stępień L,Fabiańska I,et al.Plant-pathogenic fungi in seeds of different pea cultivars in Poland[J].Arhiv Za Higijenu Rada I Toksikologiju,2014,65(3):329-338.
[5]Jin W,Wu F.Characterization of miRNAs associated withBotrytiscinereainfection of tomato leaves[J].BMC Plant Biology,2015,15(1):1-14.
[6]Munafo J,Gianfagna T J.Antifungal activity and fungal metabolism of steroidal glycosides of Easter lily (Liliumlongiflorumthunb.) by the plant pathogenic fungus,Botrytiscinerea[J].Journal of Agricultural and Food Chemistry,2011,59(11):5945-5954.
[7]Lyons R,Rusu A,Stiller J,et al.Investigating the association between flowering time and defense in theArabidopsisthaliana-Fusariumoxysporuminteraction[J].PLoS One,2015,10(6):1-24.
[8]Kfoury M,Sahraoui A L,Bourdon N,et al.Solubility,photostability and antifungal activity of phenylpropanoids encapsulated in cyclodextrins[J].Food Chemistry,2016,19(6):518-525.
[9]Antonio I,Franco N.Impact of preharvest application of biological control agents on postharvest diseases of fresh fruits and vegetables[J].Crop Protection,2000,19(8):715-723.
[10]Fisher P J,Petrini O.Location of fungal endophytes in tissues ofSuaedafruticosa:a preliminary study[J].Transactions of the British Mycological Society,1987,89(2):246-249.
[11]Kefi A,Ben Slimene I,Karkouch I,et al.Characterization of endophyticBacillusstrains from tomato plants (Lycopersiconesculentum) displaying antifungal activity againstBotrytiscinereaPers[J].World Journal of Microbiology & Biotechnology,2015,31(12):1967-1976.
[12]Katz E,Demain A L.Peptide antibiotics ofBacillus:chemistry,biogenesis,and possible functions[J].Bacteriological Reviews,1977,41(2):449-474.
[13]Evidente A,Punzo B,Andolfi A,et al.Alternethanoxins a and B,polycyclic ethanones produced byAlternariasonchi,potential mycoherbicides forSonchusarvensisbiocontrol[J].Journal of Agricultural and Food Chemistry,2009,57(15):6656-6660.
[14]Oslizlo A,Stefanic P,Vatovec S,et al.Exploring ComQXPA quorum-sensing diversity and biocontrol potential ofBacillusspp.isolates from tomato rhizoplane[J].Microbial Biotechnology,2015,8(3):527-540.
[15]张亮,王改兰,段建南,等.广谱生防菌对番茄枯萎病的防病效果及其机理[J].中国生物防治学报,2015,31(6):897-906.
[16]张淑梅,李晶,姜威,等.内生细菌TF28诱导番茄抗病分子机制研究[J].中国生物防治学报,2015,31(6):913-920.
[17]张铎,谢莉,张蕾,等.棉花黄萎病拮抗内生菌的筛选鉴定及抗菌物质研究[J].河北师范大学学报:自然科学版,2008,32(5):673-678.
[18]胡瑞萍,张铎,张丽萍,等.枯草芽孢杆菌BSD-2一种抗菌肽的分离纯化与鉴定[J].华北农学报,2011,26(6):201-206.
[19]周竞,程辉彩,仇燕肖,等.枯草芽孢杆菌BSD-2抗菌物质超滤浓缩工艺优化[J].农药,2015,54(11):805-808.
[20]张根伟,张丽萍,李书生,等.复合土壤微生态制剂在连作花生上的应用效果[J].河南农业科学,2012,41(9):47-49.
[21]王培培,郭庆港,李社增,等.枯草芽孢杆菌NCD-2菌株的高效电击转化[J].中国生物防治学报,2011,27(3):368-372.
[22]田涛.蜡样芽孢杆菌绿色荧光蛋白标记及其在小麦上定殖的初探[D].北京:中国农业大学,2004.
[23]武志江,李业燕,王亚军,等.百合枯萎病拮抗细菌的筛选、鉴定及其抑菌物质研究[J].微生物学通报,2015,42(7):1307-1320.
[24]范晓静,邱思鑫,吴小平,等.绿色荧光蛋白基因标记内生枯草芽孢杆菌[J].应用与环境生物学报,2007,13(4):530-534.
[25]Mayer K,Iolyeva M E,Meyer-Grahle U,et al.Intestine-specific expression of green fluorescent protein-tagged cathepsin B:proof-of-principle experiments[J].Biological Chemistry,2008,389(8):1085-1096.
[26]崔长征,沈萍,张甲耀,等.利用绿色荧光蛋白标记革兰氏阴性细菌的研究[J].环境科学学报,2011,31(2):276-282.
[27]Davidson M W,Campbell R E.Engineered fluorescent proteins:innovations and applications[J].Nature Methods,2009,6(10):713-717.
[28]Zhang F,Moniz H A,Walcott B,et al.Probing the impact ofGFPtagging on Robo1-heparin interaction[J].Glycoconjugate Journal,2014,31(4):299-307.
[29]Kremers G J,Gilbert S G,Cranfill P J,et al.Fluorescent proteins at a glance[J].Journal of Cell Science,2011,124(124):157-160.
[30]Dower W J,Miller J F,Ragsdale C W.High efficiency transformation ofE.coliby high voltage electroporation[J].Nucleic Acids Research,1988,16(13):6127-6145.
[31]Sebti Y,Rabbani M,Sadeghi H M,et al.Effect of mutations in putative hormone binding sites on V2 vasopressin receptor function[J].Research in Pharmaceutical Sciences,2015,10(3):259-267.
[32]刘邮洲,梁雪杰,乔俊卿,等.枯草芽胞杆菌PTS-394的GFP标记及其定殖能力[J].植物保护学报,2014,41(4):416-422.
[33]田兆丰,刘伟成,董丹,等.生防枯草芽孢杆菌Kct99的GFP标记及其在甘蓝根部的定殖示踪[J].华北农学报,2012,27(6):53-57.
[34]任嘉红,刘辉,姜楠,等.GFP标记溶磷草木樨中华根瘤菌CHW10B及其定殖[J].林业科学,2015,51(1):74-79.
[35]黄其玲,高小宁,赵志博,等.GFPuv标记猕猴桃溃疡病菌的生物学特性及其在土壤、根系中的定殖[J].中国农业科学,2013,46(2):282-291.
[36]蒋晓玲,何鹏飞,王娅玲,等.玉米内生细菌Y19的荧光标记及其在玉米体内的定殖应用效果[J].玉米科学,2015,23(3):50-56.
[37]魏春燕,邢永秀,莫遥,等.绿色荧光蛋白基因标记的固氮菌DX120E在甘蔗植株内的定殖[J].作物学报,2014,40(6):1132-1139.
[38]卢靖乐,余新燕,侯毅平,等.枯草芽孢杆菌NJ-18的质粒消解及其在小麦根部的定殖[J].中国农业科学,2013,46(18):3776-3783.
[39]杜芳,何鹏飞,吴毅歆,等.GFP标记内生枯草芽孢杆菌Y10及其在白菜体内的定殖[J].生态学杂志,2015,34(7):2064-2070.
GFP-Marking and Colonization on Cucumber of Bacillus subtilis BSD-2
HAO Huijuan1,2,3,LIU Hongwei2,3,YIN Shuli2,3,LIU Qianqian2,3,ZHANG Liping2,3,SONG Shuishan2,3
(1.College of Chemical Industry,Hebei University of Technology,Tianjin300130,China;2.Biology Institute,Hebei Academy of Sciences,Shijiazhuang050081,China;3.Hebei Engineering and Technology Center of Microbiological Control on Main Crop Disease,Shijiazhuang050081,China)
For the purpose of exploring the colonization on the cucumber,theBacillussubtilisBSD-2 had remarkable control effect on theBotrytiscinerea.In this study,the plasmid of pGFP4412 that contains green fluorescent protein gene(GFP) was transformed into theBacillussubtilisBSD-2 by modified electroporation.The plasmid stability,growth curve and the inhibition activity of GFP-labeled strains were measured.The results showed that the GFP-tagged strain could emit green fluorescence successfully.The tagged strain nearly had the same trend with the wild type strain in growth.The stability of GFP-marked in engineeringB.subtilisBSD-2 strain was 86% after transference of culture 56 hours continuously without selective pressure.Inhibition activity showed that the GFP-marked strain exhibited the comparable ability as the wild type strain to inhibitFusariumoxysporumandBotrytiscinerea.Observation by fluorescence microscope indicated that the GFP-tagged BSD-2 could colonize on the root tissue after inoculated 24 hours.It could be seen on the leaf veins after five days.It still could be observed on the leaf veins after 50 days.All of these data indicated that the GFP-marked strain could colonize on the cucumber so properly that stopped pathogens to invade the plant.
Bacillussubtilis;GFP;Fusariumoxysporum;Botrytiscinerea;Inhibitory activity
2016-06-11
河北省重点基础研究项目(13966503D);河北省省级省校科技合作开发资金支持项目(Y-15);河北省科学院重点项目(2015302)
郝慧娟(1989-),女,河北石家庄人,在读硕士,主要从事代谢工程与分子生物学研究。
张丽萍(1969-),女,河北张家口人,研究员,硕士,主要从事农业微生物研究。
Q78;S436.421
A
1000-7091(2016)04-0106-06
10.7668/hbnxb.2016.04.018
