蓖麻矮化相关基因RcDof的克隆及分析
2016-09-23孙华军李国瑞黄凤兰丛安琪陈永胜
孙华军,李国瑞,2,3,4,黄凤兰,2,3,4,李 跃,丛安琪,李 威,齐 蒙,陈永胜,2,3,4
(1.内蒙古民族大学 生命科学学院,内蒙古 通辽 028000;2.内蒙古自治区高校蓖麻产业工程技术研究中心,内蒙古 通辽 028000;3.内蒙古自治区蓖麻育种重点实验室,内蒙古 通辽 028000;4.内蒙古自治区蓖麻产业协同创新培育中心,内蒙古 通辽 028000;5.内蒙古民族大学 农学院,内蒙古 通辽 028000)
蓖麻矮化相关基因RcDof的克隆及分析
孙华军1,李国瑞1,2,3,4,黄凤兰1,2,3,4,李跃1,丛安琪1,李威5,齐蒙5,陈永胜1,2,3,4
(1.内蒙古民族大学 生命科学学院,内蒙古 通辽028000;2.内蒙古自治区高校蓖麻产业工程技术研究中心,内蒙古 通辽028000;3.内蒙古自治区蓖麻育种重点实验室,内蒙古 通辽028000;4.内蒙古自治区蓖麻产业协同创新培育中心,内蒙古 通辽028000;5.内蒙古民族大学 农学院,内蒙古 通辽028000)
为研究RcDof基因在蓖麻矮化中的作用及生物学功能,提取蓖麻生长跃变期茎尖中基因组DNA,根据蓖麻中已获得的锌指蛋白基因片段设计引物,采用RACE技术克隆得到该基因,基因完整阅读框全长为924 bp,可编码307个氨基酸,为C2C2型锌指蛋白,预测蛋白质分子量为34.020 9 kDa,等电点为9.23。二级结构预测表明α螺旋占1.63%,β折叠占1.30%,其他无规则卷曲占97.07%,为外释放蛋白。亚细胞定位于细胞核中,对RcDof基因的生物信息学分析为进一步研究其在蓖麻矮化过程中的作用机制和功能特征提供理论依据。
蓖麻矮化;基因克隆;亚细胞定位;生物信息学分析
蓖麻(RicinuscommunisL.)为大戟科蓖麻属植物,是特种油料作物[1]。蓖麻油及其衍生物广泛应用于工业、国防、农业、医药等领域,具有较高的经济价值。由于目前蓖麻产量不高,与其他经济作物如玉米、水稻等相比种植效益低下,使得农民的种植积极性受到制约,从而极大地限制了蓖麻种植业的发展。而矮秆蓖麻植株矮,增强了其抗倒伏、抗旱性及耐瘠薄能力,使蓖麻防灾抗灾能力明显增强,提高了瘠薄地或边际地的利用效率,提高蓖麻产量,进而调动了农民种植的积极性[2]。因此,培育抵抗能力强、适合机械化栽培、产量高的蓖麻矮化新品种为蓖麻育种的首要目标[3],也是实现农民增收、提高国民利益的有效途径。
Dof(DNA-binding with one finger)蛋白是植物特有的一类转录因子[4],在植物生长发育过程中起着重要的作用。Dof 蛋白一般由200~400 个氨基酸组成。通常包含2 个主要的结构域:位于N-末端的DNA 高度保守结合域[5]和位于C-末端的转录调控域[6]。Dof蛋白N-末端的DNA结合域是由52个保守的氨基酸残基组成的C2C2型单锌指结构域,此单锌指结构中有4个绝对保守的Cys残基和1个Zn2+共价结合。Zn2+和Cys残基是Dof蛋白保持活性所必需的,二价离子鳌合剂的存在以及对Cys残基的任何替换都会使Dof蛋白丧失活性[7]。位于Dof 蛋白C-末端的转录调控结构域,其氨基酸序列较为多变不具有保守性[8]。
研究表明:Dof蛋白在植物生长发育过程中参与多种生物学过程,如碳氮代谢、光响应、花和花粉发育、种子发育和萌发、次生代谢、保卫细胞特异基因的调控、植物生长素响应等,可以调控植株矮化、花粉败育等表型变化[9-15]。本试验拟通过克隆与蓖麻矮化相关的RcDof基因并进行生物信息学分析,为进一步研究RcDof基因对蓖麻矮化的调控机制奠定理论依据。
1 材料和方法
1.1试验材料
蓖麻通蓖5号及其子代矮化品种由内蒙古通辽市农业科学研究院提供。
1.2试验方法
1.2.1总RNA的提取采用TaKaRa的RNA提取试剂盒提取蓖麻通蓖5号生长跃变期茎尖的总RNA,备用。
1.2.2RcDof基因5′RACE和3′RACE的扩增以蓖麻通蓖5号生长跃变期茎尖的总RNA为模板,参照TaKaRa公司的cDNA逆转录试剂盒说明书进行逆转录,分别合成5′RACE和3′RACE cDNA第一链。根据蓖麻中已获得的锌指蛋白基因片段设计3′端引物序列为AATTCTGTTGCAACACTG,5′端引物序列为GAAACAAAAGCAAAACC。2条引物间重叠序列为107 bp,扩增出的3′端序列和5′端序列送GENERAY公司测序。
1.2.3RACE扩增片段的克隆5′RACE和3′RACE的PCR扩增产物大小用10 g/L琼脂糖凝胶电泳进行鉴定,然后用琼脂糖凝胶DNA回收试剂盒回收特异条带,连接pMD-18T载体,转化大肠杆菌DH5α感受态细胞,进行蓝白斑筛选,挑取白色单菌落,放大培养后用5′RACE和3′RACE引物进行PCR扩增,扩增程序:94 ℃预变性 5 min,94 ℃ 变性30 s,51.4 ℃退火30 s,72 ℃ 延伸30 s,28个循环。将阳性克隆送至GENERAY公司测序。
1.2.4RcDof基因的生物信息学分析克隆得到的RcDof基因序列,利用ExPASy ProtParam(http://web.expasy.org/protparam/)预测蛋白质的分子式、分子量、等电点和不稳定系数等。利用Predict-protein(http://www.predictprotein.org)对蛋白质二级结构进行预测,利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)对蛋白质跨膜型进行预测,利用SMART(http://smart.embl-heidelberg.de/smart/job)对蛋白质结构域进行预测。
1.2.5亚细胞定位分析用限制性内切酶NocⅠ和SpeⅠ对表达载体pCAMBIA1302线性化,将RcDof基因与线性化的表达载体pCAMBIA1302连接,得到连接产物为pCAMBIA1302-RcDof,并将连接产物pCAMBIA1302-RcDof转化到大肠杆菌感受态DH5α中,对重组子进行PCR扩增检测和酶切检测。将连有RcDof基因的表达载体pCAMBIA1302-RcDof转入到农杆菌感受态EHA105中,并对重组子进行PCR扩增检测和酶切检测。参照连肖华等[16]利用农杆菌介导法转化洋葱表皮细胞进行定位,并在荧光显微镜下进行观察。
2 结果与分析
2.1蓖麻总RNA的提取
通过图1可以看出,利用RNA提取试剂盒法提取蓖麻生长跃变期茎尖的总RNA,经电泳检测后没有DNA污染,28S和18S核糖体RNA亮度接近2∶1,紫外分光光度计检测结果显示OD260/280为1.90,说明提取的蓖麻茎尖总RNA纯度高,可用于后续试验。
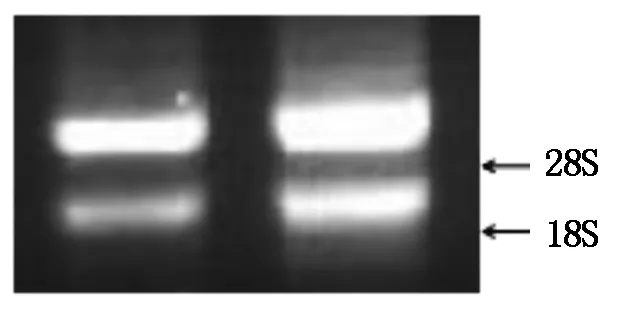
图1 蓖麻总RNA提取结果
2.2RcDof基因及编码的氨基酸特征分析
在已知序列的基础上利用RACE试剂盒对锌指蛋白RcDof基因进行5′RACE PCR扩增和3′RACE PCR扩增,产物大小分别为485,513 bp(图2)。测序后对序列进行拼接获得具有完整开放阅读框(Open reading frame,ORF) 全长为924 bp的序列,编码307个氨基酸,其中丝氨酸含量最高达到41个,占13.4%;苏氨酸30个,占9.8%;谷氨酰胺和天冬酰胺27个,占8.8%。根据ExPASy ProtParam 预测:RcDof基因编码蛋白的分子式为C1465H2325N425O480S14,分子量为34.020 9 kDa,推测的等电点为9.23,不稳定系数为51.54(>40),属于不稳定蛋白。RcDof肽链中带负电荷残基总数20,带正电荷残基总数30,半衰期为30 h。根据ProtScale 预测和分析RcDof蛋白氨基酸序列疏水性平均值为-0.727,表现出疏水性,由此推断该蛋白可能为疏水蛋白。Predict-protein分析发现α螺旋占1.63%,β折叠占1.30%,其他无规则卷曲占97.07%。
2.3RcDof同源性和系统进化分析
利用ClustalW 软件将RcDof的氨基酸序列与其他已知植物的氨基酸序列进行多序列比对(图3),结果表明,RcDof与已知植物的Dof家族蛋白高度同源,与毛果杨氨基酸序列同源性达90%。利用MEGA 5.2 软件构建系统进化树(图4),结果表明,RcDof先与毛果杨PtDof形成分支,结果符合进化关系,与同源性比对结果一致。
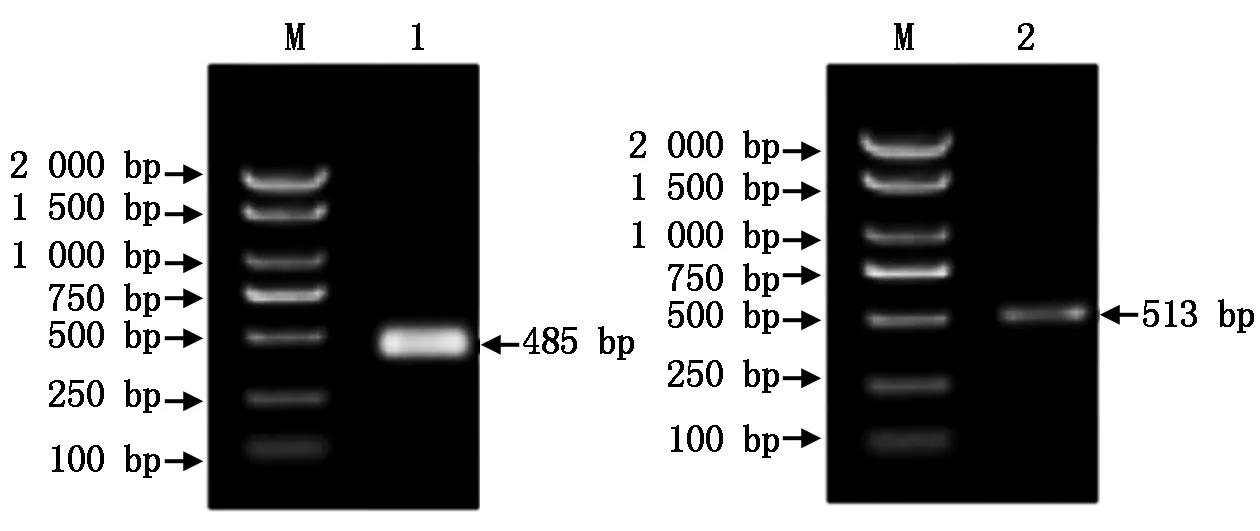
M.DL2000 Marker;1.5′RACE扩增产物;2.3′RACE扩增产物。

图3 多个蛋白同源性比较

图4 进化树分析
2.4RcDof功能预测
Iprscan分析后发现在RcDof氨基酸序列中有3个Dof型锌指蛋白结构域,分别位于44~101的zf-Dof-1,55~86的zf-Dof和48~102的zf-Dof-2氨基酸(图5)。进一步证实该基因具有锌指结构,并极有可能为锌指蛋白。
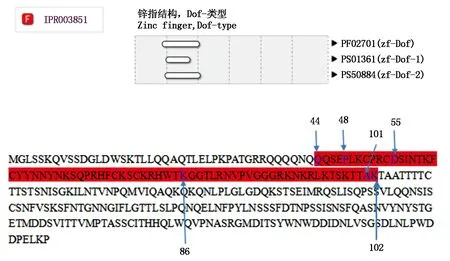
图5 三个锌指结构区
SMART软件进一步分析后发现48~84位氨基酸有ZnF_C2C2锌指结构,功能为转录延伸因子TFIIS和RNA聚合酶的结合序列。46~81位氨基酸有一个ZnF_RBZ锌指结构,(Ran是细胞内的一种具有GTP酶活性的功能蛋白,可以调节染色体稳定性、细胞核组建以及核质运输等多种细胞进程[17])其主要功能是锌指中的Ran-binding蛋白质结合域,还有其他蛋白,该区域能够结合RanGDP。47~81位氨基酸有ZnF_C4锌指结构,是一种激素的受体,功能为C4锌指核激素受体,可以与激素相互作用而发挥相应的生物学功能。70~105位氨基酸有Znf_U1锌指蛋白(表1)。该分析结果表明该序列含有很多锌指结构,属于Dof锌指蛋白,并且极有可能具有以上的功能。

表1 SMART软件分析结果
2.5亚细胞定位
利用农杆菌介导法进行洋葱表皮细胞定位发现RcDof蛋白定位于细胞核中,表明该基因在细胞核中表达(图6)。
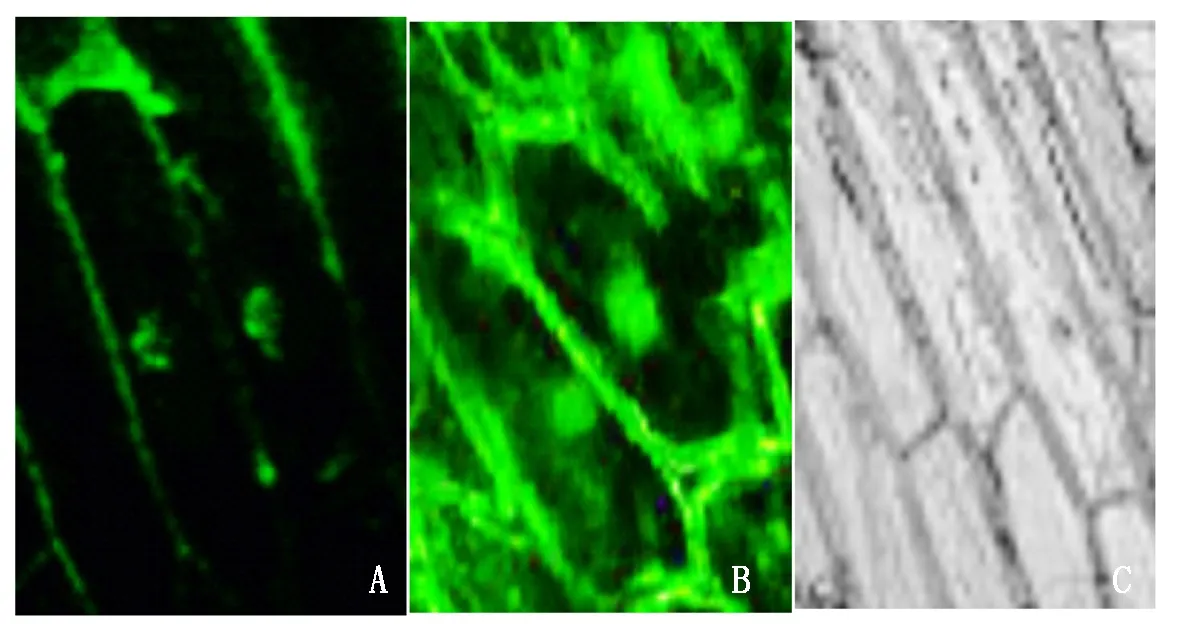
A.定位结果;B.阳性对照;C.阴性对照。
3 讨论
Dof蛋白是植物特有的一类转录因子,在动物和酵母中并不存在。Dof蛋白在植物生长发育过程中起着重要作用,包括调控模式植物拟南芥的开花和光敏色素信号的转导[17],拟南芥中Dof6转录因子可以通过调控ABA的合成影响种子的萌发[18],拟南芥AtDof4.2基因可以导致花粉败育[19],烟草Dof蛋白NtBBF1能调控生长素的诱导表达[20],大豆中Dof转录因子GmDof4和GmDof11可以通过调控脂肪酸生物合成过程中的相关基因,提高种子中油脂含量[21]。上述的报道表明,Dof转录因子参与植物生长发育的多个生物学过程。
本试验克隆得到的Dof型锌指蛋白RcDof基因是蓖麻中第1个报道的锌指蛋白基因。结合C2C2锌指蛋白的结构及功能预测,以及参照其在拟南芥和水稻中的功能,该C2C2型锌指蛋白可能参与蓖麻的生长、发育及代谢等过程,对该锌指蛋白基因的表达分析及其功能研究将是下一步探讨的主要内容。同时亚细胞定位分析也表明该基因定位于细胞核中,本研究可为Dof转录因子在蓖麻植物中的调控作用奠定基础理论,为培育蓖麻新品种提供思路和方法。
[1]郑鹭,祁建民,陈绍军,等.蓖麻遗传育种进展及其在生物能源与医药综合利用潜势[J].中国农学通报,2006,22(9):109-113.
[2]黄志银,黄爱玲,刘红光,等.优质高产淄蓖系列新品种[J].农业科技通讯,2002(7):41.
[3]Chan A P,Crabtree J,Zhao Q,et al.Draft genome sequence of the oilseed speciesRicinuscommunisNat Biotech[J].Nature Biotechnology,2010,28(9):951-956.
[4]蔡晓锋,张余洋,张俊红,等.植物Dof基因家族功能研究进展[J].植物生理学报,2013,49(1):1-12.
[5] Pedone P V,Ghirlando R,Clore G M,et al.The single Cys2-His2 zinc finger domain of the GAGA protein flanked by basic residues is sufficient for high-affinity specific DNA binding[J].Proceedings of the National Academy of Sciences,1996,93(7):2822-2826.
[6]Baglivo I,Palmieri M,Rivellino A,et al.Molecular strategies to replace the structural metal site in the prokaryotic Zinc finger domain[J].Biochimica et Biophysica acta,2014,1844(3):497-504.
[7]Lindorff-Larsen K,Piana S,Dror R O,et al.How Dof fast-folding proteins fold[J].Science ,2011,334(6055):517-520.
[8]Santos L A,Souza S R,Fernandes M S.OsDof25 expression alters carbon and nitrogen metabolism inArabidopsisunder high N-supply[J].Plant Biotechnol Rep,2012,6:327-337.
[9]Chen X Y,Wang D X,Liu C,et al.Maize transcription factor Zmdof1 involves in the regulation ofZm401 gene[J].Plant Growth Regulation,2012,66(3):271-284.
[10]Negi J,Moriwaki K,Konishi M,et al.A Dof transcription factor,SCAP1,is essential for the development of functional stomata inArabidopsis[J].Current Biology,2013,23(6):479-484.
[11]Wei P C,Tan F,Gao X Q,et al.Overexpression of AtDOF4.7,anArabidopsisDOF family transcription factor,induces floral organ abscission deficiency inArabidopsis[J].Plant Physiology,2010,153(3):1031-1045.
[12]Gaur V S,Singh U S,Kumar A.Transcriptional profi ling and in silico analysis of Dof transcription factor gene family for understanding their regulation during seed development of riceOryzasativaL.[J].Mol Biol Rep,2011,38(4):2827-2848.
[13]Kushwaha H,Gupta S,Singh V K,et al.Genome wide identification of Dof transcription factor gene family in sorghum and its comparative phylogenetic analysis with rice andArabidopsis[J].Mol Biol Rep,2014,16(4):372-384.
[14]Gupta N,Gupta A K,Kumar A.Spatial distribution pattern analysis of Dof1 transcription factor in different tissues of threeEleusinecoracanagenotypes differing in their grain colour,yield and photosynthetic efficiency[J].Molecular Biology Reports,2012,39(3):2089-95.
[15]Guo Y,Qiu L J.Genome-wide analysis of the Dof transcription factor gene family reveals soybean-specific duplicable and functional characteristics[J].PLoS One,2013,8(9):e76809.
[16]连肖华,陈坚.SUSIRI基因的生物信息学分析及亚细胞定位[J].中国农学通报,2015,31(6):128-135.
[17]Tark D H,Sim P O,Kim J S,et al.TheArabidopsisRangene encodes Dof domain transcription factor [J].Plant J,2013,34:161-171.
[18]Rueda-Romero P,Barrero-Sicilia C,Gómez-Cadenas A,et al.ArabidopsisthalianaDOF6 negatively affects germination in non-after-ripened seeds and interacts with TCP14[J].Journal of Experimental Botany,2012,63(5):1937-1949.
[19]Skirycz A,Jozefczuk S,Stobiecki M,et al.Transcription factor AtDOF4;2 affects phenylpropanoid metabolism inArabidopsisthaliana[J].The New Phytologist,2007,175(3):425-438.
[20]Baumann K,De Paolis A,Costantino P,et al.The DNA binding site of the Dof protein NtBBF1 is essential for tissue-specific and auxin-regulated expression of the rolB oncogene in plants[J].The Plant Cell,1999,11(3):323-334.
[21]Wang H W,Zhang B,Hao Y J,et al.The soybean Dof-type transcription factor genes,GmDof4 andGmDof11,enhance lipid content in the seeds of transgenicArabidopsisplants[J].The Plant Journal:for Cell and Molecular Biology,2007,52(4):716-729.
Cloning and Analysis of RcDof Gene Associated with Castor Dwarfing
SUN Huajun1,LI Guorui1,2,3,4,HUANG Fenglan1,2,3,4,LI Yue1,CONG Anqi1,LI Wei5,QI Meng5,CHEN Yongsheng1,2,3,4
(1.College of Life Science,Inner Mongolia University for Nationalities,Tongliao028000,China;2.Inner Mongolia Industrial Engineering Research Center of Universities for Castor,Tongliao028000,China;3.Inner Mongolia Key Laboratory of Castor Breeding,Tongliao028000,China;4.Inner Mongolia Collaborate Innovation Cultivate Center for Castor,Tongliao02800,China;5.College of Agronomy,Inner Mongolia University for Nationalities,Tongliao028000,China)
In order to research the features and biological function ofRcDofgene in dwarf castor,stem tip genome DNA was extracted in growth climacteric age.Primers were designed according to obtained Zinc finger protein gene fragment.Using RACE technology,the complete full-length open reading frame of 924 bp was cloned,encoding 307 amino acids,belonged to C2C2 zinc finger protein,predicted protein molecular weight was 34.020 9 kDa,isoelectric point was 9.23.The predicted secondary structure α helix accounted for 1.63%,β fold accounted for 1.30%,other non-random coil accounted 97.07%,belonged to outer release proteins.Subcellular localization showed that theRcDofgene located in the nucleus.The bioinformatics analysis ofRcDofgene will lay the foundations for the further study on its action mechanism and function characteristics in the castor dwarfing process.
Castor dwarfing;Gene clone;Subcellular localization;Bioinformatics analysis
2016-03-21
国家自然科学基金项目(31460353);2015年全区研究生科研创新资助项目(S20151013601);内蒙古民族大学市校合作项目(SXZD2012006;SXZD2012017);内蒙古自治区科技创新引导资金项目(KJCX15002);内蒙古自治区蓖麻产业协同创新培育中心项目;内蒙古自治区蓖麻育种重点实验室开放基金项目(MDK2016030)
孙华军(1992-),女,内蒙古呼伦贝尔人,在读硕士,主要从事蓖麻分子育种研究。
陈永胜(1971-),男,内蒙古通辽人,教授,博士,主要从事蓖麻分子育种研究。
Q78
A
1000-7091(2016)04-0063-05
10.7668/hbnxb.2016.04.011
