外源水杨酸对低温胁迫下养心菜生理代谢的调节作用
2016-09-23徐冬梅贺忠群
徐冬梅,贺忠群,张 杰
(1.四川农业大学,四川 成都 611134;2.绵阳农业科学研究院,四川 绵阳 621023)
外源水杨酸对低温胁迫下养心菜生理代谢的调节作用
徐冬梅1,2,贺忠群1,张杰1
(1.四川农业大学,四川 成都611134;2.绵阳农业科学研究院,四川 绵阳621023)
为探讨外源SA对低温胁迫下养心菜生理代谢的调节作用,以养心菜为试材,在0,5 ℃低温胁迫下,分析叶面喷施不同浓度(0,0.5,1.0,2.0,4.0 mmol/L)的水杨酸(SA)对养心菜膜透性、MDA含量、抗氧化酶活性、可溶性蛋白、脯氨酸、叶绿素含量以及叶绿素荧光参数的影响。结果表明:0.5,1.0,2.0 mmol/L的水杨酸处理均能抑制低温下养心菜相对电导率和MDA的升高,提高养心菜叶片SOD和POD活性,增加可溶性蛋白、脯氨酸和叶绿素含量,也使养心菜叶片Fv/Fm的下降幅度减缓,光抑制对植物的伤害也得以减缓,养心菜的抗寒指标在低温下均有不同程度的缓解。同一浓度的水杨酸处理对不同温度的作用效果不同。综合评价的结果显示,1.0 mmol/L SA处理对养心菜在5 ℃低温下的缓解效果最好。
水杨酸;低温胁迫;养心菜;生理代谢
养心菜(SedumaizoonL.),也称景天三七,为景天科多年生肉质宿根草本植物,是一种药食及园林绿化兼用植物,近年来逐渐应用于食品、园林和医疗等领域。养心菜最适合生长的温度为18~25 ℃。生长期为3-9,10-11月后地上部分枝叶逐渐枯黄,以宿根越冬,次年3月在根茎外萌生新芽[1-2]。低温是影响养心菜冬季生长发育的重要环境因子之一,是阻碍其周年生产的关键问题。目前,国内外对养心菜的研究,主要集中在化学成分分析[3-7]、药理学[8-9]、药用成分提取[10-13]、显微解剖[14-15]、组织培养[16-17]和栽培管理技术[2,18-19]等方面,而关于养心菜的耐寒性研究较少。因此,探究养心菜对低温胁迫的生理响应机制,寻求适当的调控措施来提升其对低温胁迫的抗性和恢复能力,实现其四季常绿、周年生产具有重要意义。水杨酸(Salicylic acid,SA)是一种内源信号分子和新型植物激素[20],对植物具有多种生理调节作用[21]。研究表明,作为信号物质的水杨酸与抗氧化酶的合成和某些抗病基因的启动有关,通过信号传导启动抗氧化防卫系统及开启与抗性有关基因的表达,提高抗性。如适宜浓度的水杨酸可提高多种植物对病害[22]、盐害[23]、重金属毒害[24]和温度胁迫[25-26]等逆境的抗性。SA在提高植物抗寒性方面的相关研究已在番茄[27]、甜瓜[28]、黄瓜[29]、石榴[26]、狭叶红景天[30]等植物中得到证实。另外,水杨酸因毒性小,价格低,可在生产上广泛的推广应用。
目前,有关外源SA在养心菜抗寒性方面的研究尚鲜见文献报道。因此,有必要探索SA能否缓解低温对养心菜的伤害,并确定最佳使用浓度,为合理应用化学调控技术于养心菜的生产栽培中提供参考依据。本试验以养心菜为试材,通过施用外源SA对养心菜进行低温胁迫处理,探讨外源SA对低温胁迫下养心菜生长和生理特性的影响,为外源SA在养心菜生产中的推广应用提供理论依据。
1 材料和方法
1.1试验材料
供试植物为养心菜(SedumaizoonL.),采自四川农业大学实验农场。
试验药剂为水杨酸(Salicylic acid,SA),蒸馏水溶解后用1 mol/L NaOH调至pH值6.8,配成10 mmol/L 母液,使用前配成所需浓度。
1.2试验设计
选择健壮、无病虫害的养心菜茎剪成5~6 cm带4~5个腋芽的茎段,扦插入30穴营养盘中,扦插基质为珍珠岩,扦插期间按常规管理。30 d后选择生长一致的养心菜扦插苗定植于10 cm×10 cm黑色塑料营养钵中,每钵1株,以腐殖质和园土(1∶1)为栽培基质,常温下统一进行肥水管理。植株长至20 cm左右时,选取健壮且生长一致的植株进行SA喷施处理,以叶片上溶液欲滴为度。SA浓度分别为0,0.5,1.0,2.0,4.0 mmol/L(以S0、S0.5、S1、S2、S4表示),以喷施清水为对照。每处理10株,3次重复。每天喷施1次,连喷3 d。喷药结束后,把植株放入工气候培养箱(GZ-380-GSI)内,进行低温胁迫处理。胁迫处理温度选用受低温伤害较重的0,5 ℃。人工气候箱内光照强度为10 000 lx、光周期12 h/12 h(昼/夜)、相对湿度70%。在低温下处理0,2,4,6,8,10 d时取不同处理养心菜叶片样测定细胞膜透性、MDA含量、SOD、POD、CAT活性、可溶性蛋白和脯氨酸含量、叶绿素含量、叶绿素荧光参数。取样方法为叶片样取自顶部向下第3-6片功能叶。
1.3测定方法
细胞膜透性采用相对电导率(REC)法测定[31];丙二醛(MDA)含量采用硫代巴比妥酸法测定[31];超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法[31]测定;过氧化物酶(POD)活性采用愈创木酚法[31]测定;过氧化氢酶(CAT)活性采用紫外分光光度法[31]测定;可溶性蛋白含量采用考马斯亮蓝G-250法[31]测定;游离脯氨酸含量采用酸性茚三酮比色法[31]测定;叶绿素含量采用乙醇提取法[31]测定;叶绿素荧光动力学参数采用便携式调制叶绿素荧光仪(PAM-2500)测定。
采用SPSS 20.0统计软件对试验数据进行方差分析,用 Microsoft Excel 2007软件对数据进行作图。
2 结果与分析
2.1SA对低温胁迫下养心菜叶片细胞膜透性的影响
细胞膜是植物细胞与外界环境之间的保护屏障,维持着植物的正常生命活动。低温下细胞膜透性改变,是植物低温伤害的一个重要原因[32]。由图1可知,养心菜叶片细胞膜透性在低温下增大,并随着低温处理时间的延长而增加。而与对照(0 mmol/L SA处理)相比,喷施较低浓度的SA处理,能明显降低0,5 ℃低温下养心菜的相对电导率,喷施较高浓度(4.0 mmol/L)的SA处理则提高了低温下养心菜的相对电导率,加速了细胞膜的破坏。0 ℃低温下10 d,SA处理浓度为1.0 mmol/L时养心菜的相对电导率比对照(0 mmol/L SA处理)降低了24.91%;5 ℃低温下10 d,SA处理浓度为0.5 mmol/L时养心菜的相对电导率比对照(0 mmol/L SA处理)降低了14.6%。这表明:适宜浓度的SA可明显减轻细胞膜损伤。2.2SA对低温胁迫下养心菜叶片MDA含量的影响
膜脂过氧化产物MDA含量的变化是衡量植物受伤害程度的重要指标。由图2可看出,养心菜叶片在低温下MDA含量(以鲜质量计)增加,并随低温胁迫时间的延长而积累,而外施较低浓度的SA处理,能抑制0,5 ℃低温下养心菜叶片中MDA的积累,外施较高浓度(4.0 mmol/L)的SA处理则促进低温下养心菜叶片中MDA的积累。经1.0 mmol/L的SA处理后能明显降低0 ℃低温下养心菜的MDA含量,胁迫10 d后,MDA含量比未经SA处理的对照降低30.35%;经0.5 mmol/L的SA处理后能明显降低5 ℃低温下养心菜的MDA含量,胁迫10 d后,MDA含量比0 mmol/L SA处理的对照降低27.29%。这表明:适宜浓度的SA可抑制受低温胁迫后的养心菜叶片中MDA的累积,有效降低低温胁迫对养心菜细胞膜脂的过氧化程度,从而减轻低温胁迫伤害。
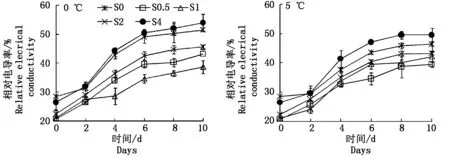
图1 SA对0,5 ℃低温胁迫下养心菜细胞膜透性的影响
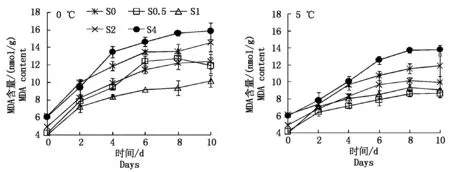
图2 SA对0,5 ℃低温胁迫下养心菜丙二醛含量的影响
2.3SA对低温胁迫下养心菜叶片抗氧化酶活性的影响
抗氧化酶SOD、POD和CAT是细胞内自由基清除系统中的关键酶,在保护细胞器免遭活性氧损伤中起着重要作用。由图3可以看出,0,5 ℃低温导致养心菜叶片内SOD活性(以鲜质量计)随低温胁迫时间的延长先呈逐渐上升的趋势,后呈先上升-下降-再上升的趋势。POD活性除5 ℃下S1处理及0 ℃下S4处理在8 d时有个峰值外,其他处理均呈现先升高4 d后又下降的趋势。CAT活性在0,5 ℃低温下变化略有不同,在0 ℃低温下,经0.5~0.2 mmol/L的SA处理后,CAT活性低于对照,(0 mmol/L SA处理),而5 ℃低温下,各处理没有一致的规律。在4.0 mmol/L时CAT活性大多比对照高。经1.0 mmol/L的SA处理的养心菜叶片在0 ℃低温下胁迫10 d时,SOD活性(以鲜质量计)为240.27 μmol/(min·g),比对照(0 mmol/L SA处理)高63.39%;在5 ℃低温下胁迫10 d时,SOD活性为244.72 μmol/(min·g),比对照高83.91%;低温胁迫8 d时,在0 ℃低温下POD活性(以鲜质量计)为7.17 μmol/(min·g),比对照浓度高28.10%;5 ℃低温下POD活性为10.66 μmol/(min·g),比对照高59.26%。这表明适宜浓度的水杨酸处理可提高养心菜叶片SOD、POD活性,提高其耐寒性。同时能表明1.0 mmol/L的SA处理更能提高5 ℃低温下养心菜叶片SOD、POD活性,更好的缓解5 ℃低温胁迫对养心菜的伤害。施用适宜浓度的SA后养心菜SOD和POD活性比同期对照高,表明SA能更好地促进SOD和POD活性的提高。
2.4SA对低温胁迫下养心菜叶片渗透调节物质的影响
2.4.1SA对低温胁迫下养心菜叶片可溶性蛋白含量的影响植物体内的可溶性蛋白具有亲水胶体性,能使细胞持水力明显增强,从而使植物的耐寒性提高[33]。由图4可知,在0,5 ℃低温下,养心菜在低温处理初期同一SA浓度处理可溶性蛋白质含量随温度的降低而升高,但随着处理时间延长而下降。外施不同浓度的SA后,养心菜叶片中可溶性蛋白含量(以鲜质量计)大都有不同程度的提高,并随SA浓度的增大而呈先增加后下降的趋势,其中以1.0 mmol/L SA处理的可溶性蛋白含量最高。低温胁迫10 d后,1.0 mmol/L SA处理的可溶性蛋白含量比未经SA处理的对照(0 mmol/L)在0 ℃时增加21.02%,5 ℃时增加15.28%。这表明:适宜浓度的SA可通过提高养心菜叶片中的可溶性蛋白含量来提高其耐寒性。

图3 SA对0,5 ℃低温胁迫下养心菜SOD、POD、CAT活性的影响

图4 SA对0,5 ℃低温胁迫下养心菜可溶性蛋白含量的影响
2.4.2SA对低温胁迫下养心菜叶片游离脯氨酸含量的影响游离脯氨酸作为细胞质重要的渗透调节物质可提高细胞液的浓度,降低质膜受冻害的程度。由图5表明,在0,5 ℃低温下,随着低温胁迫时间的延长,养心菜体内的游离脯氨酸含量(以鲜质量计)呈上升趋势。喷施不同浓度的SA能促进低温胁迫下养心菜叶片游离脯氨酸的积累。从总体上看,无论是在0 ℃低温下还是在5 ℃低温下,SA的处理浓度为1.0 mmol/L时养心菜体内的游离脯氨酸含量最高。0 ℃胁迫10 d时,S1(1.0 mmol/L)处理的游离脯氨酸含量比对照(喷清水处理)高43.96%;5 ℃胁迫10 d时,则比对照高49.82%。表明1.0 mmol/L的SA能有效地缓解养心菜的低温伤害。
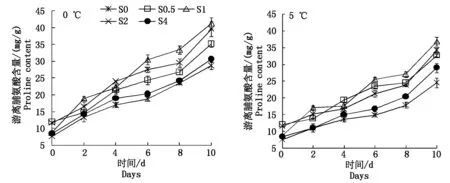
图5 SA对0,5 ℃低温胁迫下养心菜游离脯氨酸含量的影响
2.5SA对低温胁迫下养心菜叶绿素含量的影响
叶绿素作为光合色素参与光合作用中光能的吸收、传递和转化,在植物光合作用中起着关键性的作用。由图6表明,养心菜叶片中叶绿素a、叶绿素b、叶绿素总量变化基本相似,低温胁迫下均降低。外施不同浓度的SA后叶绿素总量比对照高。喷施不同浓度的SA可以不同程度的缓解叶绿素含量的下降。总体上看,S1(1.0 mmol/L)处理的效果较好,其次是S0.5(0.5 mmol/L)处理。0,5 ℃这2个温度下的表现趋势基本一致,均为S1(1.0 mmol/L)处理的效果较好。

图6 SA对0,5 ℃低温胁迫下养心菜叶绿素a、叶绿素b、叶绿素总量的影响
2.6SA对低温胁迫下养心菜叶绿素荧光参数的影响
叶绿素荧光参数是植物对逆境胁迫较敏感的指标。Fo反映PSⅡ反应中心受到伤害的程度,Fv/Fm值反映植物叶片PSⅡ原初光能转换效率。由表1,2可知,0,5 ℃低温下,随低温胁迫时间的延长,养心菜叶片Fo呈上升趋势,而Fv/Fm呈下降的变化趋势。外施不同浓度的SA后,养心菜Fo值随着SA浓度的上升呈下降-上升的趋势,Fv/Fm值随着SA浓度的上升呈上升-下降的趋势,并随着低温处理时间的延长,Fo值呈升高趋势,Fv/Fm值呈降低趋势。S0.5(0.5 mmol/L)、S1(1.0 mmol/L)和S2(2.0 mmol/L)处理的Fo均低于对照(0 mmol/L),Fv/Fm均显著高于对照,以S1处理的Fo值最小,Fv/Fm值最大。0 ℃胁迫10 d时,S0.5、S1和S2处理的养心菜Fo分别比对照低6.89%,11.52%,4.29%;Fv/Fm分别比对照高8.42%,14.97%,7.87%。5 ℃胁迫10 d时,S0.5、S1和S2处理的养心菜Fo分别比对照低6.19%,10.67%,4.93%;Fv/Fm分别比对照高4.55%,9.15%,4.46%。说明喷施SA能缓解Fo的上升和Fv/Fm的下降,说明喷施适宜浓度的SA对养心菜抗寒性的提高有一定的作用。

表1 SA对0,5 ℃低温胁迫下养心菜Fo的影响
注:同列数据后不同小写字母表示处理间差异显著(P<0.05)。表2同。
Note:The different letters in the same column meant significant difference among treatments at 0.05 level.The same as Tab.2

表2 SA对0,5 ℃低温胁迫下养心菜Fv/Fm的影响
3 结论与讨论
植物对低温的响应是一个复杂的生理过程。许多研究表明,植物在低温胁迫中,导致细胞内的活性氧自由基的积累和膜脂的过氧化,细胞膜的完整性受到破坏,膜的透性增大,MDA含量增加。本试验中,低温使养心菜叶片的MDA含量持续上升,膜透性增加,对养心菜细胞膜造成不同程度的损伤,而外施较低浓度(0.5~2.0 mmol/L)的SA处理降低了低温胁迫下养心菜幼苗叶片的相对电导率和质膜透性。这与何淑玲等[30]在狭叶红景天的研究一致。这可能是由于水杨酸对细胞膜上的信号传递途径产生诱导作用,使低温逆境信号被传导,从而使植物产生抗寒的能力。
许多研究认为,低温促进活性氧的积累,对植物细胞产生伤害。植物体内保护酶(SOD、POD)系统起着清除活性氧的作用,所以这些保护酶活性的大小可作为衡量植物抗低温性强弱的指标。在低温胁迫中养心菜叶片保护酶活性升高,叶绿素含量降低。与未喷施SA的对照相比,喷施低浓度(0.5~2.0 mmol/L)的SA处理的养心菜体内保护酶(SOD、POD)的活性提高,自由基含量较少,减缓了叶绿素含量的降低和低温胁迫期间植物Fv/Fm的下降幅度。说明SA能进一步增强养心菜幼苗抗低温胁迫的能力。
植物体内的脯氨酸含量和可溶性蛋白含量与多数植物抗寒性相关。无论是在0 ℃还是5 ℃低温下,喷施低浓度(0.5~2.0 mmol/L)的SA都能明显增加养心菜体内的脯氨酸含量和可溶性蛋白含量,从而使养心菜体内的细胞液浓度提高,平衡细胞质与液胞间的渗透势,使细胞膨压维持在正常的范围内,保证细胞的生理生化过程能够正常进行,从而提高养心菜的耐寒性。喷施相同浓度的SA对不同低温的作用效果不同。
综上所述,适宜浓度的SA处理可能通过降低细胞膜透性,保护膜系统的稳定性,提高抗氧化酶(SOD和POD)的活性,降低低温胁迫下膜脂过氧化程度,增加可溶性蛋白和游离脯氨酸含量,增加叶绿素含量,提高Fv/Fm来增强养心菜的抗低温能力,以1.0 mmol/L水杨酸处理对缓解养心菜在5 ℃低温下的伤害作用最好。
[1]林开和.特色无公害保健型蔬菜-养心菜[J].上海蔬菜,2003(6):16.
[2]宋波,徐海,陈龙正,等.绿色保健蔬菜费菜的优质高效栽培技术[J].江苏农业科学,2010(6):246.
[3]张晶晶,王晶,薛娇,等.费菜茎叶的化学成分[J].沈阳药科大学学报,2010,27(8):635-638.
[4]时政.养心菜的营养保健成分研究[J].北方园艺,2013(15):36-38.
[5]Li W L,Luo Q Y,Wu L Q.Two new prenylatedisoflavones fromSedumaizoonL.[J].Fitoterapia,2011,82(3):405-407.
[6]Maria W.Polyphenolic compounds fromSedumaizoonL.[J].Acta Poloniae Pharmaceutica,1996,53(3):225-227.
[7]Wang Q Z,Luo A X,Fan Y J.Invitroantioxidant activity of polysaccharide fromSedumaizoonL.extracts[J].Journal of Medicinal Plants Research,2011,5(30):6604-6608.
[8]钟露苗,夏新华,姜德建,等.景天三七药材不同提取部位对小鼠胃粘膜保护作用的研究[J].中国临床药理学杂志,2014,30(3):208-211.
[9]刘雪梅,吴符火,黄启福.养心草胶囊调脂作用药效学实验研究[J].中国病理生理杂志,2005,21(8):1628.
[10]Xiao W H,Han L J,Shi B.Microwave-assisted extraction of flavonoids from Radix astragali[J].Separation and Purification Technology,2008,62(3):614-618.
[11]Malene S,Jan H C,John N.Pressurisedliquidexeaction of flavonoids in onions[J].Method Development and Validation Talanta,2009,80(1):269-278.
[12]Lin Z C,Long Z,Zhang R Z,et al.Antiinflammatory effect of ethyl acetate extract ofSedumaizoonL.in LPS-stimulated RAW 264.7 macrophages and its HPLC fingerprint[J].Journal of Chinese Pharmaceutical Sciences,2015,24(10):647-653.
[13]杨艳俊,王一洋.微波辅助法提取景天三七中齐墩果酸的工艺研究[J].北方园艺,2014(10):152-155.
[14]韩荣春.景天科景天属四种药用植物生药学研究[D].沈阳:辽宁中医药大学,2007.
[15]苏丹,张金政,孙国峰,等.费菜和长药八宝叶形态结构及其与耐旱性关系的研究[J].植物研究,2007,27(4):428-433.
[16]李莺,王朝.景天三七的组织培养和植株再生[J].西北农业学报,2010,19(12):109-112,176.
[17]卜复鸣,谢兰曼,胡建新.费菜1叶1芽微体快繁技术初探[J].江苏农业科学,2012,40(12):177-179.
[18]王嵩,马杰,赵维,等.黔西北景天三七高产栽培优化研究[J].北方园艺,2014(11):147-149.
[19]王秀英,李恩彪.药菜兼用的救心菜日光温室可移动式生产技术[J].北方园艺,2009(3):146-148.
[20]Jones A M.Surprising signals in plant cells[J].Science,1994,263(5144):183-184.
[21]Fariduddin Q,Hayat S,Ahmad A.Salicylic acid influences net photosynthetic rate,carboxylation efficiency,nitrate reductase activity,and seed yield inBrassicajuncea[J].Photosynthetica,2003,41(2):281-284.
[22]Rivas-San Vicente M,Plasencia J.Salicylic acid beyond defence:its role in plant growth and development[J].Journal of Experimental Botany,2011,62(10):3321-3338.
[23]Idress M,Naeem M,Aftab T,et al.Salicylic acid mitigates salinity stress by improving antioxidant system and enhances vincristine and vinblastine alkaloids production in periwinkle[Catharanthusroseus(L.) G.Don][J].Acta Physiol Plant,2011,33:987-999.
[24]Freeman J L,Garcia D,Kim D,et al.Constitutively elevated salicylic acid signals glutathione-mediated Nickel tolerance in Thlaspi Nickel hyperaccumulators[J].Plant Physiology,2005,137(3):1082-1091.
[25]Larkindale J,Hall J D,Knight M R,et al.Heat stress phenotypes ofArabidopsismutants implicate multiple signaling pathways in the acquisition of thermotolerance[J].Plant Physiology,2005,138(2):882-897.
[26]Sayyari M,Castillo S,Valero D,et al.Acetyl salicylic acid alleviates chilling injury and maintains nutritive and bioactive compounds and antioxidant activity during postharvest storage of pomegranates[J].Postharvest Biology and Technology,2011,60(2):136-142.
[27]赵敏,杜彩云,王俊英,等.水杨酸对番茄幼苗抗冷性的影响[J].河南农业科学,2013,42(8):89-91.
[28]苗永美,王万洋,杨海林,等.外源Ca2+、SA和ABA缓解甜瓜低温胁迫伤害的生理作用[J].南京农业大学学报,2013,36(4):25-29.
[29]常云霞,徐克东,陈璨,等.水杨酸对低温胁迫下黄瓜幼苗叶片抗寒生理指标的影响[J].北方园艺,2013(12):1-4.
[30]何淑玲,马令法,杨敬军,等.外源水杨酸对低温胁迫下狭叶红景天幼苗生理及膜伤害的影响[J].北方园艺,2015(17):61-65.
[31]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
[32]简令成.生物膜与植物寒害和抗寒性的关系[J].植物学通报,1983(1):19-25.
[33]何若韬,王光洁.植物寒冷驯化的机理[J].植物生理生化进展,1987(5):17-29.
[34]Horváth E,Szalai G,Janda T.Induction of abiotic stress tolerance by salicylic acid signaling[J].Journal of Plant Growth Regulation,2007,26(3):290-300.
[35]Dat J F,Lopez-Delgado H,Foyer C H,et al.Effects of salicylic acid on oxidative stress and thermthermotolerance in tobacco[J].Plant Physiology,2000(156):659-665.
[36]刘伟,艾希珍,梁文娟,等.低温弱光下水杨酸对黄瓜幼苗光合作用及抗氧化酶活性的影响[J].应用生态学报,2009,20(2):441-445.
[37]宋士清,郭世荣,尚庆茂,等.外源SA对盐胁迫下黄瓜幼苗的生理效应[J].园艺学报,2006,33(1):68-72.
Regulating of Exogenous Salicylic Acid on Physiological Metabolism ofSedumaizoonL.under Low Temperature Stress
XU Dongmei1,2,HE Zhongqun1,ZHANG Jie1
(1.Sichuan Agricultural University,Chengdu611134,China;2.Mianyang Agricultural Science Research Institute,Mianyang621023,China)
In order to analyze the regulating effect of 0,5 ℃ low temperature treatment on theSedumaizoonL.with salicylic acid of different concentrations (0,0.5,1.0,2.0,4.0 mmol/L) on membrane permeability,MDA content,antioxidant enzyme activity,soluble protein,proline,chlorophyll content and chlorophyll fluorescence parameter to investigate the effects of its pretreatment on leaf physiological metabolism.The results showed that 0.5,1.0,2.0 mmol/L concentration of salicylic acid processing,salicylic acid treatment could inhibit raising relative conductivity and MDA increasing,improving SOD,POD activity in the leave ofSedumaizoonL.;Increasing soluble protein,proline,chlorophyll content,could also slow down the Fv/Fm decline under low temperature stress,slowed photo inhibition damage to plants,SedumaizoonL.at low temperatures cold indicators had varying degrees of ease.Evaluation results expressed,salicylic acid concentration of 1.0 mmol/L was the best for 5 ℃ low temperature stress inSedumaizoonL..
Salicylic acid;Low temperature stress;SedumaizoonL.;Physiological metabolism
2016-01-20
四川省教育厅项目(10ZB044)
徐冬梅(1986-),女,四川绵阳人,硕士,主要从事蔬菜栽培生理研究。
贺忠群(1971-),女,重庆开县人,教授,博士,主要从事蔬菜逆境生理及设施园艺研究。
S634.01
A
1000-7091(2016)04-0138-08
10.7668/hbnxb.2016.04.023
