SH-SY5Y细胞α7尼古丁受体基因沉默对tau蛋白磷酸化水平及p38 MAPK信号通路的影响
2016-09-19吴昌学官志忠齐晓岚
周 飞, 吴昌学, 李 毅, 官志忠, 齐晓岚
SH-SY5Y细胞α7尼古丁受体基因沉默对tau蛋白磷酸化水平及p38 MAPK信号通路的影响
周飞,吴昌学,李毅,官志忠,齐晓岚
目的研究α7尼古丁受体 (nAChR)沉默对SH-SY5Y细胞tau蛋白磷酸化水平和p38 MAPK通路的影响,探讨α7 nAChR对tau蛋白磷酸化的调节作用及其与p38 MAPK通路的关系。方法Real-time PCR法和Western blotting法分别测定α7 nAChR沉默细胞中α7 nAChR在mRNA和蛋白表达水平的变化;Western blotting法检测细胞tau蛋白、p-tau (S404)、p-tau (S214)、p38 MAPK和p-p38 MAPK(Thr180/Tyr182)蛋白水平。结果α7 nAChR沉默组与空质粒组相比,α7 nAChR mRNA和蛋白质水平分别降低了91%(P<0.01) 和80% (P<0.01);tau蛋白水平升高了79% (P<0.01);p-tau (S404)蛋白水平升高了74%(P<0.01);p-tau (S214)蛋白水平升高了72%(P<0.01);p38蛋白水平升高了64%(P<0.01);p-p38蛋白水平升高了67%(P<0.01)。结论α7 nAChR沉默可导致tau蛋白过度磷酸化,这可能和激动p38 MAPK通路有一定关系。
阿尔茨海默病;tau;α7 nAChR;p38 MAPK
阿尔茨海默病 (Alzheimer’s disease,AD) 是一种神经元退行性病变疾病,是痴呆病中主要类型,临床上主要表现为进行性认知功能障碍和记忆力减退等[1]。病理学上以β-淀粉样蛋白(β-amyloid peptide,Aβ)沉积形成的老年斑 (senile plaques,SPs) 以及tau蛋白过度磷酸化引起的神经原纤维缠结 (neurofibrillary tangles,NFTs)为主要特征[2]。病理学相关研究发现AD患者出现痴呆的严重程度与其脑组织中的NFTs数量呈正相关[3],tau蛋白去磷酸化受阻或过度磷酸化是造成NFT形成的关键因素[4]。
在AD发病机制中神经型尼古丁乙酰胆碱能受体(neuronal nicotinic acetylcholine receptor,nAChR)研究颇多,其具有调节大脑记忆学习、智力发展、识别能力等方面功能和显著的神经保护作用[5],尼古丁受体含有多种亚单位,其中α7 nAChR较为常见,在AD相关病变研究中扮演重要角色。研究表明在AD患者大脑海马、皮质区nAChR数目减少,α7 亚单位蛋白表达降低,其与神经毒性作用紧密相连[6],体内选择性激动α7 nAChR,引起tau蛋白磷酸化水平下降[7],α7 nAChR表达增加,能对抗冈田酸促使的tau蛋白磷酸化[8]。也有研究表明,尼古丁作用SH-SY5Y细胞,tau蛋白磷酸化程度明显升高[9]。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路由相关激动的丝/苏氨酸蛋白激酶组成,其在哺乳类动物中已发现6种亚群,分别是细胞外信号调节蛋白激酶1/2 (extracellular signal-regulated kinase,ERK1/2)、c-Jun氨基末端激酶1/2/3 (c-Jun NH2-terminal kinase,JNK1/2/3)、p38 MAPK (p38 α/β/γ/δ)、ERK7/8、ERK3/4和ERK5[10]。其中p38 MAPK参加调节神经细胞存活的整个生命过程,在神经受损及细胞坏死中涉及较多。通过体外激动α7 nAChR,可以促进nAChR 离子通道对Ca2+通透性,伴随Ca2+水平升高,MAPK通路被激活并发挥作用,调节神经细胞受损后相关基因表达[11]。有报告显示p38 MAPK具有磷酸化tau蛋白功能,这些磷酸化位点与AD患者大脑中抽提的NFTs中所含一样。同时,p38 MAPK对tau蛋白磷酸化程度也具有一定调节功能[12]。因此,本实验将研究AD中α7 nAChR对tau蛋白磷酸化影响及其与p38 MAPK通路的关系,为进一步探讨α7 nAChR调节tau蛋白的神经庇护相关机制做铺垫。
1 材料与方法
1.1源于人脑的SH-SY5Y神经细胞由本课题组保存;稳定转染α7 nAChR shRNA 沉默载体和空载体的SH-SY5Y细胞由本课题组液氮保存;DMEM培养基、血清、0.25%胰酶均来源于Hyclone公司;嘌呤霉素购于Sigma公司;Trizol试剂购于Invitrogen公司;α7 nAChR、β-actin引物由上海生物工程公司设计并合成;RNA逆转录试剂盒购于Thermo公司;兔抗人tau单克隆抗体(ab32057)、兔抗人p-tau (S404)单克隆抗体(ab92676)、兔抗人p-Tau (S214)多克隆抗体(ab10891)均购于英国Abcam公司;兔抗人p38 MAPK单克隆抗体(8690s)、兔抗人P-p38 MAPK (Thr180/Tyr182) 单克隆抗体(4511s)均购于美国Cell Signaling公司;鼠抗人Actin 单克隆抗体(M20010)购于美国Abmart公司;辣根过氧化物酶(HRP)标记的羊抗兔二抗(7074s)来源于美国Cell Signaling公司;辣根酶标记的羊抗鼠二抗(ZB2305)来源于中杉金桥公司、蛋白Marker来源于美国Thermo公司;5×蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒、PMSF蛋白酶抑制剂、显影液、定影液均购自上海碧云天生物技术有限公司;蛋白磷酸酶抑制剂混合物、RIPA高效裂解液均来源于北京索莱宝公司;PVDF膜、ECL-Plus发光试剂购自美国Millipoe公司;胶片购于中国柯达公司。
1.2方法
1.2.1细胞培养空白组SH-SY5Y细胞以DMEM为培养基,其中添加10%血清、1%双抗(青霉素100 U/ml,链霉素100 U/ml),转染α7 nAChR shRNA Plasmid(h)实验组和转染Control shRNA Plasmid-B空载体组SH-SY5Y细胞以添加13%胎牛血清、0.004 g/L嘌呤霉素的DMEM为培养基,放入37 ℃含5% CO2恒温箱中进行孵育。
1.2.2实时荧光定量PCR检测α7 nAChR mRNA表达水平采用Trizol一步法提炼细胞总RNA,通过逆转录试剂盒把mRNA逆转录为cDNA,并以此作为模板进行real-timePCR。α7 nAChR和内参β-actin引物序列(见表1),用ABI Step One Plus型实时荧光定量PCR仪采集α7 nAChR及内参β-actin扩增各循环荧光信号,用SDS2.1软件收集荧光信息并分析相关资料,主要分析α7 nAChRΔΔCt值及RQ值,RQ=2-ΔΔCt。分析结果时,用β-actin做内参,计算沉默组分别与空载体对照组、正常对照组之间的相对水平。
1.2.3Western blot检测α7 nAChR、tau、S404、S214、p38及P-p38蛋白水平按RIPA∶PMSF∶蛋白磷酸酶抑制剂混合物=100∶1∶1配制裂解液,收集细胞,冷冻离心12000 r、4 ℃、15 min,汲取上清蛋白。采用BCA定量法测定蛋白浓度;运用Western blotting法检测α7 nAChR、tau、S404、S214、p38、p-p38蛋白表达水平及其各自内参β-actin的蛋白表达情况。运用Image J 软件进行图片像素灰度值处理,以β-actin条带作为内对照,分别计算α7 nAChR、tau、S404、S214、p38、P-p38蛋白条带相对其内参的灰度比值并作为目的蛋白的相对表达水平。每组蛋白复孔3个,重复3次独立试验。
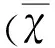
2 结 果
2.1稳定转染α7 nAChR shRNA Plasmid(h)后细胞α7 nAChR mRNA及其蛋白质表达水平稳定转染α7 nAChR shRNA Plasmid(h)后细胞α7nAChRmRNA及其蛋白质表达水平:受体沉默组与空质粒组相比,α7 nAChR mRNA(见图1A)和蛋白质水平(见图1B)分别降低了91%(P<0.01)和80%(P<0.01)。说明稳定转染α7 nAChR shRNA沉默载体的SH-SY5Y细胞,α7 nAChR 在mRNA和蛋白程度被高度抑制。
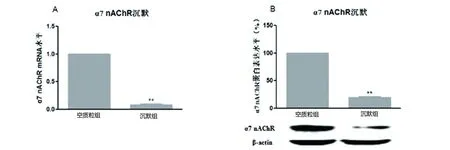
2.2α7 nAChR沉默调节tau蛋白磷酸化水平受体沉默组与空质粒组相比,tau蛋白(见图2A)、p-tau (S404)(见图2B)、p-tau (S214)(见图2C)蛋白质水平分别升高了79%(P<0.01)、74%(P<0.01)、72%(P<0.01)。说明稳定转染α7 nAChR沉默质粒后,与空载对照组细胞相比,细胞总tau蛋白、S404及S214位点磷酸化水平明显升高,差异具有高度统计学意义。
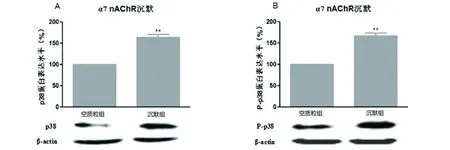
2.3α7 nAChR沉默对p38 MAPK信号通路蛋白水平的影响受体沉默组与空质粒组相比,p38(见图3A)、p-p38(见图3B)蛋白质水平分别升高了64%(P<0.01)、67%(P<0.01)。说明α7 nAChR基因抑制,与空载组相比,p38及p-p38程度明显上升,差异具有统计学价值。

表1 荧光定量PCR引物序列及产物片段
**:表示与空质粒组比较,具有高度统计学价值(P<0.01)
**:表示与空质粒组比较,具有高度统计学价值(P<0.01)
图2α7 nAChR基因沉默细胞tau蛋白(见图2A)、S404(见图2B)、S214(见图2C)蛋白表达水平
**:表示与空质粒组比较,具有高度统计学价值(P<0.01)
3 讨 论
在AD的病变研究中,nAChR常被提及,能参与大脑多种功能调节,对神经系统毒性损伤具有一定的神经保护作用,通过对AD患者进行尸检发现其大脑皮质萎缩、nAChRs数量减少、密度降低[13],本课题组前期研究结果也表明,下调SH-SY5Y细胞α7 nAChR,可增加Aβ的产生及其毒性作用[14]。此外,有研究者认为AD患者α7 nAChR明显减少,是由于受体与Aβ相互作用所致并诱导神经元凋亡,因此猜测α7 nAChR激动剂可能会对AD患者有较好疗效[15]。tau蛋白作为一类细胞骨架蛋白,常表达于神经元,生物学功能重点表现为辅助微管装置及稳定构造。tau蛋白磷酸化位点,大部分表现为丝氨酸(Ser)及苏氨酸(Thr)残基磷酸化,在AD中磷酸化tau蛋白以Thrl81、Thr205、Ser-198/199/202、Ser-396/404及Ser422等位点研究较多,异常磷酸化tau使微管失去稳定性,游离tau蛋白剧增,促使其沉积于大脑和脑脊液形成细胞内NFT[16]。NFT可损伤神经元、神经胶质细胞和tau蛋白功能等多种途径导致强大的神经毒性。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)传导通路作为主要的基本信息传递链之一,参与调节细胞生长、分化、凋亡等整个生命过程[17],其中p38 MAPK是该家族中重要成员之一,能介导神经损伤及细胞坏死。在Seino等[18]建造的2×Tgtau (+/-)APP(+/-)双转基因鼠模型中发现MAPK能诱导tau蛋白磷酸化水平显著升高,AD中Aβ及tau蛋白导致的神经毒性都与p38 MAPK激活存在一定联系[19]。尸检AD患者也发现其脑组织中磷酸化p38显著增加[20],因此抑制p38通路,对造成的毒性损害可明显减轻,具有一定神经保护功能[21]。此外,近期研究显示激活p38 MAPK可引起神经系统tau蛋白过度磷酸化[22],微管稳定性下降及微管重排,提出p38 MAPK阻断剂可能会对神经类疾病有一定疗效[23]。
因此本实验主要研究SH-SY5Y细胞转染α7 nAChR沉默质粒后,细胞tau蛋白磷酸化程度和相关信号通路p38 MAPK蛋白表达情况,从而探索尼古丁受体基因沉默对神经原纤维缠结形成过程的影响以及受体调节tau蛋白的可能机制。实验结果显示,α7 nAChR沉默时,tau蛋白AD相关位点S404、S214磷酸化程度明显升高,表明尼古丁受体基因抑制可导致tau蛋白过度磷酸化,这可能与AD发病中NFTs的形成有关,同时研究还发现α7 nAChR基因抑制后可激动p38通路,推测α7 nAChR促使tau蛋白过度磷酸化可能与p38 MAPK通路活化有一定关系,这可能与α7 nAChR在AD发病机制中的神经保护作用机制有关。
[1]Selkoe DJ.Alzheimer’s disease:genes,proteins,and therapy[J].Physiol Rev,2001,81:741-766.
[2]Ballard C,Gauthier S,Corbett A,et al.Alzheimer’s disease[J].Lancet,2011,377(9770):1019-1031.
[3]Serrano-Pozo A,Frosch MP,Maslish E,et al.Neuropathological alteration in Alzheimer disease[J].Cold Spring Harb Perspect Biol Med Sep,2011,1:a006189.
[4]Taly A,Omorringer PJ,Uedin D,et al.Nicotinic receptors: allosteric transitions and therapeutic targets in the nervous system[J].Nat Rev Drug Discov,2009,8(9):733-750.
[5]Griguoli M,Cherubini E.Regulation of hippocampal inhibitory circuits by nicotinic acetylcholine receptors[J].J Physiol,2012,590(4):655-666.
[6]Conejero-Goldberg C,Davies P,Ulloa L.Alpha7 nicotinic acetylcholine receptor:A link between inflammation and neurodegeneration[J].Neurosci Biobehavioral Rev,2008,32(4):693-706.
[7]Bitner RS,Nikkel AL,Markosyan S,et al.Selective α7 nicotinic acetylcholine receptor activation regulates glycogen synthase kinase3β and decreases tau phosphorylation in vivo[J].Brain Res,2009,1265:65-74.
[8]del Barrio L,Martin-de-Saavedra MD,Romero A,et al.Neurotoxicity induced by okadaic acid in the human neuroblastoma SH-SY5Y line can bi differentially prevented by α7 and β2* nicotinic stimulation[J].Toxicological Sci,2011,123(1):193-205.
[9]Hellstrom-Lindahl E,Moore H,Nordberg A.Increased levels of Tau protein in SH-SY5Y cells after treatment with cholinesterase inhibitors and nicotinic agonists[J].J Neurochem,2000,74(2):777-784.
[10]Petrunewich MA,Trimarchi JR,Hanlan AK,et al.Second meiotic spindle integrity requires MEK/MAP kinase activity in mouse eggs[J].J Reprod Dev,2009,55(1):30-38.
[11]Gubbins EJ,Gopalakrishnan M,Li J.α7 nAChR-mediated activation of MAP kinase pathways in PC12 cells[J].Brain Res,2010,1328:1-11.
[12]Meng G,Sun Y,Fu W,et al.Microcystin-LR induces cytoskeleton system reorganization through hyperphosphorylation of tau and HSP27 via PP2A inhibition and subsequent activation of the p38 MAPK signaling pathway in neuroendocrine (PC12) cells[J].Toxicology,2011,290(2/3):218-229.
[13]Lilja AM.Functional interactions of fibrillar and oligomeric amyloid-with alpha7 nicotinic receptors in Alzheimer’s disease[J].Alzheimers Dis,2011,23(2):335-347.
[14]Qi XL,Ou-yang K,Ren JM,et al.Preventing expression of the nicotinic receptor subunit α7 in SH-SY5Y cells with interferenc RNA indicates that this receptor may protect against the neurotoxicity of Aβ[J].Neurochem Res,2013,38(5):943-950.
[15]Fan H,Gu R,Wei D.The α7 nAChR selective agonists as drug candidates for Alzheimer’s disease[J].Advances Exp Med Biol,2015,827:353-365.
[16]Plouffe V,Mohamed NV,Rivest-McGraw J,et al.Hyperphosphorylation and cleavage D421 enhance tau secretion[J].PloS One,2012,7(5):e36873.
[17]Cargnello M,Roux PP.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases[J].Microbiol Mol Biol Rev,2011,75(1):50-83.
[18]Seino Y,Kawarabayashi T,Wakasaya Y.Amyloid-β accelerates phosphorylation of tau and neurofibrillary tangle formation in an amyloid precursor protein and tau double-transgenic mouse model[J].J Neurosci Res,2010,88(16):3547 - 3554.
[19]Giraldo E,Lloret A,Fuchsberger T,et al.Aβ and tau toxicities in Alzheimer’s are linked via oxidative stress-induced p38 activation.Protective role of vitamin E[J].Redox Biology,2014,2:873-877.
[20]Munoz L,Ammit AJ.Targeting P38 MAPK pathway for the treatment of Alzheimer’s disease[J].Neuropharmacology,2010,58:561-568.
[21]Lan AP,Liao XX,Mo LQ,et al.Hydrogen sulfide protects against chemical hypoxia-induced injury by inhibing ROS-activated ERK1/2 and p38MAPK signaling pathways in PC12 cells[J].PLOSE One,2011,6(2333-9721):25921.
[22]Cao M,Liu F,Ji F,et al.Effect of c-Jun N-terminal kinase (JNK)/p38 mitogen-activated protein kinase (p38 MAPK) in morphine-induced tau protein hyperphosphorylation[J].Behavioural Brain Res,2013,237(2):249-255.
[23]Yasuda S,Sugiura H,Tanaka H,et al.P38 MAPK kinase inhibitors as potential therapeutic drugs for neural diseases[J].Cent Nerv Syst Agents Med Chem,2011,11(1):45-59.
Influence of inhibited α7 nicotinic acetylcholine receptor gene expression on tau phosphorylation and p38 MAPK signal transduction pathway in SH-SY5Y cells
ZHOUFei,WUChangxue,LIYi,etal.
(TheKeyLaboratoryofMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,China)
ObjectiveTo investigate the influence of inhibited gene expression of α7 neuronal nicotinic acetylcholine receptor (nAChR) on tau phosphorylation and p38 MAPK signal transduction pathway in SH-SY5Y cells,to study the effect of α7 nAChR on tau phosphorylation,and the realationship with p38 MAPK transduction pathway.MethodsThe level of α7nAChR mRNA and protein were detected by real-time PCR and Western blotting,respectively.The protein levels of tau,p-tau (S404), p-tau (S214),p38 MAPK and P-p38 MAPK (Thr180/Tyr182) were determined by Western blotting.ResultsAs compared with negative controls,the expression of α7 nAChR at mRNA and protein levels in the SH-SY5Y cells with α7 nAChR silencing were decreased by 91% and 80%,respectively.And the expression of tau,p-tau (S404),p-tau (S214),p38 MAPK and P-p38 MAPK (Thr180/Tyr182) proteins were increased by 79%、74%、72%、64%、67%,respectively.ConclusionsThe inhibited gene expression of α7 nAChR by RNA interference can lead to tau hyperphosphorylation, which may associate to p38 MAPK transduction pathway.
Alzheimer disease;tau;Receptors;Cholinergic;p38 MAPK
1003-2754(2016)08-0676-04
2016-06-11;
2016-07-29
国家自然科学基金资助项目(No.81360178);教育部“长江学者和创新团队发展计划资助”(No.IRT13058);贵州省科技厅重大专项[黔科合重大专项字2014(6008)];贵州省科技厅项目[201344,黔科合SY字(2013)3020]
(贵州医科大学分子生物学重点实验室,贵州 贵阳 550004)
齐晓岚,E-mail:xiaolan76@163.com
R749.1
A
